จาก ปฐมวัยเรากำลังเผชิญกับวลีที่ว่าสิ่งนั้นและวัตถุดังกล่าวทำจากโลหะ โลหะคืออะไร?
โลหะเป็นกลุ่มขององค์ประกอบทางเคมี (เช่นเดียวกับโลหะผสม) ที่มีคุณสมบัติร่วมกันกับทั้งกลุ่ม เช่น ความแข็งแรงที่เพิ่มขึ้น การนำความร้อนและไฟฟ้าที่ดี ความอ่อนตัว ความเหนียว และความมันวาวของโลหะ
เกือบ 80% ขององค์ประกอบทางเคมีที่รู้จักทั้งหมดเป็นของโลหะ (96 จาก 118)
คุณสมบัติทางกายภาพของโลหะ
โลหะทั้งหมด ยกเว้นปรอท อยู่ในสถานะของแข็งภายใต้สภาวะปกติ ในแง่ของความแข็ง โลหะที่อ่อนที่สุดคือซีเซียม (0.2 คะแนนในระดับ Mohs 10 จุด) ที่ยากที่สุดคือทังสเตน ความแข็งของมันคือ 6 จุด ความแข็งของเหล็กคือ 4 จุด
จุดหลอมเหลว (การเปลี่ยนสถานะเป็นของเหลว) สำหรับโลหะแตกต่างกันไป: ตั้งแต่ -39º สำหรับปรอท ถึง 3410º สำหรับทังสเตน โลหะอัลคาไลทั้งหมดมีจุดหลอมเหลวต่ำ และของทั่วไป ได้แก่ ดีบุกและตะกั่ว พวกเขาสามารถละลายได้แม้ที่บ้านด้วยเตาแก๊ส โลหะส่วนใหญ่หลอมละลายในเตาเผาพิเศษที่อุณหภูมิสูง
เนื่องจากการมีอยู่ของอิเล็กตรอนเคลื่อนที่อิสระในโครงผลึกของโลหะ พวกมันทั้งหมดนำไฟฟ้าและความร้อนได้ดีมาก ตัวนำไฟฟ้าที่ดีที่สุดจากโลหะ ได้แก่ เงิน ทองแดง และอลูมิเนียม ไม่ใช่เรื่องบังเอิญที่การเดินสายไฟฟ้าทำจากโลหะสองชนิดสุดท้าย
ด้วยการนำความร้อนที่ดีเยี่ยมของโลหะ เรามักพบเจอในชีวิตประจำวัน ในการต้มน้ำให้เทลงในกระทะโลหะแล้ววางบนเตา สิบทำให้โลหะร้อน และโลหะส่งผ่านเกือบทั้งหมด พลังงานความร้อนน้ำ.
คุณสมบัติทางเคมีของโลหะ
ในปฏิกิริยาเคมี โลหะทั้งหมดจะปล่อยอิเลคตรอนและทำหน้าที่เป็นตัวรีดิวซ์ได้ง่าย
โลหะเกือบทั้งหมดถูกออกซิไดซ์โดยออกซิเจน โลหะอัลคาไล (ลิเธียม, แคลเซียม) ทำปฏิกิริยากับออกซิเจนภายใต้สภาวะปกติ สำหรับโลหะอื่นๆ ที่จะออกซิไดซ์ด้วยออกซิเจน จำเป็นต้องมีอุณหภูมิสูงขึ้น ตัวอย่างเช่น หากคุณทำให้ลวดทองแดงร้อนบนไฟ ทองแดงจะทำปฏิกิริยากับออกซิเจนจากอากาศและปกคลุมด้วยฟิล์มสีดำ (คอปเปอร์ออกไซด์):
- 2Сu +O 2 → 2CuO
ทองและแพลตตินั่มไม่ทำปฏิกิริยากับออกซิเจน
ของตัวออกซิไดซ์อื่นๆ คลอรีนและซัลเฟอร์ทำปฏิกิริยากับโลหะ หากเราผสมตะไบเหล็กและผงกำมะถันและให้ความร้อนกับส่วนผสม จากนั้นต่อหน้าต่อตาเราจะได้ธาตุเหล็กซัลไฟด์:
- Fe+S → FeS
กิจกรรมรีดิวซ์ของโลหะชนิดต่างๆ จะแตกต่างกัน ตามกิจกรรมของพวกเขาโลหะมีการกระจายดังนี้:
- Li - K - Ba - Sr - Ca - Na - Mg - Al - Mn - Zn - Cr - Fe - Ca - Co - Ni - Sn - Pb - (H2) - Cu - Hg - Ag - Pt - Au.
ยิ่งแถวนี้ไปทางซ้ายเป็นโลหะ ยิ่งมีความว่องไวมากขึ้น องค์ประกอบก่อนหน้าสามารถแทนที่โลหะไปทางขวา ตัวอย่างเช่น หากวางชิ้นส่วนของเหล็กในหลอดทดลองด้วยสารละลายของคอปเปอร์ซัลเฟต ก็จะถูกเคลือบด้วยสีน้ำตาล (ฟิล์มทองแดง):
- เฟ + CuSO4 → FeSO4 + Cu
โลหะทางด้านซ้ายของไฮโดรเจน (H2) สามารถแทนที่ได้จากกรดไฮโดรคลอริก หากชิ้นส่วนของสังกะสีจุ่มลงในกรดไฮโดรคลอริก ไฮโดรเจนจะเริ่มถูกปลดปล่อยออกมา:
- HCl + Zn → ZnCl2 + H2
โลหะอัลคาไลทำปฏิกิริยากับน้ำได้ง่าย หากใส่โซเดียมชิ้นหนึ่งลงในภาชนะที่มีน้ำ ไฮโดรเจนจะเริ่มวิวัฒนาการอย่างแข็งขันและเกิดอัลคาไล:
- 2Na + 2H2O → 2NaOH + H2
การประยุกต์ใช้โลหะ
ขอบคุณพวกเขา คุณสมบัติที่มีประโยชน์โลหะเข้าสู่ชีวิตมนุษย์อย่างแน่นหนา บุคคลใช้ความแข็งแกร่งของโลหะ ทำให้พวกเขาเป็นโครงของอาคาร (ตั้งแต่ศาลาขนาดเล็กไปจนถึงตึกระฟ้าขนาดใหญ่) ตัวเครื่อง (รถยนต์ เกวียน เรือ เครื่องมือกล) รวมถึงชิ้นส่วนที่ใช้งานของเครื่องมือต่างๆ
คำนิยาม
อยู่ในธรรมชาติ
คุณสมบัติของโลหะ
คุณสมบัติลักษณะ โลหะ
คุณสมบัติทางกายภาพ โลหะ
คุณสมบัติทางเคมีของโลหะ
โครงสร้างกล้องจุลทรรศน์
โลหะอัลคาไล
ลักษณะทั่วไปของโลหะอัลคาไล
คุณสมบัติทางเคมีของโลหะอัลคาไล
รับโลหะอัลคาไล
ไฮดรอกไซด์
คาร์บอเนต
รูบิเดียม
โลหะอัลคาไลน์เอิร์ ธ
แคลเซียม
สตรอนเทียม
โลหะทรานซิชัน
ลักษณะทั่วไปขององค์ประกอบการเปลี่ยนแปลง
การประยุกต์ใช้โลหะ
วัสดุก่อสร้าง
วัสดุไฟฟ้า
วัสดุเครื่องมือ
ประวัติศาสตร์
การขุด โลหะวิทยา
โลหะคือ(ชื่อมาจากภาษาละติน metallum - mine) - กลุ่มของธาตุที่มีคุณสมบัติทางโลหะเฉพาะ เช่น การนำความร้อนและไฟฟ้าสูง ค่าสัมประสิทธิ์อุณหภูมิบวกของความต้านทาน ความเหนียวสูง เป็นต้น ประมาณ 70% ขององค์ประกอบทางเคมีทั้งหมดเป็นโลหะ .
โลหะ (Metal) is











![]()





















![]()


![]()





อยู่ในธรรมชาติ
โลหะส่วนใหญ่มีอยู่ในธรรมชาติในรูปของแร่และสารประกอบ เกิดเป็นออกไซด์ ซัลไฟด์ คาร์บอเนต และอื่นๆ สารประกอบทางเคมี. เพื่อให้ได้โลหะบริสุทธิ์และการใช้งานต่อไป จำเป็นต้องแยกโลหะออกจากแร่และดำเนินการทำให้บริสุทธิ์ หากจำเป็น ให้ทำการเจือและการแปรรูปโลหะอื่นๆ วิทยาศาสตร์กำลังศึกษาสิ่งนี้ โลหะวิทยา. โลหะวิทยาแยกแยะแร่โลหะเหล็ก (ขึ้นอยู่กับ ต่อม) และสี (ไม่รวม เหล็กรวมประมาณ 70 องค์ประกอบ) และแพลตตินั่มก็มี โลหะมีค่า. นอกจากนี้ยังมีอยู่ในน้ำทะเล พืช สิ่งมีชีวิตในปริมาณเล็กน้อย (ในขณะที่มีบทบาทสำคัญ)
เป็นที่ทราบกันดีอยู่แล้วว่า 3% ของร่างกายมนุษย์ประกอบด้วยโลหะ ส่วนใหญ่ในเซลล์ของเราคือแคลเซียมและโซเดียมซึ่งกระจุกตัวอยู่ในระบบน้ำเหลือง แมกนีเซียมถูกเก็บไว้ในกล้ามเนื้อและ ระบบประสาท, ทองแดงในตับในเลือด
คุณสมบัติของโลหะ
โลหะ (Metal) is
คุณสมบัติเฉพาะของโลหะ
ความแวววาวของโลหะ (ยกเว้นไอโอดีนและคาร์บอนในรูปของกราไฟต์ แม้จะมีความแวววาวของโลหะ ผลึกไอโอดีนและกราไฟต์ก็ไม่ใช่โลหะ)
การนำไฟฟ้าได้ดี (ยกเว้นคาร์บอน)
ความเป็นไปได้ของการตัดเฉือนแบบเบา
ความหนาแน่นสูง (โดยปกติโลหะจะหนักกว่าอโลหะ)
จุดหลอมเหลวสูง (ยกเว้น: ปรอท แกลเลียม และโลหะอัลคาไล)
การนำความร้อนได้ดี
ในปฏิกิริยาจะเป็นตัวรีดิวซ์เสมอ
คุณสมบัติทางกายภาพของโลหะ
โลหะทั้งหมด (ยกเว้นปรอทและตามเงื่อนไข) อยู่ในสถานะของแข็งภายใต้สภาวะปกติ แต่มีความแข็งต่างกัน ดังนั้นโลหะอัลคาไลจึงสามารถตัดได้อย่างง่ายดายด้วยมีดทำครัว และโลหะเช่นวาเนเดียม ทังสเตน และโครเมียมจะขูดส่วนที่แข็งที่สุดและแก้วได้อย่างง่ายดาย ด้านล่างนี้คือความแข็งของโลหะบางชนิดในระดับ Mohs
จุดหลอมเหลวมีตั้งแต่ −39°C (ปรอท) ถึง 34100°C (ทังสเตน) จุดหลอมเหลวของโลหะส่วนใหญ่ (ยกเว้นอัลคาไล) สูง แต่โลหะ "ปกติ" บางชนิด เช่น ดีบุกและ ตะกั่วสามารถละลายบนเตาไฟฟ้าหรือเตาแก๊สทั่วไปได้
โลหะแบ่งออกเป็นแสง (ความหนาแน่น 0.53 ชั่วโมง 5 ก./ซม.³) และหนัก (5 ชม. 22.5 ก./ซม.³) ทั้งนี้ขึ้นอยู่กับความหนาแน่น โลหะที่เบาที่สุดคือลิเธียม (ความหนาแน่น 0.53 ก./ซม.³) ขณะนี้ยังไม่สามารถระบุชื่อโลหะที่หนักที่สุดได้ เนื่องจากความหนาแน่นของออสเมียมและอิริเดียมซึ่งเป็นโลหะที่หนักที่สุดทั้งสองชนิดนั้นเกือบเท่ากัน (ประมาณ 22.6 g / cm3 - สองเท่าของความหนาแน่น ตะกั่ว) และเป็นการยากมากที่จะคำนวณความหนาแน่นที่แน่นอนของพวกมัน สำหรับสิ่งนี้ คุณต้องทำให้โลหะบริสุทธิ์ให้บริสุทธิ์ เนื่องจากสิ่งเจือปนใดๆ จะลดความหนาแน่นของพวกมัน
โลหะส่วนใหญ่มีความเหนียว หมายความว่าลวดโลหะสามารถดัดงอได้โดยไม่แตกหัก นี่เป็นเพราะการกระจัดของชั้นของอะตอมโลหะโดยไม่ทำลายพันธะระหว่างพวกมัน พลาสติกมากที่สุดคือ ทอง, เงินและ ทองแดง. จาก ทองสามารถทำฟอยล์หนา 0.003 มม. ซึ่งใช้สำหรับปิดทองรายการการค้า อย่างไรก็ตาม ไม่ใช่โลหะทั้งหมดที่เป็นพลาสติก สายจาก สังกะสีหรือ ดีบุกกระทืบเมื่องอ แมงกานีสและบิสมัทไม่งอเลยในระหว่างการเปลี่ยนรูป แต่จะแตกทันที ความเป็นพลาสติกยังขึ้นอยู่กับความบริสุทธิ์ของโลหะด้วย ดังนั้นโครเมียมบริสุทธิ์มากจึงมีความเหนียวมาก แต่มีการปนเปื้อนด้วยสิ่งเจือปนแม้เพียงเล็กน้อย ทำให้เปราะและแข็งขึ้น
โลหะทั้งหมดนำไฟฟ้าได้ดี ไฟฟ้า; นี่เป็นเพราะการปรากฏตัวในโครงผลึกของอิเล็กตรอนเคลื่อนที่ที่เคลื่อนที่ภายใต้การกระทำของสนามไฟฟ้า เงิน, ทองแดง และ อลูมิเนียมมีการนำไฟฟ้าสูงสุด ด้วยเหตุนี้โลหะสองชนิดสุดท้ายจึงมักใช้เป็นวัสดุสำหรับสายไฟ โซเดียมยังมีค่าการนำไฟฟ้าสูงมาก เป็นที่ทราบกันดีว่ามีการใช้ตัวนำโซเดียมในรูปของท่อสแตนเลสที่มีผนังบางซึ่งบรรจุโซเดียมไว้ในอุปกรณ์ทดลอง เนื่องจากโซเดียมมีความถ่วงจำเพาะต่ำ โดยมีความต้านทานเท่ากัน "สายไฟ" ของโซเดียมจึงเบากว่าทองแดงมากและเบากว่าอะลูมิเนียมบ้าง
การนำความร้อนสูงของโลหะยังขึ้นอยู่กับการเคลื่อนที่ของอิเล็กตรอนอิสระด้วย ดังนั้นชุดของการนำความร้อนจึงคล้ายกับชุดของการนำไฟฟ้าและตัวนำความร้อนที่ดีที่สุดเช่นไฟฟ้าคือ โซเดียมยังพบว่าใช้เป็นตัวนำความร้อนได้ดี เป็นที่รู้จักกันอย่างแพร่หลาย เช่น การใช้โซเดียมในวาล์วของเครื่องยนต์รถยนต์เพื่อปรับปรุงการระบายความร้อน
พื้นผิวเรียบของโลหะสะท้อนแสงได้มาก - ปรากฏการณ์นี้เรียกว่าความมันวาวของโลหะ อย่างไรก็ตาม ในสถานะผง โลหะส่วนใหญ่จะสูญเสียความมันวาว อลูมิเนียมและแมกนีเซียมยังคงความแวววาวเป็นผง เงินสะท้อนแสงได้ดีที่สุด และกระจกก็ทำมาจากโลหะเหล่านี้ บางครั้งโรเดียมยังใช้ทำกระจก แม้ว่าราคาจะสูงเป็นพิเศษ เนื่องจากความแข็งและความทนทานต่อสารเคมีที่สูงกว่าเงินหรือแพลเลเดียมมาก ชั้นโรเดียมจึงบางกว่าสีเงินได้มาก
สีของโลหะส่วนใหญ่จะใกล้เคียงกัน - สีเทาอ่อนกับโทนสีน้ำเงิน ทองแดงและซีเซียมตามลำดับ สีเหลือง สีแดง และสีเหลืองอ่อน
คุณสมบัติทางเคมีของโลหะ
โลหะ (Metal) is
บนชั้นอิเล็กทรอนิกส์ภายนอก โลหะส่วนใหญ่มีอิเล็กตรอนจำนวนน้อย (1-3) ดังนั้นในปฏิกิริยาส่วนใหญ่พวกมันจะทำหน้าที่เป็นตัวรีดิวซ์ (นั่นคือพวกมัน "ปล่อย" อิเล็กตรอนของพวกมัน)
1. ปฏิกิริยากับสารอย่างง่าย
โลหะทั้งหมดทำปฏิกิริยากับออกซิเจน ยกเว้นทองคำและทองคำขาว ปฏิกิริยากับเงินเกิดขึ้นที่อุณหภูมิสูง แต่ซิลเวอร์ (II) ออกไซด์จะไม่เกิดขึ้นจริง เนื่องจากมีความไม่เสถียรทางความร้อน ผลลัพธ์อาจเป็นออกไซด์ เปอร์ออกไซด์ ซูเปอร์ออกไซด์ ทั้งนี้ขึ้นอยู่กับโลหะ:
4Li + O2 = 2Li2O ลิเธียมออกไซด์
2Na + O2 = Na2O2 โซเดียมเปอร์ออกไซด์
K + O2 = KO2 โพแทสเซียมซูเปอร์ออกไซด์
เพื่อให้ได้ออกไซด์จากเปอร์ออกไซด์ เปอร์ออกไซด์จะลดลงด้วยโลหะ:
Na2O2 + 2Na = 2Na2O
สำหรับโลหะที่มีฤทธิ์ปานกลางและต่ำ ปฏิกิริยาจะเกิดขึ้นเมื่อถูกความร้อน:
3Fe + 2O2 = Fe3O4
เฉพาะโลหะที่มีปฏิกิริยามากที่สุดเท่านั้นที่ทำปฏิกิริยากับไนโตรเจน ลิเธียมเท่านั้นที่ทำปฏิกิริยาที่อุณหภูมิห้องทำให้เกิดไนไตรด์:
6Li + N2 = 2Li3N
เมื่อถูกความร้อน:
3Ca + N2 = Ca3N2
โลหะทั้งหมดทำปฏิกิริยากับกำมะถันยกเว้นทองและ แพลตตินั่ม:
เหล็กทำปฏิกิริยากับ สีเทาเมื่อถูกความร้อนจะเกิดซัลไฟด์:
โลหะที่มีปฏิกิริยามากที่สุดเท่านั้นที่ทำปฏิกิริยากับไฮโดรเจน กล่าวคือ โลหะในกลุ่ม IA และ IIA ยกเว้น Be ปฏิกิริยาจะเกิดขึ้นเมื่อถูกความร้อนและเกิดไฮไดรด์ ในปฏิกิริยา โลหะทำหน้าที่เป็นตัวรีดิวซ์ สถานะออกซิเดชันของไฮโดรเจนคือ -1:
เฉพาะโลหะที่มีปฏิกิริยามากที่สุดเท่านั้นที่ทำปฏิกิริยากับคาร์บอน ในกรณีนี้จะเกิดอะเซทิลีไนด์หรือเมทาไนด์ อะเซทิไลด์ทำปฏิกิริยากับน้ำให้อะเซทิลีน เมทาไนด์ให้ก๊าซมีเทน
2Na + 2C = Na2C2
Na2C2 + 2H2O = 2NaOH + C2H2
การผสมคือการนำองค์ประกอบเพิ่มเติมเข้าไปในการหลอมที่ปรับเปลี่ยนกลไก กายภาพ และ คุณสมบัติทางเคมีวัสดุฐาน

โครงสร้างกล้องจุลทรรศน์
คุณสมบัติเฉพาะของโลหะสามารถเข้าใจได้จาก โครงสร้างภายใน. พวกมันทั้งหมดมีการเชื่อมต่อที่อ่อนแอของอิเล็กตรอนในระดับพลังงานภายนอก (กล่าวคือ เวเลนซ์อิเล็กตรอน) กับนิวเคลียส ด้วยเหตุนี้ ความต่างศักย์ที่เกิดขึ้นในตัวนำจึงทำให้เกิดการเคลื่อนที่เหมือนหิมะถล่มของอิเล็กตรอน (เรียกว่าอิเล็กตรอนแบบสื่อกระแสไฟฟ้า) ในตะแกรงผลึก คอลเล็กชันของอิเล็กตรอนดังกล่าวมักเรียกกันว่าแก๊สอิเล็กตรอน นอกจากอิเล็คตรอนแล้ว โฟตอนยังมีส่วนช่วยในการนำความร้อนอีกด้วย (แรงสั่นสะเทือนจากตาข่าย) ความเป็นพลาสติกเกิดจากสิ่งกีดขวางพลังงานขนาดเล็กสำหรับการเคลื่อนที่ของความคลาดเคลื่อนและการเปลี่ยนแปลงของระนาบผลึกศาสตร์ ความแข็งสามารถอธิบายได้จากข้อบกพร่องทางโครงสร้างจำนวนมาก (อะตอมคั่นระหว่างหน้า ฯลฯ)
เนื่องจากการส่งคืนอิเล็กตรอนได้ง่าย การเกิดออกซิเดชันของโลหะจึงเป็นไปได้ ซึ่งอาจนำไปสู่การกัดกร่อนและการเสื่อมสลายของคุณสมบัติเพิ่มเติม ความสามารถในการออกซิไดซ์สามารถพบได้โดย แถวมาตรฐานกิจกรรมโลหะ ข้อเท็จจริงนี้ยืนยันความจำเป็นในการใช้โลหะร่วมกับองค์ประกอบอื่นๆ (โลหะผสม ที่สำคัญที่สุดคือ เหล็ก) การผสมและการใช้สารเคลือบต่างๆ
สำหรับคำอธิบายที่ถูกต้องมากขึ้น คุณสมบัติทางอิเล็กทรอนิกส์โลหะจำเป็นต้องใช้กลศาสตร์ควอนตัม ในของแข็งทั้งหมดที่มีความสมมาตรเพียงพอ ระดับพลังงานของอิเล็กตรอนของอะตอมแต่ละตัวคาบเกี่ยวกันและเกิดเป็นแถบที่อนุญาต และแถบที่เกิดจากวาเลนซ์อิเล็กตรอนจะเรียกว่าแถบวาเลนซ์ พันธะที่อ่อนแอของเวเลนซ์อิเล็กตรอนในโลหะนำไปสู่ความจริงที่ว่าแถบเวเลนซ์ในโลหะนั้นกว้างมากและวาเลนซ์อิเล็กตรอนทั้งหมดไม่เพียงพอที่จะเติมให้เต็ม
คุณลักษณะพื้นฐานของแถบที่เติมบางส่วนดังกล่าวคือแม้ที่แรงดันไฟฟ้าขั้นต่ำ การจัดเรียงอิเล็กตรอนของวาเลนซ์จะเริ่มขึ้นในตัวอย่าง กล่าวคือ กระแสไฟฟ้าไหล
การเคลื่อนที่ของอิเล็กตรอนที่สูงเช่นเดียวกันทำให้เกิดการนำความร้อนสูง รวมทั้งความสามารถในการสะท้อนแสงแบบพิเศษ รังสีแม่เหล็กไฟฟ้า(ซึ่งทำให้โลหะมีความวาวเป็นลักษณะเฉพาะ)
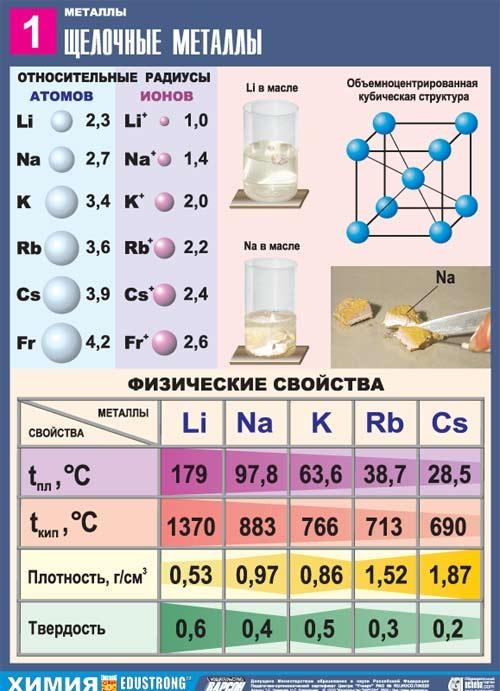
โลหะอัลคาไล
โลหะ (Metal) is
โลหะอัลคาไลเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่ม I ของตารางธาตุขององค์ประกอบทางเคมีของ D. I. Dmitry Ivanovich Mendeleev: ลิเธียม Li, โซเดียม Na, โพแทสเซียม K, รูบิเดียม Rb, ซีเซียม Cs และแฟรนเซียม Fr. โลหะเหล่านี้เรียกว่าอัลคาไลน์เนื่องจากสารประกอบส่วนใหญ่ละลายได้ในน้ำ ในภาษาสลาฟ "leach" หมายถึง "ละลาย" และสิ่งนี้เป็นตัวกำหนดชื่อของโลหะกลุ่มนี้ เมื่อโลหะอัลคาไลละลายในน้ำจะเกิดไฮดรอกไซด์ที่ละลายน้ำได้เรียกว่าอัลคาลิส
ลักษณะทั่วไปของโลหะอัลคาไล
ในตารางธาตุ พวกมันตามก๊าซเฉื่อยทันที ดังนั้นลักษณะโครงสร้างของอะตอมของโลหะอัลคาไลก็คือพวกมันประกอบด้วยอิเล็กตรอนหนึ่งตัวที่ระดับพลังงานใหม่: การกำหนดค่าทางอิเล็กทรอนิกส์ของพวกมันคือ ns1 เป็นที่แน่ชัดว่าวาเลนซ์อิเล็กตรอนของโลหะอัลคาไลสามารถขจัดออกได้ง่าย เนื่องจากอะตอมจะบริจาคอิเล็กตรอนและได้รับการกำหนดค่าของก๊าซเฉื่อยอย่างกระฉับกระเฉง ดังนั้นโลหะอัลคาไลทั้งหมดจึงมีลักษณะเฉพาะโดยลดคุณสมบัติ สิ่งนี้ได้รับการยืนยันโดยค่าที่ต่ำของศักยภาพการแตกตัวเป็นไอออน
โลหะทั้งหมดในกลุ่มย่อยนี้มีสีขาวเงิน (ยกเว้นซีเซียมสีเหลืองเงิน) พวกมันนิ่มมาก สามารถใช้มีดผ่าตัดตัดได้ ลิเธียม โซเดียม และโพแทสเซียมจะเบากว่าน้ำและลอยอยู่บนผิวน้ำ ทำปฏิกิริยากับมัน
โลหะอัลคาไลเกิดขึ้นตามธรรมชาติในรูปของสารประกอบที่มีไอออนบวกที่มีประจุเดี่ยว แร่ธาตุหลายชนิดประกอบด้วยโลหะในกลุ่มย่อยหลักของกลุ่ม I ตัวอย่างเช่น ออร์โธคลอสหรือเฟลด์สปาร์ประกอบด้วยโพแทสเซียมอะลูมิโนซิลิเกต K2 คล้ายกับ แร่ซึ่งประกอบด้วยโซเดียม - อัลไบต์ - มีองค์ประกอบ Na2 น้ำทะเลประกอบด้วยโซเดียมคลอไรด์ NaCl และดินมีเกลือโพแทสเซียม - sylvin KCl, sylvinite NaCl KCl, คาร์นัลไลต์ KCl. MgCl2 . 6H2O, โพลีเฮไลต์ K2SO4 MgSO4 CaSO4 . 2H2O.
คุณสมบัติทางเคมีของโลหะอัลคาไล
โลหะ (Metal) is
เนื่องจากกิจกรรมทางเคมีสูงของโลหะอัลคาไลที่สัมพันธ์กับน้ำ ออกซิเจน ไนโตรเจน พวกมันจึงถูกเก็บไว้ภายใต้ชั้นของน้ำมันก๊าด ในการทำปฏิกิริยากับโลหะอัลคาไลชิ้นที่มีขนาดที่ต้องการจะถูกตัดอย่างระมัดระวังด้วยมีดผ่าตัดใต้ชั้น น้ำมันก๊าดในบรรยากาศอาร์กอน ให้ทำความสะอาดพื้นผิวโลหะอย่างทั่วถึงจากผลิตภัณฑ์ที่มีปฏิสัมพันธ์กับอากาศ จากนั้นจึงวางตัวอย่างลงในถังปฏิกิริยา
1. ปฏิสัมพันธ์กับน้ำ คุณสมบัติที่สำคัญของโลหะอัลคาไลคือกิจกรรมที่สูงเมื่อเทียบกับน้ำ ลิเธียมทำปฏิกิริยากับน้ำอย่างสงบที่สุด (ไม่มีการระเบิด)
เมื่อทำปฏิกิริยาที่คล้ายกัน โซเดียมจะเผาไหม้ด้วยเปลวไฟสีเหลืองและเกิดการระเบิดเล็กน้อย โพแทสเซียมมีความกระตือรือร้นมากขึ้น ในกรณีนี้ การระเบิดจะรุนแรงกว่ามาก และเปลวไฟเป็นสีม่วง
2. ปฏิสัมพันธ์กับออกซิเจน ผลิตภัณฑ์การเผาไหม้ของโลหะอัลคาไลในอากาศมี องค์ประกอบที่แตกต่างกันขึ้นอยู่กับกิจกรรมของโลหะ
ลิเธียมเท่านั้นที่เผาไหม้ในอากาศเพื่อสร้างออกไซด์ขององค์ประกอบปริมาณสัมพันธ์
ในระหว่างการเผาไหม้โซเดียม เปอร์ออกไซด์ Na2O2 ส่วนใหญ่ถูกสร้างขึ้นด้วยส่วนผสมของซูเปอร์ออกไซด์ NaO2 เล็กน้อย
ผลิตภัณฑ์จากการเผาไหม้ของโพแทสเซียม รูบิเดียม และซีเซียมประกอบด้วยซุปเปอร์ออกไซด์เป็นส่วนใหญ่
เพื่อให้ได้ออกไซด์ของโซเดียมและโพแทสเซียม ส่วนผสมของไฮดรอกไซด์ เปอร์ออกไซด์หรือซูเปอร์ออกไซด์จะถูกทำให้ร้อนด้วยโลหะส่วนเกินในกรณีที่ไม่มีออกซิเจน
สำหรับสารประกอบออกซิเจนของโลหะอัลคาไล ลักษณะเฉพาะดังต่อไปนี้: เมื่อรัศมีของไอออนบวกของโลหะอัลคาไลเพิ่มขึ้น ความคงตัวของสารประกอบออกซิเจนที่มีเปอร์ออกไซด์ไอออน O22- และซูเปอร์ออกไซด์ไอออน O2- จะเพิ่มขึ้น
โลหะอัลคาไลหนักมีลักษณะเฉพาะโดยการก่อตัวของโอโซนที่ค่อนข้างเสถียรขององค์ประกอบ EO3 สารประกอบออกซิเจนทั้งหมดมีสีต่างกัน ซึ่งความเข้มของสีจะเข้มขึ้นในอนุกรมตั้งแต่ Li ถึง Cs
ออกไซด์ของโลหะอัลคาไลมีคุณสมบัติทั้งหมดของออกไซด์พื้นฐาน: ทำปฏิกิริยากับน้ำ กรดออกไซด์และกรด
เปอร์ออกไซด์และซูเปอร์ออกไซด์แสดงคุณสมบัติของตัวออกซิไดซ์ที่แรง
เปอร์ออกไซด์และซูเปอร์ออกไซด์ทำปฏิกิริยารุนแรงกับน้ำ เกิดเป็นไฮดรอกไซด์
3. ปฏิกิริยากับสารอื่น ๆ โลหะอัลคาไลทำปฏิกิริยากับอโลหะหลายชนิด เมื่อถูกความร้อน จะรวมตัวกับไฮโดรเจนเพื่อสร้างไฮไดรด์ โดยมีฮาโลเจน สีเทา, ไนโตรเจน, ฟอสฟอรัส, คาร์บอนและซิลิกอนเพื่อสร้างเฮไลด์, ซัลไฟด์, ไนไตรด์, ฟอสไฟด์, คาร์ไบด์และซิลิไซด์ตามลำดับ
เมื่อถูกความร้อน โลหะอัลคาไลสามารถทำปฏิกิริยากับโลหะอื่นๆ ทำให้เกิดสารประกอบระหว่างโลหะได้ โลหะอัลคาไลทำปฏิกิริยาอย่างแข็งขัน (ด้วยการระเบิด) กับกรด
โลหะอัลคาไลละลายในแอมโมเนียเหลวและอนุพันธ์ - เอมีนและเอไมด์
เมื่อละลายในแอมโมเนียเหลว โลหะอัลคาไลจะสูญเสียอิเล็กตรอน ซึ่งถูกละลายโดยโมเลกุลแอมโมเนียและทำให้สารละลายมีสีฟ้า เอไมด์ที่เกิดขึ้นจะถูกย่อยสลายได้ง่ายด้วยน้ำด้วยการก่อตัวของอัลคาไลและแอมโมเนีย
โลหะอัลคาไลทำปฏิกิริยากับสารอินทรีย์ แอลกอฮอล์ (กับการก่อตัวของแอลกอฮอล์) และกรดคาร์บอกซิลิก (ด้วยการก่อตัวของเกลือ)
4. การกำหนดคุณภาพของโลหะอัลคาไล เนื่องจากศักยภาพการแตกตัวเป็นไอออนของโลหะอัลคาไลมีขนาดเล็ก เมื่อโลหะหรือสารประกอบของโลหะถูกทำให้ร้อนในเปลวไฟ อะตอมจะแตกตัวเป็นไอออน ทำให้เปลวไฟมีสีที่แน่นอน
รับโลหะอัลคาไล
1. เพื่อให้ได้โลหะอัลคาไล ส่วนใหญ่จะใช้อิเล็กโทรไลซิสของการหลอมเหลวของเฮไลด์ ซึ่งส่วนใหญ่มักจะเป็นคลอไรด์ ซึ่งก่อตัวตามธรรมชาติ แร่ธาตุ:
แคโทด: Li+ + e → Li
ขั้วบวก: 2Cl- - 2e → Cl2
2. บางครั้งเพื่อให้ได้โลหะอัลคาไลอิเล็กโทรไลซิสของการหลอมของไฮดรอกไซด์จะดำเนินการ:
แคโทด: Na+ + e → Na
แอโนด: 4OH- - 4e → 2H2O + O2
เนื่องจากโลหะอัลคาไลอยู่ทางด้านซ้ายของไฮโดรเจนในชุดแรงดันไฟฟ้าแบบไฟฟ้าเคมี จึงเป็นไปไม่ได้ที่จะได้รับจากสารละลายเกลือด้วยไฟฟ้า ในกรณีนี้จะเกิดอัลคาไลและไฮโดรเจนที่สอดคล้องกัน
ไฮดรอกไซด์
สำหรับการผลิตโลหะอัลคาไลไฮดรอกไซด์ส่วนใหญ่จะใช้วิธีอิเล็กโทรไลต์ ขนาดใหญ่ที่สุดคือการผลิตโซเดียมไฮดรอกไซด์โดยอิเล็กโทรไลซิสของสารละลายเข้มข้นในน้ำเกลือทั่วไป
ก่อนหน้านี้ อัลคาไลได้มาจากปฏิกิริยาแลกเปลี่ยน
ด่างที่ได้รับในลักษณะนี้ปนเปื้อนอย่างมากด้วยโซดา Na2CO3
ไฮดรอกไซด์ของโลหะอัลคาไลเป็นสารดูดความชื้นสีขาวซึ่งมีสารละลายที่เป็นน้ำเป็นเบสที่แข็งแรง พวกเขามีส่วนร่วมในลักษณะปฏิกิริยาทั้งหมดของเบส - ทำปฏิกิริยากับกรดออกไซด์ที่เป็นกรดและแอมโฟเทอริกออกไซด์แอมโฟเทอริกไฮดรอกไซด์
ไฮดรอกไซด์ของโลหะอัลคาไลประเสริฐโดยไม่มีการสลายตัวเมื่อถูกความร้อน ยกเว้นลิเธียมไฮดรอกไซด์ ซึ่งเช่นเดียวกับไฮดรอกไซด์ของโลหะในกลุ่มย่อยหลักของกลุ่ม II จะสลายตัวเป็นออกไซด์และน้ำเมื่อเผา
โซเดียมไฮดรอกไซด์ใช้ทำสบู่ ผงซักฟอกสังเคราะห์ เส้นใยประดิษฐ์ สารประกอบอินทรีย์เช่น ฟีนอล
คาร์บอเนต
ผลิตภัณฑ์ที่สำคัญที่มีโลหะอัลคาไลคือโซดา Na2CO3 ปริมาณโซดาไฟหลักทั่วโลกผลิตขึ้นตามวิธีของ Solvay ซึ่งเสนอเมื่อต้นศตวรรษที่ 20 สาระสำคัญของวิธีการมีดังนี้: สารละลาย NaCl ในน้ำซึ่งเติมแอมโมเนียอิ่มตัวด้วยคาร์บอนไดออกไซด์ที่อุณหภูมิ 26 - 30 ° C ในกรณีนี้จะเกิดโซเดียมไบคาร์บอเนตที่ละลายได้ไม่ดีซึ่งเรียกว่าเบกกิ้งโซดา
แอมโมเนียถูกเติมเพื่อทำให้สภาพแวดล้อมที่เป็นกรดเป็นกลางซึ่งเกิดขึ้นเมื่อคาร์บอนไดออกไซด์ถูกส่งผ่านเข้าไปในสารละลายและเพื่อให้ได้ HCO3- ไบคาร์บอเนตไอออนที่จำเป็นสำหรับการตกตะกอนของโซเดียมไบคาร์บอเนต หลังจากแยกเบกกิ้งโซดาแล้ว สารละลายที่มีแอมโมเนียมคลอไรด์จะถูกทำให้ร้อนด้วยปูนขาวและแอมโมเนียจะถูกปล่อยออกมา ซึ่งจะถูกส่งกลับไปยังโซนปฏิกิริยา
ดังนั้นด้วยวิธีการผลิตโซดาแอมโมเนีย ของเสียเพียงอย่างเดียวคือแคลเซียมคลอไรด์ ซึ่งยังคงอยู่ในสารละลายและมีการใช้งานจำกัด
เมื่อโซเดียมไบคาร์บอเนตถูกเผา โซดาแอช หรือการล้าง จะได้ Na2CO3 และคาร์บอนไดออกไซด์ ซึ่งใช้ในกระบวนการรับโซเดียมไบคาร์บอเนต
ผู้ซื้อหลักของโซดาคือแก้ว
แตกต่างจากที่ไม่ละลายน้ำ เกลือกรด NaHCO3 โพแทสเซียมไบคาร์บอเนต KHCO3 ละลายได้ดีในน้ำ ดังนั้นโพแทสเซียมคาร์บอเนตหรือโปแตช K2CO3 ได้มาจากการกระทำของคาร์บอนไดออกไซด์ในสารละลายโพแทสเซียมไฮดรอกไซด์
โปแตชใช้ในการผลิตสบู่แก้วและสบู่เหลว
ลิเธียมเป็นโลหะอัลคาไลเพียงชนิดเดียวที่ไม่ได้รับไบคาร์บอเนต สาเหตุของปรากฏการณ์นี้คือรัศมีที่เล็กมากของลิเธียมไอออน ซึ่งทำให้ไม่สามารถเก็บ HCO3- ion ที่ค่อนข้างใหญ่ได้
ลิเธียม
โลหะ (Metal) is
ลิเธียมเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มแรก ช่วงที่สอง ระบบเป็นระยะองค์ประกอบทางเคมี D.I. Mendeleev Dmitry Ivanovichมีเลขอะตอม 3 แทนด้วยสัญลักษณ์ Li (lat. Lithium) ลิเธียมสารอย่างง่าย (หมายเลข CAS: 7439-93-2) เป็นโลหะอัลคาไลสีขาวนวลสีเงินอ่อน
ลิเธียมถูกค้นพบในปี พ.ศ. 2360 โดยนักเคมีและนักแร่วิทยาชาวสวีเดนชื่อ A. Arfvedson ครั้งแรกในแร่ petalite (Li,Na) และต่อมาใน spodumene LiAl และใน lepidolite KLi1.5Al1.5(F,OH)2 โลหะลิเธียมถูกค้นพบครั้งแรกโดย Humphry Davy ในปี 1825
ลิเธียมได้ชื่อมาเพราะพบใน "หิน" (กรีก λίθος - หิน) เดิมเรียกว่า "ลิเธียน" ชื่อทันสมัยเสนอโดย Berzelius
ลิเธียมเป็นโลหะสีขาวสีเงิน อ่อนและเหนียว แข็งกว่าโซเดียมแต่อ่อนกว่าตะกั่ว สามารถแปรรูปได้ด้วยการกดและกลิ้ง
ที่อุณหภูมิห้อง ลิเธียมโลหะมีโครงตาข่ายที่มีตัวเป็นศูนย์กลางลูกบาศก์ (การประสานงานหมายเลข 8) ซึ่งเมื่อเย็นลงแล้ว จะกลายเป็นตาข่ายที่อัดแน่นด้วยลูกบาศก์ โดยที่แต่ละอะตอมมีการประสานกันรูปลูกบาศก์คู่ล้อมรอบไปด้วยอีก 12 อะตอม ที่ต่ำกว่า 78 K รูปแบบผลึกที่เสถียรคือโครงสร้างที่อัดแน่นเป็นรูปหกเหลี่ยม ซึ่งแต่ละอะตอมของลิเธียมจะมีเพื่อนบ้านที่ใกล้ที่สุด 12 แห่งซึ่งตั้งอยู่ที่จุดยอดของทรงลูกบาศก์
ในบรรดาโลหะอัลคาไลทั้งหมด ลิเธียมมีจุดหลอมเหลวและจุดเดือดสูงสุด (180.54 และ 1340 องศาเซลเซียส ตามลำดับ) และความหนาแน่นต่ำสุดที่อุณหภูมิห้องของโลหะใดๆ (0.533 ก./ซม.³ เกือบครึ่งหนึ่งของน้ำ)
อะตอมลิเธียมขนาดเล็กทำให้เกิดคุณสมบัติพิเศษของโลหะ ตัวอย่างเช่น มันผสมกับโซเดียมที่อุณหภูมิต่ำกว่า 380 ° C เท่านั้น และไม่ผสมกับโพแทสเซียมที่หลอมเหลว รูบิเดียม และซีเซียม ในขณะที่โลหะอัลคาไลคู่อื่นๆ จะผสมกันในอัตราส่วนใดๆ
โลหะอัลคาไล ไม่เสถียรในอากาศ ลิเธียมเป็นโลหะอัลคาไลที่มีฤทธิ์น้อยที่สุด แทบไม่ทำปฏิกิริยากับอากาศแห้ง (และแม้แต่ออกซิเจนแห้ง) ที่อุณหภูมิห้อง
ในอากาศชื้น มันจะออกซิไดซ์อย่างช้าๆ กลายเป็น Li3N ไนไตรด์ LiOH ไฮดรอกไซด์ และ Li2CO3 คาร์บอเนต ในออกซิเจนเมื่อถูกความร้อนจะเผาไหม้กลายเป็นออกไซด์ Li2O มี คุณสมบัติที่น่าสนใจในช่วงอุณหภูมิตั้งแต่ 100 °C ถึง 300 °C ลิเธียมจะถูกปกคลุมด้วยฟิล์มออกไซด์ที่มีความหนาแน่นสูงและไม่เกิดออกซิไดซ์เพิ่มเติม
ในปี ค.ศ. 1818 นักเคมีชาวเยอรมันชื่อ Leopold Gmelin พบว่าลิเธียมและเกลือของลิเธียมทำให้เปลวไฟสีแดงเลือดนก ซึ่งเป็นสัญญาณบ่งชี้คุณภาพในการหาลิเธียม อุณหภูมิจุดติดไฟอยู่ที่ประมาณ 300 °C ผลิตภัณฑ์จากการเผาไหม้จะระคายเคืองต่อเยื่อเมือกของช่องจมูก
ทำปฏิกิริยากับน้ำอย่างสงบ โดยปราศจากการระเบิดและการจุดไฟ ก่อตัวเป็น LiOH และ H2 นอกจากนี้ยังทำปฏิกิริยากับเอทิลแอลกอฮอล์ ก่อตัวเป็นแอลกอฮอล์ กับแอมโมเนียและกับฮาโลเจน (มีไอโอดีน - เมื่อถูกความร้อนเท่านั้น)
ลิเธียมถูกเก็บไว้ในปิโตรเลียมอีเทอร์ พาราฟิน น้ำมันเบนซิน และ/หรือน้ำมันแร่ในกระป๋องที่ปิดสนิท โลหะลิเธียมทำให้เกิดแผลไหม้เมื่อสัมผัสกับผิวหนัง เยื่อเมือก และตา
ในโลหะวิทยาที่เป็นเหล็กและนอกกลุ่มเหล็ก ลิเธียมใช้เพื่อขจัดออกซิไดซ์และเพิ่มความเหนียวและความแข็งแรงของโลหะผสม ลิเธียมบางครั้งใช้สำหรับการลดโลหะหายากโดยวิธีทางความร้อนโลหะ
ลิเธียมคาร์บอเนตเป็นสารเสริมที่สำคัญที่สุด (เพิ่มลงในอิเล็กโทรไลต์) ในการหลอมอลูมิเนียมและปริมาณการใช้เพิ่มขึ้นทุกปีตามสัดส่วนของปริมาณการผลิตอลูมิเนียมของโลก (ต้นทุนของลิเธียมคาร์บอเนตอยู่ที่ 2.5-3.5 กิโลกรัมต่อตันถลุง อะลูมิเนียม)
โลหะผสมลิเธียมที่มีเงินและทอง เช่นเดียวกับคิวรัม เป็นสารบัดกรีที่มีประสิทธิภาพมาก โลหะผสมของลิเธียมกับแมกนีเซียม สแกนเดียม คิวรัม แคดเมียม และอะลูมิเนียม เป็นวัสดุใหม่ที่มีแนวโน้มว่าจะนำมาใช้ในการบินและอวกาศ จากลิเธียมอะลูมิเนตและซิลิเกต เซรามิกส์ได้ถูกสร้างให้แข็งตัวที่อุณหภูมิห้องและนำไปใช้ใน อุปกรณ์ทางทหารโลหวิทยาและในอนาคตในพลังงานแสนสาหัส แก้วที่ใช้ลิเธียม-อะลูมิเนียม-ซิลิเกตเสริมด้วยเส้นใยซิลิกอนคาร์ไบด์มีความแข็งแรงสูง ลิเธียมมีประสิทธิภาพมากในการเสริมความแข็งแกร่งของโลหะผสมตะกั่วและให้ความเหนียวและความต้านทานการกัดกร่อน
เกลือลิเธียมมีผลทางจิตและใช้ในยาสำหรับการป้องกันและรักษา ป่วยทางจิต. ลิเธียมคาร์บอเนตเป็นเรื่องธรรมดาที่สุดในความสามารถนี้ ใช้ในจิตเวชเพื่อรักษาอารมณ์ของผู้ที่ทุกข์ทรมานจากโรคสองขั้วและอารมณ์แปรปรวนบ่อยครั้ง มีประสิทธิภาพในการป้องกันภาวะซึมเศร้าและลดการฆ่าตัวตาย แพทย์ได้สังเกตซ้ำ ๆ ว่าสารประกอบลิเธียมบางชนิด (ในปริมาณที่เหมาะสมแน่นอน) มี อิทธิพลเชิงบวกในคนไข้ที่เป็นโรคซึมเศร้า เอฟเฟกต์นี้อธิบายได้สองวิธี ในอีกด้านหนึ่ง มีการระบุแล้วว่าลิเธียมสามารถควบคุมการทำงานของเอนไซม์บางชนิดที่เกี่ยวข้องกับการถ่ายโอนโซเดียมและโพแทสเซียมไอออนจากของเหลวระหว่างเซลล์ไปยังเซลล์สมอง ในทางกลับกัน มีการสังเกตว่าลิเธียมไอออนส่งผลโดยตรงต่อความสมดุลของไอออนิกของเซลล์ และสภาพของผู้ป่วยขึ้นอยู่กับความสมดุลของโซเดียมและโพแทสเซียมในระดับสูง: โซเดียมส่วนเกินในเซลล์เป็นลักษณะเฉพาะของผู้ป่วยที่เป็นโรคซึมเศร้าซึ่งเป็นข้อบกพร่องสำหรับผู้ที่ทุกข์ทรมานจากความบ้าคลั่ง เกลือลิเธียมที่ปรับสมดุลโซเดียมโพแทสเซียมมีผลดีต่อทั้งสองอย่าง
โซเดียม
โลหะ (Metal) is
โซเดียมเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มแรก ที่สาม ระยะเวลาระบบธาตุเคมี D.I. ดมีตรี อิวาโนวิช เมนเดเลเยฟด้วยเลขอะตอม 11 แสดงด้วยสัญลักษณ์นา (lat. Natrium) สารโซเดียมอย่างง่าย (หมายเลข CAS: 7440-23-5) เป็นโลหะอัลคาไลสีขาวนวลสีเงินอ่อน
ในน้ำ โซเดียมมีพฤติกรรมเกือบเหมือนกับลิเธียม: ปฏิกิริยาเกิดขึ้นจากการปลดปล่อยไฮโดรเจนอย่างรวดเร็ว โซเดียมไฮดรอกไซด์จะก่อตัวขึ้นในสารละลาย
โซเดียม (หรือมากกว่าสารประกอบของมัน) ถูกใช้มาตั้งแต่สมัยโบราณ ตัวอย่างเช่น โซดา (natron) ซึ่งพบตามธรรมชาติในน่านน้ำของทะเลสาบโซดาในอียิปต์ ชาวอียิปต์โบราณใช้โซดาธรรมชาติสำหรับดอง ฟอกผ้าใบ ทำอาหาร ทำสีและเคลือบ พลินีผู้เฒ่าเขียนว่าในสามเหลี่ยมปากแม่น้ำไนล์ โซดา (มีสัดส่วนของสิ่งสกปรกเพียงพอ) ถูกแยกออกจากน้ำในแม่น้ำ มันขายเป็นชิ้นใหญ่เนื่องจากส่วนผสมของถ่านหินทาสีเทาหรือสีดำ
นักเคมีชาวอังกฤษ Humphry Davy ได้รับโซเดียมเป็นครั้งแรกในปี พ.ศ. 2350 โดยอิเล็กโทรไลซิสของ NaOH ที่เป็นของแข็ง
ชื่อ "โซเดียม" (natrium) มาจากภาษาอาหรับ natrun (ในภาษากรีก - ไนตรอน) และเดิมเรียกว่าโซดาธรรมชาติ ธาตุนี้ก่อนหน้านี้เรียกว่าโซเดียม (lat. Sodium)

โซเดียมเป็นโลหะสีขาวเงิน มีชั้นบางๆ มี โทนสีม่วง, พลาสติกที่อ่อนนุ่ม (ตัดด้วยมีดได้ง่าย) โซเดียมชิ้นใหม่วาววับ ค่าการนำไฟฟ้าและความร้อนของโซเดียมค่อนข้างสูง ความหนาแน่น 0.96842 g/cm³ (ที่ 19.7°C) จุดหลอมเหลว 97.86°C และจุดเดือด 883.15°C
โลหะอัลคาไล ออกซิไดซ์ได้ง่ายในอากาศ เพื่อป้องกันออกซิเจนในบรรยากาศ โซเดียมโลหะเก็บไว้ด้านล่าง น้ำมันก๊าด. โซเดียมมีการใช้งานน้อยกว่าลิเธียม ดังนั้นจึงทำปฏิกิริยากับไนโตรเจนเมื่อถูกความร้อนเท่านั้น:
โซเดียมเปอร์ออกไซด์จะเกิดขึ้นเมื่อมีออกซิเจนมากเกินไป
2Na + O2 = Na2O2
โลหะโซเดียมถูกนำมาใช้กันอย่างแพร่หลายในเคมีเตรียมการและ อุตสาหกรรมเป็นตัวรีดิวซ์ที่แรง รวมทั้งในโลหะวิทยา โซเดียมใช้ในการผลิตแบตเตอรี่โซเดียมซัลเฟอร์ที่ใช้พลังงานสูง มันยังใช้ในวาล์วไอเสียของรถบรรทุกเป็นแผงระบายความร้อน ในบางครั้ง โซเดียมโลหะถูกใช้เป็นวัสดุสำหรับสายไฟฟ้าที่ออกแบบมาสำหรับกระแสที่สูงมาก
ในโลหะผสมที่มีโพแทสเซียม รูบิเดียมและซีเซียม ใช้เป็นสารหล่อเย็นที่มีประสิทธิภาพสูง โดยเฉพาะอย่างยิ่ง โลหะผสมของโซเดียมองค์ประกอบ 12% โพแทสเซียม 47% ซีเซียม 41% มีจุดหลอมเหลวต่ำเป็นประวัติการณ์ที่ −78 °C และเสนอให้เป็นสารทำงานสำหรับเครื่องยนต์จรวดไอออนและเป็นสารหล่อเย็นสำหรับโรงไฟฟ้านิวเคลียร์
โซเดียมยังใช้ในหลอดดิสชาร์จแรงดันสูงและแรงดันต่ำ (HLD และ HLD) โคมไฟประเภท NLVD DNaT (Arc Sodium Tubular) ใช้กันอย่างแพร่หลายในไฟถนน พวกเขาให้แสงสีเหลืองสดใส อายุการใช้งานของหลอด HPS คือ 12-24,000 ชั่วโมง ดังนั้นหลอดปล่อยก๊าซประเภท DNaT จึงจำเป็นสำหรับแสงในเมือง สถาปัตยกรรม และอุตสาหกรรม นอกจากนี้ยังมีหลอดไฟ DNaS, DNaMT (Arc Sodium Matte), DNaZ (Arc Sodium Mirror) และ DNaTBR (Arc Sodium Tubular ไม่มีปรอท)
โลหะโซเดียมถูกนำมาใช้ใน การวิเคราะห์เชิงคุณภาพ อินทรียฺวัตถุ. โลหะผสมของโซเดียมและสารทดสอบถูกทำให้เป็นกลางด้วยเอธานอลเติมน้ำกลั่นสองสามมิลลิลิตรแล้วแบ่งออกเป็น 3 ส่วนคือ J. Lassen (1843) มีวัตถุประสงค์เพื่อกำหนดไนโตรเจนกำมะถันและฮาโลเจน ( พยายามไบลสไตน์)
โซเดียมคลอไรด์ (เกลือทั่วไป) เป็นเครื่องปรุงและสารกันบูดที่เก่าแก่ที่สุดที่ใช้
โซเดียมเอไซด์ (Na3N) ใช้เป็นสารไนไตรดิ้งในโลหะวิทยาและในการผลิตตะกั่วเอไซด์
โซเดียมไซยาไนด์ (NaCN) ใช้ในวิธีการไฮโดรเมทัลโลจิคัลในการชะทองออกจากหิน เช่นเดียวกับในไนโตรคาร์บูไรซิ่งเหล็กและการชุบด้วยไฟฟ้า (เงิน ปิดทอง)
โซเดียมคลอเรต (NaClO3) ใช้เพื่อทำลายพืชที่ไม่ต้องการบนรางรถไฟ
โพแทสเซียม
โพแทสเซียมเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มที่สี่ ระยะเวลาของระบบธาตุเคมีของ D. I. Mendeleev Dmitry Ivanovich ที่มีเลขอะตอม 19 แทนด้วยสัญลักษณ์ K (lat. Kalium) สารโพแทสเซียมอย่างง่าย (หมายเลข CAS: 7440-09-7) เป็นโลหะอัลคาไลสีขาวนวลสีเงินอ่อน
โดยธรรมชาติแล้ว โพแทสเซียมจะพบได้ในสารประกอบที่มีธาตุอื่นๆ เท่านั้น เช่น ในน้ำทะเล เช่นเดียวกับในแร่ธาตุหลายชนิด มันออกซิไดซ์อย่างรวดเร็วในอากาศและทำปฏิกิริยาได้ง่ายมาก โดยเฉพาะอย่างยิ่งกับน้ำ กลายเป็นด่าง คุณสมบัติทางเคมีของโพแทสเซียมมีความคล้ายคลึงกับโซเดียมในหลาย ๆ ด้าน แต่ในแง่ของการทำงานทางชีวภาพและการใช้โดยเซลล์ของสิ่งมีชีวิตนั้นยังคงแตกต่างกัน
โพแทสเซียม (ที่แม่นยำกว่าคือสารประกอบ) ถูกใช้มาตั้งแต่สมัยโบราณ ดังนั้นการผลิตโปแตช (ซึ่งใช้เป็นผงซักฟอก) มีอยู่แล้วในศตวรรษที่ 11 เถ้าที่เกิดขึ้นระหว่างการเผาไหม้ฟางหรือไม้ได้รับการรักษาด้วยน้ำ และสารละลายที่ได้ (เหล้า) ระเหยหลังจากการกรอง กากแห้ง นอกเหนือจากโพแทสเซียมคาร์บอเนตแล้ว ยังมีโพแทสเซียมซัลเฟต K2SO4 โซดา และโพแทสเซียมคลอไรด์ KCl
ในปี ค.ศ. 1807 Davy นักเคมีชาวอังกฤษได้แยกโปแตสเซียมด้วยกระแสไฟฟ้าของโซดาไฟที่เป็นของแข็ง (KOH) และตั้งชื่อมันว่า "โพแทสเซียม" (lat. โพแทสเซียม ชื่อนี้ยังคงใช้กันทั่วไปในภาษาอังกฤษ ฝรั่งเศส สเปน โปรตุเกส และโปแลนด์) ในปี พ.ศ. 2352 แอล. วี. กิลเบิร์ตเสนอชื่อ "โพแทสเซียม" (lat. kalium จากภาษาอาหรับ al-kali - โปแตช) ชื่อนี้รวมอยู่ใน เยอรมัน, จากที่นั่นไปยังภาษาส่วนใหญ่ของภาคเหนือและ ของยุโรปตะวันออก(รวมถึงรัสเซีย) และ "ชนะ" เมื่อเลือกสัญลักษณ์สำหรับองค์ประกอบนี้ - K.
โพแทสเซียมเป็นสารสีเงินที่มีลักษณะเป็นมันเงาบนพื้นผิวที่เพิ่งสร้างใหม่ น้ำหนักเบาและน้ำหนักเบามาก ละลายได้ดีในปรอท ทำให้เกิดอะมัลกัม เมื่อนำโพแทสเซียมเข้าไปในเปลวไฟของเตาเผา (เช่นเดียวกับสารประกอบ) จะทำให้เปลวไฟเป็นสีชมพูม่วง
โพแทสเซียม เช่นเดียวกับโลหะอัลคาไลอื่น ๆ แสดงคุณสมบัติของโลหะโดยทั่วไป และมีปฏิกิริยาสูง ให้อิเล็กตรอนได้ง่าย
เป็นตัวรีดิวซ์ที่แข็งแกร่ง มันรวมกับออกซิเจนอย่างแข็งขันจนไม่ใช่ออกไซด์ที่เกิดขึ้น แต่เป็นโพแทสเซียมซูเปอร์ออกไซด์ KO2 (หรือ K2O4) เมื่อถูกความร้อนในบรรยากาศไฮโดรเจน จะเกิดโพแทสเซียมไฮไดรด์ KH มันเข้ากันได้ดีกับอโลหะทั้งหมด ก่อตัวเป็นเฮไลด์ ซัลไฟด์ ไนไตรด์ ฟอสไฟด์ ฯลฯ เช่นเดียวกับสารที่ซับซ้อน เช่น น้ำ (ปฏิกิริยาเกิดขึ้นกับการระเบิด) ออกไซด์และเกลือต่างๆ ในกรณีนี้จะลดโลหะอื่นๆ ให้อยู่ในสถานะอิสระ
โพแทสเซียมถูกเก็บไว้ภายใต้ชั้นของน้ำมันก๊าด
โลหะผสมของโพแทสเซียมและโซเดียมซึ่งเป็นของเหลวที่อุณหภูมิห้องถูกใช้เป็นสารหล่อเย็นในระบบปิด เช่น ในโรงไฟฟ้านิวเคลียร์แบบนิวตรอนแบบเร็ว นอกจากนี้ยังใช้โลหะผสมเหลวกับรูบิเดียมและซีเซียมอย่างแพร่หลาย โลหะผสมของโซเดียม 12% โพแทสเซียม 47% ซีเซียม 41% มีจุดหลอมเหลวต่ำเป็นประวัติการณ์ที่ −78 °C
สารประกอบโพแทสเซียมเป็นองค์ประกอบทางชีวภาพที่สำคัญที่สุดและดังนั้นจึงใช้เป็นปุ๋ย
เกลือโพแทสเซียมมีการใช้กันอย่างแพร่หลายในการชุบด้วยไฟฟ้า เพราะถึงแม้จะมีราคาค่อนข้างสูง แต่ก็มักจะละลายได้ดีกว่าเกลือโซเดียมที่สอดคล้องกัน ดังนั้นจึงมั่นใจได้ว่าอิเล็กโทรไลต์จะทำงานอย่างเข้มข้นที่ความหนาแน่นกระแสที่เพิ่มขึ้น
โพแทสเซียมเป็นองค์ประกอบทางชีวภาพที่สำคัญที่สุด โดยเฉพาะอย่างยิ่งในอาณาจักรพืช ด้วยการขาดโพแทสเซียมในดิน พืชจึงพัฒนาได้ไม่ดีนัก มันจึงลดลง ดังนั้นประมาณ 90% ของเกลือโพแทสเซียมที่สกัดออกมาจึงถูกใช้เป็นปุ๋ย
โพแทสเซียมพร้อมกับไนโตรเจนและฟอสฟอรัสเป็นธาตุอาหารหลักในพืช หน้าที่ของโพแทสเซียมในพืชรวมถึงองค์ประกอบอื่น ๆ ที่จำเป็นสำหรับพวกเขานั้นมีความเฉพาะเจาะจงอย่างยิ่ง ในพืช โพแทสเซียมอยู่ในรูปไอออนิก โพแทสเซียมส่วนใหญ่พบในไซโตพลาสซึมและแวคิวโอลของเซลล์ โพแทสเซียมประมาณ 80% พบได้ในน้ำนมเซลล์
หน้าที่ของโพแทสเซียมมีความหลากหลายมาก เป็นที่ยอมรับแล้วว่าช่วยกระตุ้นการสังเคราะห์ด้วยแสงตามปกติช่วยเพิ่มการไหลออกของคาร์โบไฮเดรตจากใบมีดไปยังอวัยวะอื่น ๆ รวมถึงการสังเคราะห์น้ำตาล
โพแทสเซียมช่วยเพิ่มการสะสมของโมโนแซ็กคาไรด์ในพืชผลและผัก เพิ่มปริมาณน้ำตาลในพืชหัว แป้งในมันฝรั่ง ทำให้ผนังเซลล์ของฟางของพืชธัญพืชหนาขึ้น และเพิ่มความทนทานต่อที่พักของขนมปัง และปรับปรุงคุณภาพเส้นใยในแฟลกซ์และ กัญชา.
ส่งเสริมการสะสมของคาร์โบไฮเดรตในเซลล์พืช โปแตสเซียมจะเพิ่มแรงดันออสโมติกของน้ำนมเซลล์ ดังนั้นจึงเพิ่มความต้านทานความหนาวเย็นและความต้านทานน้ำค้างแข็งของพืช
โพแทสเซียมถูกดูดซึมโดยพืชในรูปของไอออนบวกและเห็นได้ชัดว่ายังคงอยู่ในเซลล์ในรูปแบบนี้ซึ่งกระตุ้นชีวเคมีที่สำคัญที่สุด กระบวนการในเซลล์พืช โพแทสเซียมจะเพิ่มความต้านทานต่อโรคต่างๆ ทั้งในช่วงฤดูปลูกและหลังการเก็บเกี่ยว ช่วยเพิ่มคุณภาพการรักษาผักและผลไม้ได้อย่างมาก
การขาดโพแทสเซียมทำให้เกิดความผิดปกติของการเผาผลาญหลายอย่างในพืช กิจกรรมของเอ็นไซม์จำนวนหนึ่งลดลง การเผาผลาญคาร์โบไฮเดรตและโปรตีนถูกรบกวน และ ค่าใช้จ่ายคาร์โบไฮเดรตในลมหายใจ เป็นผลให้ผลผลิตของพืชลดลงคุณภาพของผลิตภัณฑ์ลดลง



รูบิเดียม
รูบิเดียมเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มแรก ซึ่งเป็นช่วงที่ห้าของตารางธาตุขององค์ประกอบทางเคมีของ D. I. Dmitry Ivanovich Mendeleev โดยมีเลขอะตอม 37 ถูกกำหนดโดยสัญลักษณ์ Rb (lat. Rubidium) สารรูบิเดียมอย่างง่าย (หมายเลข CAS: 7440-17-7) เป็นโลหะอัลคาไลสีขาวนวลสีเงินอ่อน
ในปี พ.ศ. 2404 นักวิทยาศาสตร์ชาวเยอรมัน Robert Wilhelm Bunsen และ Gustav Robert Kirchhoff ได้ศึกษาอะลูมิโนซิลิเกตธรรมชาติโดยใช้การวิเคราะห์ด้วยสเปกตรัม ได้ค้นพบองค์ประกอบใหม่ในนั้น ซึ่งภายหลังเรียกว่ารูบิเดียมด้วยสีของเส้นที่เข้มที่สุดของสเปกตรัม
รูบิเดียมสร้างผลึกสีขาวนวลสีเงินที่มีความแวววาวของโลหะเมื่อตัดใหม่ ความแข็งบริเนล 0.2 MN/m² (0.02 kgf/mm²) ตาข่ายคริสตัลของรูบิเดียมเป็นลูกบาศก์ ศูนย์กลางร่างกาย a = 5.71 E (ที่อุณหภูมิห้อง) รัศมีอะตอม 2.48 Е, Rb+ รัศมีไอออน 1.49 Е. ความหนาแน่น 1.525 g/cm³ (0 °C), mp 38.9 °C, tbp 703 °C ความจุความร้อนจำเพาะ 335.2 J/(kg K) สัมประสิทธิ์ความร้อนของการขยายตัวเชิงเส้น 9.0 10-5 องศา-1 (0-38 °C) โมดูลัสความยืดหยุ่น 2.4 H/m² (240 กก./มม.²) ความต้านทานไฟฟ้าเชิงปริมาตรจำเพาะ 11.29 10-6 โอห์ม ซม. (20 °C); รูบิเดียมเป็นพาราแมกเนติก
โลหะอัลคาไล ไม่เสถียรอย่างยิ่งในอากาศ (ทำปฏิกิริยากับอากาศเมื่อมีน้ำ ไวไฟ) สร้างเกลือได้ทุกชนิด - ส่วนใหญ่ละลายได้ง่าย (คลอเรตและเปอร์คลอเรตละลายได้เพียงเล็กน้อย) รูบิเดียมไฮดรอกไซด์เป็นสารที่มีฤทธิ์รุนแรงมากต่อแก้วและวัสดุโครงสร้างและภาชนะอื่นๆ และหลอมละลายจะทำลายโลหะส่วนใหญ่ (แม้กระทั่งแพลตตินัม)
การใช้รูบิเดียมมีความหลากหลายและแม้ว่าในหลายพื้นที่ของการใช้งาน จะมีลักษณะทางกายภาพที่สำคัญที่สุดต่อซีเซียมที่ด้อยกว่า อย่างไรก็ตาม โลหะอัลคาไลหายากนี้มีบทบาทสำคัญใน เทคโนโลยีสมัยใหม่. การใช้งานของรูบิเดียมต่อไปนี้สามารถสังเกตได้: ตัวเร่งปฏิกิริยา, อิเล็กทรอนิกส์ อุตสาหกรรม, เลนส์พิเศษ, อะตอม, ยา.
รูบิเดียมไม่เพียงใช้ในรูปแบบบริสุทธิ์เท่านั้น แต่ยังใช้ในรูปของโลหะผสมและสารประกอบทางเคมีอีกด้วย สิ่งสำคัญคือต้องสังเกตว่า รูบิเดียมมีฐานวัตถุดิบที่ดีและเป็นที่น่าพอใจ แต่ในขณะเดียวกัน สถานการณ์ที่มีทรัพยากรก็เอื้ออำนวยมากกว่าในกรณีของซีเซียม และรูบิเดียมสามารถเล่นได้มากกว่านี้ บทบาทสำคัญ เช่น ในการเร่งปฏิกิริยา (ซึ่งพิสูจน์ได้สำเร็จ)
ไอโซโทปรูบิเดียม-86 ถูกนำมาใช้กันอย่างแพร่หลายในการตรวจจับจุดบกพร่องของรังสีแกมมา เทคโนโลยีการวัด ตลอดจนในการฆ่าเชื้อยาที่สำคัญจำนวนหนึ่งและ ผลิตภัณฑ์อาหาร. รูบิเดียมและโลหะผสมที่มีซีเซียมเป็นสารหล่อเย็นและสื่อการทำงานที่มีแนวโน้มสูงสำหรับหน่วยเทอร์ไบน์ที่มีอุณหภูมิสูง (ในเรื่องนี้ รูบิเดียมและซีเซียมใน ปีที่แล้วได้มา ความสำคัญและโลหะที่มีราคาสูงมากจะค่อยๆ จางหายไปในพื้นหลัง โดยสัมพันธ์กับความเป็นไปได้ที่จะเพิ่มประสิทธิภาพของหน่วยกังหันอย่างมาก และด้วยเหตุนี้จึงลดลง ค่าใช้จ่ายเชื้อเพลิงและมลภาวะต่อสิ่งแวดล้อม) ระบบที่ใช้รูบิเดียมที่ใช้กันอย่างแพร่หลายมากที่สุดในฐานะสารหล่อเย็นคือโลหะผสมที่ประกอบด้วยสามส่วน ได้แก่ โซเดียม-โพแทสเซียม-รูบิเดียม และโซเดียม-รูบิเดียม-ซีเซียม
ในการเร่งปฏิกิริยา รูบิเดียมใช้ในการสังเคราะห์สารอินทรีย์และอนินทรีย์ กิจกรรมเร่งปฏิกิริยาของรูบิเดียมส่วนใหญ่จะใช้ในการกลั่นน้ำมันสำหรับผลิตภัณฑ์ที่สำคัญจำนวนหนึ่ง ยกตัวอย่างเช่น รูบิเดียมอะซิเตทใช้ในการสังเคราะห์เมทานอลและแอลกอฮอล์ที่สูงขึ้นจำนวนหนึ่งจากก๊าซน้ำ ซึ่งในทางกลับกันก็มีความสำคัญอย่างยิ่งในการเชื่อมต่อกับการแปรสภาพเป็นแก๊สของถ่านหินใต้ดินและการผลิตเชื้อเพลิงเหลวเทียมสำหรับรถยนต์และเชื้อเพลิงเครื่องบิน โลหะผสมรูบิเดียม-เทลลูเรียมจำนวนหนึ่งมีความไวแสงในบริเวณอัลตราไวโอเลตของสเปกตรัมสูงกว่าสารประกอบซีเซียม และในกรณีนี้ ก็สามารถแข่งขันกับซีเซียม-133 เป็นวัสดุสำหรับโฟโตคอนเวอร์เตอร์ได้ รูบิเดียมถูกใช้เป็นสารหล่อลื่นที่มีประสิทธิภาพสูงในสุญญากาศ (เทคโนโลยีจรวดและอวกาศ) เป็นส่วนหนึ่งขององค์ประกอบการหล่อลื่นพิเศษ (โลหะผสม)
รูบิเดียมไฮดรอกไซด์ใช้เพื่อเตรียมอิเล็กโทรไลต์สำหรับ CPS ที่อุณหภูมิต่ำ เช่นเดียวกับสารเติมแต่งในสารละลายโพแทสเซียมไฮดรอกไซด์เพื่อปรับปรุงประสิทธิภาพที่อุณหภูมิต่ำและเพิ่มการนำไฟฟ้าของอิเล็กโทรไลต์ รูบิเดียมเมทัลลิกใช้ในเซลล์เชื้อเพลิงไฮไดรด์
รูบิเดียมคลอไรด์ในโลหะผสมที่มีคิวรัมคลอไรด์ใช้ในการวัดอุณหภูมิสูง (สูงถึง 400 °C)
พลาสมารูบิเดียมใช้เพื่อกระตุ้นการแผ่รังสีเลเซอร์
รูบิเดียมคลอไรด์ถูกใช้เป็นอิเล็กโทรไลต์ในเซลล์เชื้อเพลิง และสามารถพูดได้เช่นเดียวกันเกี่ยวกับรูบิเดียมไฮดรอกไซด์ ซึ่งมีประสิทธิภาพมากในฐานะอิเล็กโทรไลต์ในเซลล์เชื้อเพลิงโดยใช้ปฏิกิริยาออกซิเดชันของถ่านหินโดยตรง
ซีเซียม
ซีเซียมเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มแรก ซึ่งเป็นช่วงที่หกของระบบธาตุเคมีของ D. I. Mendeleev Dmitry Ivanovich โดยมีเลขอะตอม 55 ถูกกำหนดโดยสัญลักษณ์ Cs (lat. Caesium) ซีเซียมสารอย่างง่าย (หมายเลข CAS: 7440-46-2) เป็นโลหะอัลคาไลสีเหลืองอ่อนสีเงิน ซีเซียมได้ชื่อมาจากการมีเส้นสีฟ้าสดใสสองเส้นในสเปกตรัมการแผ่รังสี (จากภาษาละติน caesius - ท้องฟ้าสีคราม)
ซีเซียมถูกค้นพบในปี พ.ศ. 2403 โดยนักวิทยาศาสตร์ชาวเยอรมัน R.W. Bunsen และ G.R. Kirchhoff ในแหล่งน้ำแร่ Durchheim ในสาธารณรัฐเยอรมนีโดยวิธี optical spectroscopy จึงกลายเป็นองค์ประกอบแรกที่ค้นพบโดยใช้การวิเคราะห์สเปกตรัม ในรูปแบบที่บริสุทธิ์ ซีเซียมถูกแยกออกเป็นครั้งแรกในปี พ.ศ. 2425 โดยนักเคมีชาวสวีเดนชื่อเค. เซ็ตเทอร์เบิร์ก ระหว่างอิเล็กโทรลิซิสของการหลอมของส่วนผสมของซีเซียมไซยาไนด์ (CsCN) และแบเรียม
แร่ธาตุซีเซียมหลัก ได้แก่ โพลูไซต์และอะโวกาไดรต์ (K,Cs) ที่หายากมาก นอกจากนี้ ในรูปแบบของสิ่งเจือปน ซีเซียมยังรวมอยู่ในอะลูมิโนซิลิเกตหลายชนิด ได้แก่ เลปิโดไลต์ โฟโลโกไพต์ ไบโอไทต์ อะเมซอนไซต์ กลีบไลต์ เบริล ซินน์วัลไดต์ ลิวไซต์ คาร์นัลไลต์ Pollucite และ lepidolite ใช้เป็นวัตถุดิบทางอุตสาหกรรม
ที่ การผลิตภาคอุตสาหกรรมซีเซียมในรูปของสารประกอบที่สกัดจากแร่พอลลูไซต์ ทำได้โดยการเปิดคลอไรด์หรือซัลเฟต วิธีแรกเกี่ยวข้องกับการบำบัดแร่ธาตุดั้งเดิมด้วยกรดไฮโดรคลอริกที่ให้ความร้อน เติมแอนติโมนีคลอไรด์ SbCl3 เพื่อตกตะกอนสารประกอบ Cs3 และล้างด้วยน้ำร้อนหรือสารละลายแอมโมเนียเพื่อสร้างซีเซียมคลอไรด์ CsCl ในกรณีที่สอง จะได้รับการบำบัดด้วยกรดซัลฟิวริกที่ให้ความร้อนเพื่อสร้างซีเซียมสารส้ม CsAl(SO4)2 12H2O
ใน สหพันธรัฐรัสเซียหลังจากการล่มสลายของสหภาพโซเวียต การผลิตมลพิษทางอุตสาหกรรมไม่ได้ดำเนินการ แม้ว่าในทุ่งทุนดราโวรอนยาใกล้เมืองมูร์มันสค์กลับเข้ามา สมัยโซเวียตมีการค้นพบแร่สำรองมหาศาล เมื่อถึงเวลาที่อุตสาหกรรมของรัสเซียสามารถก้าวไปข้างหน้าได้ปรากฏว่าแคนาดาซื้อใบอนุญาตในการพัฒนาสาขานี้ ปัจจุบันการแปรรูปและการสกัดเกลือซีเซียมจากโพลลูไซต์ดำเนินการในโนโวซีบีร์สค์ที่โรงงานโลหะหายาก ZAO
มีวิธีการทางห้องปฏิบัติการหลายวิธีในการรับซีเซียม สามารถรับได้:
การให้ความร้อนในสุญญากาศ ส่วนผสมของซีเซียมโครเมตหรือไดโครเมตกับเซอร์โคเนียม
การสลายตัวของซีเซียมเอไซด์ในสุญญากาศ
ให้ความร้อนส่วนผสมของซีเซียมคลอไรด์และแคลเซียมที่เตรียมไว้เป็นพิเศษ
วิธีการทั้งหมดใช้แรงงานเข้มข้น วิธีที่สองทำให้ได้โลหะที่มีความบริสุทธิ์สูง แต่สามารถระเบิดได้และต้องใช้เวลาหลายวันกว่าจะทำได้
ซีเซียมพบการใช้งานเฉพาะเมื่อต้นศตวรรษที่ 20 เมื่อมีการค้นพบแร่ธาตุและเทคโนโลยีเพื่อให้ได้มาในรูปแบบบริสุทธิ์ ปัจจุบันซีเซียมและสารประกอบของซีเซียมถูกใช้ในอุปกรณ์อิเล็กทรอนิกส์ วิทยุ ไฟฟ้า วิศวกรรมเอ็กซ์เรย์ อุตสาหกรรมเคมี ทัศนศาสตร์ การแพทย์ และพลังงานนิวเคลียร์ ซีเซียม-133 ธรรมชาติที่เสถียรส่วนใหญ่จะใช้ และในขอบเขตที่จำกัดของไอโซโทปกัมมันตภาพรังสีซีเซียม-137 ที่แยกได้จากผลรวมของชิ้นส่วนฟิชชันของยูเรเนียม พลูโทเนียม ทอเรียมในเครื่องปฏิกรณ์โรงไฟฟ้านิวเคลียร์
โลหะอัลคาไลน์เอิร์ ธ
โลหะอัลคาไลน์เอิร์ ธ - องค์ประกอบทางเคมีแคลเซียม Ca, strontium Sr, แบเรียม Ba, เรเดียม Ra (บางครั้ง beryllium Be และแมกนีเซียม Mg ก็เรียกอีกอย่างว่าโลหะอัลคาไลน์เอิร์ ธ อย่างผิดพลาด) พวกมันถูกตั้งชื่อเช่นนั้นเพราะออกไซด์ของพวกมัน - "ดิน" (ในศัพท์ของนักเล่นแร่แปรธาตุ) - ให้ปฏิกิริยาเป็นด่างแก่น้ำ เกลือของโลหะอัลคาไลน์เอิร์ ธ ยกเว้นเรเดียมมีการกระจายอย่างกว้างขวางในธรรมชาติในรูปของแร่ธาตุ
แคลเซียม
แคลเซียมเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มที่สอง ซึ่งเป็นช่วงที่สี่ของตารางธาตุขององค์ประกอบทางเคมีของ D. I. Dmitry Ivanovich Mendeleev โดยมีเลขอะตอม 20 ถูกกำหนดโดยสัญลักษณ์ Ca (lat. Calcium) แคลเซียมจากสารอย่างง่าย (หมายเลข CAS: 7440-70-2) เป็นโลหะอัลคาไลน์เอิร์ธที่อ่อนนุ่ม ปฏิกิริยา สีขาวเงิน
โลหะแคลเซียมมีอยู่ในการดัดแปลงแบบ allotropic สองครั้ง สูงถึง 443 °C α-Ca ที่มีโครงตาข่ายหน้าลูกบาศก์มีความเสถียร (พารามิเตอร์ a = 0.558 นาโนเมตร) ที่สูงกว่า β-Ca จะเสถียรด้วยตาข่ายที่มีตัวกลางลูกบาศก์ของประเภท α-Fe (พารามิเตอร์ a = 0.448 นาโนเมตร) เอนทาลปีมาตรฐาน ΔH0 ของการเปลี่ยนแปลง α → β คือ 0.93 kJ/mol
แคลเซียมเป็นโลหะอัลคาไลน์เอิร์ททั่วไป กิจกรรมทางเคมีของแคลเซียมสูง แต่ต่ำกว่าโลหะอัลคาไลน์เอิร์ธอื่นๆ ทั้งหมด มันทำปฏิกิริยากับออกซิเจน คาร์บอนไดออกไซด์ และความชื้นในอากาศได้ง่าย ซึ่งเป็นสาเหตุที่พื้นผิวของโลหะแคลเซียมมักจะเป็นสีเทาทึบ ดังนั้นแคลเซียมจึงมักถูกเก็บไว้ในห้องปฏิบัติการ เช่นเดียวกับโลหะอัลคาไลน์เอิร์ธอื่นๆ ในโถที่ปิดสนิทใต้ชั้น ของน้ำมันก๊าดหรือพาราฟินเหลว
ในชุดศักย์มาตรฐาน แคลเซียมจะอยู่ทางด้านซ้ายของไฮโดรเจน ศักย์ไฟฟ้ามาตรฐานของคู่ Ca2+/Ca0 คือ −2.84 V เพื่อให้แคลเซียมทำปฏิกิริยากับน้ำอย่างแข็งขัน แต่ไม่มีการจุดไฟ:
Ca + 2H2O \u003d Ca (OH) 2 + H2 + Q.
ด้วยอโลหะ (ออกซิเจน คลอรีน โบรมีน) แคลเซียมจะทำปฏิกิริยาภายใต้สภาวะปกติ:
2Ca + O2 = 2CaO, Ca + Br2 = CaBr2
เมื่อถูกความร้อนในอากาศหรือออกซิเจน แคลเซียมจะติดไฟ ด้วยอโลหะที่มีฤทธิ์น้อยกว่า (ไฮโดรเจน โบรอน คาร์บอน ซิลิกอน ไนโตรเจน ฟอสฟอรัส และอื่นๆ) แคลเซียมจะทำปฏิกิริยาเมื่อถูกความร้อน ตัวอย่างเช่น
Ca + H2 = CaH2, Ca + 6B = CaB6,
3Ca + N2 = Ca3N2, Ca + 2C = CaC2,
3Ca + 2P = Ca3P2 (แคลเซียมฟอสไฟด์) แคลเซียมฟอสไฟด์ขององค์ประกอบ CaP และ CaP5 ยังเป็นที่รู้จัก
2Ca + Si = Ca2Si (แคลเซียมซิลิไซด์), แคลเซียมซิลิไซด์ขององค์ประกอบ CaSi, Ca3Si4 และ CaSi2 เป็นที่รู้จักกัน
ปฏิกิริยาข้างต้นตามกฎจะมาพร้อมกับการปลดปล่อย จำนวนมากความร้อน (นั่นคือปฏิกิริยาเหล่านี้เป็นคายความร้อน) ในสารประกอบทั้งหมดที่ไม่ใช่โลหะ สถานะออกซิเดชันของแคลเซียมคือ +2 สารประกอบแคลเซียมที่ไม่ใช่โลหะส่วนใหญ่สามารถย่อยสลายได้ง่ายด้วยน้ำ ตัวอย่างเช่น
CaH2 + 2H2O \u003d Ca (OH) 2 + 2H2,
Ca3N2 + 3H2O = 3Ca(OH)2 + 2NH3
ไอออน Ca2+ ไม่มีสี เมื่อเติมเกลือแคลเซียมที่ละลายได้ลงในเปลวไฟ เปลวไฟจะเปลี่ยนเป็นสีแดงอิฐ
เกลือแคลเซียม เช่น CaCl2 chloride, CaBr2 bromide, CaI2 iodide และ Ca(NO3)2 nitrate สามารถละลายได้ดีในน้ำ CaF2 fluoride, CaCO3 carbonate, CaSO4 sulfate, Ca3(PO4)2 orthophosphate, CaC2O4 oxalate และอื่นๆ บางชนิดไม่ละลายในน้ำ
สิ่งที่สำคัญอย่างยิ่งคือข้อเท็จจริงที่ว่าแคลเซียมคาร์บอเนตที่เป็นกรด (ไฮโดรคาร์บอเนต) Ca(HCO3)2 แตกต่างจากแคลเซียมคาร์บอเนต CaCO3 ซึ่งละลายได้ในน้ำ โดยธรรมชาติแล้ว สิ่งนี้นำไปสู่กระบวนการดังต่อไปนี้ เมื่อฝนตกเย็นหรือน้ำในแม่น้ำอิ่มตัวด้วยคาร์บอนไดออกไซด์แทรกซึมใต้ดินและตกลงบนหินปูนจะสังเกตเห็นการละลาย:
CaCO3 + CO2 + H2O \u003d Ca (HCO3) 2
ในสถานที่เดียวกันกับที่น้ำอิ่มตัวด้วยแคลเซียมไบคาร์บอเนตมาถึงพื้นผิวโลกและถูกทำให้ร้อนจากแสงอาทิตย์ ปฏิกิริยาย้อนกลับเกิดขึ้น:
Ca (HCO3) 2 \u003d CaCO3 + CO2 + H2O
ดังนั้นในธรรมชาติจึงมีการถ่ายโอนสารจำนวนมาก เป็นผลให้ช่องว่างขนาดใหญ่สามารถก่อตัวใต้ดินและ "หยาด" หินที่สวยงาม - หินย้อยและหินงอก - ก่อตัวในถ้ำ
การปรากฏตัวของแคลเซียมไบคาร์บอเนตที่ละลายในน้ำส่วนใหญ่จะเป็นตัวกำหนดความกระด้างชั่วคราวของน้ำ เรียกว่าชั่วคราวเพราะเมื่อต้มน้ำ ไบคาร์บอเนตจะสลายตัวและ CaCO3 จะตกตะกอน ปรากฏการณ์นี้นำไปสู่ความจริงที่ว่าตะกรันก่อตัวในกาต้มน้ำเมื่อเวลาผ่านไป
สตรอนเทียม
สตรอนเทียมเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มที่สองซึ่งเป็นช่วงที่ห้าของระบบธาตุเคมีของ D. I. Mendeleev Dmitry Ivanovich โดยมีเลขอะตอม 38 ถูกกำหนดโดยสัญลักษณ์ Sr (lat. Strontium) สตรอนเทียมสารอย่างง่าย (หมายเลข CAS: 7440-24-6) เป็นโลหะอัลคาไลน์เอิร์ ธ สีขาวเงินที่อ่อนนุ่ม หลอมได้ และเหนียว มีกิจกรรมทางเคมีสูง ในอากาศจะทำปฏิกิริยากับความชื้นและออกซิเจนอย่างรวดเร็ว ปกคลุมด้วยฟิล์มออกไซด์สีเหลือง
ธาตุใหม่นี้ถูกค้นพบในแร่สตรอนเทียนไนต์ ซึ่งพบในปี ค.ศ. 1764 ในเหมืองตะกั่วใกล้หมู่บ้านสตรอนเชียนในสกอตแลนด์ ซึ่งต่อมาได้ตั้งชื่อธาตุใหม่ว่า การปรากฏตัวของโลหะออกไซด์ใหม่ในแร่นี้เกิดขึ้นเกือบ 30 ปีต่อมาโดย William Cruikshank และ Ader Crawford แยกตัวออกมาในรูปแบบที่บริสุทธิ์ที่สุดโดยเซอร์ฮัมฟรีย์ เดวีในปี 1808
สตรอนเทียมเป็นโลหะเนื้ออ่อนสีขาวเงิน อ่อนได้และอ่อนได้ และสามารถตัดด้วยมีดได้ง่าย
Polymorphine - รู้จักการดัดแปลงสามครั้ง สูงสุด 215 ° C การดัดแปลงที่มีลูกบาศก์ใบหน้าเป็นศูนย์กลาง (α-Sr) นั้นเสถียรระหว่าง 215 ถึง 605°C - หกเหลี่ยม (β-Sr) สูงกว่า 605°C - การดัดแปลงที่มีศูนย์กลางอยู่ที่ลูกบาศก์ (γ-Sr)
จุดหลอมเหลว - 768oC, จุดเดือด - 1390oC
สตรอนเทียมในสารประกอบจะมีความจุ +2 เสมอ โดยคุณสมบัติสตรอนเทียมอยู่ใกล้กับแคลเซียมและแบเรียมซึ่งมีตำแหน่งตรงกลางระหว่างกัน
ในชุดแรงดันไฟฟ้าเคมีไฟฟ้า สตรอนเทียมเป็นโลหะที่มีฤทธิ์มากที่สุด (ศักย์ไฟฟ้าปกติของมันคือ −2.89 V. มันทำปฏิกิริยารุนแรงกับน้ำ ก่อตัวเป็นไฮดรอกไซด์:
ซีเนียร์ + 2H2O = ซีเนียร์(OH)2 + H2
ทำปฏิกิริยากับกรด แทนที่โลหะหนักจากเกลือของพวกมัน ทำปฏิกิริยาเล็กน้อยกับกรดเข้มข้น (H2SO4, HNO3)
โลหะสตรอนเทียมออกซิไดซ์อย่างรวดเร็วในอากาศ ก่อตัวเป็นฟิล์มสีเหลือง ซึ่งนอกจาก SrO ออกไซด์แล้ว ยังมี SrO2 เปอร์ออกไซด์ และ Sr3N2 ไนไตรด์อยู่เสมอ เมื่อถูกความร้อนในอากาศ มันจะติดไฟ ผงสตรอนเทียมในอากาศมีแนวโน้มที่จะติดไฟได้เอง
ทำปฏิกิริยารุนแรงกับอโลหะ - กำมะถัน ฟอสฟอรัส ฮาโลเจน ทำปฏิกิริยากับไฮโดรเจน (สูงกว่า 200°C) ไนโตรเจน (สูงกว่า 400°C) ในทางปฏิบัติไม่ทำปฏิกิริยากับด่าง
ที่อุณหภูมิสูง ทำปฏิกิริยากับ CO2 เพื่อสร้างคาร์ไบด์:
5Sr + 2CO2 = SrC2 + 4SrO
เกลือสตรอนเทียมที่ละลายได้ง่ายที่มีแอนไอออน Cl-, I-, NO3- เกลือที่มีแอนไอออน F-, SO42-, CO32-, PO43- ละลายได้น้อย
สตรอนเทียมใช้สำหรับผสมคิวรัมและโลหะผสมบางชนิด เพื่อนำไปเป็นโลหะผสมตะกั่วของแบตเตอรี่ เพื่อทำให้เหล็กหล่อ คูปรัม และเหล็กหล่อลดซัลเฟต เหล็ก.
แบเรียม
แบเรียมเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มที่สอง ซึ่งเป็นช่วงที่หกของตารางธาตุขององค์ประกอบทางเคมีของ D. I. Dmitry Ivanovich Mendeleev โดยมีเลขอะตอม 56 ถูกกำหนดโดยสัญลักษณ์ Ba (lat. Barium) แบเรียมสารอย่างง่าย (หมายเลข CAS: 7440-39-3) เป็นโลหะอัลคาไลน์เอิร์ ธ สีขาวสีเงินที่อ่อนนุ่ม อ่อนได้ มีกิจกรรมทางเคมีสูง
แบเรียมถูกค้นพบในรูปของออกไซด์ BaO ในปี พ.ศ. 2317 โดย Karl Scheele ในปี ค.ศ. 1808 นักเคมีชาวอังกฤษ ฮัมฟรีย์ เดวี่ ได้มาจากการแยกอิเล็กโทรไลซิสของแบเรียมไฮดรอกไซด์เปียกที่มีแคโทดปรอท มัลกัมแบเรียม; หลังจากระเหยปรอทด้วยความร้อน เขาก็แยกโลหะแบเรียมออก
แบเรียมเป็นโลหะอ่อนสีเงิน-ขาว มันแตกเป็นเสี่ยงๆ มีการดัดแปลงแบเรียมแบบ allotropic สองแบบ: α-Ba ที่มีโครงตาข่ายที่มีลูกบาศก์เป็นศูนย์กลางมีความเสถียรสูงถึง 375 °C (พารามิเตอร์ a = 0.501 นาโนเมตร) β-Ba มีความคงตัวเหนือ
ความแข็งในระดับแร่ 1.25; ในระดับ Mohs 2
โลหะแบเรียมถูกเก็บไว้ในน้ำมันก๊าดหรือใต้ชั้นของพาราฟิน
แบเรียมเป็นโลหะอัลคาไลน์เอิร์ ธ มันออกซิไดซ์อย่างเข้มข้นในอากาศ ก่อตัวเป็นแบเรียมออกไซด์ BaO และแบเรียมไนไตรด์ Ba3N2 และจุดไฟเมื่อถูกความร้อนเล็กน้อย ทำปฏิกิริยากับน้ำอย่างรุนแรง เกิดเป็นแบเรียมไฮดรอกไซด์ Ba (OH) 2:
Ba + 2H2O \u003d Ba (OH) 2 + H2
ทำปฏิกิริยากับกรดเจือจาง เกลือแบเรียมหลายชนิดไม่ละลายน้ำหรือละลายได้เล็กน้อยในน้ำ: แบเรียมซัลเฟต BaSO4, แบเรียมซัลไฟต์ BaSO3, แบเรียมคาร์บอเนต BaCO3, แบเรียมฟอสเฟต Ba3(PO4)2 แบเรียมซัลไฟด์ BaS ซึ่งแตกต่างจากแคลเซียมซัลไฟด์ CaS ซึ่งสามารถละลายได้ดีในน้ำ
ทำปฏิกิริยากับฮาโลเจนได้อย่างง่ายดายเพื่อสร้างเฮไลด์
เมื่อถูกความร้อนด้วยไฮโดรเจน จะเกิดแบเรียมไฮไดรด์ BaH2 ซึ่งในทางกลับกัน ลิเธียมไฮไดรด์ LiH จะให้สารเชิงซ้อน Li
ทำปฏิกิริยากับความร้อนด้วยแอมโมเนีย:
6Ba + 2NH3 = 3BaH2 + Ba3N2
เมื่อถูกความร้อน แบเรียมไนไตรด์ Ba3N2 ทำปฏิกิริยากับ CO เพื่อสร้างไซยาไนด์:
Ba3N2 + 2CO = Ba(CN)2 + 2BaO
แอมโมเนียเหลวทำให้ได้สารละลายสีน้ำเงินเข้ม ซึ่งสามารถแยกแอมโมเนียออกได้ ซึ่งมีความมันวาวเป็นสีทองและสลายตัวได้ง่ายด้วยการกำจัด NH3 ในที่ที่มีตัวเร่งปฏิกิริยาแพลตตินั่ม แอมโมเนียจะสลายตัวเป็นแบเรียมเอไมด์:
บา(NH2)2 + 4NH3 + H2
สามารถรับแบเรียมคาร์ไบด์ BaC2 ได้โดยให้ความร้อน BaO ด้วยถ่านหินในเตาอาร์ค
ด้วยฟอสฟอรัส ทำให้เกิดฟอสไฟด์ Ba3P2
แบเรียมช่วยลดออกไซด์ เฮไลด์ และซัลไฟด์ของโลหะหลายชนิดให้เป็นโลหะที่สอดคล้องกัน
โลหะแบเรียม ซึ่งมักเป็นโลหะผสมกับอลูมิเนียม ถูกใช้เป็นตัวดึง (getter) ในอุปกรณ์อิเล็กทรอนิกส์สูญญากาศสูง และยังถูกเติมร่วมกับเซอร์โคเนียมกับสารหล่อเย็นโลหะเหลว (โลหะผสมของโซเดียม โพแทสเซียม รูบิเดียม ลิเธียม ซีเซียม) ถึง ลดความก้าวร้าวต่อท่อและในโลหะวิทยา
โลหะทรานซิชัน
โลหะทรานซิชัน (องค์ประกอบทรานซิชัน) เป็นองค์ประกอบของกลุ่มย่อยด้านข้างของตารางธาตุขององค์ประกอบทางเคมีของ D. I. Mendeleev Dmitry Ivanovich ซึ่งมีอิเล็กตรอนอะตอมปรากฏบน d- และ f-orbitals ใน ปริทัศน์ โครงสร้างอิเล็กทรอนิกส์องค์ประกอบเฉพาะกาลสามารถแสดงได้ดังนี้: . ns-orbital ประกอบด้วยอิเล็กตรอน 1 หรือ 2 ตัว ส่วนที่เหลืออยู่ใน -orbital เนื่องจากจำนวนเวเลนซ์อิเล็กตรอนน้อยกว่าจำนวนออร์บิทัลอย่างเห็นได้ชัด สารธรรมดาที่เกิดจากธาตุทรานซิชันจึงเป็นโลหะ
ลักษณะทั่วไปขององค์ประกอบการเปลี่ยนแปลง
องค์ประกอบการเปลี่ยนแปลงทั้งหมดมีคุณสมบัติทั่วไปดังต่อไปนี้:
ค่าอิเล็กโตรเนกาติวีตี้น้อย
สถานะออกซิเดชันที่แปรผัน สำหรับองค์ประกอบ d เกือบทั้งหมด ในอะตอมซึ่งมีเวเลนซ์อิเล็กตรอน 2 ตัวที่ระดับ ns-sub ภายนอก จะทราบสถานะออกซิเดชัน +2
เริ่มต้นจากองค์ประกอบ d ของกลุ่มที่ 3 ของตารางธาตุขององค์ประกอบทางเคมีของ D. I. Dmitry Ivanovich Mendeleev องค์ประกอบในสถานะออกซิเดชันต่ำสุดในรูปแบบสารประกอบที่แสดงคุณสมบัติพื้นฐาน ในระดับสูงสุด - เป็นกรด ในระดับกลาง - amphoteric
เหล็ก
ธาตุเหล็กเป็นองค์ประกอบของกลุ่มย่อยรองของกลุ่มที่แปดของช่วงที่สี่ของระบบธาตุเคมีของ D. I. Mendeleev Dmitry Ivanovich เลขอะตอม 26 ถูกกำหนดโดยสัญลักษณ์ Fe (lat. Ferrum) ที่พบมากที่สุดแห่งหนึ่งใน เปลือกโลกโลหะ (อันดับสองรองจากอลูมิเนียม)
ธาตุเหล็กอย่างง่าย (หมายเลข CAS: 7439-89-6) เป็นโลหะสีเงินขาวที่หลอมได้และมีปฏิกิริยาเคมีสูง: เหล็กจะสึกกร่อนอย่างรวดเร็วที่อุณหภูมิสูงหรือมีความชื้นสูงในอากาศ ในออกซิเจนบริสุทธิ์ ธาตุเหล็กจะเผาไหม้ และในสถานะที่กระจายตัวอย่างประณีต จะจุดไฟในอากาศได้เองตามธรรมชาติ
อันที่จริง เหล็กมักถูกเรียกว่าโลหะผสมที่มีสารเจือปนต่ำ (มากถึง 0.8%) ซึ่งยังคงความนุ่มนวลและความเหนียวของโลหะบริสุทธิ์ แต่ในทางปฏิบัติมักใช้โลหะผสมของเหล็กกับคาร์บอน: (คาร์บอนมากถึง 2%) และ (คาร์บอนมากกว่า 2%) เช่นเดียวกับเหล็กสแตนเลส (อัลลอยด์) ด้วยการเติมโลหะผสม (โครเมียม, แมงกานีส, Ni เป็นต้น) การรวมกันของคุณสมบัติเฉพาะของเหล็กและโลหะผสมทำให้เป็น "โลหะหมายเลข 1" ที่มีความสำคัญต่อมนุษย์
โดยธรรมชาติแล้ว ธาตุเหล็กจะไม่ค่อยพบในรูปที่บริสุทธิ์ โดยส่วนใหญ่มักเกิดขึ้นจากอุกกาบาตที่เป็นเหล็กและนิกเกิล ความชุกของธาตุเหล็กในเปลือกโลกอยู่ที่ 4.65% (อันดับที่ 4 รองจาก O, Si, Al) เชื่อกันว่าเหล็กเป็นส่วนประกอบส่วนใหญ่ของแกนโลก




เหล็กเป็นโลหะทั่วไป ในสภาวะอิสระจะมีสีขาวเงินและมีโทนสีเทา โลหะบริสุทธิ์มีความเหนียว สิ่งสกปรกต่างๆ (โดยเฉพาะคาร์บอน) ช่วยเพิ่มความแข็งและความเปราะบาง ได้ออกเสียง คุณสมบัติของแม่เหล็ก. ที่เรียกว่า "กลุ่มเหล็ก" มักจะมีความโดดเด่น - กลุ่มสามโลหะ (เหล็ก Fe, โคบอลต์ Co, นิ Ni) ซึ่งมีคุณสมบัติทางกายภาพ รัศมีอะตอม และค่าอิเล็กโตรเนกาติวีตี้ที่คล้ายคลึงกัน
ธาตุเหล็กมีลักษณะที่หลากหลาย โดยมีการปรับเปลี่ยนผลึกสี่แบบ:
สูงถึง 769 °C มี α-Fe (เฟอร์ไรท์) ที่มีลูกบาศก์ตาข่ายที่มีตัวเป็นศูนย์กลางและคุณสมบัติของเฟอร์โรแม่เหล็ก (769 °C ≈ 1043 K คือจุด Curie สำหรับเหล็ก)
ในช่วงอุณหภูมิ 769–917 °C มี β-Fe ซึ่งแตกต่างจาก α-Fe เฉพาะในพารามิเตอร์ของโครงตาข่ายลูกบาศก์ที่มีศูนย์กลางอยู่ที่ลำตัวและคุณสมบัติทางแม่เหล็กของพาราแมกเนติก
ในช่วงอุณหภูมิ 917–1394 °C มี γ-Fe (ออสเทนไนต์) ที่มีลูกบาศก์ตาข่ายอยู่กึ่งกลางใบหน้า
สูงกว่า 1394 °C δ-Fe มีความเสถียรด้วยลูกบาศก์ตาข่ายที่มีร่างกายเป็นศูนย์กลาง
วิทยาศาสตร์โลหะไม่ได้แยกแยะ β-Fe เป็นเฟสที่แยกจากกัน และถือว่ามันเป็นความหลากหลายของ α-Fe เมื่อเหล็กหรือเหล็กกล้าถูกทำให้ร้อนเหนือจุด Curie (769 °C ≈ 1043 K) การเคลื่อนที่ด้วยความร้อนของไอออนจะทำให้ทิศทางการหมุนของโมเมนต์แม่เหล็กของอิเล็กตรอนบิดเบี้ยว เฟอโรแม่เหล็กจะกลายเป็นพาราแมกเนติก - การเปลี่ยนเฟสลำดับที่สองเกิดขึ้น แต่การเปลี่ยนเฟสลำดับแรกจะไม่เกิดขึ้นกับการเปลี่ยนแปลงพารามิเตอร์ทางกายภาพพื้นฐานของผลึก
สำหรับเหล็กบริสุทธิ์ที่ความดันปกติ จากมุมมองของโลหะวิทยา มีการดัดแปลงที่เสถียรดังต่อไปนี้:
จากศูนย์สัมบูรณ์ถึง 910 ºC การดัดแปลง α ด้วยตาข่ายคริสตัลลูกบาศก์ที่มีศูนย์กลางอยู่ที่ลำตัว (bcc) จะมีความเสถียร สารละลายที่เป็นของแข็งของคาร์บอนในเหล็ก α เรียกว่าเฟอร์ไรท์
ตั้งแต่ 910 ถึง 1400 ºC การดัดแปลง γ ด้วยตะแกรงคริสตัลลูกบาศก์ (fcc) ที่มีผิวหน้าอยู่ตรงกลางจะมีความเสถียร สารละลายที่เป็นของแข็งของคาร์บอนในเหล็ก γ เรียกว่า ออสเทนไนต์
ตั้งแต่ 910 ถึง 1539 ºC การดัดแปลง δ ด้วยตาข่ายคริสตัลลูกบาศก์ที่มีศูนย์กลางอยู่ที่ตัวเครื่องจะมีความเสถียร สารละลายที่เป็นของแข็งของคาร์บอนในเหล็ก δ (เช่นเดียวกับในเหล็ก α) เรียกว่าเฟอร์ไรท์ บางครั้งมีความแตกต่างระหว่าง δ-เฟอร์ไรท์ที่อุณหภูมิสูงและ α-เฟอร์ไรท์ที่อุณหภูมิต่ำ (หรือเพียงแค่เฟอร์ไรท์) แม้ว่าโครงสร้างอะตอมจะเหมือนกัน
การปรากฏตัวขององค์ประกอบคาร์บอนและโลหะผสมในเหล็กเปลี่ยนแปลงอุณหภูมิของการเปลี่ยนเฟสอย่างมีนัยสำคัญ
ในพื้นที่ที่มีความกดดันสูง (มากกว่า 104 MPa, 100,000 atm.) การดัดแปลงของเหล็กεที่มีตาข่ายปิดหกเหลี่ยม (hcp) จะปรากฏขึ้น
ปรากฏการณ์ของความหลากหลายทางโลหะวิทยามีความสำคัญอย่างยิ่งต่อโลหะผสมเหล็ก ต้องขอบคุณการเปลี่ยนผ่าน α-γ ตาข่ายคริสตัลเหล็กผ่านการอบชุบด้วยความร้อน หากปราศจากปรากฏการณ์นี้ เหล็กซึ่งเป็นพื้นฐานของเหล็กกล้า ก็จะไม่ได้รับการใช้อย่างแพร่หลายเช่นนี้
เหล็กเป็นวัสดุทนไฟเป็นโลหะที่มีกิจกรรมปานกลาง จุดหลอมเหลวของเหล็กคือ 1539 °C จุดเดือดประมาณ 3200 °C
เหล็กเป็นโลหะที่ใช้กันมากที่สุดชนิดหนึ่ง โดยคิดเป็นสัดส่วนถึง 95% ของการผลิตทางโลหะวิทยาของโลก
เหล็กเป็นส่วนประกอบหลักของเหล็กและเหล็กหล่อ ซึ่งเป็นวัสดุโครงสร้างที่สำคัญที่สุด
เหล็กสามารถรวมอยู่ในโลหะผสมที่มีพื้นฐานมาจากโลหะอื่นๆ เช่น นิกเกิล
เหล็กออกไซด์แม่เหล็ก (แม่เหล็ก) เป็นวัสดุสำคัญในการผลิตอุปกรณ์หน่วยความจำคอมพิวเตอร์ระยะยาว: ฮาร์ดไดรฟ์ ฟลอปปีดิสก์ ฯลฯ
ผงแม่เหล็กแบบ Ultrafine ใช้ในเครื่องพิมพ์เลเซอร์ขาวดำเป็นผงหมึก
คุณสมบัติพิเศษของเฟอร์โรแมกเนติกของโลหะผสมที่มีธาตุเหล็กเป็นส่วนประกอบหลักมีส่วนช่วยให้มีการใช้กันอย่างแพร่หลายในด้านวิศวกรรมไฟฟ้าสำหรับแกนแม่เหล็กของหม้อแปลงไฟฟ้าและมอเตอร์ไฟฟ้า
เหล็ก (III) คลอไรด์ (เฟอริกคลอไรด์) ใช้ในการปฏิบัติการวิทยุสมัครเล่นสำหรับการแกะสลักแผงวงจรพิมพ์
เฟอร์รัสซัลเฟต (ไอรอนซัลเฟต) ผสมกับคอปเปอร์ซัลเฟตใช้เพื่อควบคุมเชื้อราที่เป็นอันตรายในสวนและการก่อสร้าง
เหล็กใช้เป็นแอโนดในแบตเตอรี่เหล็ก-นิกเกิล แบตเตอรี่ไอรอน-แอร์
ทองแดง
ทองแดงเป็นองค์ประกอบของกลุ่มย่อยด้านข้างของกลุ่มแรก ซึ่งเป็นช่วงที่สี่ของตารางธาตุขององค์ประกอบทางเคมีของ D. I. Dmitry Ivanovich Mendeleev โดยมีเลขอะตอม 29 ถูกกำหนดโดยสัญลักษณ์ Cu (lat. Cuprum) ทองแดงสารธรรมดา (หมายเลข CAS: 7440-50-8) เป็นโลหะทรานซิชันแบบเหนียวที่มีสีทอง สีชมพู(สีชมพูในกรณีที่ไม่มีฟิล์มออกไซด์) มนุษย์ใช้กันอย่างแพร่หลายตั้งแต่สมัยโบราณ



ทองแดงเป็นโลหะเหนียวสีชมพูทอง ปกคลุมด้วยฟิล์มออกไซด์ในอากาศอย่างรวดเร็ว ซึ่งทำให้มีลักษณะเฉพาะในโทนสีเหลือง-แดง ทองแดงมีค่าการนำความร้อนและไฟฟ้าสูง (อันดับที่สองในด้านการนำไฟฟ้ารองจากเงิน) มีไอโซโทปเสถียรสองไอโซโทป - 63Cu และ 65Cu และไอโซโทปกัมมันตภาพรังสีหลายไอโซโทป 64Cu ที่มีอายุยาวนานที่สุดมีครึ่งชีวิต 12.7 ชั่วโมงและการสลายตัวสองครั้งด้วยผลิตภัณฑ์ที่แตกต่างกัน
ความหนาแน่น — 8.94*10іkg/mі
ความจุความร้อนจำเพาะที่ 20 °C - 390 J/kg*K
ความต้านทานไฟฟ้า ที่ 20-100 °C - 1.78 10−8 Ohm m
จุดหลอมเหลว - 1083 ° C
จุดเดือด - 2600 ° C
คิวรัมอัลลอยด์มีหลายประเภท: ทองเหลือง - โลหะผสมคิวรัมกับสังกะสี - โลหะผสมของคิวรัมกับดีบุก เงินนิกเกิล - โลหะผสมของคิวรัมและนิกเกิล และอื่นๆ บางส่วน
สังกะสี
สังกะสีเป็นองค์ประกอบของกลุ่มย่อยด้านข้างของกลุ่มที่สอง ซึ่งเป็นช่วงที่สี่ของระบบธาตุเคมีของ D. I. Mendeleev Dmitry Ivanovich โดยมีเลขอะตอม 30 แทนด้วยสัญลักษณ์ Zn (lat. Zinkum) สารธรรมดา (หมายเลข CAS: 7440-66-6) ภายใต้สภาวะปกติคือโลหะทรานซิชันสีน้ำเงินอมขาวที่เปราะ (ทำให้เสื่อมเสียในอากาศกลายเป็นชั้นบาง ๆ ของซิงค์ออกไซด์)
ในรูปแบบที่บริสุทธิ์ มันเป็นโลหะสีเงินขาวที่ค่อนข้างเหนียว มีโครงตาข่ายหกเหลี่ยมพร้อมพารามิเตอร์ a = 0.26649 nm, c = 0.49468 nm มันเปราะที่อุณหภูมิห้อง เมื่อจานงอ จะได้ยินเสียงแตกจากการเสียดสีของผลึก ที่อุณหภูมิ 100–150 องศาเซลเซียส สังกะสีเป็นพลาสติก สิ่งเจือปนแม้เพียงเล็กน้อยก็เพิ่มความเปราะบางของสังกะสีอย่างรวดเร็ว
โลหะแอมโฟเทอริกทั่วไป ศักย์ไฟฟ้ามาตรฐานคือ −0.76 V ในอนุกรมของศักย์ไฟฟ้ามาตรฐานจะตั้งอยู่ก่อนเหล็ก
ในอากาศ สังกะสีถูกปกคลุมด้วยฟิล์มบางของ ZnO ออกไซด์ เมื่อถูกความร้อนอย่างรุนแรงจะเกิดการเผาไหม้ด้วยการก่อตัวของแอมโฟเทอริกไวท์ออกไซด์ ZnO:
2Zn + O2 = 2ZnO
ซิงค์ออกไซด์ทำปฏิกิริยาทั้งคู่กับสารละลายกรด:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
และด่าง:
ZnO + 2NaOH = Na2ZnO2 + H2O,
สังกะสีที่มีความบริสุทธิ์ธรรมดาทำปฏิกิริยากับสารละลายกรดอย่างแข็งขัน:
Zn + 2HCl = ZnCl2 + H2,
Zn + H2SO4(dil.) = ZnSO4 + H2
และสารละลายด่าง:
Zn + 2NaOH + 2H2O = Na2 + H2,
เกิดเป็นไฮดรอกโซ-ซินเคต สังกะสีที่บริสุทธิ์มากจะไม่ทำปฏิกิริยากับสารละลายของกรดและด่าง ปฏิกิริยาเริ่มต้นด้วยการเติมสารละลายคิวรัมซัลเฟต CuSO4 สองสามหยด
เมื่อถูกความร้อน สังกะสีจะทำปฏิกิริยากับฮาโลเจนเพื่อสร้างเฮไลด์ของ ZnHal2 ด้วยฟอสฟอรัส สังกะสีจะสร้างฟอสไฟด์ Zn3P2 และ ZnP2 ด้วยกำมะถันและแอนะล็อก - ซีลีเนียมและเทลลูเรียม - คัลโคเจไนด์ต่างๆ, ZnS, ZnSe, ZnSe2 และ ZnTe
สังกะสีไม่ทำปฏิกิริยาโดยตรงกับไฮโดรเจน ไนโตรเจน คาร์บอน ซิลิกอน และโบรอน ไนไตรด์ Zn3N2 ได้มาจากปฏิกิริยาของสังกะสีกับแอมโมเนียที่อุณหภูมิ 550–600 องศาเซลเซียส
ใน สารละลายน้ำสังกะสีไอออน Zn2+ ก่อตัวเป็น aquacomplexes 2+ และ 2+
สังกะสีที่เป็นโลหะบริสุทธิ์ใช้เพื่อกู้คืนโลหะมีค่าที่ขุดได้จากการชะล้างใต้ดิน (ทอง เงิน) นอกจากนี้ สังกะสียังใช้สกัดเงิน ทอง (และโลหะอื่นๆ) จากตะกั่วดิบในรูปของสารประกอบระหว่างโลหะสังกะสี-เงิน-ทอง (ที่เรียกว่า "โฟมเงิน") ซึ่งผ่านกรรมวิธีแล้ว วิธีการทั่วไปการกลั่น
ใช้เพื่อป้องกันเหล็กจากการกัดกร่อน (การชุบสังกะสีของพื้นผิวที่ไม่อยู่ภายใต้ อิทธิพลทางกล, หรือการชุบโลหะ - สำหรับสะพาน, ถัง, โครงสร้างโลหะ) นอกจากนี้ยังใช้เป็นวัสดุอิเล็กโทรดลบในแหล่งกระแสเคมี เช่น แบตเตอรี่และตัวสะสม เช่น เซลล์แมงกานีส-สังกะสี, dmi แบตเตอรี่ซิลเวอร์-ซิงค์, ความต้านทานต่ำและกระแสปล่อยมหาศาล, ธาตุปรอท-สังกะสี (EMF 1.35 V, 135 W h / kg , 550-650 W h / dmi), ธาตุไดออกซีซัลเฟต-ปรอท, ธาตุไอโอเดต-สังกะสี, เซลล์แกลวานิกคอปเปอร์ออกไซด์ (EMF 0.7-1.6 โวลต์, 84-127 Wh/kg, 410-570 Wh/dmi), เซลล์โครเมียม-สังกะสี , เซลล์สังกะสี-ซิลเวอร์คลอไรด์, แบตเตอรี่นิกเกิล-ซิงค์ (EMF 1, 82 โวลต์, 95-118 Wh/kg, 230-295 Wh/dmi), เซลล์ตะกั่ว-สังกะสี, แบตเตอรี่ซิงค์-คลอรีน, แบตเตอรี่ซิงค์-โบรมีน ฯลฯ ). บทบาทของสังกะสีในแบตเตอรี่ซิงค์-แอร์มีความสำคัญมาก ในช่วงไม่กี่ปีที่ผ่านมา แบตเตอรี่เหล่านี้ได้รับการพัฒนาอย่างเข้มข้นบนพื้นฐานของระบบอากาศสังกะสี - แบตเตอรี่สำหรับคอมพิวเตอร์ (แล็ปท็อป) และประสบความสำเร็จอย่างมากในด้านนี้ (ใหญ่กว่าลิเธียม แบตเตอรี่ความจุและทรัพยากรน้อยกว่า 3 เท่าของราคา) ระบบนี้ยังมีแนวโน้มที่ดีสำหรับการสตาร์ทเครื่องยนต์ (แบตเตอรี่ตะกั่ว - 55 W h / kg, สังกะสีอากาศ - 220-300 W h / kg) และสำหรับรถยนต์ไฟฟ้า ( ระยะทางสูงสุด 900 กม.) ใช้ในโลหะผสมประสานหลายชนิดเพื่อลดจุดหลอมเหลว สังกะสีเป็นส่วนประกอบสำคัญของทองเหลือง ซิงค์ออกไซด์มีการใช้กันอย่างแพร่หลายในทางการแพทย์ในฐานะยาฆ่าเชื้อและต้านการอักเสบ ซิงค์ออกไซด์ยังใช้ในการผลิตสี - สังกะสีสีขาว
ซิงค์คลอไรด์เป็นฟลักซ์ที่สำคัญสำหรับการบัดกรีโลหะและส่วนประกอบในการผลิตเส้นใย
เทลลูไรด์, ซีลีไนด์, ฟอสไฟด์, ซิงค์ซัลไฟด์เป็นสารกึ่งตัวนำที่ใช้กันอย่างแพร่หลาย
Zinc selenide ใช้ทำแว่นสายตาได้ดีมาก อัตราต่อรองต่ำการดูดซับในช่วงอินฟราเรดกลาง เช่น ในเลเซอร์คาร์บอนไดออกไซด์
ปรอท
ดาวพุธเป็นองค์ประกอบของกลุ่มย่อยด้านข้างของกลุ่มที่สอง ซึ่งเป็นช่วงที่หกของตารางธาตุขององค์ประกอบทางเคมีของ D. I. Dmitry Ivanovich Mendeleev โดยมีเลขอะตอม 80 แทนด้วยสัญลักษณ์ Hg (lat. Hydrargyrum) สารปรอทอย่างง่าย (หมายเลข CAS: 7439-97-6) เป็นโลหะทรานซิชัน ที่อุณหภูมิห้องเป็นของเหลวหนัก สีขาวเงิน ระเหยอย่างเห็นได้ชัด ไอระเหยที่เป็นพิษอย่างยิ่ง ปรอทเป็นหนึ่งในสององค์ประกอบทางเคมี (และโลหะชนิดเดียว) ซึ่งสารธรรมดาภายใต้สภาวะปกติอยู่ในสถานะการรวมตัวของของเหลว (ธาตุที่สองคือโบรมีน) โดยธรรมชาติจะพบได้ทั้งในรูปแบบพื้นเมืองและจากแร่ธาตุหลายชนิด ส่วนใหญ่มักจะได้รับปรอทโดยการลดจากแร่ที่พบบ่อยที่สุด - ชาด ใช้สำหรับการผลิตเครื่องมือวัด ปั๊มสุญญากาศ แหล่งกำเนิดแสง และในด้านอื่นๆ ของวิทยาศาสตร์และเทคโนโลยี
ปรอทเป็นโลหะชนิดเดียวที่เป็นของเหลวที่อุณหภูมิห้อง มีคุณสมบัติของไดอะแมกเนติก เกิดเป็นโลหะผสมเหลวกับโลหะหลายชนิด มัลกัม. เฉพาะธาตุเหล็ก แมงกานีส และ นิ.
ปรอทเป็นโลหะที่ไม่ใช้งาน
เมื่อถูกความร้อนถึง 300 °C ปรอทจะทำปฏิกิริยากับออกซิเจน: 2Hg + O2 → 2HgO ออกไซด์ของปรอทสีแดง (II) จะเกิดขึ้น ปฏิกิริยานี้สามารถย้อนกลับได้: เมื่อถูกความร้อนสูงกว่า 340 °C ออกไซด์จะสลายตัวเป็น สารง่ายๆ. ปฏิกิริยาการสลายตัวของปรอทออกไซด์เป็นหนึ่งในวิธีแรกๆ ในการผลิตออกซิเจนในอดีต
เมื่อปรอทถูกทำให้ร้อนด้วยกำมะถัน ปรอท (II) ซัลไฟด์จะเกิดขึ้น
ปรอทไม่ละลายในสารละลายของกรดที่ไม่มีคุณสมบัติในการออกซิไดซ์ แต่จะละลายในกรดน้ำกัดทองและกรดไนตริก ทำให้เกิดเกลือปรอทสองวาเลนต์ เมื่อปรอทส่วนเกินละลายในกรดไนตริกในที่เย็น จะเกิด Hg2(NO3)2 ไนเตรตขึ้น
องค์ประกอบของกลุ่ม IIB เป็นปรอทที่มีความเป็นไปได้ที่จะทำลายเปลือกอิเล็กตรอน 6d10 ที่เสถียรมากซึ่งนำไปสู่ความเป็นไปได้ของการมีอยู่ของสารประกอบปรอท (+4) ดังนั้น นอกจาก Hg2F2 และ HgF2 ที่ละลายได้เล็กน้อยที่สลายตัวด้วยน้ำแล้ว ยังมี HgF4 ซึ่งได้มาจากปฏิกิริยาของอะตอมของปรอทและส่วนผสมของนีออนและฟลูออรีนที่อุณหภูมิ 4K
ปรอทใช้ในการผลิตเทอร์โมมิเตอร์ ไอปรอทจะเติมด้วยปรอทควอทซ์และหลอดฟลูออเรสเซนต์ หน้าสัมผัสปรอททำหน้าที่เป็นเซ็นเซอร์ตำแหน่ง นอกจากนี้ ปรอทโลหะยังใช้เพื่อให้ได้โลหะผสมที่สำคัญจำนวนหนึ่ง
ก่อนหน้านี้ โลหะอมัลกัมหลายชนิด โดยเฉพาะทองคำและเงิน ถูกนำมาใช้กันอย่างแพร่หลายในเครื่องประดับ ในการผลิตกระจกและวัสดุอุดฟัน ในทางวิศวกรรม ปรอทถูกใช้อย่างกว้างขวางสำหรับบารอมิเตอร์และมาโนมิเตอร์ สารประกอบปรอทถูกใช้เป็นยาฆ่าเชื้อ (sublimate) ยาระบาย (calomel) ในการผลิตหมวก ฯลฯ แต่เนื่องจากความเป็นพิษสูงในปลายศตวรรษที่ 20 พวกมันจึงถูกขับออกจากพื้นที่เหล่านี้ (แทนที่การควบรวมกิจการ) โดยการฉีดพ่นและการวางตำแหน่งอิเล็กโทรดของโลหะ การอุดฟันด้วยพอลิเมอร์ในทางทันตกรรม)
โลหะผสมของปรอทกับแทลเลียมใช้สำหรับเทอร์โมมิเตอร์อุณหภูมิต่ำ
ปรอทโลหะทำหน้าที่เป็นแคโทดสำหรับ การผลิตไฟฟ้าโลหะออกฤทธิ์จำนวนหนึ่ง คลอรีน และด่าง ในแหล่งกระแสเคมีบางชนิด (เช่น RT ชนิดปรอท-สังกะสี) ในแหล่งแรงดันอ้างอิง (องค์ประกอบเวสตัน) ธาตุปรอท-สังกะสี (emf 1.35 โวลต์) มีพลังงานสูงมากในแง่ของปริมาตรและมวล (130 W/h/kg, 550 W/h/dm)
ปรอทใช้สำหรับรีไซเคิลอะลูมิเนียมทุติยภูมิและการขุดทอง (ดูอมัลกัม)
บางครั้งปรอทยังถูกใช้เป็นสารทำงานในตลับลูกปืนอุทกพลศาสตร์ที่รับน้ำหนักมาก
ปรอทเป็นส่วนผสมในสีฆ่าเชื้อแบคทีเรียบางชนิด เพื่อป้องกันไม่ให้ตัวเรือสกปรกในน้ำทะเล
Mercury-203 (T1/2 = 53 วินาที) ใช้ในเภสัชรังสี
เกลือปรอทยังใช้:
ปรอทไอโอไดด์ใช้เป็นเครื่องตรวจจับรังสีเซมิคอนดักเตอร์
Mercury fulminate ("Explosive Mercury") ถูกใช้เป็นสารตั้งต้น (ตัวจุดชนวน) มานานแล้ว
ปรอทโบรไมด์ใช้ในการสลายตัวทางความร้อนทางเคมีของน้ำให้เป็นไฮโดรเจนและออกซิเจน (พลังงานอะตอมไฮโดรเจน)
สารประกอบปรอทบางชนิดใช้เป็นยา (เช่น เมอร์ไทโอเลตสำหรับเก็บรักษาวัคซีน) แต่ส่วนใหญ่เกิดจากความเป็นพิษ สารปรอทจึงถูกขับออกจากยา (sublimate, oxycyanide ปรอท - น้ำยาฆ่าเชื้อ calomel - ยาระบาย ฯลฯ ) ตรงกลางถึง ปลายศตวรรษที่ 20

อลูมิเนียม
อลูมิเนียมเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มที่สามของช่วงที่สามของระบบธาตุเคมีของ D. I. Mendeleev Dmitry Ivanovich เลขอะตอม 13 ถูกกำหนดโดยสัญลักษณ์ Al (lat. Aluminium) อยู่ในกลุ่มของโลหะเบา โลหะที่พบมากที่สุดและองค์ประกอบทางเคมีที่พบมากที่สุดเป็นอันดับสาม (รองจากออกซิเจนและซิลิกอน) ในเปลือกโลก
อะลูมิเนียมสารอย่างง่าย (หมายเลข CAS: 7429-90-5) เป็นโลหะสีเงิน-ขาวที่เบาและไม่เป็นแม่เหล็ก ซึ่งหล่อขึ้นรูป หล่อ และกลึงได้ง่าย อะลูมิเนียมมีค่าการนำความร้อนและไฟฟ้าสูง ทนทานต่อการกัดกร่อนอันเนื่องมาจากการก่อตัวอย่างรวดเร็วของฟิล์มออกไซด์ที่แรงซึ่งปกป้องพื้นผิวจากการปฏิสัมพันธ์ต่อไป
จากการศึกษาทางชีววิทยา การบริโภคอะลูมิเนียมในร่างกายมนุษย์ถือเป็นปัจจัยในการพัฒนาโรคอัลไซเมอร์ แต่การศึกษาเหล่านี้ถูกวิพากษ์วิจารณ์ในเวลาต่อมา และข้อสรุปเกี่ยวกับความเชื่อมโยงระหว่างสิ่งหนึ่งกับอีกสิ่งหนึ่งถูกหักล้าง
โลหะสีเงิน-ขาว น้ำหนักเบา ความหนาแน่น 2.7 g/cm³ จุดหลอมเหลวทางเทคนิค 658 °C สำหรับอะลูมิเนียม ความบริสุทธิ์สูง 660 °C จุดเดือด 2500 °C ความต้านแรงดึงของการหล่อ 10-12 กก./มม.² เสียรูป 18-25 กก./มม² โลหะผสม 38-42 กก./มม.²
ความแข็งของ Brinell 24-32 kgf / mm², ความเป็นพลาสติกสูง: ทางเทคนิค 35%, บริสุทธิ์ 50%, รีดเป็นแผ่นบางและแม้แต่ฟอยล์
อลูมิเนียมมีค่าการนำไฟฟ้าและความร้อนสูง 65% ของค่าการนำไฟฟ้าของ Cuprum มีการสะท้อนแสงสูง
อะลูมิเนียมเป็นโลหะผสมกับโลหะเกือบทั้งหมด
ภายใต้สภาวะปกติ อะลูมิเนียมจะถูกเคลือบด้วยฟิล์มออกไซด์ที่บางและแข็งแรง ดังนั้นจึงไม่ทำปฏิกิริยากับตัวออกซิไดซ์แบบเดิม: ด้วย H2O (t°); O2, HNO3 (ไม่มีความร้อน) ด้วยเหตุนี้ อลูมิเนียมจึงไม่อยู่ภายใต้การกัดกร่อน ดังนั้นจึงเป็นที่ต้องการอย่างกว้างขวาง อุตสาหกรรมสมัยใหม่. อย่างไรก็ตาม เมื่อฟิล์มออกไซด์ถูกทำลาย (ตัวอย่างเช่น เมื่อสัมผัสกับสารละลายของแอมโมเนียมเกลือ NH4 + ด่างร้อน หรือเป็นผลจากการควบรวม) อลูมิเนียมทำหน้าที่เป็นโลหะรีดิวซ์แบบแอคทีฟ
ทำปฏิกิริยากับสารอย่างง่าย:
ด้วยออกซิเจน:
4Al + 3O2 = 2Al2O3
ด้วยฮาโลเจน:
2Al + 3Br2 = 2AlBr3
ทำปฏิกิริยากับอโลหะอื่นๆ เมื่อถูกความร้อน:
ด้วยกำมะถันเพื่อสร้างอะลูมิเนียมซัลไฟด์:
2Al + 3S = Al2S3
ด้วยไนโตรเจน ขึ้นรูปอะลูมิเนียมไนไตรด์:
ด้วยคาร์บอน ขึ้นรูปอะลูมิเนียมคาร์ไบด์:
4Al + 3С = Al4С3
อะลูมิเนียมซัลไฟด์และอะลูมิเนียมคาร์ไบด์ถูกไฮโดรไลซ์อย่างสมบูรณ์:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
ด้วยสารที่ซับซ้อน:
ด้วยน้ำ (หลังจากลอกฟิล์มป้องกันออกไซด์ออก เช่น โดยการผสมหรือสารละลายด่างร้อน):
2Al + 6H2O = 2Al(OH)3 + 3H2
ด้วยด่าง (ด้วยการก่อตัวของเตตระไฮดรอกโซอะลูมิเนตและอะลูมิเนตอื่น ๆ ):
2Al + 2NaOH + 6H2O = 2Na + 3H2
2(NaOH.H2O) + 2Al = 2NaAlO2 + 3H2
ละลายได้ง่ายในกรดไฮโดรคลอริกและกรดซัลฟิวริกเจือจาง:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(razb) = Al2(SO4)3 + 3H2
เมื่อถูกความร้อน มันจะละลายในกรด - ตัวออกซิไดซ์ที่สร้างเกลืออลูมิเนียมที่ละลายน้ำได้:
2Al + 6H2SO4(conc) = Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3(conc) = Al(NO3)3 + 3NO2 + 3H2O
คืนค่าโลหะจากออกไซด์ (aluminothermy):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + Cr2O3 = Al2O3 + 2Cr
ใช้กันอย่างแพร่หลายเป็นวัสดุโครงสร้าง ข้อได้เปรียบหลักของอลูมิเนียมในด้านนี้คือ ความเบา ความอ่อนตัวในการปั๊ม ความต้านทานการกัดกร่อน(อะลูมิเนียมเคลือบด้วยฟิล์ม Al2O3 ที่แข็งแรงในอากาศทันที ซึ่งจะป้องกันการเกิดออกซิเดชันเพิ่มเติม) การนำความร้อนสูง และไม่เป็นพิษของสารประกอบ โดยเฉพาะคุณสมบัติเหล่านี้ทำให้อะลูมิเนียมได้รับความนิยมอย่างมากในการผลิตเครื่องครัว อลูมิเนียมฟอยล์ในอุตสาหกรรมอาหารและบรรจุภัณฑ์
ข้อเสียเปรียบหลักของอลูมิเนียมเนื่องจากเป็นวัสดุโครงสร้างคือมีความแข็งแรงต่ำ ดังนั้นจึงมักผสมกับคิวรัมและแมกนีเซียมในปริมาณเล็กน้อย (โลหะผสมนี้เรียกว่าดูราลูมิน)
ค่าการนำไฟฟ้าของอะลูมิเนียมนั้นน้อยกว่า Cuprum เพียง 1.7 เท่า ในขณะที่อะลูมิเนียมนั้นถูกกว่าประมาณ 2 เท่า ดังนั้นจึงใช้กันอย่างแพร่หลายในด้านวิศวกรรมไฟฟ้าสำหรับการผลิตสายไฟ ฉนวนป้องกัน และแม้กระทั่งในไมโครอิเล็กทรอนิกส์สำหรับการผลิตตัวนำในชิป ค่าการนำไฟฟ้าที่ต่ำกว่าของอะลูมิเนียม (37 1/โอห์ม) เมื่อเทียบกับคิวรัม (63 1/โอห์ม) ได้รับการชดเชยด้วยการเพิ่มหน้าตัดของตัวนำอะลูมิเนียม ข้อเสียของอะลูมิเนียมที่เป็นวัสดุไฟฟ้าคือฟิล์มออกไซด์ที่แข็งแรงซึ่งทำให้การบัดกรีทำได้ยาก
เนื่องจากคุณสมบัติที่ซับซ้อนจึงถูกนำมาใช้กันอย่างแพร่หลายในอุปกรณ์ระบายความร้อน
อะลูมิเนียมและโลหะผสมมีความแข็งแรงที่อุณหภูมิต่ำมาก ด้วยเหตุนี้จึงมีการใช้กันอย่างแพร่หลายในเทคโนโลยีการแช่แข็ง
การสะท้อนแสงสูงรวมกับต้นทุนต่ำและความสะดวกในการสะสมทำให้ Aluminium วัสดุในอุดมคติสำหรับทำกระจก
ในการผลิต วัสดุก่อสร้างเป็นตัวสร้างก๊าซ
อะลูมิเนียมช่วยเพิ่มความทนทานต่อการกัดกร่อนและตะกรันต่อเหล็กกล้าและโลหะผสมอื่นๆ เช่น วาล์วเครื่องยนต์สันดาปภายในแบบลูกสูบ ใบพัดกังหัน แท่นขุดเจาะน้ำมัน อุปกรณ์แลกเปลี่ยนความร้อน และยังใช้แทนการชุบสังกะสีอีกด้วย
อะลูมิเนียมซัลไฟด์ใช้ในการผลิตไฮโดรเจนซัลไฟด์
กำลังดำเนินการวิจัยเพื่อพัฒนาโฟมอะลูมิเนียมให้เป็นวัสดุที่แข็งแรงและน้ำหนักเบาเป็นพิเศษ
เมื่ออะลูมิเนียมมีราคาแพงมาก จึงมีการทำเครื่องประดับหลากหลายรูปแบบ แฟชั่นสำหรับพวกเขาผ่านไปทันทีเมื่อเทคโนโลยีใหม่ (การพัฒนา) สำหรับการผลิตปรากฏขึ้นซึ่งลดลงหลายครั้ง ปัจจุบันอะลูมิเนียมถูกนำมาใช้ในการผลิตเครื่องประดับเครื่องแต่งกายเป็นบางครั้ง


โลหะอื่นๆ
ตะกั่ว
ตะกั่วเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มที่สี่ ซึ่งเป็นช่วงที่หกของระบบธาตุเคมีของ D. I. Dmitry Ivanovich Mendeleev โดยมีเลขอะตอม 82 แทนด้วยสัญลักษณ์ Pb (lat. Plumbum) สารตะกั่วอย่างง่าย (หมายเลข CAS: 7439-92-1) เป็นโลหะสีเทาที่หลอมละลายได้ค่อนข้างต่ำ
ตะกั่วมีค่าการนำความร้อนค่อนข้างต่ำที่ 35.1 W/(m K) ที่ 0°C โลหะนั้นนิ่มและตัดง่ายด้วยมีด บนพื้นผิวมักจะปกคลุมด้วยฟิล์มออกไซด์ที่มีความหนาไม่มากก็น้อย เมื่อตัดแล้ว พื้นผิวมันวาวจะเปิดออก ซึ่งจะจางหายไปตามกาลเวลาในอากาศ
จุดหลอมเหลว: 327.4 °C
จุดเดือด: 1740 °C
ตะกั่วไนเตรตใช้สำหรับการผลิตวัตถุระเบิดผสมที่ทรงพลัง ตะกั่วเอไซด์ถูกใช้เป็นเครื่องจุดชนวนที่ใช้กันอย่างแพร่หลายมากที่สุด ตะกั่วเปอร์คลอเรตใช้เพื่อเตรียมของเหลวหนัก (ความหนาแน่น 2.6 ก./ซม.3) ที่ใช้ในการกลั่นแร่ที่ลอยอยู่ในน้ำ บางครั้งก็ใช้ในวัตถุระเบิดผสมทรงพลังในฐานะสารออกซิไดซ์ ตะกั่วฟลูออไรด์เพียงอย่างเดียว เช่นเดียวกับบิสมัท คิวรัม ซิลเวอร์ฟลูออไรด์ ถูกใช้เป็นวัสดุแคโทดในแหล่งกระแสเคมี ตะกั่วบิสมัท, ตะกั่วซัลไฟด์ PbS, ตะกั่วไอโอไดด์ใช้เป็นวัสดุแคโทดในแบตเตอรี่ลิเธียม ตะกั่วคลอไรด์ PbCl2 เป็นวัสดุแคโทดในแหล่งกระแสไฟสแตนด์บาย ตะกั่วเทลลูไรด์ PbTe ถูกนำมาใช้กันอย่างแพร่หลายในฐานะวัสดุเทอร์โมอิเล็กทริก (thermo-emf ที่มี 350 μV/K) ซึ่งเป็นวัสดุที่ใช้กันอย่างแพร่หลายมากที่สุดในการผลิตเครื่องกำเนิดไฟฟ้าเทอร์โมอิเล็กทริกและตู้เย็นเทอร์โมอิเล็กทริก ตะกั่วไดออกไซด์ PbO2 มีการใช้กันอย่างแพร่หลายไม่เพียงแต่ในแบตเตอรี่ตะกั่วเท่านั้น แต่ยังมีการผลิตแหล่งกระแสเคมีสำรองจำนวนมากบนพื้นฐานของมัน เช่น ธาตุตะกั่ว-คลอรีน ธาตุตะกั่วฟลูออรีน เป็นต้น
ตะกั่วขาว คาร์บอเนตพื้นฐาน Pb(OH)2.PbCO3 ซึ่งเป็นผงสีขาวหนาแน่น ได้มาจากตะกั่วในอากาศภายใต้การกระทำของคาร์บอนไดออกไซด์และกรดอะซิติก การใช้ตะกั่วขาวเป็นเม็ดสีสำหรับระบายสีนั้นไม่ธรรมดาอย่างที่เคยเป็นมา เนื่องจากการสลายตัวของสารตะกั่วขาวโดยการกระทำของไฮโดรเจนซัลไฟด์ H2S ตะกั่วขาวยังใช้สำหรับการผลิตผงสำหรับอุดรูในเทคโนโลยีซีเมนต์และกระดาษตะกั่วคาร์บอเนต
สารหนูตะกั่วและสารหนูถูกนำมาใช้ในเทคโนโลยียาฆ่าแมลงเพื่อทำลายแมลงศัตรูพืช เกษตรกรรม(มอดยิปซีและมอดฝ้าย). ตะกั่วบอเรต Pb(BO2)2 H2O ซึ่งเป็นผงสีขาวที่ไม่ละลายน้ำ ใช้เพื่อทำให้ภาพวาดและน้ำยาเคลือบเงาแห้ง และใช้ร่วมกับโลหะอื่นๆ เพื่อเคลือบแก้วและพอร์ซเลน ตะกั่วคลอไรด์ PbCl2 ผงผลึกสีขาว ละลายได้ในน้ำร้อน สารละลายของคลอไรด์อื่นๆ และโดยเฉพาะอย่างยิ่งแอมโมเนียมคลอไรด์ NH4Cl ใช้สำหรับเตรียมขี้ผึ้งในการรักษาเนื้องอก
ตะกั่วโครเมต PbCrO4 หรือที่เรียกว่าสีเหลืองโครเมียมเป็นเม็ดสีที่สำคัญสำหรับการเตรียมสี สำหรับการย้อมสีพอร์ซเลนและสิ่งทอ ในอุตสาหกรรม โครเมตส่วนใหญ่จะใช้ในการผลิตเม็ดสีเหลือง ตะกั่วไนเตรต Pb(NO3)2 เป็นสารผลึกสีขาว ละลายได้ดีในน้ำ เป็นสารยึดเกาะที่มีการใช้งานจำกัด ในอุตสาหกรรม มันถูกใช้ในการจับคู่ การย้อมและการบรรจุสิ่งทอ การย้อมเขากวาง และการแกะสลัก ตะกั่วซัลเฟต Pb(SO4)2 ซึ่งเป็นผงสีขาวที่ไม่ละลายน้ำ ใช้เป็นเม็ดสีในแบตเตอรี่ การพิมพ์หิน และเทคโนโลยีผ้าพิมพ์
ตะกั่วซัลไฟด์ PbS ซึ่งเป็นผงสีดำที่ไม่ละลายน้ำ ใช้ในการเผาเครื่องปั้นดินเผาและตรวจจับไอออนของตะกั่ว
เนื่องจากตะกั่วดูดซับรังสีแกมมาได้ดี จึงใช้สำหรับป้องกันรังสีในเครื่องเอ็กซ์เรย์และในเครื่องปฏิกรณ์นิวเคลียร์ นอกจากนี้ ตะกั่วยังถือเป็นสารหล่อเย็นในโครงการเครื่องปฏิกรณ์นิวเคลียร์แบบนิวตรอนเร็วแบบเร็วขั้นสูง
โลหะผสมตะกั่วพบว่ามีการใช้งานมาก พิวเตอร์ (โลหะผสมตะกั่วดีบุก) ที่มีโลหะดีบุก 85-90% และ Pb 15-10% สามารถขึ้นรูปได้ ราคาไม่แพง และใช้ในการผลิตเครื่องใช้ในครัวเรือน บัดกรีที่มี 67% Pb และโลหะดีบุก 33% ใช้ในวิศวกรรมไฟฟ้า โลหะผสมของตะกั่วที่มีพลวงใช้ในการผลิตกระสุนและประเภทการพิมพ์ และโลหะผสมของตะกั่ว พลวง และดีบุกจะใช้สำหรับการหล่อและตลับลูกปืน โลหะผสมของตะกั่วกับพลวงมักใช้สำหรับปลอกสายเคเบิลและแผ่นสะสมไฟฟ้า สารประกอบตะกั่วใช้ในการผลิตสีย้อม, สี, ยาฆ่าแมลง, แก้ว รายการการค้าและเป็นสารเติมแต่งสำหรับน้ำมันเบนซินในรูปของตะกั่วเตตระเอทิล (C2H5) 4Pb (ของเหลวระเหยปานกลาง ไอระเหยในระดับความเข้มข้นน้อยมีกลิ่นผลไม้รสหวาน ความเข้มข้นสูง กลิ่นไม่พึงประสงค์ Tm = 130 ° C, Tbp = 80 ° C / 13 mm Hg .st. ความหนาแน่น 1.650 g/cm³ nD2v = 1.5198 ไม่ละลายในน้ำ ผสมกับตัวทำละลายอินทรีย์ เป็นพิษสูง แทรกซึมผ่านผิวหนังได้ง่าย MPC = 0.005 mg/m³; LD50 = 12.7 mg/m³ kg ( หนูปากเปล่า)) เพื่อเพิ่มค่าออกเทน

ดีบุก
ดีบุกเป็นองค์ประกอบของกลุ่มย่อยหลักของกลุ่มที่สี่ ซึ่งเป็นช่วงที่ห้าของระบบธาตุเคมีของ D. I. Mendeleev Dmitry Ivanovich โดยมีเลขอะตอม 50 ถูกกำหนดโดยสัญลักษณ์โลหะดีบุก (lat. Stannum) ภายใต้สภาวะปกติ สารธรรมดาคือพลาสติก โลหะมันวาวที่หลอมได้และหลอมได้ซึ่งมีสีขาวเงิน ดีบุกสร้างการปรับเปลี่ยนแบบ allotropic หลายอย่าง: α-tin ที่มีความเสถียรต่ำกว่า 13.2 °C (ดีบุกสีเทา) ที่มีตาข่ายประเภทเพชรลูกบาศก์ ส่วน β-tin (ดีบุกสีขาว) ที่มีความเสถียรสูงกว่า 13.2 °C พร้อมตาข่ายคริสตัลทรงสี่เหลี่ยม
ดีบุกถูกใช้เป็นหลักในการเป็นสารเคลือบป้องกันการกัดกร่อนที่ปลอดภัย ปลอดสารพิษ ในรูปแบบบริสุทธิ์หรือในโลหะผสมกับโลหะอื่นๆ การใช้งานในอุตสาหกรรมหลักของดีบุกอยู่ในเหล็กวิลาด (เหล็กกระป๋อง) สำหรับการผลิตภาชนะบรรจุอาหาร ในการบัดกรีสำหรับอุปกรณ์อิเล็กทรอนิกส์ ประปาในบ้าน ในโลหะผสมแบริ่ง และในการเคลือบดีบุกและโลหะผสม โลหะผสมที่สำคัญที่สุดของดีบุกคือ บรอนซ์(กับคิวรัม). โลหะผสมดีบุกที่รู้จักกันดีอีกชนิดหนึ่งที่ใช้ทำเครื่องใช้บนโต๊ะอาหาร ใน เมื่อเร็ว ๆ นี้มีการฟื้นฟูความสนใจในการใช้โลหะ เนื่องจากเป็นโลหะที่ “เป็นมิตรกับสิ่งแวดล้อม” มากที่สุดในบรรดาโลหะที่ไม่ใช่เหล็กหนัก ใช้ในการสร้างลวดตัวนำยิ่งยวดโดยใช้สารประกอบระหว่างโลหะ Nb3Sn
ราคาสำหรับดีบุกโลหะในปี 2549 โดยเฉลี่ยอยู่ที่ 12-18 ดอลลาร์/กก. ดีบุกไดออกไซด์ที่มีความบริสุทธิ์สูงอยู่ที่ 25 ดอลลาร์/กก. ดีบุกที่มีผลึกเดี่ยวที่มีความบริสุทธิ์สูงอยู่ที่ 210 ดอลลาร์/กก.
สารประกอบระหว่างโลหะของดีบุกและเซอร์โคเนียมมีจุดหลอมเหลวสูง (สูงถึง 2,000 °C) และทนต่อการเกิดออกซิเดชันเมื่อถูกความร้อนในอากาศและมีการใช้งานที่หลากหลาย
ดีบุกเป็นส่วนประกอบโลหะผสมที่สำคัญที่สุดในการผลิตโลหะผสมไทเทเนียมที่มีโครงสร้าง
ทินไดออกไซด์เป็นวัสดุขัดถูที่มีประสิทธิภาพมากซึ่งใช้ในการ "เก็บผิวละเอียด" ของพื้นผิวของกระจกออปติคัล
ส่วนผสมของเกลือดีบุก - "องค์ประกอบสีเหลือง" - ก่อนหน้านี้ใช้เป็นสีย้อมผ้าขนสัตว์
ดีบุกยังใช้ในแหล่งกระแสเคมีเป็นวัสดุขั้วบวก เช่น ธาตุแมงกานีส-ดีบุก ธาตุออกไซด์-ปรอท-ดีบุก การใช้ดีบุกในแบตเตอรี่ตะกั่วดีบุกมีแนวโน้มดี ตัวอย่างเช่น ที่แรงดันไฟฟ้าเท่ากันกับแบตเตอรี่ตะกั่ว แบตเตอรี่ตะกั่ว-ดีบุกมีความจุมากกว่า 2.5 เท่า และความหนาแน่นของพลังงานมากกว่า 5 เท่าต่อปริมาตรต่อหน่วย ความต้านทานภายในจะต่ำกว่ามาก
ดีบุกโลหะปลอดสารพิษซึ่งช่วยให้สามารถใช้ในอุตสาหกรรมอาหารได้ สิ่งเจือปนที่เป็นอันตรายที่มีอยู่ในดีบุกภายใต้สภาวะปกติของการจัดเก็บและการใช้งาน รวมทั้งในการหลอมที่อุณหภูมิสูงถึง 600 °C จะไม่ถูกปล่อยสู่อากาศของพื้นที่ทำงานในปริมาณที่เกินความเข้มข้นสูงสุดที่อนุญาตตาม GOST การสัมผัสกับฝุ่นดีบุกเป็นเวลานาน (15-20 ปี) ส่งผลต่อปอดและอาจทำให้เกิดโรคปอดบวมในคนงาน
การประยุกต์ใช้โลหะ
วัสดุก่อสร้าง
โลหะและโลหะผสมเป็นหนึ่งในวัสดุโครงสร้างหลัก อารยธรรมสมัยใหม่. โดยพิจารณาจากความแข็งแรง ความสม่ำเสมอ และการซึมผ่านของของเหลวและก๊าซเป็นหลัก นอกจากนี้ โดยการเปลี่ยนสูตรของโลหะผสม เราสามารถเปลี่ยนคุณสมบัติของโลหะผสมได้ในช่วงกว้างมาก
วัสดุไฟฟ้า
ใช้โลหะทั้งเป็นตัวนำที่ดี ไฟฟ้า(ทองแดง อะลูมิเนียม) และเป็นวัสดุที่มีความต้านทานสูงสำหรับตัวต้านทานและองค์ประกอบความร้อนไฟฟ้า (นิโครม ฯลฯ)
วัสดุเครื่องมือ
โลหะและโลหะผสมนั้นใช้กันอย่างแพร่หลายในการผลิตเครื่องมือ (ส่วนที่ใช้ทำงาน) ส่วนใหญ่เป็นเหล็กกล้าเครื่องมือและโลหะผสมแข็ง เพชร โบรอนไนไตรด์ และเซรามิกยังใช้เป็นวัสดุเครื่องมือ
โลหะวิทยา
โลหะวิทยาหรือโลหะวิทยาเป็นสาขาวิชาวัสดุศาสตร์ที่ศึกษาพฤติกรรมทางกายภาพและเคมีของโลหะ สารประกอบระหว่างโลหะและโลหะผสม โลหะวิทยายังรวมถึง การใช้งานจริงความรู้ที่มีอยู่เกี่ยวกับโลหะ - ตั้งแต่การสกัดวัตถุดิบไปจนถึงการปล่อยผลิตภัณฑ์สำเร็จรูปเป็นตัวเงิน
การศึกษาโครงสร้างและ คุณสมบัติทางกายภาพและทางเคมีการหลอมโลหะและออกไซด์และสารละลายที่เป็นของแข็ง การพัฒนาทฤษฎีสภาวะควบแน่นของสสาร
ศึกษาอุณหพลศาสตร์ จลนศาสตร์ และกลไกของปฏิกิริยาทางโลหะวิทยา
การพัฒนาพื้นฐานทางวิทยาศาสตร์และทางเทคนิคและเศรษฐกิจสำหรับการใช้วัตถุดิบแร่โพลีเมทัลลิกและของเสียที่มนุษย์สร้างขึ้นผสมผสานกับการแก้ปัญหาสิ่งแวดล้อม
การพัฒนาทฤษฎีฐานรากของ pyrometallurgical, electrothermal, hydrometallurgical และ gas-phase กระบวนการการผลิตโลหะ โลหะผสม ผงโลหะ และวัสดุผสมและสารเคลือบ
โลหะเหล็ก ได้แก่ เหล็ก แมงกานีส โครเมียม วาเนเดียม อื่น ๆ ทั้งหมดเป็นสี โดย คุณสมบัติทางกายภาพและวัตถุประสงค์ โลหะที่ไม่ใช่เหล็กแบ่งออกเป็นแบบมีเงื่อนไขเป็นหนัก (ทองแดง ตะกั่ว สังกะสี ดีบุก Ni) และเบา (อะลูมิเนียม แมกนีเซียม)
หลัก กระบวนการทางเทคโนโลยีแบ่งออกเป็น pyrometallurgy (ถลุง) และ hydrometallurgy (การสกัดโลหะในสารละลายเคมี) รูปแบบของไพโรเมทัลโลจีคือโลหะวิทยาในพลาสมา
โลหะวิทยาพลาสม่า - การสกัดจากแร่ การถลุงและการแปรรูปโลหะและโลหะผสมภายใต้อิทธิพลของพลาสมา
การแปรรูปแร่ (ออกไซด์ ฯลฯ ) ดำเนินการโดยการสลายตัวทางความร้อนในพลาสมา เพื่อป้องกันปฏิกิริยาย้อนกลับ จะใช้สารรีดิวซ์ (คาร์บอน ไฮโดรเจน มีเทน ฯลฯ) หรือการระบายความร้อนอย่างรวดเร็วของกระแสพลาสม่า ซึ่งละเมิดสมดุลทางอุณหพลศาสตร์
พลาสมาโลหกรรมช่วยให้สามารถกู้คืนโลหะจากแร่ได้โดยตรง เร่งกระบวนการทางโลหะวิทยาได้อย่างมาก ได้ วัสดุสะอาด, ลดต้นทุนเชื้อเพลิง (reductant) ข้อเสียของโลหะวิทยาพลาสม่าคือการใช้ไฟฟ้าสูงเพื่อสร้างพลาสมา

ประวัติศาสตร์
หลักฐานแรกที่แสดงว่าบุคคลนั้นมีส่วนร่วมในโลหะวิทยามีอายุย้อนไปถึง 5-6 พันปีก่อนคริสต์ศักราช อี และถูกพบที่ Majdanpek, Pločnik และไซต์อื่นๆ ในเซอร์เบีย (รวมถึงขวานทองแดง Vinca 5500 ปีก่อนคริสตกาล), บัลแกเรีย (5,000 ปีก่อนคริสตกาล), Palmela (), สเปน, Stonehenge () อย่างไรก็ตาม มักเป็นกรณีที่มีปรากฏการณ์อันยาวนานเช่นนี้ ไม่สามารถกำหนดอายุได้อย่างแม่นยำเสมอไป
ในวัฒนธรรมยุคแรกนั้น เงิน ทองแดง ดีบุก และเหล็กอุกกาบาตมีอยู่ ซึ่งทำให้งานโลหะมีจำกัด ดังนั้น "กริชสวรรค์" จึงมีมูลค่าสูง - อาวุธอียิปต์ที่สร้างขึ้นจากเหล็กอุกกาบาต 3000 ปีก่อนคริสตกาล อี แต่ได้เรียนรู้การสกัดทองแดงและดีบุกจาก การก่อตัวของหินและรับโลหะผสมที่เรียกว่าบรอนซ์ ผู้คนใน 3500 ปีก่อนคริสตกาล อี เข้าสู่ยุคสำริด
การรับเหล็กจากแร่และการหลอมโลหะนั้นยากกว่ามาก เชื่อกันว่าเทคโนโลยีนี้ถูกประดิษฐ์ขึ้นโดยชาวฮิตไทต์เมื่อประมาณ 1200 ปีก่อนคริสตกาล e. ซึ่งเป็นจุดเริ่มต้นของยุคเหล็ก ความลับของการขุดและการผลิตเหล็กได้กลายเป็นปัจจัยสำคัญในการปกครองของชาวฟิลิสเตีย
ร่องรอยของการพัฒนาโลหะวิทยาสีดำสามารถสืบหาได้จากวัฒนธรรมและอารยธรรมในอดีตมากมาย ซึ่งรวมถึงอาณาจักรและอาณาจักรโบราณและยุคกลางของตะวันออกกลางและตะวันออกใกล้ อียิปต์โบราณและอนาโตเลีย () คาร์เธจ ชาวกรีกและโรมันในสมัยโบราณและยุคกลาง ยุโรป, ประเทศจีน เป็นต้น ควรสังเกตว่าวิธีการอุปกรณ์และเทคโนโลยีมากมายของโลหะผสมถูกคิดค้นขึ้นในปี จีนโบราณจากนั้นชาวยุโรปก็เชี่ยวชาญงานฝีมือนี้ (การประดิษฐ์เตาหลอม เหล็กหล่อ, เหล็ก , ค้อนไฮดรอลิก ฯลฯ ) อย่างไรก็ตาม การวิจัยเมื่อเร็ว ๆ นี้ชี้ให้เห็นว่าเทคโนโลยีของโรมันนั้นก้าวหน้ากว่าที่เคยคิดไว้มาก โดยเฉพาะอย่างยิ่งในการขุดและการตีขึ้นรูป
เหมืองแร่โลหะวิทยา
การทำเหมืองแร่โลหะวิทยาประกอบด้วยการสกัดโลหะมีค่าจากแร่และหลอมวัตถุดิบที่สกัดออกมาเป็นโลหะบริสุทธิ์ ในการแปลงเมทัลออกไซด์หรือซัลไฟด์ให้เป็นโลหะบริสุทธิ์ แร่ต้องถูกแยกออกด้วยวิธีทางกายภาพ เคมี หรืออิเล็กโทรไลต์
นักโลหะวิทยาทำงานกับสามองค์ประกอบหลัก: วัตถุดิบ สารเข้มข้น (ออกไซด์ของโลหะมีค่าหรือซัลไฟด์) และของเสีย หลังจากการขุด แร่ก้อนใหญ่จะถูกบดขยี้จนแต่ละอนุภาคมีความเข้มข้นหรือของเสียที่มีค่า
ภูเขา ผลงานไม่จำเป็นถ้าแร่และสิ่งแวดล้อมอนุญาตให้ชะล้าง ด้วยวิธีนี้จึงสามารถละลายและรับสารละลายที่อุดมด้วยแร่ธาตุได้
บ่อยครั้งที่แร่มีโลหะมีค่าหลายชนิด ในกรณีเช่นนี้ ของเสียจากกระบวนการหนึ่งสามารถใช้เป็นวัตถุดิบสำหรับกระบวนการอื่นได้
ล้อแม็ก
โลหะผสมเป็นส่วนผสมที่เป็นเนื้อเดียวกันในระดับมหภาคของสองหรือ มากกว่าองค์ประกอบทางเคมีที่มีส่วนประกอบที่เป็นโลหะเด่นกว่า เฟสหลักหรือเฟสเดียวของโลหะผสมนั้นเป็นสารละลายที่เป็นของแข็งขององค์ประกอบการผสมในโลหะซึ่งเป็นพื้นฐานของโลหะผสม
โลหะผสมมีคุณสมบัติทางโลหะ เช่น ความมันวาวของโลหะ การนำไฟฟ้าและความร้อนสูง บางครั้งส่วนประกอบโลหะผสมไม่เพียงแต่เป็นองค์ประกอบทางเคมีเท่านั้น แต่ยังรวมถึงสารประกอบทางเคมีที่มีคุณสมบัติของโลหะด้วย ตัวอย่างเช่น ส่วนประกอบหลัก โลหะผสมแข็งเป็นทังสเตนหรือไททาเนียมคาร์ไบด์ คุณสมบัติระดับมหภาคของโลหะผสมมักจะแตกต่างจากคุณสมบัติของส่วนประกอบเสมอ และความเป็นเนื้อเดียวกันในระดับมหภาคของโลหะผสมหลายเฟส (ต่างกัน) เกิดขึ้นได้เนื่องจากการกระจายตัวของเฟสสิ่งเจือปนในเมทริกซ์โลหะอย่างสม่ำเสมอ
โลหะผสมมักจะได้มาจากการผสมส่วนประกอบในสถานะหลอมเหลว ตามด้วยการทำให้เย็นลง ที่อุณหภูมิหลอมเหลวสูงของส่วนประกอบ โลหะผสมถูกผลิตขึ้นโดยการผสมผงโลหะกับการเผาผนึกที่ตามมา (นี่คือจำนวนโลหะผสมทังสเตนที่ได้มา เป็นต้น)
โลหะผสมเป็นหนึ่งในวัสดุโครงสร้างหลัก ในหมู่พวกเขา มูลค่าสูงสุดมีโลหะผสมตามเหล็กและอลูมิเนียม อโลหะ เช่น คาร์บอน ซิลิกอน โบรอน ฯลฯ สามารถนำเข้าสู่องค์ประกอบของโลหะผสมได้หลายชนิด เทคโนโลยีมีการใช้โลหะผสมมากกว่า 5 พันชนิด
แหล่งที่มา
http://ru.wikipedia.org/
สารานุกรมของนักลงทุน. 2013 .
คำพ้องความหมาย:- - METAL ตัวผู้ โลหะ ลต. เครื่องบด; และในรูปแบบเล็ก ๆ ในการหลอม: kinglet ในชีวิตประจำวัน โลหะมีค่าและมีราคาแพง: ทอง แพลตตินั่ม เงิน; ง่าย: เหล็ก, ทองแดง, สังกะสี, ดีบุก, ตะกั่ว; เคมีได้ค้นพบจุดเริ่มต้นของฟอสซิลเกือบทั้งหมด ซึ่งประกอบด้วย ... ... พจนานุกรมต้าเหลียง
องค์ประกอบทางเคมีที่รู้จักในปัจจุบันส่วนใหญ่ (93 จาก 117) เป็นโลหะ
อะตอมของโลหะชนิดต่างๆ มีโครงสร้างเหมือนกันมาก และสารที่ง่ายและซับซ้อนที่พวกมันก่อตัวขึ้นมีคุณสมบัติคล้ายกัน (ทางกายภาพและเคมี)
ตำแหน่งในระบบธาตุและโครงสร้างของอะตอมโลหะ
ในตารางธาตุ โลหะจะอยู่ทางด้านซ้ายและใต้เส้นแบ่งตามเงื่อนไขที่ส่งผ่านจากโบรอนไปยังแอสทาทีน (ดูตารางด้านล่าง) โลหะประกอบด้วยองค์ประกอบ s เกือบทั้งหมด (ยกเว้น H, He) ประมาณครึ่งหนึ่ง R-องค์ประกอบทั้งหมด d- และ ฉ-องค์ประกอบ ( แลนทาไนด์และ แอคติไนด์).
อะตอมของโลหะส่วนใหญ่มีระดับพลังงานภายนอกที่ประกอบด้วย ตัวเล็ก(มากถึง 3) อิเล็กตรอนมีเพียงอะตอมขององค์ประกอบ p (Sn, Pb, Bi, Po) เท่านั้นที่มีมากกว่า (จากสี่ถึงหก) เวเลนซ์อิเล็กตรอนของอะตอมโลหะนั้นจับกับนิวเคลียสได้อ่อน (เมื่อเทียบกับอะตอมที่ไม่ใช่โลหะ) ดังนั้นอะตอมของโลหะจึงค่อนข้างจะบริจาคอิเล็กตรอนเหล่านี้ให้กับอะตอมอื่นได้ง่าย ปฏิกริยาเคมีเฉพาะตัวรีดิวซ์และในขณะเดียวกันก็เปลี่ยนเป็นไอออนบวกที่มีประจุบวก:
ฉัน - ne - \u003d ฉัน n +
อะตอมของโลหะต่างจากโลหะที่ไม่ใช่โลหะ เฉพาะสถานะออกซิเดชันที่เป็นบวกตั้งแต่ +1 ถึง +8
ความง่ายในการที่อะตอมของโลหะบริจาคเวเลนซ์อิเล็กตรอนให้กับอะตอมอื่น ๆ นั้นบ่งบอกถึงกิจกรรมการรีดิวซ์ของโลหะที่กำหนด ยิ่งอะตอมของโลหะปล่อยอิเลคตรอนไปได้ง่ายขึ้นเท่าไร อะตอมของโลหะก็จะยิ่งแข็งแกร่งขึ้นในฐานะตัวรีดิวซ์ หากเราจัดเรียงโลหะเป็นแถวเพื่อลดความสามารถในการรีดิวซ์ในสารละลายที่เป็นน้ำ เราจะรู้จักเรา ชุดรางของโลหะซึ่งเรียกอีกอย่างว่าชุดแรงดันไฟฟ้าเคมีไฟฟ้า (หรือ กิจกรรมใกล้เคียง) โลหะ (ดูตารางด้านล่าง)
ความชุก mโลหะในธรรมชาติ.
โลหะที่พบมากที่สุดสามอันดับแรกในเปลือกโลก (นี่คือชั้นผิวของโลกที่มีความหนาประมาณ 16 กม.) ได้แก่ อะลูมิเนียม เหล็ก และแคลเซียม พบได้น้อยกว่าคือโซเดียม โพแทสเซียม และแมกนีเซียม ตารางด้านล่างแสดงเศษส่วนมวลของโลหะบางชนิดในเปลือกโลก
ธาตุเหล็กและแคลเซียม พบได้น้อยกว่าคือโซเดียม โพแทสเซียม และแมกนีเซียม ตารางด้านล่างแสดงเศษส่วนมวลของโลหะบางชนิดในเปลือกโลก
ความชุกของโลหะในเปลือกโลก
| โลหะ | โลหะ | เศษส่วนมวลในเปลือกโลก% | |
|---|---|---|---|
| อัล | 8,8 | Cr | 8,3 ∙ 10 -3 |
| เฟ | 4,65 | สังกะสี | 8,3 ∙ 10 -3 |
| Ca | 3,38 | นิ | 8 ∙ 10 -3 |
| นา | 2,65 | Cu | 4,7 ∙ 10 -3 |
| K | 2,41 | พีบี | 1,6 ∙ 10 -3 |
| มก. | 2,35 | Ag | 7 ∙ 10 -6 |
| Ti | 0,57 | hg | 1,35 ∙ 10 -6 |
| มิน | 0,10 | Au | 5 ∙ 10 -8 |
ธาตุที่มีเศษส่วนมวลในเปลือกโลกน้อยกว่า 0.01% เรียกว่า หายาก. โลหะหายาก ได้แก่ แลนทาไนด์ทุกชนิด หากธาตุใดไม่สามารถมีสมาธิในเปลือกโลกได้ กล่าวคือ ธาตุนั้นไม่ได้สร้างแร่ขึ้นเอง แต่เกิดขึ้นเป็นส่วนผสมกับธาตุอื่น ๆ จึงจัดเป็น กระจัดกระจายองค์ประกอบ โลหะที่กระจัดกระจาย เช่น Sc, Ga, In, Tl, Hf.
ในยุค 40 ของศตวรรษที่ XX นักวิทยาศาสตร์ชาวเยอรมัน วอลเตอร์ และไอดา โนลลา แนะนำว่า ก้อนหินปูถนนทุกก้อนบนทางเท้ามีองค์ประกอบทางเคมีทั้งหมดของตารางธาตุ ในตอนแรก คำพูดเหล่านี้ไม่ได้รับการยินยอมอย่างเป็นเอกฉันท์จากเพื่อนร่วมงาน อย่างไรก็ตาม เมื่อมีวิธีการวิเคราะห์ที่แม่นยำขึ้นเรื่อยๆ นักวิทยาศาสตร์ก็เชื่อมั่นในความจริงของคำเหล่านี้มากขึ้น
เนื่องจากสิ่งมีชีวิตทั้งหมดสัมผัสใกล้ชิดกับ สิ่งแวดล้อมจากนั้นแต่ละรายการควรมีองค์ประกอบทางเคมีส่วนใหญ่ของระบบธาตุถ้าไม่ใช่ทั้งหมด ตัวอย่างเช่น ในร่างกายของผู้ใหญ่ เศษส่วนมวล สารอนินทรีย์คือ 6% ของโลหะในสารประกอบเหล่านี้มี Mg, Ca, Na, K เอนไซม์จำนวนมากและสารประกอบอินทรีย์ที่ออกฤทธิ์ทางชีวภาพอื่น ๆ ในร่างกายของเราประกอบด้วย V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Cr และโลหะอื่น ๆ .
ร่างกายของผู้ใหญ่มีโพแทสเซียมไอออนประมาณ 140 กรัมโดยเฉลี่ยและโซเดียมไอออนประมาณ 100 กรัม สำหรับอาหาร เราบริโภคโพแทสเซียมไอออน 1.5 ถึง 7 กรัมทุกวัน และโซเดียมไอออน 2 กรัมถึง 15 กรัม ความต้องการโซเดียมไอออนนั้นสูงมากจนต้องเติมลงในอาหารเป็นพิเศษ การสูญเสียโซเดียมไอออนอย่างมีนัยสำคัญ (ในรูปของ NaCl กับปัสสาวะและเหงื่อ) ส่งผลเสียต่อสุขภาพของมนุษย์ ดังนั้นในสภาพอากาศร้อน แพทย์จึงแนะนำให้ดื่มน้ำแร่ อย่างไรก็ตาม ปริมาณเกลือที่มากเกินไปในอาหารส่งผลเสียต่อการทำงานของอวัยวะภายในของเรา (โดยหลักคือหัวใจและไต)
คุณต้องเปิดใช้ JavaScript เพื่อโหวตและสารเคมีอื่นๆ เพื่อให้ได้โลหะบริสุทธิ์และการใช้งานต่อไป จำเป็นต้องแยกโลหะออกจากแร่และดำเนินการทำให้บริสุทธิ์ หากจำเป็น ให้ทำการเจือและการแปรรูปโลหะอื่นๆ ศาสตร์ของโลหกรรมเกี่ยวข้องกับการศึกษาเรื่องนี้ โลหะวิทยาแยกความแตกต่างระหว่างแร่โลหะเหล็ก (ตามธาตุเหล็ก) และแร่ที่ไม่ใช่เหล็ก (ธาตุเหล็กไม่รวมอยู่ในองค์ประกอบของมัน เพียงประมาณ 70 องค์ประกอบเท่านั้น) ทอง เงิน และแพลตตินั่มก็เช่นกัน โลหะมีค่า (มีเกียรติ). นอกจากนี้ยังมีอยู่ในน้ำทะเล พืช สิ่งมีชีวิตในปริมาณเล็กน้อย (ในขณะที่มีบทบาทสำคัญ)
เป็นที่ทราบกันดีอยู่แล้วว่าร่างกายมนุษย์ประกอบด้วยโลหะ 3% ส่วนใหญ่ในเซลล์ของเราคือแคลเซียมและโซเดียมซึ่งกระจุกตัวอยู่ในระบบน้ำเหลือง แมกนีเซียมสะสมในกล้ามเนื้อและระบบประสาท ทองแดง - ในตับ ธาตุเหล็ก - ในเลือด
การขุด
โลหะมักจะถูกสกัดจากโลกโดยวิธีการของอุตสาหกรรมเหมืองแร่ ผลลัพธ์ - แร่ที่ขุดได้ - ทำหน้าที่เป็นแหล่งที่ค่อนข้างสมบูรณ์ขององค์ประกอบที่จำเป็น ในการค้นหาตำแหน่งของแร่ ใช้วิธีการค้นหาพิเศษ รวมถึงการสำรวจแร่และการสำรวจแหล่งแร่ เงินฝากมักจะแบ่งออกเป็นเหมืองหิน (การพัฒนาแร่บนพื้นผิว) ซึ่งการขุดจะดำเนินการโดยการขุดดินโดยใช้เครื่องมือหนักเช่นเดียวกับเหมืองใต้ดิน
จากแร่ที่ขุดได้โลหะจะถูกสกัดโดยใช้สารเคมีหรือการลดอิเล็กโทรไลต์ ใน pyrometallurgy อุณหภูมิสูงใช้ในการแปลงแร่เป็นวัตถุดิบโลหะ ใน hydrometallurgy เคมีน้ำใช้เพื่อวัตถุประสงค์เดียวกัน วิธีการที่ใช้ขึ้นอยู่กับชนิดของโลหะและชนิดของการปนเปื้อน
เมื่อแร่โลหะเป็นสารประกอบไอออนิกของโลหะและอโลหะ โดยปกติแล้วจะต้องผ่านการถลุง—ให้ความร้อนด้วยตัวรีดิวซ์—เพื่อสกัดโลหะบริสุทธิ์ โลหะทั่วไปหลายชนิด เช่น เหล็ก หลอมโดยใช้คาร์บอน (ที่ได้จากการเผาไหม้ถ่านหิน) เป็นตัวรีดิวซ์ โลหะบางชนิด เช่น อะลูมิเนียมและโซเดียม ไม่มีสารรีดิวซ์ที่ทำงานได้ในเชิงเศรษฐกิจและนำกลับมาใช้ใหม่โดยใช้อิเล็กโทรไลซิส
ความแข็งของโลหะบางชนิดในระดับ Mohs:
| ความแข็ง | โลหะ |
|---|---|
| 0.2 | ซีเซียม |
| 0.3 | รูบิเดียม |
| 0.4 | โพแทสเซียม |
| 0.5 | โซเดียม |
| 0.6 | ลิเธียม |
| 1.2 | อินเดียม |
| 1.2 | แทลเลียม |
| 1.25 | แบเรียม |
| 1.5 | สตรอนเทียม |
| 1.5 | แกลเลียม |
| 1.5 | ดีบุก |
| 1.5 | ตะกั่ว |
| 1.5 | |
| 1.75 | แคลเซียม |
| 2.0 | แคดเมียม |
| 2.25 | บิสมัท |
| 2.5 | แมกนีเซียม |
| 2.5 | สังกะสี |
| 2.5 | แลนทานัม |
| 2.5 | เงิน |
| 2.5 | ทอง |
| 2.59 | อิตเทรียม |
| 2.75 | อลูมิเนียม |
| 3.0 | ทองแดง |
| 3.0 | พลวง |
| 3.0 | ทอเรียม |
| 3.17 | Scandium |
| 3.5 | แพลตตินั่ม |
| 3.75 | โคบอลต์ |
| 3.75 | แพลเลเดียม |
| 3.75 | เซอร์โคเนียม |
| 4.0 | เหล็ก |
| 4.0 | นิกเกิล |
| 4.0 | แฮฟเนียม |
| 4.0 | แมงกานีส |
| 4.5 | วาเนเดียม |
| 4.5 | โมลิบดีนัม |
| 4.5 | โรเดียม |
| 4.5 | ไทเทเนียม |
| 4.75 | ไนโอเบียม |
| 5.0 | อิริเดียม |
| 5.0 | รูทีเนียม |
| 5.0 | แทนทาลัม |
| 5.0 | เทคนีเชียม |
| 5.0 | โครเมียม |
| 5.5 | เบริลเลียม |
| 5.5 | ออสเมียม |
| 5.5 | รีเนียม |
| 6.0 | ทังสเตน |
| 6.0 | β-ยูเรเนียม |
เนื่องจากการส่งคืนอิเล็กตรอนได้ง่าย การเกิดออกซิเดชันของโลหะจึงเป็นไปได้ ซึ่งอาจนำไปสู่การกัดกร่อนและการเสื่อมสลายของคุณสมบัติเพิ่มเติม ความสามารถในการออกซิไดซ์สามารถรับรู้ได้จากชุดกิจกรรมมาตรฐานของโลหะ ข้อเท็จจริงนี้ยืนยันความจำเป็นในการใช้โลหะร่วมกับองค์ประกอบอื่นๆ (โลหะผสม ที่สำคัญที่สุดคือเหล็ก) การผสมและการใช้สารเคลือบต่างๆ
เพื่อให้คำอธิบายคุณสมบัติทางอิเล็กทรอนิกส์ของโลหะถูกต้องมากขึ้น จำเป็นต้องใช้กลศาสตร์ควอนตัม ในของแข็งทั้งหมดที่มีความสมมาตรเพียงพอ ระดับพลังงานของอิเล็กตรอนของอะตอมแต่ละตัวคาบเกี่ยวกันและเกิดเป็นแถบที่อนุญาต และแถบที่เกิดจากวาเลนซ์อิเล็กตรอนจะเรียกว่าแถบวาเลนซ์ พันธะที่อ่อนแอของเวเลนซ์อิเล็กตรอนในโลหะนำไปสู่ความจริงที่ว่าแถบเวเลนซ์ในโลหะนั้นกว้างมากและวาเลนซ์อิเล็กตรอนทั้งหมดไม่เพียงพอที่จะเติมให้เต็ม
คุณสมบัติพื้นฐานของโซนที่เติมบางส่วนดังกล่าวคือแม้ที่แรงดันไฟฟ้าขั้นต่ำ การจัดเรียงอิเล็กตรอนของวาเลนซ์จะเริ่มขึ้นในตัวอย่าง กล่าวคือ กระแสไฟฟ้าไหล
การเคลื่อนที่ของอิเล็กตรอนที่สูงเช่นเดียวกันทำให้เกิดการนำความร้อนสูง เช่นเดียวกับความสามารถในการสะท้อนรังสีแม่เหล็กไฟฟ้า (ซึ่งทำให้โลหะมีความวาวเป็นลักษณะเฉพาะ)
โลหะบางชนิด
- ปอด:
- อื่น:
การประยุกต์ใช้โลหะ
วัสดุก่อสร้าง
วัสดุเครื่องมือ
ประวัติความเป็นมาของการพัฒนาความคิดเกี่ยวกับโลหะ
ความคุ้นเคยของมนุษย์กับโลหะเริ่มต้นด้วยทองคำ เงิน และทองแดง นั่นคือโลหะที่พบในสภาวะอิสระบนพื้นผิวโลก ต่อจากนั้นก็เชื่อมโลหะเข้าด้วยกันซึ่งมีการกระจายอย่างกว้างขวางในธรรมชาติและแยกได้ง่ายจากสารประกอบ ได้แก่ ดีบุก ตะกั่ว เหล็ก และ โลหะทั้งเจ็ดนี้คุ้นเคยกับมนุษย์ในสมัยโบราณ ในบรรดาสิ่งประดิษฐ์ของอียิปต์โบราณมีรายการทองคำและทองแดงซึ่งตามแหล่งข้อมูลบางแห่งเป็นของยุคที่จะถูกลบออกจาก 3,000-4000 ปีก่อนคริสตกาล อี
สังกะสี บิสมัท พลวง ถูกเติมเข้าไปในโลหะที่รู้จักเจ็ดชนิดเท่านั้นในยุคกลางและใน ต้น XVIIIศตวรรษสารหนู ตั้งแต่กลางศตวรรษที่ 18 จำนวนโลหะที่ค้นพบได้เพิ่มขึ้นอย่างรวดเร็วและในตอนต้นของศตวรรษที่ 20 ก็ถึง 65 และโดย จุดเริ่มต้นของXXIศตวรรษ - มากถึง 96
ไม่มีอุตสาหกรรมเคมีใดที่มีส่วนช่วยในการพัฒนาความรู้ทางเคมีมากเท่ากับกระบวนการที่เกี่ยวข้องกับการผลิตและการแปรรูปโลหะ เกี่ยวข้องกับประวัติศาสตร์ของพวกเขา ไฮไลท์ประวัติศาสตร์เคมี คุณสมบัติของโลหะมีลักษณะเฉพาะที่มาก ยุคต้นๆทอง เงิน ทองแดง ตะกั่ว ดีบุก เหล็ก และปรอทเป็นกลุ่มของสารที่เป็นเนื้อเดียวกันตามธรรมชาติ และแนวคิดของ "โลหะ" เป็นแนวคิดทางเคมีที่เก่าแก่ที่สุด อย่างไรก็ตามความคิดเห็นเกี่ยวกับธรรมชาติของพวกเขาในรูปแบบที่ชัดเจนไม่มากก็น้อยปรากฏเฉพาะในยุคกลางในหมู่นักเล่นแร่แปรธาตุ จริงอยู่ ความคิดของอริสโตเติลเกี่ยวกับธรรมชาติ: การก่อตัวของทุกสิ่งที่มีอยู่ในธาตุทั้งสี่ (ไฟ ดิน น้ำ และอากาศ) ได้บ่งชี้ถึงความซับซ้อนของโลหะแล้ว แต่ความคิดเหล่านี้คลุมเครือและเป็นนามธรรมเกินไป สำหรับนักเล่นแร่แปรธาตุ แนวคิดเรื่องความซับซ้อนของโลหะและด้วยเหตุนี้ ความเชื่อในความสามารถในการเปลี่ยนโลหะหนึ่งเป็นอีกโลหะหนึ่ง เพื่อสร้างพวกมันขึ้นมาใหม่ เป็นแนวคิดหลักของโลกทัศน์ของพวกเขา แนวคิดนี้เป็นข้อสรุปโดยธรรมชาติจากข้อเท็จจริงจำนวนมากที่เกี่ยวข้องกับการเปลี่ยนแปลงทางเคมีของโลหะที่สะสมในเวลานั้น อันที่จริง การเปลี่ยนแปลงของโลหะเป็นออกไซด์ที่แตกต่างจากพวกเขาอย่างสิ้นเชิงโดยการเผาในอากาศอย่างง่าย ๆ และการผลิตโลหะกลับจากออกไซด์ การแยกโลหะบางชนิดออกจากสิ่งอื่น การก่อตัวของโลหะผสมที่มีคุณสมบัติอื่นนอกเหนือจากที่นำมา โลหะและอื่น ๆ ทั้งหมดนี้ดูเหมือนจะบ่งบอกถึงความซับซ้อนของธรรมชาติของมัน
ในแง่ของการเปลี่ยนแปลงที่แท้จริงของโลหะเป็นทองคำ ความเชื่อในความเป็นไปได้ของสิ่งนี้มีพื้นฐานมาจากหลาย ข้อเท็จจริงที่มองเห็นได้. ในตอนแรก การก่อตัวของโลหะผสมที่มีสีคล้ายกับทอง ตัวอย่างเช่น จากทองแดงและสังกะสี ในสายตาของนักเล่นแร่แปรธาตุได้แปรสภาพเป็นทองคำแล้ว ดูเหมือนว่าพวกเขาจะต้องเปลี่ยนสีเท่านั้นและคุณสมบัติของโลหะก็จะแตกต่างกันเช่นกัน โดยเฉพาะอย่างยิ่ง การทดลองที่ไม่ดีมีส่วนอย่างมากต่อความเชื่อนี้ เมื่อนำสารที่มีส่วนผสมของทองคำนี้มาเปลี่ยนโลหะพื้นฐานให้เป็นทองคำ ตัวอย่างเช่น อยู่แล้วใน ปลาย XVIIIเป็นเวลาหลายศตวรรษ เภสัชกรในโคเปนเฮเกนมั่นใจว่าเงินบริสุทธิ์ทางเคมี เมื่อผสมกับสารหนู บางส่วนจะเปลี่ยนเป็นทองคำ ข้อเท็จจริงนี้ได้รับการยืนยันโดยนักเคมีชื่อดัง Guiton de Morvo และทำเสียงดังมาก หลังจากนั้นไม่นาน พบว่าสารหนูที่ใช้ในการทดลองมีร่องรอยของเงินกับทองคำ
เนื่องจากโลหะทั้งเจ็ดที่รู้จักกันในสมัยนั้น บางชนิดจึงเปลี่ยนรูปทางเคมีได้ง่ายกว่า บางชนิดก็ยากกว่า นักเล่นแร่แปรธาตุจึงแบ่งโลหะเหล่านี้ออกเป็นชั้นสูง - สมบูรณ์แบบ และไร้ตำหนิ - ไม่สมบูรณ์ อย่างแรกรวมถึงทองคำและเงิน ทองแดงที่สอง ดีบุก ตะกั่ว เหล็กและปรอท อย่างหลังซึ่งมีคุณสมบัติของโลหะมีตระกูล แต่ในขณะเดียวกันก็มีความแตกต่างอย่างมากจากโลหะทั้งหมดที่อยู่ในสถานะของเหลวและความผันผวน นักวิทยาศาสตร์ในขณะนั้นยึดครองอย่างมากและบางคนก็แยกออกเป็น กลุ่มพิเศษ; ความสนใจที่ดึงดูดไปยังมันนั้นยิ่งใหญ่มากจนปรอทเริ่มได้รับการพิจารณาจากองค์ประกอบที่โลหะก่อตัวขึ้นเองและเห็นได้ชัดว่าพวกเขาเห็นว่าเป็นพาหะของคุณสมบัติของโลหะ นักเล่นแร่แปรธาตุยอมรับการมีอยู่ตามธรรมชาติของการเปลี่ยนผ่านของโลหะบางชนิดไปเป็นโลหะอื่น ไม่สมบูรณ์ถึงสมบูรณ์แบบ นักเล่นแร่แปรธาตุสันนิษฐานว่าภายใต้สภาวะปกติ การเปลี่ยนแปลงนี้ดำเนินไปอย่างช้ามาก เป็นเวลาหลายศตวรรษ และบางทีอาจไม่ใช่โดยปราศจากการมีส่วนร่วมอันลึกลับของร่างกายสวรรค์ บทบาทที่ยิ่งใหญ่ในเวลานั้นและในชะตากรรมของมนุษย์ บังเอิญมีโลหะเจ็ดชนิดที่รู้จักในขณะนั้น เช่นเดียวกับดาวเคราะห์ที่รู้จักในขณะนั้น และสิ่งนี้ยิ่งบ่งชี้ถึงความเชื่อมโยงที่ลึกลับระหว่างพวกมัน ในบรรดานักเล่นแร่แปรธาตุ โลหะมักถูกเรียกว่าดาวเคราะห์ ทองเรียกว่าดวงอาทิตย์, เงิน - ดวงจันทร์, ทองแดง - ดาวศุกร์, ดีบุก - ดาวพฤหัสบดี, ตะกั่ว - ดาวเสาร์, เหล็ก - ดาวอังคารและปรอท - ปรอท เมื่อพบสังกะสี บิสมัท พลวง และสารหนู วัตถุที่มีลักษณะคล้ายกับโลหะทุกประการ แต่คุณสมบัติที่มีลักษณะเฉพาะมากที่สุดอย่างหนึ่งของโลหะ คือ ความอ่อนตัว ได้รับการพัฒนาได้ไม่ดี พวกมันจึงถูกแยกออกเป็นกลุ่มพิเศษ - กึ่งโลหะ. การแบ่งโลหะออกเป็นโลหะที่เหมาะสมและกึ่งโลหะมีอยู่เร็วที่สุดเท่าที่ กลางสิบแปดศตวรรษ.
การกำหนดองค์ประกอบของโลหะในขั้นต้นเป็นการเก็งกำไรอย่างหมดจด ในตอนแรก นักเล่นแร่แปรธาตุยอมรับว่าธาตุทั้งสองก่อตัวขึ้นจากธาตุสองชนิดคือกำมะถัน ต้นกำเนิดของมุมมองนี้ไม่เป็นที่รู้จักซึ่งมีอยู่แล้วในศตวรรษที่ 8 จากข้อมูลของ Geber ข้อพิสูจน์การมีอยู่ของปรอทในโลหะก็คือมันละลายพวกมัน และในสารละลายเหล่านี้ ความเป็นตัวตนของพวกมันหายไป ถูกดูดซับโดยปรอท ซึ่งจะไม่เกิดขึ้นหากพวกมันไม่มีหลักการเดียวกับปรอท นอกจากนี้ ปรอทที่มีตะกั่วยังให้สิ่งที่คล้ายกับดีบุก ส่วนกำมะถันก็อาจจะเอาเพราะว่าสารประกอบกำมะถันเป็นที่ทราบกันดีอยู่แล้วว่า รูปร่างคล้ายกับโลหะ ในอนาคต แนวคิดง่ายๆ เหล่านี้ อาจเป็นเพราะความพยายามในการรับโลหะที่ไม่สำเร็จ กลายเป็นเรื่องที่ซับซ้อนและสับสนอย่างมาก ในแนวคิดของนักเล่นแร่แปรธาตุ ตัวอย่างเช่น ของศตวรรษที่ X-XIII ปรอทและกำมะถันซึ่งก่อตัวเป็นโลหะนั้นไม่ใช่ปรอทและกำมะถันชนิดเดียวกับที่นักเล่นแร่แปรธาตุมีอยู่ในมือ มันเป็นเพียงสิ่งที่คล้ายกับพวกเขา มีคุณสมบัติพิเศษ; สิ่งที่มีอยู่ในกำมะถันและปรอทธรรมดามีอยู่จริงในพวกเขาในระดับที่มากกว่าในร่างกายอื่น ภายใต้ปรอทซึ่งเป็นส่วนหนึ่งของโลหะ พวกมันเป็นตัวแทนของสิ่งที่กำหนดความไม่เปลี่ยนรูปของพวกมัน ความแวววาวของโลหะ ความอ่อนตัว พูดได้คำเดียวว่า เป็นพาหะของรูปลักษณ์ที่เป็นโลหะ กำมะถันหมายถึงพาหะของความแปรปรวน, การสลายตัว, การติดไฟได้ของโลหะ ธาตุทั้งสองนี้พบได้ในโลหะในสัดส่วนต่างๆ และดังที่กล่าวไปแล้ว ในรูปแบบต่างๆแก้ไขแล้ว; นอกจากนี้ อาจมีระดับความบริสุทธิ์ต่างกันไป ตามคำกล่าวของ Geber ทองคำประกอบด้วยปรอทจำนวนมากและกำมะถันจำนวนเล็กน้อยในความบริสุทธิ์สูงสุดและคงที่ที่สุด ในทางตรงกันข้าม ในดีบุก กลับคิดว่ามีกำมะถันและปรอทอยู่มาก ซึ่งไม่บริสุทธิ์ ถูกตรึงอย่างไม่ดี และอื่นๆ ทั้งหมดนี้ พวกเขาต้องการแสดงทัศนคติที่แตกต่างกันของโลหะต่อสารเคมีที่ทรงพลังเพียงชนิดเดียวในขณะนั้น - ไฟ ที่ พัฒนาต่อไปมุมมองเหล่านี้ของธาตุสองชนิด - ปรอทและกำมะถัน - ดูเหมือนว่านักเล่นแร่แปรธาตุจะไม่เพียงพอที่จะอธิบายองค์ประกอบของโลหะ เกลือถูกเติมเข้าไปและสารหนูบางชนิด จากสิ่งนี้ พวกเขาต้องการบ่งชี้ว่าด้วยการเปลี่ยนแปลงทั้งหมดของโลหะ บางสิ่งที่ไม่ระเหยและถาวรยังคงอยู่ หากในธรรมชาติ "การแปลงโลหะพื้นฐานเป็นโลหะชั้นสูงใช้เวลาหลายศตวรรษ" นักเล่นแร่แปรธาตุพยายามที่จะสร้างเงื่อนไขที่กระบวนการปรับปรุงนี้จะทำให้สุกเร็วขึ้นและง่ายดาย เนื่องจากความสัมพันธ์ที่ใกล้ชิดของเคมีกับยาร่วมสมัยและชีววิทยาร่วมสมัย แนวคิดของการเปลี่ยนแปลงของโลหะจึงถูกระบุโดยธรรมชาติด้วยแนวคิดของการเติบโตและการพัฒนาของร่างกายที่เป็นระเบียบ: การเปลี่ยนแปลงเช่นตะกั่วเป็นทองคำ , การก่อตัวของพืชจากเมล็ดพืชที่โยนลงไปในดินและตามที่เป็นอยู่, สลายตัว, การหมัก, การรักษาอวัยวะที่เป็นโรคในคน - ทั้งหมดนี้เป็นปรากฏการณ์ส่วนตัวของกระบวนการชีวิตลึกลับทั่วไปอย่างหนึ่ง, การปรับปรุงและเกิดจาก สิ่งเร้าเดียวกัน จากนี้ไปโดยไม่บอกว่าจุดเริ่มต้นลึกลับที่ทำให้ได้ทองคำควรรักษาโรคให้หาย ร่างกายมนุษย์ในวัยเยาว์ เป็นต้น นี่คือวิธีสร้างแนวความคิดเกี่ยวกับศิลาอาถรรพ์ที่น่าอัศจรรย์
สำหรับบทบาทของศิลาอาถรรพ์ในการเปลี่ยนโลหะพื้นฐานเป็นโลหะชั้นสูง ส่วนใหญ่มีข้อบ่งชี้ทั้งหมดเกี่ยวกับการเปลี่ยนเป็นทองคำ ไม่ค่อยมีใครพูดถึงการได้มาซึ่งเงิน โดยผู้เขียนคนเดียวกัน ศิลาอาถรรพ์เปลี่ยนโลหะเป็นเงินและทอง ตามที่คนอื่น ๆ มีอยู่สองชนิดของสารนี้: หนึ่งสมบูรณ์ อื่นสมบูรณ์น้อยกว่า และสุดท้ายนี้ใช้เพื่อให้ได้เงิน เกี่ยวกับปริมาณศิลาอาถรรพ์ที่จำเป็นสำหรับการเปลี่ยนแปลงคำแนะนำก็ต่างกัน บางส่วนกล่าวว่า 1 ส่วนนั้นสามารถเปลี่ยนโลหะ 10,000,000 ส่วนให้เป็นทองคำ ตามส่วนอื่น ๆ - 100 ส่วนและแม้แต่ 2 ส่วนเท่านั้น เพื่อให้ได้ทองคำ โลหะพื้นฐานบางส่วนถูกหลอม หรือใช้ปรอทและศิลาของปราชญ์ถูกโยนลงไป บางคนมั่นใจว่าการเปลี่ยนแปลงจะเกิดขึ้นทันที ในขณะที่คนอื่น ๆ - ทีละเล็กทีละน้อย มุมมองเหล่านี้เกี่ยวกับธรรมชาติของโลหะและความสามารถในการเปลี่ยนแปลงของโลหะนั้นมีอยู่ทั่วไปเป็นเวลาหลายศตวรรษจนถึงศตวรรษที่ 17 เมื่อพวกเขาเริ่มปฏิเสธเรื่องทั้งหมดนี้อย่างเฉียบขาด ยิ่งไปกว่านั้น เนื่องจากมุมมองเหล่านี้ทำให้เกิดการปรากฏตัวของคนหลอกลวงหลายคนที่เอารัดเอาเปรียบ หวังให้คนใจง่ายได้ทอง บอยล์พยายามดิ้นรนกับแนวคิดของนักเล่นแร่แปรธาตุเป็นพิเศษ: “ฉันอยากรู้” เขาพูดในที่เดียวว่า “คุณจะย่อยสลายทองเป็นปรอท กำมะถันและเกลือได้อย่างไร ฉันยินดีจ่ายค่าใช้จ่ายของประสบการณ์นี้ สำหรับฉัน ฉันไม่เคยสามารถทำได้”
หลังจากหลายศตวรรษของความพยายามอย่างไร้ผลในการผลิตโลหะเทียมและด้วยจำนวนข้อเท็จจริงที่สะสมไว้ ศตวรรษที่สิบแปดตัวอย่างเช่นเกี่ยวกับบทบาทของอากาศในระหว่างการเผาไหม้การเพิ่มน้ำหนักของโลหะในระหว่างการออกซิเดชันซึ่ง Geber รู้อยู่แล้วในศตวรรษที่ VIII คำถามเกี่ยวกับองค์ประกอบพื้นฐานของโลหะดูเหมือนจะใกล้เคียงมาก ตอนจบ; แต่แนวโน้มใหม่ปรากฏในวิชาเคมีซึ่งเป็นผลมาจากทฤษฎีฟโลจิสตันและการแก้ปัญหานี้ยังคงล่าช้าเป็นเวลานาน
นักวิทยาศาสตร์ในสมัยนั้นได้รับความสนใจอย่างมากจากปรากฏการณ์การเผาไหม้ ตามแนวคิดพื้นฐานของปรัชญาในขณะนั้นว่าความคล้ายคลึงกันในคุณสมบัติของวัตถุควรมาจากความเหมือนกันของจุดเริ่มต้นองค์ประกอบที่ประกอบขึ้นเป็นร่างที่ติดไฟได้สรุป องค์ประกอบทั่วไป. การเผาไหม้ถือเป็นการกระทำของการสลายตัวการแตกตัวเป็นองค์ประกอบ ในกรณีนี้ องค์ประกอบที่ติดไฟได้จะถูกปล่อยออกมาในรูปของเปลวไฟ ในขณะที่องค์ประกอบอื่นๆ ยังคงอยู่ ตระหนักในทัศนะของนักเล่นแร่แปรธาตุต่อการเกิดโลหะจากธาตุทั้งสาม คือ ปรอท กำมะถัน และเกลือ แล้วยอมรับ มีอยู่จริงสำหรับโลหะ หลักการที่ติดไฟได้นั้นจะต้องได้รับการยอมรับว่าเป็นกำมะถัน เห็นได้ชัดว่าจำเป็นต้องรับรู้สิ่งตกค้างจากการเผาโลหะ - "โลก" อย่างที่พวกเขาพูดกันว่าเป็นส่วนประกอบอื่นของโลหะ ดังนั้นปรอทจึงไม่มีส่วนเกี่ยวข้องกับมัน ในทางกลับกัน กำมะถันเผาไหม้เป็นกรดซัลฟิวริก ซึ่งโดยอาศัยอำนาจตามสิ่งที่กล่าว หลายคนถือว่ามีร่างกายที่ง่ายกว่ากำมะถัน และรวมอยู่ในร่างกายเบื้องต้น มีความสับสนและขัดแย้งกัน Becher เพื่อประสานแนวคิดเก่ากับแนวคิดใหม่ ยอมรับการมีอยู่ของดินสามประเภทในโลหะ: "ดิน" ที่เหมาะสม "ดินที่ติดไฟได้" และ "ดินปรอท" ภายใต้เงื่อนไขเหล่านี้ Stahl เสนอทฤษฎีของเขา ในความเห็นของเขา จุดเริ่มต้นของการติดไฟได้ไม่ใช่กำมะถันหรือสารที่รู้จักอื่นใด แต่เป็นสิ่งที่ไม่รู้จัก ซึ่งเขาเรียกว่าโฟลจิสตัน ดูเหมือนว่าโลหะจะก่อตัวขึ้นจากโฟลจิสตันและดิน การเผาโลหะในอากาศจะมาพร้อมกับการปล่อย phlogiston; การผลิตโลหะย้อนกลับจากโลกของเขาด้วยความช่วยเหลือของถ่านหิน - สารที่อุดมไปด้วย phlogiston - เป็นการรวม phlogiston เข้ากับโลก แม้ว่าจะมีโลหะหลายชนิดและเมื่อเผาแล้วให้ดินของตัวเองธาตุหลังเป็นธาตุหนึ่งเพื่อให้ส่วนประกอบนี้ของโลหะมีลักษณะสมมติเช่นเดียวกับ phlogiston อย่างไรก็ตาม ผู้ติดตามของ Stahl บางครั้งยอมรับ "ดินแดนธาตุ" มากที่สุดเท่าที่มีโลหะ เมื่อคาเวนดิชละลายโลหะในกรด ได้ไฮโดรเจนมาและศึกษาคุณสมบัติของมัน (ไม่สามารถรักษาการเผาไหม้ การระเบิดในอากาศ ฯลฯ ) เขาจำโฟลจิสตันของสตาห์ลได้ โลหะตามแนวคิดของเขาประกอบด้วยไฮโดรเจนและ "โลก" มุมมองนี้ได้รับการยอมรับจากผู้ติดตามทฤษฎี phlogiston หลายคน
แม้จะมีความสอดคล้องที่เห็นได้ชัดของทฤษฎีโฟลจิสตัน แต่ก็มี ข้อเท็จจริงใหญ่ซึ่งไม่สามารถเกี่ยวข้องกับนางได้แต่อย่างใด Geber ยังรู้ด้วยว่าโลหะมีน้ำหนักเพิ่มขึ้นเมื่อถูกยิง ในขณะเดียวกัน ตามคำกล่าวของ Stahl พวกเขาจะต้องสูญเสีย phlogiston: เมื่อ phlogiston ถูกต่อเข้ากับ "โลก" อีกครั้ง น้ำหนักของโลหะที่ได้จะน้อยกว่าน้ำหนักของ "โลก" ดังนั้น ปรากฏว่า phlogiston ต้องมีคุณสมบัติพิเศษ - แรงโน้มถ่วงเชิงลบ แม้จะมีสมมติฐานที่แยบยลทั้งหมดที่หยิบยกมาเพื่ออธิบายปรากฏการณ์นี้ แต่ก็ไม่สามารถเข้าใจและทำให้งงได้
เมื่อ Lavoisier ชี้แจงบทบาทของอากาศในระหว่างการเผาไหม้และแสดงให้เห็นว่าการเพิ่มของน้ำหนักของโลหะในระหว่างการเผานั้นมาจากการเพิ่มออกซิเจนจากอากาศสู่โลหะและด้วยเหตุนี้การเผาโลหะไม่ใช่การสลายตัวเป็นองค์ประกอบ แต่ ในทางตรงกันข้าม การผสมผสาน คำถามเกี่ยวกับความซับซ้อนของโลหะถูกตัดสินในทางลบ โลหะถูกกำหนดให้เป็นองค์ประกอบทางเคมีอย่างง่าย เนื่องจากแนวคิดพื้นฐานของ Lavoisier ที่ว่าวัตถุธรรมดาคือสิ่งที่ไม่สามารถแยกวัตถุอื่นได้ ด้วยการสร้างระบบธาตุเคมีเป็นระยะโดย Mendeleev องค์ประกอบของโลหะจึงเข้ามาแทนที่
ดูสิ่งนี้ด้วย
หมายเหตุ
ลิงค์
- S.P. Vukolov: // พจนานุกรมสารานุกรมของ Brockhaus และ Efron: ใน 86 เล่ม (82 เล่มและ 4 เพิ่มเติม) - เซนต์ปีเตอร์สเบิร์ก. , พ.ศ. 2433-2450.(ส่วนประวัติศาสตร์)
| ตารางธาตุ | |
|---|---|
| Dmitri Ivanovich Mendeleev กฎหมายเป็นระยะ กลุ่มขององค์ประกอบ | |
| รูปแบบ | การกำหนดค่าอิเล็คทรอนิคส์แบบขยายช่วงบล็อกแบบสั้น |
| รายการโดย | ชื่อ · นิรุกติศาสตร์ (เพื่อเป็นเกียรติแก่สถานที่ เพื่อเป็นเกียรติแก่ผู้ค้นพบ) · เวลาแห่งการค้นพบ สถานะออกซิเดชัน ความอุดมสมบูรณ์ (ในมนุษย์) ความคงตัวของไอโซโทป |


