หัวข้อ: คุณสมบัติทางเคมีองค์ประกอบ
วางแผน:
1. คุณสมบัติของโลหะและสารประกอบ ( I และ II ch. ย่อย)
1.1 องค์ประกอบ IA
1.2 องค์ประกอบของ IIA ลักษณะทั่วไปของกลุ่ม
2. คุณสมบัติทางเคมีของธาตุพี
2.1 องค์ประกอบ IIIA ลักษณะทั่วไปของกลุ่ม
2.2 องค์ประกอบของ IVA ลักษณะทั่วไปของกลุ่ม
องค์ประกอบ 2.3 VA ลักษณะทั่วไปของกลุ่ม
2.4 ผ่านองค์ประกอบ ลักษณะทั่วไปของกลุ่ม
2.5 องค์ประกอบของ VIIA ลักษณะทั่วไปของกลุ่ม
2.6 องค์ประกอบของVIIIA ลักษณะทั่วไปของกลุ่ม
3. ไฮโดรเจน
องค์ประกอบโลหะอัลคาไลของกลุ่มย่อยหลักของกลุ่ม I ของระบบธาตุ องค์ประกอบทางเคมี D. I. Mendeleev: ลิเธียม Li, โซเดียม Na, โพแทสเซียม K, รูบิเดียม Rb, ซีเซียม Cs และแฟรนเซียม Fr. โลหะเหล่านี้เรียกว่าอัลคาไลน์เนื่องจากสารประกอบส่วนใหญ่ละลายได้ในน้ำ ในภาษาสลาฟ "leach" หมายถึง "ละลาย" และสิ่งนี้กำหนดชื่อของโลหะกลุ่มนี้ เมื่อโลหะอัลคาไลละลายในน้ำจะเกิดไฮดรอกไซด์ที่ละลายน้ำได้เรียกว่าอัลคาลิส G. Davy ในปี 1807 ได้รับโพแทสเซียมและโซเดียมฟรีเป็นครั้งแรก
ในชั้นอิเล็กตรอนชั้นนอก อะตอมของโลหะอัลคาไลจะมีอิเล็กตรอนหนึ่งตัวต่อหนึ่งอิเล็กตรอน ในชั้นอิเล็กตรอนที่สองจากภายนอก ลิเธียมอะตอมประกอบด้วยอิเล็กตรอนสองตัว และอะตอมของโลหะอัลคาไลอื่น ๆ มีอิเล็กตรอนแปดตัวต่อตัว การมีอิเล็กตรอนเพียงตัวเดียวในชั้นอิเล็กตรอนชั้นนอก ซึ่งอยู่ห่างจากนิวเคลียสค่อนข้างมาก อะตอมขององค์ประกอบเหล่านี้จึงยอมปล่อยอิเล็กตรอนนี้ออกอย่างง่ายดาย กล่าวคือ มีลักษณะเฉพาะด้วยพลังงานไอออไนเซชันต่ำ ไอออนบวกที่มีประจุเดี่ยวที่เกิดขึ้นในกรณีนี้มีโครงสร้างอิเล็กทรอนิกส์ที่เสถียรของก๊าซมีตระกูลที่สอดคล้องกัน (ลิเธียมไอออน - โครงสร้างของอะตอมฮีเลียม โซเดียมไอออน - อะตอมนีออน ฯลฯ) ความง่ายในการหดตัวของอิเล็กตรอนภายนอกเป็นตัวกำหนดองค์ประกอบภายใต้การพิจารณาว่ามากที่สุด ตัวแทนทั่วไปโลหะ: คุณสมบัติของโลหะแสดงในโลหะอัลคาไลอย่างรวดเร็วโดยเฉพาะ
โครงสร้างเดียวกันไม่เพียงแต่ชั้นนอกเท่านั้น แต่ยังรวมถึงชั้นอิเล็กตรอนสุดท้ายของอะตอมของโลหะอัลคาไลทั้งหมด ยกเว้นลิเธียม เป็นตัวกำหนดความคล้ายคลึงกันอย่างมากของคุณสมบัติขององค์ประกอบเหล่านี้ ในเวลาเดียวกัน การเพิ่มขึ้นของประจุนิวเคลียร์และ จำนวนทั้งหมดอิเล็กตรอนในอะตอมเมื่อเคลื่อนที่จากบนลงล่างในกลุ่มย่อยจะสร้างความแตกต่างในคุณสมบัติของพวกมัน เช่นเดียวกับในกลุ่มอื่นๆ ความแตกต่างเหล่านี้แสดงให้เห็นอย่างชัดเจนในการเพิ่มความสะดวกในการบริจาคอิเล็กตรอนเวเลนซ์และการเพิ่มคุณสมบัติของโลหะด้วยจำนวนอะตอมที่เพิ่มขึ้น
|
คุณสมบัติของโลหะอัลคาไล |
||||||||
|
อะตอม |
ชื่อ, |
โลหะ |
อิออน |
ศักยภาพ |
EO |
พี |
ทีพี , |
ทีเบล, |
|
ลิเธียม Li |
0,152 |
0,078 |
5,32 |
0,98 |
0,53 |
1347 |
||
|
โซเดียม นา |
0,190 |
0,098 |
5,14 |
0,93 |
0,97 |
|||
|
โพแทสเซียม K |
0,227 |
0,133 |
4,34 |
0,82 |
0,86 |
|||
|
รูบิเดียม Rb |
0,248 |
0,149 |
4,18 |
0,82 |
1,53 |
|||
|
ซีเซียมซีเอส |
0,265 |
0,165 |
3,89 |
0,79 |
1,87 |
|||
คุณสมบัติทางเคมีของโลหะอัลคาไล เนื่องจากกิจกรรมทางเคมีสูงของโลหะอัลคาไลที่สัมพันธ์กับน้ำ ออกซิเจน ไนโตรเจน พวกมันจึงถูกเก็บไว้ภายใต้ชั้นของน้ำมันก๊าด ในการทำปฏิกิริยากับโลหะอัลคาไล ชิ้นส่วนที่มีขนาดที่ต้องการจะถูกตัดอย่างระมัดระวังด้วยมีดผ่าตัดภายใต้ชั้นของน้ำมันก๊าด ทำความสะอาดพื้นผิวโลหะอย่างทั่วถึงจากผลิตภัณฑ์ที่มีปฏิสัมพันธ์กับอากาศในบรรยากาศอาร์กอนและเท่านั้น จากนั้นตัวอย่างจะถูกวางในถังปฏิกิริยา
1. ปฏิสัมพันธ์กับน้ำ คุณสมบัติที่สำคัญของโลหะอัลคาไลกิจกรรมสูงของพวกเขาเกี่ยวกับน้ำ ลิเธียมทำปฏิกิริยาอย่างสงบที่สุด (ไม่มีการระเบิด) กับน้ำ:
เมื่อทำปฏิกิริยาที่คล้ายกัน โซเดียมจะเผาไหม้ด้วยเปลวไฟสีเหลืองและเกิดการระเบิดเล็กน้อย โพแทสเซียมมีความกระตือรือร้นมากขึ้น: ในกรณีนี้ การระเบิดจะรุนแรงกว่ามาก และเปลวไฟเป็นสี สีม่วง. 2. ปฏิสัมพันธ์กับออกซิเจน ผลิตภัณฑ์การเผาไหม้ของโลหะอัลคาไลในอากาศมี องค์ประกอบที่แตกต่างขึ้นอยู่กับกิจกรรมของโลหะ
ลิเธียมเท่านั้นที่เผาไหม้ในอากาศด้วยการก่อตัวของออกไซด์ขององค์ประกอบปริมาณสัมพันธ์:
ในระหว่างการเผาไหม้ของโซเดียม เปอร์ออกไซด์ Na2O2 ส่วนใหญ่ถูกสร้างขึ้นด้วยส่วนผสมของซูเปอร์ออกไซด์ NaO2 เล็กน้อย:
ผลิตภัณฑ์จากการเผาไหม้ของโพแทสเซียม รูบิเดียม และซีเซียมประกอบด้วยซุปเปอร์ออกไซด์ส่วนใหญ่: ![]()
เพื่อให้ได้ออกไซด์ของโซเดียมและโพแทสเซียม ส่วนผสมของไฮดรอกไซด์ เปอร์ออกไซด์หรือซูเปอร์ออกไซด์จะถูกทำให้ร้อนด้วยโลหะส่วนเกินในกรณีที่ไม่มีออกซิเจน: 
สำหรับสารประกอบออกซิเจนของโลหะอัลคาไล ลักษณะเฉพาะดังต่อไปนี้: เมื่อรัศมีของไอออนบวกของโลหะอัลคาไลเพิ่มขึ้น ความคงตัวของสารประกอบออกซิเจนที่มีเปอร์ออกไซด์ไอออน O22- และซูเปอร์ออกไซด์ไอออน O2- จะเพิ่มขึ้น
โลหะอัลคาไลหนักมีลักษณะเฉพาะโดยการก่อตัวของโอโซนที่ค่อนข้างเสถียรขององค์ประกอบ EO3 สารประกอบออกซิเจนทั้งหมดมีสีต่างกันซึ่งความเข้มของสีจะเข้มขึ้นในชุดตั้งแต่ Li ถึง Cs:
|
สูตร |
สี |
|
Li2O |
สีขาว |
|
Na2O |
สีขาว |
|
K2O |
สีเหลือง |
|
Rb2O |
สีเหลือง |
|
Cs2O |
ส้ม |
|
Na2O2 |
แสงสว่าง |
|
KO2 |
ส้ม |
|
RbO2 |
มืด- |
|
CsO2 |
สีเหลือง |
ออกไซด์ของโลหะอัลคาไลมีคุณสมบัติทั้งหมดของออกไซด์พื้นฐาน: ทำปฏิกิริยากับน้ำ กรดออกไซด์และกรด:
เปอร์ออกไซด์และซูเปอร์ออกไซด์แสดงคุณสมบัติของตัวออกซิไดซ์ที่แรง:
เปอร์ออกไซด์และซูเปอร์ออกไซด์ทำปฏิกิริยากับน้ำอย่างเข้มข้น ทำให้เกิดไฮดรอกไซด์:
3. ปฏิกิริยากับสารอื่น ๆ โลหะอัลคาไลทำปฏิกิริยากับอโลหะหลายชนิด เมื่อถูกความร้อนจะรวมตัวกับไฮโดรเจนเพื่อสร้าง ไฮไดรด์ โดยสร้างฮาโลเจน ซัลเฟอร์ ไนโตรเจน ฟอสฟอรัส คาร์บอน และซิลิกอน ตามลำดับ เฮไลด์ ซัลไฟด์ ไนไตรด์ ฟอสไฟด์ คาร์ไบด์และซิลิไซด์:
ไฮไดรด์ โดยสร้างฮาโลเจน ซัลเฟอร์ ไนโตรเจน ฟอสฟอรัส คาร์บอน และซิลิกอน ตามลำดับ เฮไลด์ ซัลไฟด์ ไนไตรด์ ฟอสไฟด์ คาร์ไบด์และซิลิไซด์:
เมื่อถูกความร้อน โลหะอัลคาไลสามารถทำปฏิกิริยากับโลหะอื่นๆ ทำให้เกิดสารประกอบระหว่างโลหะได้ โลหะอัลคาไลทำปฏิกิริยาอย่างแข็งขัน (ด้วยการระเบิด) กับกรด
โลหะอัลคาไลละลายในแอมโมเนียเหลวและอนุพันธ์ - เอมีนและเอไมด์:
เมื่อละลายในแอมโมเนียเหลว โลหะอัลคาไลจะสูญเสียอิเล็กตรอน ซึ่งถูกละลายโดยโมเลกุลแอมโมเนียและทำให้สารละลายมีสีฟ้า เอไมด์ที่เกิดขึ้นจะถูกย่อยสลายได้ง่ายด้วยน้ำด้วยการก่อตัวของอัลคาไลและแอมโมเนีย:
โลหะอัลคาไลทำปฏิกิริยากับ อินทรียฺวัตถุแอลกอฮอล์ (ด้วยการก่อตัวของแอลกอฮอล์) และกรดคาร์บอกซิลิก (ด้วยการก่อตัวของเกลือ):
4. การกำหนดคุณภาพของโลหะอัลคาไล เนื่องจากศักยภาพการแตกตัวเป็นไอออนของโลหะอัลคาไลมีขนาดเล็ก เมื่อโลหะหรือสารประกอบของโลหะถูกทำให้ร้อนในเปลวไฟ อะตอมจะแตกตัวเป็นไอออน ทำให้เปลวไฟมีสีหนึ่ง:
|
แต่งสีเปลวไฟด้วยโลหะอัลคาไล |
|
|
สีแดงเลือดนก |
|
|
สีเหลือง |
|
|
สีม่วง |
|
|
ขาวอมชมพู |
|
|
สีม่วงแดง |
|
รับโลหะอัลคาไล
1. เพื่อให้ได้โลหะอัลคาไล ส่วนใหญ่จะใช้อิเล็กโทรไลซิสของการหลอมเหลวของเฮไลด์ ซึ่งส่วนใหญ่มักจะเป็นคลอไรด์ ซึ่งก่อตัวเป็นแร่ธาตุธรรมชาติ:
แคโทด: Li+ + e → Lianode: 2Cl- 2e → Cl22 บางครั้งเพื่อให้ได้โลหะอัลคาไล
อิเล็กโทรไลซิสของการละลายของไฮดรอกไซด์:
แคโทด: Na+ + e → Naanode: 4OH- 4e → 2H2O + O2 เนื่องจากโลหะอัลคาไลอยู่ทางด้านซ้ายของไฮโดรเจนในชุดแรงดันไฟฟ้าเคมีไฟฟ้า ดังนั้น การเตรียมอิเล็กโทรไลต์พวกเขาจากสารละลายเกลือเป็นไปไม่ได้ ในกรณีนี้จะเกิดอัลคาไลและไฮโดรเจนที่สอดคล้องกัน
ในธรรมชาติ โลหะอัลคาไลพบเฉพาะในรูปของสารประกอบ โซเดียมและโพแทสเซียมเป็นองค์ประกอบถาวรของซิลิเกตทั่วไปหลายชนิด เกลือแร่โซเดียมแต่ละชนิดที่สำคัญที่สุดเกลือทั่วไป (NaCl)รวมอยู่ในองค์ประกอบของน้ำทะเลและในบางพื้นที่ของพื้นผิวโลกจะเกิดการสะสมของเกลือสินเธาว์จำนวนมากภายใต้ชั้นของหินลุ่มน้ำ (ในสหภาพโซเวียต Solikamsk, Artemoven, Iletsk, ฯลฯ ) ชั้นบนของตะกอนดังกล่าวบางครั้งมีการสะสมของเกลือโพแทสเซียม [ในรูปของแร่ธาตุ sylvinite (KClNaCl), carnallite (KCl MgCl2 6H2 O) ฯลฯ ] ซึ่งทำหน้าที่เป็นแหล่งหลักในการรับสารประกอบขององค์ประกอบนี้ มีการสะสมเกลือโพแทสเซียมตามธรรมชาติที่มีความสำคัญทางอุตสาหกรรมเพียงไม่กี่ชนิดเท่านั้น ที่สำคัญที่สุดคือเงินฝาก Solikamsk ในสหภาพโซเวียต
แร่ธาตุจำนวนหนึ่งเป็นที่รู้จักสำหรับลิเธียม [เช่น spodumene LiAl (SiO3 ) 2 ] แต่การสะสมของแร่ธาตุนั้นหายาก รูบิเดียมและซีเซียมเกิดขึ้นเฉพาะกับสิ่งเจือปนกับสิ่งอื่นเท่านั้น โลหะอัลคาไล. ร่องรอยของแฟรนเซียมมักพบในแร่ยูเรเนียม
สารประกอบโซเดียมและโพแทสเซียมมีความสำคัญอย่างยิ่งต่อชีวิต พอเพียงที่จะระลึกได้ ตัวอย่างเช่น บุคคลที่บริโภค NaCl 510 กิโลกรัมต่อปี ในทำนองเดียวกัน เกลือโพแทสเซียมก็จำเป็นสำหรับพืช ในการนี้ ประมาณ 90% ของสารประกอบโปแตชที่ขุดได้ทั้งหมดถูกใช้สำหรับการปฏิสนธิในดิน ส่วนที่เหลืออีก 10% เช่นเดียวกับจำนวนมหาศาล การเชื่อมต่อต่างๆใช้โซเดียมในอุตสาหกรรม อนุพันธ์ลิเธียมและการใช้สารประกอบ Rb และ Cs อย่างจำกัด พบว่ามีการใช้งานเพียงเล็กน้อยเท่านั้น
ในรัฐอิสระ โลหะอัลคาไลสามารถแยกได้โดยอิเล็กโทรไลซิสของเกลือคลอไรด์ที่หลอมละลายของพวกมัน คุณค่าทางปฏิบัติที่สำคัญคือโซเดียมซึ่งมีการผลิตทั่วโลกต่อปีมากกว่า 50,000 ตัน
กลุ่มย่อยหลักของกลุ่ม II ประกอบด้วยองค์ประกอบข อีปู ลี่, แมกนีเซียม แคลเซียม สตรอนเทียม แบเรียมและเรเดียม องค์ประกอบทั้งหมดเหล่านี้ ยกเว้นเบริลเลียม มีคุณสมบัติเป็นโลหะเด่นชัด ในรัฐอิสระและเป็นสีเงิน สารสีขาวใส แข็งกว่าโลหะอัลคาไล มีจุดหลอมเหลวค่อนข้างสูง ในแง่ของความหนาแน่น ทั้งหมดยกเว้นเรเดียมเป็นของโลหะเบา
สมาชิกสองคนแรกของกลุ่มย่อยที่อยู่ระหว่างการพิจารณามีตำแหน่งที่ค่อนข้างพิเศษในนั้น ซึ่งแตกต่างจากองค์ประกอบที่เหลือสี่ประการหลายประการ บีอิริลเลียมตามตัวของมันเองบ้าง stgam เข้าใกล้อลูมิเนียม.
ไอโซโทปทั้งหมดขององค์ประกอบสุดท้ายของเรเดียมกลุ่มย่อยมีกัมมันตภาพรังสี ไอโซโทปอายุยืน 226Ra ก่อนหน้านี้ใช้ในการฉายรังสีบำบัด; ตอนนี้มันถูกแทนที่ด้วยไอโซโทปที่ถูกกว่าขององค์ประกอบอื่น ๆ ที่ผลิตในเครื่องปฏิกรณ์นิวเคลียร์
ในชั้นอิเล็กตรอนชั้นนอก อะตอมขององค์ประกอบของกลุ่มย่อยนี้มีอิเล็กตรอนสองตัว ในชั้นนอกที่สอง เบริลเลียมมีอิเล็กตรอนสองตัว และองค์ประกอบที่เหลือมีแปดตัว
สารอย่างง่ายที่เกิดจากอะตอมของธาตุเหล่านี้คือโลหะ ลิเธียม โซเดียม โพแทสเซียม รูบิเดียม ซีเซียม และแฟรนเซียม เรียกว่าโลหะอัลคาไลเนื่องจากไฮดรอกไซด์ของพวกมันเป็นด่าง แคลเซียม สตรอนเทียม และแบเรียมเรียกว่าโลหะอัลคาไลน์เอิร์ท กิจกรรมทางเคมีของสารเหล่านี้จะเพิ่มขึ้นเมื่อรัศมีอะตอมเพิ่มขึ้น คุณสมบัติทางเคมีของโลหะเหล่านี้มีคุณสมบัติในการรีดิวซ์ที่สำคัญที่สุด โลหะอัลคาไลเป็นสารรีดิวซ์ที่แรงที่สุด โลหะกลุ่ม IIA ก็เป็นสารรีดิวซ์ที่ค่อนข้างแรงเช่นกัน ทั้งหมด (ยกเว้นเบริลเลียม) ทำปฏิกิริยากับน้ำ (แมกนีเซียมเมื่อต้ม):
2M + 2H 2 O \u003d 2M aq + 2OH aq + H 2, M + 2H 2 O \u003d M 2 + 2OH + H 2
ในกรณีของแมกนีเซียม แคลเซียม และสตรอนเทียม เนื่องจากไฮดรอกไซด์ที่เกิดการละลายได้ต่ำ ปฏิกิริยาจะมาพร้อมกับการก่อตัวของตะกอน:
M 2 + 2OH \u003d Mg (OH) 2
โลหะอัลคาไลทำปฏิกิริยากับอโลหะส่วนใหญ่: 2M + H 2 = 2MH (เมื่อถูกความร้อน), 4M + O 2 \u003d 2M 2 O (M Li), 2M + Cl 2 = 2MCl (ภายใต้สภาวะปกติ), 2M + S = M 2 S (เมื่อถูกความร้อน)
จากโลหะอัลคาไลที่เผาไหม้ในออกซิเจนออกไซด์ปกติจะสร้างลิเธียมเท่านั้น โลหะอัลคาไลที่เหลือก่อตัวเป็นเปอร์ออกไซด์ (M 2O2 ) หรือซูเปอร์ออกไซด์ (MO 2
สารประกอบที่มีซูเปอร์ออกไซด์ไอออนที่มีประจุอย่างเป็นทางการเท่ากับ 1 e) เช่นเดียวกับโลหะอัลคาไล โลหะของธาตุกลุ่ม IIA ทำปฏิกิริยากับอโลหะหลายชนิดแต่ภายใต้สภาวะที่รุนแรงกว่า: M + H 2 = MH 2 (เมื่อถูกความร้อน ยกเว้นเบริลเลียม)
2M+O 2
\u003d 2MO (ภายใต้สภาวะปกติ Be และ Mg เมื่อถูกความร้อน), M + Cl 2 = MCl 2 (ภายใต้สภาวะปกติ) M + S = MS (เมื่อถูกความร้อน) ต่างจากโลหะอัลคาไล พวกมันก่อตัวเป็นออกไซด์ธรรมดาที่มีออกซิเจน แมกนีเซียมและเบริลเลียมเท่านั้นที่ทำปฏิกิริยากับกรดอย่างสงบ ส่วนที่เหลือ สารง่ายๆรุนแรงมาก มักเกิดการระเบิด เบริลเลียมทำปฏิกิริยากับสารละลายด่างเข้มข้น: Be + 2OH+ 2H 2 O \u003d 2 + H 2
ตามตำแหน่งในชุดของแรงดันไฟฟ้า มีเพียงเบริลเลียมและแมกนีเซียมเท่านั้นที่ทำปฏิกิริยากับสารละลายเกลือ โลหะที่เหลือในกรณีนี้ทำปฏิกิริยากับน้ำ การเป็นสารรีดิวซ์อย่างแรง โลหะอัลคาไลและโลหะอัลคาไลน์เอิร์ทจะลดโลหะที่มีฤทธิ์น้อยลงจำนวนมากจากสารประกอบของพวกมัน เช่น ปฏิกิริยาเกิดขึ้นเมื่อถูกความร้อน: 4Na + MnO 2 \u003d 2Na 2 O + Mn; 2Ca + SnO 2 \u003d 2CaO + Sn. เป็นเรื่องธรรมดาสำหรับโลหะอัลคาไลและโลหะของกลุ่ม IIA ซึ่งเป็นวิธีทางอุตสาหกรรมในการรับอิเล็กโทรไลซิสของเกลือหลอมเหลว
นอกจากเบริลเลียมแล้ว ออกไซด์ขององค์ประกอบทั้งหมดที่พิจารณายังเป็นออกไซด์พื้นฐาน และไฮดรอกไซด์เป็นเบสที่แข็งแรง (ในเบริลเลียม สารประกอบเหล่านี้เป็นแอมโฟเทอริก แมกนีเซียมไฮดรอกไซด์เป็นเบสอ่อน) การเสริมความแข็งแกร่งของคุณสมบัติพื้นฐานของไฮดรอกไซด์ด้วยการเพิ่มเลขอะตอมขององค์ประกอบในกลุ่มนั้นสามารถตรวจสอบได้ง่ายในชุดของไฮดรอกไซด์ขององค์ประกอบของกลุ่ม IIA เป็น(OH) 2
ไฮดรอกไซด์แอมโฟเทอริก, Mg(OH) 2
ฐานอ่อนแอ Ca(OH) 2 , Sr(OH) 2 และ Ba(OH) 2 เบสที่แข็งแรง แต่ด้วยการเพิ่มหมายเลขซีเรียล ความสามารถในการละลายจะเพิ่มขึ้น และ Ba (OH) 2
สามารถนำมาประกอบกับด่างได้
โลหะอัลคาไลน์เอิร์ ธ ทั้งหมดพบได้ (ในปริมาณที่แตกต่างกัน) ในธรรมชาติ เนื่องจากกิจกรรมทางเคมีสูง ทั้งหมดจึงไม่พบในสถานะอิสระ โลหะอัลคาไลน์เอิร์ ธ ที่พบมากที่สุดคือแคลเซียมซึ่งมีปริมาณ 3.38% (ของมวลของเปลือกโลก) แมกนีเซียมนั้นด้อยกว่าเขาเล็กน้อยซึ่งมีปริมาณ 2.35% (ของมวลของเปลือกโลก) แบเรียมและสตรอนเทียมนั้นพบได้ทั่วไปในธรรมชาติซึ่งตามลำดับคือ 0.05 และ 0.034% ของมวลของเปลือกโลก เบริลเลียมเป็นธาตุหายากซึ่งมีปริมาณ 6×10−4% ของมวลเปลือกโลก สำหรับเรเดียมซึ่งมีกัมมันตภาพรังสี เป็นโลหะอัลคาไลน์เอิร์ธที่หายากที่สุด แต่มักพบในปริมาณเล็กน้อยในแร่ยูเรเนียม โดยเฉพาะอย่างยิ่งมันสามารถแยกออกจากที่นั่นด้วยวิธีการทางเคมี เนื้อหาของมันคือ 1 × 10-10-10% (ของมวลของเปลือกโลก) /
องค์ประกอบ p ของกลุ่ม III ของระบบธาตุของ D. I. Mendeleev ได้แก่ โบรอน B, อลูมิเนียม Al, แกลเลียม Ga, อินเดียม In และ thallium Tl การกำหนดค่าอิเล็กทรอนิกส์อะตอม ns2 np1 .
ค่าคงที่บางตัวที่แสดงคุณลักษณะของอะตอมขององค์ประกอบ p ของกลุ่มที่พิจารณาและสารโลหะที่เกี่ยวข้องมีการเปรียบเทียบด้านล่าง:
คุณสมบัติของ p-elements ของกลุ่ม III ได้รับผลกระทบจาก d-compression (Al ตั้งอยู่ในระบบธาตุในช่วง III ขนาดเล็กและ Ga, In และ Tl ใน ช่วงเวลาขนาดใหญ่ทันทีหลังจากองค์ประกอบ d) ดังนั้น จากอัลถึงกา รัศมีอะตอมจึงลดลงบ้าง และศักย์อิออไนเซชันแรกจะเพิ่มขึ้น คุณสมบัติของอะตอมแทลเลียมยังได้รับผลกระทบจากการบีบอัด f นั่นคือเหตุผลที่รัศมีของอะตอม Tl อยู่ใกล้กับรัศมีของอะตอม In และพลังงานไอออไนเซชันจะสูงขึ้นบ้าง
บ. ตามโครงสร้างทางอิเล็กทรอนิกส์ของอะตอม (1s2 2s2 2p1 ) โบรอนสามารถเป็นเอกเทศได้ (อิเล็กตรอนที่ไม่มีคู่หนึ่งตัวในระดับย่อยของพลังงาน 2p) อย่างไรก็ตาม โบรอนเป็นลักษณะเฉพาะส่วนใหญ่ของสารประกอบที่มีไตรวาเลนท์ (เมื่ออะตอมตื่นเต้น จะมีอิเล็กตรอนที่ไม่คู่กันสามตัวในระดับย่อยของพลังงาน 2s และ 2p)
ออร์บิทัลอิสระ 2p ในอะตอมโบรอนที่ถูกกระตุ้นจะกำหนดคุณสมบัติของตัวรับของสารประกอบหลายชนิด ซึ่งพันธะโควาเลนต์สามพันธะเกิดขึ้นจากกลไกการแลกเปลี่ยนโควาเลนต์ (เช่น BBr3) สารประกอบเหล่านี้มีแนวโน้มที่จะเพิ่มอนุภาคที่มีคุณสมบัติของผู้ให้อิเล็กตรอน กล่าวคือ ต่อการก่อตัวของพันธะโควาเลนต์อื่นโดยกลไกตัวรับผู้บริจาค ตัวอย่างเช่น:
BBr3 + Br- = [ВВr4]-
เป็นที่รู้จักสองไอโซโทปของโบรอน: 105 B (19.6%) และ 11 5 B (80.4%) นิวเคลียสของอะตอมของไอโซโทป (105 V) ดูดซับนิวตรอนได้ง่าย:
105 V + 1 0 n = 4 2 He + 7 5 Li
ความสามารถของโบรอนในการดูดซับนิวตรอนเป็นตัวกำหนดการใช้งานในด้านวิศวกรรมพลังงานนิวเคลียร์: แท่งควบคุมของเครื่องปฏิกรณ์นิวเคลียร์ทำจากวัสดุที่มีโบรอน
ผลึกโบรอนสีดำ พวกมันเป็นวัสดุทนไฟ (mp. 2300 ° C), ไดแม่เหล็ก, มีคุณสมบัติเซมิคอนดักเตอร์ (band gap ΔE = 1.55 eV) ค่าการนำไฟฟ้าของโบรอน เช่นเดียวกับโลหะอื่นๆ มีค่าต่ำและเพิ่มขึ้นบ้างตามอุณหภูมิที่เพิ่มขึ้น
ที่อุณหภูมิห้อง โบรอนเฉื่อยทางเคมีและโต้ตอบโดยตรงกับฟลูออรีนเท่านั้น เมื่อถูกความร้อน โบรอนจะถูกออกซิไดซ์โดยคลอรีน ออกซิเจน และอโลหะอื่นๆ ตัวอย่างเช่น:
4V + 3O2 = 2V2 O3
2B + ZCl2 = 2BCl3
ในสารประกอบที่ไม่ใช่โลหะ สถานะออกซิเดชันของโบรอนคือ +3; สารประกอบเหล่านี้ทั้งหมดเป็นโควาเลนต์
สารผลึกโบรอนไตรออกไซด์ B2 O3 (mp. 450 ° C, b.p. 2250 ° C) โดดเด่นด้วย ค่านิยมสูงเอนทาลปีและกิ๊บส์พลังงานของการก่อตัว เมื่อทำปฏิกิริยากับน้ำ B2 O3 จะผ่านเข้าไปในกรดบอริก:
B2 O3 + ZH2 O = 2H3 BO3
H3 BO3 เป็นกรดโมโนเบสิกที่อ่อนมาก (Kd ≈ 10-9) การแยกตัวด้วยไฟฟ้าของ H3 BO3 ด้วยการกำจัดไอออน H+ เพียงตัวเดียวอธิบายโดยคุณสมบัติของตัวรับโบรอนที่อธิบายไว้ก่อนหน้านี้: การโคจรอิสระ 2p ของอะตอมโบรอนนั้นมอบให้กับผู้บริจาคอิเล็กตรอน OH- ซึ่งเกิดขึ้นระหว่างการแยกตัวของ H2 O โมเลกุล กระบวนการดำเนินการตามโครงการ
H3 BO3 + H2 O \u003d H [B (OH) 4] \u003d H + + [B (OH) 4] -
แอนไอออนเชิงซ้อน [B(OH)4]- มีโครงสร้างแบบจัตุรมุข (การผสม sp3 ของออร์บิทัลอิเล็กตรอน) คุณสมบัติของตัวรับโบรอนในสารประกอบที่มีสถานะออกซิเดชันที่ +3 นั้นก็แสดงให้เห็นเช่นกันในทางเคมีของเฮไลด์ ตัวอย่างเช่น ปฏิกิริยา
BF3+F-=-
BF3 + NH3 =
ซึ่งพันธะเคมีระหว่าง BF และ F- หรือ NH3 เกิดขึ้นจากกลไกการรับบริจาค คุณสมบัติของโบรอนเฮไลด์ที่จะเป็นตัวรับอิเล็กตรอนกำหนดการใช้งานอย่างกว้างขวางของพวกมันเป็นตัวเร่งปฏิกิริยาในปฏิกิริยาการสังเคราะห์สารประกอบอินทรีย์
โบรอนไม่มีปฏิกิริยาโดยตรงกับไฮโดรเจน แต่จะเกิดเป็นบอไรด์กับโลหะ ซึ่งโดยปกติแล้วจะไม่ใช่สารประกอบเชิงสัมพันธ์คือ Me4 B, Me2 B, MeB, Me3 B4, MeB2 และ MeB6
โบรอนไฮไดรด์ (โบราเนส) มีพิษร้ายแรงและมีกลิ่นไม่พึงประสงค์มาก ได้มาโดยทางอ้อมบ่อยที่สุด
ในอันตรกิริยาของปฏิกิริยาบอไรด์กับกรดหรือโบรอนเฮไลด์กับโลหะอัลคาไลไฮไดรด์:
6MgB2 + 12HCl = H2 + 8B + B4 H10 + 6MgCl2
8BF3 + 6LiH = B2 H6 + 6LiBF4
สารประกอบโบรอนที่ง่ายที่สุดกับไฮโดรเจน BH3 ไม่มีอยู่ภายใต้สภาวะปกติ sp2 -Hybridization ของอิเล็กตรอนออร์บิทัลในอะตอมโบรอนทำให้เกิดความไม่อิ่มตัวเชิงประสานกันของอนุภาค BH3 ซึ่งเป็นผลมาจากการที่อนุภาคดังกล่าวสองตัวรวมกันเป็นโมเลกุลไดโบเรน: 2BH3 = B2 H6 (ΔG0 298 = -127 kJ / โมล)
ใน diborane B2H6 โบรอนอยู่ในสถานะไฮบริไดเซชัน 5p3 โดยแต่ละอะตอมของโบรอนมีออร์บิทัลลูกผสมหนึ่งในสี่ว่าง ในขณะที่อีกสามออร์บิทัลของอะตอมไฮโดรเจนคาบเกี่ยวกัน พันธะระหว่างกลุ่ม BH3 ในโมเลกุล B2H6 นั้นก่อตัวเป็นพันธะไฮโดรเจนอันเนื่องมาจากการเปลี่ยนแปลงความหนาแน่นของอิเล็กตรอนจากอะตอมไฮโดรเจนหนึ่งของกลุ่ม BH3 ไปสู่วงโคจรที่ว่างเปล่าของกลุ่ม BH3 อีกกลุ่มหนึ่ง โบรานอื่น ๆ เป็นที่รู้จักกันซึ่งสามารถแสดงด้วยสองชุด Bn Hn+4 และ Bn Hn+6 .
เอส-เมทัลบอไรด์มีปฏิกิริยาและมักใช้เพื่อให้ได้ส่วนผสมของบอเรนโดยการบำบัดด้วยกรด บอไรด์ d- และ f-metal ส่วนใหญ่ทนความร้อน แข็งมาก และมีความเสถียรทางเคมี มีการใช้กันอย่างแพร่หลายโดยตรงในรูปแบบของโลหะผสมสำหรับการผลิตชิ้นส่วนเครื่องยนต์ไอพ่น, ใบมีด กังหันก๊าซ. บอไรด์บางชนิดใช้ทำแคโทดสำหรับอุปกรณ์อิเล็กทรอนิกส์
อลูมิเนียม โครงแบบอิเล็กทรอนิกส์ของอะตอมอะลูมิเนียมแสดงโดยสูตร 1s2 2s2 2p6 3s2 3p1 ชั้นอิเล็กตรอนชั้นนอกสุดของอะตอมมีอิเล็กตรอนที่ไม่คู่กันหนึ่งตัว:
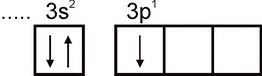
ดังนั้นอลูมิเนียมจึงสามารถแสดงความจุได้เท่ากับหนึ่ง อย่างไรก็ตาม ความจุนี้ไม่ปกติสำหรับอะลูมิเนียม ในสารประกอบที่เสถียรทั้งหมด สถานะออกซิเดชันของอะลูมิเนียมคือ +3 ความจุเท่ากับสามสอดคล้องกับสถานะตื่นเต้นของอะตอมอัล:
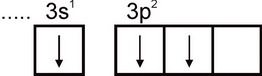
ในแง่ของความชุก อลูมิเนียมอยู่ในอันดับที่สี่ในบรรดาองค์ประกอบทั้งหมด (หลังจาก O, H และ Si) และเป็นโลหะที่พบมากที่สุดในธรรมชาติ อลูมิเนียมส่วนใหญ่มีความเข้มข้นในอะลูมิโนซิลิเกต: เฟลด์สปาร์ ไมกา ฯลฯ
อะลูมิเนียมเป็นแสงสีขาวเงินและโลหะที่เหนียวมาก มีค่าการนำความร้อนและไฟฟ้าสูง
อลูมิเนียมมีปฏิกิริยา มันทำปฏิกิริยากับคลอรีนและโบรมีนที่อุณหภูมิห้อง และกับไอโอดีนเมื่อถูกความร้อนหรือในที่ที่มีน้ำเป็นตัวเร่งปฏิกิริยา ที่ 800 °C อลูมิเนียมทำปฏิกิริยากับไนโตรเจน และที่ 2000 °C กับคาร์บอน อะลูมิเนียมมีความสัมพันธ์ทางเคมีกับออกซิเจนสูง (ΔG0 298 = -1582 kJ/mol):
2Al + 0.502 \u003d Al2 O3, ΔH0 298 \u003d -1650 kJ / mol
ในอากาศ อะลูมิเนียมถูกปกคลุมด้วยฟิล์มออกไซด์บาง (10-8 ม.) ที่แข็งแรงมาก ซึ่งทำให้ความมันวาวของโลหะอะลูมิเนียมลดลงบ้าง เนื่องจากฟิล์มออกไซด์ทำให้พื้นผิวของอะลูมิเนียมมีค่าสูง ความต้านทานการกัดกร่อน. สิ่งนี้แสดงให้เห็นเป็นหลักในความไม่แยแสของอลูมิเนียมต่อน้ำและไอน้ำ เนื่องจากการก่อตัวของฟิล์มป้องกัน อลูมิเนียมจึงทนทานต่อกรดไนตริกและกรดซัลฟิวริกเข้มข้น กรดเหล่านี้ทำให้อะลูมิเนียมละลายในที่เย็น แนวโน้มที่จะเกิดฟิล์มทู่ทำให้สามารถเพิ่มความต้านทานการกัดกร่อนของอะลูมิเนียมได้โดยการบำบัดพื้นผิวด้วยตัวออกซิไดซ์ที่แรง (เช่น K2 Cr2 O7) หรือใช้ขั้วบวกออกซิเดชัน ในกรณีนี้ ความหนาของฟิล์มออกไซด์จะเพิ่มขึ้นเป็น 3·10-5 ม. ที่อุณหภูมิสูง ความแข็งแรงของฟิล์มป้องกันจะลดลงอย่างรวดเร็ว ถ้า การกระทำทางกลเอาฟิล์มออกไซด์อลูมิเนียมจะกลายเป็นปฏิกิริยามาก มันทำปฏิกิริยาอย่างรุนแรงกับน้ำและสารละลายที่เป็นน้ำของกรดและด่าง แทนที่ไฮโดรเจนและเกิดเป็นไอออนบวกหรือแอนไอออน ปฏิกิริยาของอะลูมิเนียมกับสารละลายกรดเป็นไปตามสมการปฏิกิริยา
อัล + 6H2 O + 3H+ \u003d [Al (H2 O) 6] 3+ + 0.5H2
และด้วยสารละลายด่าง
อัล + ZH2 O + OH- \u003d [Al (OH) 4] - + 0.5H2
ไอออนบวกของอะลูมิเนียมและแอนไอออนจะผ่านเข้าสู่กันและกันได้ง่ายเมื่อค่า pH ของสารละลายเปลี่ยนไป:
[Al(Н2 O)6]3+ + 4OH- = [Al(Н2 O)4]- + 6Н2 O
[Al(OH)4]- + 4H+ + 2H2 O = [Al(H2 O)6]3+
สารประกอบผสมยังสามารถก่อตัวในสารละลาย เช่น [Al(H2 O)5 (OH)]2+, [Al(H2 O)4 (OH)2]+, [Al(H2 O)3 (OH)3] . อย่างหลังง่าย (โดยเฉพาะเมื่อถูกความร้อน) ทำให้แห้งและเปลี่ยนเป็นไฮดรอกไซด์ Al(OH)3:
[อัล (H2 O) 3 (OH) 3] \u003d อัล (OH) 3 + ZH2 O
การใช้อะลูมิเนียมในวงกว้างที่สุดในเทคโนโลยีขึ้นอยู่กับคุณสมบัติทางกายภาพและทางเคมีที่มีคุณค่าและความชุกใน เปลือกโลก. เนื่องจากมีค่าการนำไฟฟ้าสูง (4 10-5 โอห์ม-1 ซม.-1 ) และความหนาแน่นต่ำ จึงใช้สำหรับการผลิตสายไฟ อลูมิเนียมที่มีความเหนียวสูงทำให้สามารถผลิตฟอยล์ที่บางที่สุดได้ ซึ่งใช้ในตัวเก็บประจุและแทนที่ตะกั่วในปลอกสายเคเบิลด้วยอะลูมิเนียม อะลูมิเนียมอัลลอยด์จึงถูกใช้ในงานวิศวกรรมวิทยุเนื่องจากไม่เป็นแม่เหล็ก
อลูมิเนียมส่วนใหญ่ใช้ในการผลิตโลหะผสมเบาดูราลูมิน (94% Al ส่วนที่เหลือคือ Cu, Mg, Mn, Fe และ Si), ซิลูมิน (8590% Al, 1014% Si ส่วนที่เหลือคือ Na) เป็นต้น นอกจากนี้ ยังใช้เป็นสารเติมแต่งในการผสมโลหะผสมเพื่อให้ทนความร้อนได้ อลูมิเนียมและโลหะผสมเป็นหนึ่งในวัสดุโครงสร้างในการก่อสร้างเครื่องบิน จรวด วิศวกรรมเครื่องกล ฯลฯ ความต้านทานการกัดกร่อนของอลูมิเนียม (โดยเฉพาะอย่างยิ่งการชุบผิว) มีความทนทานต่อการกัดกร่อนของเหล็กมาก ดังนั้นโลหะผสมจึงถูกใช้เป็นวัสดุโครงสร้างและในการต่อเรือ ด้วยองค์ประกอบ d อลูมิเนียมจะสร้างสารประกอบทางเคมี - สารประกอบระหว่างโลหะ (อะลูมิไนด์): NiAl, Ni3 Al, CoAl ฯลฯ ซึ่งใช้เป็นวัสดุทนความร้อน อะลูมิเนียมใช้ในความร้อนจากอะลูมิเนียมเพื่อให้ได้โลหะจำนวนมากและสำหรับการเชื่อมด้วยความร้อน Aluminothermy มีความสัมพันธ์กับอลูมิเนียมสูงสำหรับออกซิเจน ตัวอย่างเช่น ในปฏิกิริยาที่ดำเนินไปตามสมการ
8Al + 3Fe3 O4 = 4Al2 O3 + 9Fe
ปล่อยความร้อนประมาณ 3500 kJ และอุณหภูมิจะสูงถึง 3000 °C
อะลูมิเนียมออกไซด์เป็นที่รู้จักในรูปแบบของการดัดแปลงหลายอย่าง เสถียรที่สุดคือ α-Al2 O3 การดัดแปลงนี้พบได้ในเปลือกโลกในรูปแบบของคอรันดัมแร่ซึ่งเตรียมแผ่นเจียรและผงกากกะรุน การใช้คอรันดัมเป็นวัสดุที่มีฤทธิ์กัดกร่อนขึ้นอยู่กับความแข็งสูง รองจากความแข็งของเพชร คาร์บอรันดัม SiC และโบราซอน BN เท่านั้น การผสมผสานของ Al2 O3 กับ Cr2 O3 ทำให้เกิดทับทิมเทียม ใช้ทำหินรองรับในกลไกที่แม่นยำ ที่ ครั้งล่าสุดทับทิมเทียมใช้ในเครื่องกำเนิดควอนตัม (เลเซอร์) ผลิตภัณฑ์จาก Al2 O3 ใช้เป็นวัสดุทนไฟและไดอิเล็กทริก
อะลูมิเนียมไฮดรอกไซด์ Al(OH)3 เป็นสารประกอบโพลีเมอร์ มีตะแกรงคริสตัลเป็นชั้นๆ แต่ละชั้นประกอบด้วย Al(OH)6 octahedra (รูปที่ 1); มีพันธะไฮโดรเจนระหว่างชั้น อะลูมิเนียมไฮดรอกไซด์ที่ได้จากปฏิกิริยาการแลกเปลี่ยนคือตะกอนสีขาวเจลาตินที่ละลายได้ง่ายในกรดและด่าง เมื่อยืนอยู่ ตะกอนจะ "แก่" และสูญเสียกิจกรรมทางเคมีไป เมื่อเผาแล้ว ไฮดรอกไซด์จะสูญเสียน้ำและเปลี่ยนเป็นออกไซด์ Al2 O3 หนึ่งในรูปแบบของไฮดรอกไซด์แห้ง, เจลอลูมิเนียม, ใช้ในเทคโนโลยีเป็นตัวดูดซับ
สิ่งที่น่าสนใจอย่างยิ่งคือซีโอไลต์ของสารประกอบอะลูมิเนียมที่เกี่ยวข้องกับอะลูมิโนซิลิเกต องค์ประกอบของพวกเขาสามารถแสดงโดยสูตรทั่วไป Mex Eu O2y nH2 O โดยที่MeСаหรือ Na (น้อยกว่า Ba, Sr, K); E Si และ Al ในอัตราส่วนตัวแปร ผลึกซีโอไลต์มีช่องที่โมเลกุล H2O สามารถทะลุผ่านได้ ปริมาณน้ำในซีโอไลต์จะแตกต่างกันไปตามความดันไอน้ำ ซีโอไลต์สามารถแลกเปลี่ยนน้ำที่บรรจุเป็นของเหลวอื่นๆ (แอลกอฮอล์ ฯลฯ) ด้วยการให้ความร้อนอย่างนุ่มนวล น้ำจะค่อยๆ ถูกกำจัดออกจากซีโอไลต์ แต่การคายน้ำอย่างสมบูรณ์ก็ไม่ได้นำไปสู่การทำลายผลึกซีโอไลต์ Ca2+ หรือ Na+ cations ในซีโอไลต์สร้างชั้นการแพร่กระจาย พวกเขาไม่ได้รับการแก้ไขในตาข่ายคริสตัล แต่ร่วมกับน้ำจะอยู่ในช่องว่างของคริสตัล สิ่งนี้อธิบายการมีอยู่ของคุณสมบัติการแลกเปลี่ยนไอออนบวกในซีโอไลต์ที่มีความสำคัญต่อวัตถุประสงค์ทางเทคนิค ความเป็นไปได้ในการเปลี่ยนไอออนบวกบางส่วนด้วยไอออนอื่นทำให้สามารถใช้ซีโอไลต์เป็นตัวแลกเปลี่ยนไอออนได้
ซีโอไลต์เทียมจำนวนหนึ่งถูกใช้เป็นตะแกรงโมเลกุลที่เรียกว่า ผลึกของผลึกหลังมีลักษณะเป็นช่องแคบที่มีเส้นผ่านศูนย์กลาง 3·10-10 ถึง 13·10-10 ม. ตะแกรงโมเลกุลดูดซับสารที่โมเลกุลสามารถเข้าไปในรูเหล่านี้ได้
ตัวอย่างเช่น ตะแกรงโมเลกุลที่มีเส้นผ่านศูนย์กลางรู 3.5 x 10-10 ม. สามารถดูดซับโมเลกุล H2, O2, N2 ได้ แต่ไม่ดูดซับโมเลกุล CH4 หรือ Ar ที่ใหญ่กว่า สามารถใช้ตะแกรงโมเลกุลเพื่อแยกไฮโดรคาร์บอน ก๊าซแห้ง ฯลฯ
แกลเลียม อินเดียม และแทลเลียม ในรูปของสารง่าย ๆ หลอมโลหะเงิน-ขาว คุณสมบัติทางกายภาพและเคมีของ Ga, In และ Tl แตกต่างอย่างเห็นได้ชัดจากคุณสมบัติของ Al แม้จะมีความคล้ายคลึงกันของโครงสร้างอิเล็กทรอนิกส์ของระดับพลังงานภายนอกของอะตอมของธาตุที่อยู่ระหว่างการพิจารณา
เห็นได้ชัดว่าความแตกต่างในโครงสร้างอิเล็กทรอนิกส์ของระดับพลังงานภายนอกของอะตอม Al: (n-1)s2 (n-1)p6 ในมือข้างหนึ่งและอะตอม Ga, In และ Tl ในอีกทางหนึ่ง: (n- 1)s2 (n- 1)р6 (n-1)d10 .
สถานะออกซิเดชันของแกลเลียมและอินเดียมในสารประกอบที่เสถียรคือ +3 สำหรับแทลเลียม สถานะออกซิเดชัน + 1 มีลักษณะเฉพาะมากกว่า สารประกอบแทลเลียม ซึ่งสถานะออกซิเดชันของโลหะคือ +3 เป็นตัวออกซิไดซ์ที่แรง
แกลเลียมมีช่วงอุณหภูมิกว้างสำหรับการดำรงอยู่ของสถานะของเหลว จุดหลอมเหลวต่ำ (ประมาณ 30 °C) จุดเดือดสูง (2205 °C) ทำให้สามารถใช้แกลเลียมเหลวในการผลิตเกจวัดแรงดันได้
อินเดียมสะท้อนคลื่นแสงของความยาวคลื่นทั้งหมดอย่างสม่ำเสมอ ดังนั้นจึงใช้ในเครื่องมือวัดที่แม่นยำสำหรับการผลิตกระจกเงา นอกจากนี้ In ยังเป็นส่วนประกอบของโลหะผสมที่หลอมละลายได้บางชนิด
แทลเลียมยังถูกนำมาใช้ในโลหะผสมบางชนิด ซึ่งส่วนใหญ่เป็นโลหะผสมที่มีดีบุกและตะกั่ว (ทนกรด แบริ่ง)
Oxides Ga2 O3 , In2 O3 และ Тl2 O3 ไม่ละลายในน้ำ คุณสมบัติพื้นฐานที่เพิ่มขึ้นอย่างเห็นได้ชัดในซีรีส์ Ga2 O3 In2 O3 Tl2 O3 แสดงให้เห็นในความสามารถในการละลายที่เพิ่มขึ้นของออกไซด์ในกรด
ไฮดรอกไซด์ Ga (OH) 3 , ใน (OH) 3 , Tl (OH) 3 ในน้ำจะไม่ละลายเหมือนออกไซด์ ตะกอนสีขาว Ga(OH)3 สามารถละลายได้เท่ากันทั้งในกรดและด่าง และ Тl(OH)3 สีน้ำตาลแดงสามารถละลายได้ในกรดเท่านั้น
แกลเลียมและอินเดียมเป็นสารประกอบไบนารีของประเภท AIII BV ที่มีองค์ประกอบ p ของกลุ่ม V ของระบบธาตุ (เช่น GaP, GaAs, InSb เป็นต้น) ในสารประกอบประเภท AIII BV ส่วนใหญ่ ออร์บิทัลอิเล็กทรอนิกส์นั้นถูกผสมด้วย sp3; โครงผลึกของสารประกอบเหล่านี้มีโครงสร้างที่มีลักษณะเป็นรูปสี่เหลี่ยมผืนผ้าของพันธะเคมี สารประกอบคล้ายเพชรเหล่านี้หลายชนิดเป็นสารกึ่งตัวนำ พวกมันถูกใช้เป็นวัสดุสำหรับวงจรเรียงกระแส AC, เซ็นเซอร์, เครื่องกำเนิดเทอร์โมอิเล็กทริก ฯลฯ
คาร์บอน ซิลิกอน เจอร์เมเนียม ดีบุก และตะกั่ว เป็นกลุ่มย่อยหลักของกลุ่ม IV. ระดับพลังงานภายนอกขององค์ประกอบ p ของกลุ่ม IV ประกอบด้วยอิเล็กตรอนสี่ตัวแต่ละตัว (การกำหนดค่า ns2np2) โดยที่สองตัวเป็นอิเล็กตรอนคู่ที่จับคู่กันและอิเล็กตรอน p ที่ไม่มีการจับคู่สองตัว
ในสภาวะที่ไม่ถูกกระตุ้น องค์ประกอบของกลุ่มย่อยนี้มีความจุเท่ากับสอง เมื่อเปลี่ยนเป็นสถานะตื่นเต้นพร้อมกับการเปลี่ยนแปลงของหนึ่งในอิเล็กตรอนระดับนอกไปยังเซลล์อิสระของระดับ p-sub ในระดับเดียวกันอิเล็กตรอนทั้งหมดของชั้นนอกจะไม่ถูกจับคู่และวาเลนซีจะเพิ่มขึ้นเป็น 4.
กำมะถัน ซีลีเนียม เทลลูเรียม และพอโลเนียม ยังมีอิเลคตรอน 6 ตัวที่ระดับชั้นนอก (s 2 หน้า 4 ) แต่พวกมันทั้งหมดมีระดับ d ที่ไม่ได้รับการเติม ดังนั้นพวกมันจึงสามารถมีอิเล็กตรอนที่ไม่ได้จับคู่มากถึง 6 ตัว และแสดงสถานะออกซิเดชัน - 2, +4 และ +6 ในสารประกอบ
รูปแบบของการเปลี่ยนแปลงในกิจกรรมขององค์ประกอบเหล่านี้เหมือนกับในกลุ่มย่อยของฮาโลเจน: เทลลูไรด์ถูกออกซิไดซ์ได้ง่ายที่สุด จากนั้นเป็นซีลีไนด์และซัลไฟด์ สารประกอบออกซิเจนของกำมะถัน สารประกอบซัลเฟอร์ (VI) ที่เสถียรที่สุด และสำหรับสารประกอบเทลลูเรียม สารประกอบเทลลูเรียม (IV) สารประกอบซีลีเนียมอยู่ในตำแหน่งกลาง
ในองค์ประกอบของกลุ่มย่อยโครเมียมระดับ d จะถูกเติมดังนั้นที่ระดับ s ของอะตอมมีอิเล็กตรอน 1 (สำหรับโครเมียมและโมลิบดีนัม) หรือ 2 (สำหรับทังสเตน) ทั้งหมดแสดงสถานะออกซิเดชันสูงสุดที่ +6 แต่สำหรับโมลิบดีนัม และโดยเฉพาะอย่างยิ่งสำหรับโครเมียม สารประกอบมีลักษณะเฉพาะซึ่งมีสถานะออกซิเดชันต่ำกว่า (+4 สำหรับโมลิบดีนัมและ +3 หรือ +2 สำหรับโครเมียม) สารประกอบโครเมียม (III) มีความเสถียรมากและคล้ายกับสารประกอบอะลูมิเนียม
โลหะทั้งหมดของกลุ่มย่อยโครเมียมใช้กันอย่างแพร่หลาย
โมลิบดีนัมได้มาเป็นครั้งแรกโดย K.V. Scheele ในปี ค.ศ. 1778 ใช้ในการผลิตเหล็กกล้าที่มีความแข็งแรงสูงและมีความเหนียวสูงซึ่งใช้สำหรับการผลิตกระบอกปืน เกราะ เพลา ฯลฯ
เนื่องจากความสามารถในการระเหยที่อุณหภูมิสูง จึงไม่เหมาะสำหรับการผลิตเส้นใย แต่มีความสามารถในการหลอมรวมกับแก้วได้ดี ดังนั้นจึงใช้ทำที่ยึดไส้หลอดทังสเตนในหลอดไส้
ทังสเตนถูกค้นพบโดย K.V. Scheele ในปี ค.ศ. 1781 ซึ่งใช้ในการผลิตเหล็กพิเศษ การเติมทังสเตนลงในเหล็กกล้าจะเพิ่มความแข็ง ความยืดหยุ่น และความแข็งแรง ทังสเตนช่วยให้เหล็กสามารถรักษาความแข็งที่อุณหภูมิสูงมากเมื่อใช้ร่วมกับโครเมียม ดังนั้นเหล็กเหล่านี้จึงถูกนำมาใช้ทำหัวกัดสำหรับเครื่องกลึงความเร็วสูง
ทังสเตนบริสุทธิ์มีจุดหลอมเหลวสูงที่สุดในบรรดาโลหะ (3370 องศาเซลเซียส) ดังนั้นจึงใช้ทำเส้นใยในหลอดไส้ ทังสเตนคาร์ไบด์มีความแข็งและทนความร้อนสูงมาก และเป็นส่วนประกอบหลักของโลหะผสมทนไฟ
กลุ่มย่อยไนโตรเจนประกอบด้วยห้าองค์ประกอบ: ไนโตรเจน ฟอสฟอรัส สารหนู พลวง และบิสมัท นี่คือองค์ประกอบ p ของกลุ่ม V ของระบบธาตุของ D.I. Mendeleevที่ระดับพลังงานภายนอก อะตอมของธาตุเหล่านี้ประกอบด้วยอิเล็กตรอน 5 ตัว ซึ่งมีการกำหนดค่าเป็น ns2np3 และมีการกระจายดังนี้
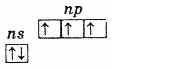
ดังนั้นสถานะออกซิเดชันสูงสุดขององค์ประกอบเหล่านี้คือ +5 ค่า -3 ต่ำสุดก็เป็นลักษณะของ +3 เช่นกัน การมีอยู่ของอิเล็กตรอนสามตัวที่ไม่มีการจับคู่ที่ระดับชั้นนอกบ่งชี้ว่าในสภาวะที่ไม่ถูกกระตุ้น อะตอมขององค์ประกอบจะมีความจุเท่ากับ 3 . ระดับภายนอกของอะตอมไนโตรเจนประกอบด้วยสองระดับย่อย 2s และ 2r เท่านั้น อะตอมขององค์ประกอบที่เหลือของกลุ่มย่อยนี้มีเซลล์ว่างของระดับ d-sub ที่ระดับพลังงานภายนอก ดังนั้นหนึ่งใน s-electron ของระดับนอกสามารถไปที่ d-sublevel ในระดับเดียวกันได้เมื่อถูกกระตุ้นซึ่งนำไปสู่การก่อตัวของอิเล็กตรอนที่ไม่คู่กัน 5 ตัว
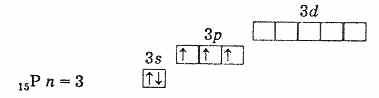
เปลือกอิเล็กตรอนชั้นนอกของฟอสฟอรัส (อะตอมที่ไม่ถูกกระตุ้น)
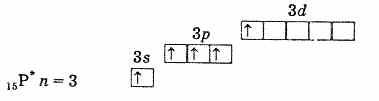
เปลือกอิเล็กตรอนชั้นนอกของอะตอมฟอสฟอรัสที่ถูกกระตุ้น ดังนั้นฟอสฟอรัส สารหนู พลวง และบิสมัทในสถานะตื่นเต้นจะมีอิเล็กตรอนที่ไม่คู่กัน 5 ตัว และความจุของพวกมันในสถานะนี้คือ 5 กระตุ้นอิเล็กตรอนในอะตอมไนโตรเจน ในทำนองเดียวกันเป็นไปไม่ได้เนื่องจากไม่มี d-sublevel ในระดับที่สอง ดังนั้นไนโตรเจนจึงไม่สามารถเพนตาวาเลนต์ได้ แต่มันสามารถสร้างพันธะโควาเลนต์ที่สี่ได้โดยกลไกตัวรับ-บริจาคอันเนื่องมาจากคู่อิเล็กตรอนเดี่ยว 2s2 กระบวนการอื่นเป็นไปได้สำหรับอะตอมไนโตรเจน เมื่ออิเล็กตรอน 2s ตัวใดตัวหนึ่งถูกแยกออก ไนโตรเจนจะผ่านเข้าไปในไอออน N+ เตตระวาเลนต์ที่มีประจุเพียงตัวเดียว

จากไนโตรเจนเป็นบิสมัท รัศมีอะตอมเพิ่มขึ้นและศักย์ของไอออไนเซชันลดลง คุณสมบัติการรีดิวซ์ของอะตอมที่เป็นกลางเพิ่มขึ้นจาก N เป็น Bi ในขณะที่คุณสมบัติการออกซิไดซ์จะอ่อนลง (ดูตารางที่ 21)
ด้วยสารประกอบ RH3 ที่มีขั้วของไฮโดรเจน ไนโตรเจน ฟอสฟอรัส และสารหนู ซึ่งแสดงสถานะออกซิเดชันเชิงลบที่ -3 โมเลกุล RH3 มีรูปร่างเสี้ยม ในสารประกอบเหล่านี้ พันธะของธาตุที่มีไฮโดรเจนจะแข็งแรงกว่าสารประกอบที่สอดคล้องกันขององค์ประกอบของกลุ่มย่อยของออกซิเจน และโดยเฉพาะอย่างยิ่งในกลุ่มย่อยของฮาโลเจน ดังนั้น สารประกอบไฮโดรเจนของธาตุในกลุ่มย่อยไนโตรเจนใน สารละลายน้ำไม่ก่อให้เกิดไฮโดรเจนไอออน
ด้วยออกซิเจน องค์ประกอบของกลุ่มย่อยไนโตรเจนจะก่อตัวเป็นออกไซด์ของสูตรทั่วไป R2O3 และ R2O5 ออกไซด์สอดคล้องกับกรด HRO2 และ HRO3 (และออร์โธแอซิด H3RO4 ยกเว้นไนโตรเจน) ภายในกลุ่มย่อย ลักษณะของออกไซด์จะเปลี่ยนแปลงดังนี้: N2O3 กรดออกไซด์; Р4О6 กรดอ่อน ๆ ออกไซด์; As2O3 amphoteric ออกไซด์ที่มีคุณสมบัติเป็นกรดเด่น Sb2O3 แอมโฟเทอริกออกไซด์ที่มีคุณสมบัติพื้นฐานเด่น ออกไซด์พื้นฐาน Bi2O3 ดังนั้นสมบัติความเป็นกรดของออกไซด์ขององค์ประกอบ R2O3 และ R2O5 จะลดลงตามจำนวนอะตอมของธาตุที่เพิ่มขึ้น ดังที่เห็นได้จากตาราง 21 ภายในกลุ่มย่อยตั้งแต่ไนโตรเจนจนถึงบิสมัท คุณสมบัติของอโลหะลดลงและคุณสมบัติของโลหะเพิ่มขึ้น ในพลวง คุณสมบัติเหล่านี้แสดงในลักษณะเดียวกัน ในบิสมัท คุณสมบัติของโลหะเหนือกว่า ในไนโตรเจน คุณสมบัติที่ไม่ใช่โลหะ ฟอสฟอรัส สารหนู และพลวงเป็นสารประกอบอัลโลทรอปิกหลายชนิด
กลุ่มที่หกของระบบธาตุเป็นระยะประกอบด้วยสองกลุ่มย่อย: ออกซิเจนหลัก, กำมะถัน, ซีลีเนียม, เทลลูเรียมและพอโลเนียมและโครเมียมทุติยภูมิ, โมลิบดีนัมและทังสเตน ในกลุ่มย่อยหลัก กลุ่มย่อยของซีลีเนียม (ซีลีเนียม เทลลูเรียม และพอโลเนียม) มีความโดดเด่น กลุ่มย่อยรองเรียกว่ากลุ่มย่อยโครเมียม องค์ประกอบทั้งหมดของกลุ่มย่อยหลัก ยกเว้นออกซิเจน สามารถยึดอิเล็กตรอนได้สองตัวแต่ละตัว ทำให้เกิดอิเล็กโตรเนกาทีฟไอออน
องค์ประกอบของกลุ่มย่อยหลักมีอิเล็กตรอน 6 ตัว (s2p4) ที่ระดับอิเล็กทรอนิกส์ภายนอก อะตอมของออกซิเจนมีอิเล็กตรอนสองตัวที่ไม่มีคู่และไม่มีระดับ d ดังนั้นออกซิเจนจึงมีสถานะออกซิเดชันเป็นส่วนใหญ่ (2 และเฉพาะในสารประกอบที่มีฟลูออรีน +2 เท่านั้น ซัลเฟอร์ ซีลีเนียม เทลลูเรียม และพอโลเนียมยังมีอิเล็กตรอน 6 ตัว (s2p4) ที่ระดับชั้นนอก แต่พวกมันทั้งหมดมีระดับ d ว่างเปล่า ดังนั้นพวกมันจึงสามารถมีอิเล็กตรอนที่ไม่ได้จับคู่ได้มากถึงหกตัว และแสดงสถานะออกซิเดชัน 2, +4 และ +6 ในสารประกอบ
รูปแบบของการเปลี่ยนแปลงในกิจกรรมขององค์ประกอบเหล่านี้เหมือนกับในกลุ่มย่อยของฮาโลเจน: เทลลูไรด์ถูกออกซิไดซ์ได้ง่ายที่สุด จากนั้นเป็นซีลีไนด์และซัลไฟด์ สารประกอบออกซิเจนของกำมะถัน สารประกอบซัลเฟอร์ (VI) มีความคงตัวมากที่สุด และสำหรับสารประกอบเทลลูเรียม เทลลูเรียม (IV) สารประกอบซีลีเนียมอยู่ในตำแหน่งกลาง
ซีลีเนียมและเทลลูเรียม รวมทั้งสารประกอบของโลหะบางชนิด (อินเดียม แทลเลียม ฯลฯ) มีคุณสมบัติเซมิคอนดักเตอร์และมีการใช้กันอย่างแพร่หลายในอุปกรณ์อิเล็กทรอนิกส์วิทยุ สารประกอบซีลีเนียมและเทลลูเรียมเป็นพิษสูง ใช้ในอุตสาหกรรมแก้วเพื่อผลิตแว่นตาสี (สีแดงและสีน้ำตาล)
ในองค์ประกอบของกลุ่มย่อยโครเมียม ระดับ d จะถูกเติม ดังนั้น ที่ระดับ s ของอะตอมของพวกมันอย่างละตัว (สำหรับโครเมียมและโมลิบดีนัม) หรือสองอิเล็กตรอน (สำหรับทังสเตน) ทั้งหมดมีสถานะออกซิเดชันสูงสุดที่ +6 แต่โมลิบดีนัมและโดยเฉพาะอย่างยิ่งโครเมียมมีลักษณะเฉพาะโดยสารประกอบที่มีสถานะออกซิเดชันต่ำกว่า (+4 สำหรับโมลิบดีนัมและ +3 หรือ +2 สำหรับโครเมียม) สารประกอบโครเมียม (III) มีความเสถียรมากและคล้ายกับสารประกอบอะลูมิเนียม โลหะทั้งหมดของกลุ่มย่อยโครเมียมใช้กันอย่างแพร่หลาย
โมลิบดีนัมได้รับครั้งแรกโดย K. V. Scheele ในปี ค.ศ. 1778 ใช้ในการผลิตเหล็กที่มีความแข็งแรงสูงและมีความเหนียวซึ่งใช้สำหรับการผลิตกระบอกปืน เกราะ เพลา ฯลฯ เนื่องจากความสามารถในการระเหยที่อุณหภูมิสูง มีประโยชน์เพียงเล็กน้อยในการผลิตเส้นใย แต่มีความสามารถในการหลอมรวมกับแก้วได้ดี ดังนั้นจึงใช้ทำที่ใส่ไส้หลอดทังสเตนในหลอดไส้
ทังสเตนถูกค้นพบโดย K.V. Scheele ในปี 178! d. ใช้ในการผลิตเหล็กพิเศษ. การเติมทังสเตนลงในเหล็กกล้าจะเพิ่มความแข็ง ความยืดหยุ่น และความแข็งแรง ทังสเตนช่วยให้เหล็กสามารถรักษาความแข็งที่อุณหภูมิสูงมากเมื่อใช้ร่วมกับโครเมียม ดังนั้นเหล็กเหล่านี้จึงถูกนำมาใช้ทำหัวกัดสำหรับเครื่องกลึงความเร็วสูง ทังสเตนบริสุทธิ์มีจุดหลอมเหลวสูงที่สุดในบรรดาโลหะ (3370 (C) ดังนั้นจึงใช้สำหรับการผลิตเส้นใยในหลอดไส้ทังสเตนคาร์ไบด์มีความแข็งและทนความร้อนสูงมากและเป็นส่วนประกอบหลักของโลหะผสมทนไฟ
องค์ประกอบที่รวมอยู่ในกลุ่ม VII ของระบบธาตุแบ่งออกเป็น 2 กลุ่มย่อย: กลุ่มหลัก - กลุ่มย่อยฮาโลเจน - และด้านข้าง - กลุ่มย่อยแมงกานีส. ไฮโดรเจนอยู่ในกลุ่มเดียวกัน แม้ว่าอะตอมของไฮโดรเจนจะมีอิเล็กตรอนเพียงตัวเดียวที่ระดับเวเลนซ์ภายนอก และควรจัดวางไว้ในกลุ่ม I
อย่างไรก็ตาม ไฮโดรเจนมีความเหมือนกันน้อยมากทั้งกับองค์ประกอบของกลุ่มย่อยหลัก - โลหะอัลคาไล และองค์ประกอบของกลุ่มย่อยรอง - ทองแดง เงิน และทอง ในเวลาเดียวกัน เช่นเดียวกับฮาโลเจน โดยการเพิ่มอิเล็กตรอนในปฏิกิริยากับโลหะที่ออกฤทธิ์ มันจะก่อตัวเป็นไฮไดรด์ ซึ่งมีความคล้ายคลึงกันกับเฮไลด์อยู่บ้าง
กลุ่มย่อยของฮาโลเจนรวมถึงฟลูออรีน, คลอรีน, โบรมีน, ไอโอดีนและแอสทาทีน ธาตุ 4 ตัวแรกพบได้ในธรรมชาติ ส่วนสุดท้ายมาจากการประดิษฐ์ขึ้น ดังนั้นจึงได้รับการศึกษาน้อยกว่าฮาโลเจนที่เหลือมาก คำว่า "ฮาโลเจน" หมายถึงการก่อเกลือ องค์ประกอบของกลุ่มย่อยได้รับชื่อนี้เนื่องจากความสะดวกในการทำปฏิกิริยากับโลหะหลายชนิดทำให้เกิดเกลือ
ฮาโลเจนทั้งหมดมีโครงสร้างเปลือกอิเล็กตรอนชั้นนอก s 2p5 . ดังนั้นพวกมันจึงรับอิเล็กตรอนได้ง่าย ทำให้เกิดเปลือกอิเล็กตรอนก๊าซมีตระกูลที่เสถียร (s 2 r 6 ). รัศมีที่เล็กที่สุดของอะตอมในกลุ่มย่อยมีไว้สำหรับฟลูออรีน ส่วนที่เหลือจะเพิ่มขึ้นในอนุกรม F< Cl < Br < I < Аt и составляет соответственно 133; 181; 196; 220 и 270 нм. В таком же порядке уменьшается сродство атомов элементов к электрону.
ฮาโลเจน - องค์ประกอบที่ใช้งานมาก พวกมันสามารถรับอิเล็กตรอนได้ไม่เพียงแต่จากอะตอมซึ่งบริจาคได้ง่าย แต่ยังมาจากไอออน และแม้กระทั่งแทนที่ฮาโลเจนอื่นๆ ที่มีฤทธิ์น้อยกว่าจากสารประกอบของพวกมัน ตัวอย่างเช่น ฟลูออรีนจะแทนที่คลอรีนจากคลอไรด์ โบรมีนจากโบรไมด์ และไอโอดีนจากไอโอไดด์
ในบรรดาฮาโลเจนทั้งหมด มีเพียงฟลูออรีนซึ่งอยู่ในช่วง II เท่านั้นที่ไม่มีระดับ d ที่ยังไม่เติม ด้วยเหตุผลนี้ อิเล็กตรอนจึงไม่สามารถมีอิเล็กตรอนเกิน 1 ตัวและมีเวเลนซ์เพียง -1 เท่านั้น ในอะตอมของฮาโลเจนอื่น ๆ ระดับ d จะไม่ถูกเติม ซึ่งทำให้พวกมันมีอิเล็กตรอนที่ไม่คู่กันจำนวนต่างกันและแสดงความจุ -1, +1, +3, +5 และ +7 ที่สังเกตได้ในออกซิเจน สารประกอบของคลอรีน โบรมีน และไอโอดีน
กลุ่มย่อยของแมงกานีสประกอบด้วยแมงกานีส เทคนีเซียม และรีเนียม ต่างจากฮาโลเจน องค์ประกอบของกลุ่มย่อยแมงกานีสมีอิเล็กตรอนเพียง 2 ตัวในระดับอิเล็กทรอนิกส์ภายนอก ดังนั้นจึงไม่แสดงความสามารถในการติดอิเล็กตรอน ทำให้เกิดไอออนที่มีประจุลบ
แมงกานีสเป็นเรื่องธรรมดาในธรรมชาติและใช้กันอย่างแพร่หลายในอุตสาหกรรม
Technetium มีกัมมันตภาพรังสีเราไม่ได้พบในธรรมชาติ แต่ได้มาโดยธรรมชาติ (เป็นครั้งแรก - E. Segre และ K. Perrier, 1937) องค์ประกอบนี้เกิดขึ้นเนื่องจากการสลายตัวของกัมมันตภาพรังสีของยูเรเนียม รีเนียมเป็นหนึ่งในธาตุ มันไม่ได้สร้างแร่ธาตุอิสระ แต่เกิดขึ้นเป็นคู่หูของแร่ธาตุบางชนิดโดยเฉพาะโมลิบดีนัม
มันถูกค้นพบโดย V. และ I. Noddak ในปี 1925 โลหะผสมที่มีการเติมรีเนียมเล็กน้อยมีความต้านทานการกัดกร่อนเพิ่มขึ้น การเพิ่มรีเนียมในโลหะผสมจะเพิ่มความแข็งแรงเชิงกล
คุณสมบัติของรีเนียมนี้ทำให้สามารถใช้แทนอิริเดียมโลหะมีตระกูลได้ เทอร์โมคัปเปิลแพลตตินั่ม-แพลตตินั่ม-รีเนียมทำงานได้ดีกว่าเทอร์โมคัปเปิลแพลตตินัม-แพลตตินัม-อิริเดียม แต่ไม่สามารถใช้งานได้ที่อุณหภูมิสูงมาก เนื่องจากเกิดสารประกอบ Re ที่ระเหยง่าย 2 โอ 7 .
กลุ่มย่อยหลักของกลุ่มที่แปดของระบบธาตุคือก๊าซมีตระกูลฮีเลียม นีออน อาร์กอน คริปทอน ซีนอนและเรดอน องค์ประกอบเหล่านี้มีลักษณะเฉพาะด้วยกิจกรรมทางเคมีที่ต่ำมาก ซึ่งทำให้เหตุผลที่เรียกพวกมันว่าก๊าซมีตระกูลหรือก๊าซเฉื่อย พวกมันมีความยากลำบากในการสร้างสารประกอบที่มีองค์ประกอบหรือสารอื่น ๆ เท่านั้น ยังไม่ได้รับสารประกอบทางเคมีของฮีเลียม นีออนและอาร์กอน อะตอมของก๊าซมีตระกูลไม่ได้รวมกันเป็นโมเลกุล กล่าวอีกนัยหนึ่ง โมเลกุลของก๊าซมีตระกูลเป็นแบบโมโนโทมิก
ก๊าซมีตระกูลทำให้แต่ละช่วงของระบบธาตุสมบูรณ์ นอกจากฮีเลียมแล้ว พวกมันทั้งหมดยังมีอิเล็กตรอนแปดตัวในชั้นอิเล็กตรอนชั้นนอกของอะตอม ทำให้เกิดระบบที่เสถียรมาก เปลือกอิเล็กตรอนของฮีเลียมซึ่งประกอบด้วยอิเล็กตรอนสองตัวก็มีเสถียรภาพเช่นกัน ดังนั้นอะตอมของก๊าซมีตระกูลจึงมีพลังงานไอออไนเซชันสูงและตามกฎแล้วพลังงานสัมพรรคภาพอิเล็กตรอนเชิงลบ
เชื่อกันมานานแล้วว่าอะตอมของก๊าซมีตระกูลโดยทั่วไปไม่สามารถสร้างพันธะเคมีกับอะตอมของธาตุอื่นได้ มีเพียงสารประกอบโมเลกุลที่ไม่เสถียรของก๊าซมีตระกูลเท่านั้นที่ทราบ เช่น ไฮเดรต
Ag-6N 2 0, Kg-6N 2 0, Xe-6N 2 0 เกิดขึ้นจากการกระทำของก๊าซมีตระกูลที่ถูกบีบอัดบนน้ำที่เย็นจัดจนกลายเป็นผลึก ไฮเดรตเหล่านี้อยู่ในประเภทคลาเทรต พันธะวาเลนซ์จะไม่เกิดขึ้นระหว่างการก่อตัวของสารประกอบดังกล่าว การก่อตัวของคลาเทรตกับน้ำนั้นเกิดจากการมีโพรงจำนวนมากในโครงสร้างผลึกของน้ำแข็ง
อย่างไรก็ตาม ในช่วง ทศวรรษที่ผ่านมาพบว่าคริปทอน ซีนอน และเรดอนสามารถรวมเข้ากับองค์ประกอบอื่นๆ และเหนือสิ่งอื่นใดคือฟลูออรีน ดังนั้น, ; ฟลูออไรด์ได้มาจากปฏิกิริยาโดยตรงของก๊าซมีตระกูลกับฟลูออรีน (เมื่อถูกความร้อนหรือปล่อยไฟฟ้า) KrF 2 , XeF 2 , KrF 4 , XeF 4 และ RnF 4 . ทั้งหมดเป็นคริสตัลที่มีความเสถียรภายใต้สภาวะปกติ อนุพันธ์ของซีนอนยังได้รับในสถานะออกซิเดชัน +6 เฮกซาฟลูออไรด์ XEF 6 , XeO3 ไตรออกไซด์, Xe(OH)b ไฮดรอกไซด์ สารประกอบสองชนิดสุดท้ายมีคุณสมบัติเป็นกรด ดังนั้น เมื่อทำปฏิกิริยากับด่าง จะเกิดเป็นเกลือกรดซีโนนิก,ตัวอย่างเช่น: Xe0 3 + Ba (OH) 2 BaXe0 4 + H 2 0
อนุพันธ์ ซีนอน (VI)ตัวออกซิไดซ์ที่แรง อย่างไรก็ตาม ภายใต้การกระทำของตัวออกซิไดซ์ที่แรงกว่านั้น สารประกอบสามารถรับได้ซึ่งซีนอนมีสถานะออกซิเดชัน -4-8 สารประกอบเหล่านี้รู้จักออกตาฟลูออไรด์ XeF 8, Xe0 4 เตตรอกไซด์ และออกโซเฮกซาฟลูออไรด์ XeOF6.
กิจกรรมทางเคมีที่สูงขึ้นของคริปทอน ซีนอน และเรดอนเมื่อเทียบกับสมาชิกกลุ่มแรกของกลุ่มก๊าซมีตระกูลนั้นอธิบายได้จากศักยภาพในการแตกตัวเป็นไอออนของอะตอมที่ค่อนข้างต่ำ สำหรับคริปทอน ซีนอน และเรดอน ค่าเหล่านี้ใกล้เคียงกับศักยภาพการแตกตัวเป็นไอออนของธาตุอื่นๆ (เช่น ศักยภาพการแตกตัวเป็นไอออนของอะตอมไนโตรเจนคือ 14.53ที่, คลอรีนอะตอม 12.97 V)
ยิ่งใหญ่ที่สุด การใช้งานจริงหาอาร์กอน นีออน และฮีเลียม
ไฮโดรเจน (lat. Hydrogenium),H, องค์ประกอบทางเคมี, อันดับแรกในลำดับของตัวเลขในระบบธาตุของ Mendeleev; มวลอะตอม 1.0079 ภายใต้สภาวะปกติ ไฮโดรเจนเป็นก๊าซ ไม่มีสี กลิ่น และรส
ประวัติอ้างอิงในงานของนักเคมีแห่งศตวรรษที่ 16 และ 17 มีการกล่าวถึงการปล่อยก๊าซที่ติดไฟได้ระหว่างการกระทำของกรดบนโลหะซ้ำแล้วซ้ำอีก ในปี ค.ศ. 1766 G. Cavendish ได้รวบรวมและตรวจสอบก๊าซที่ปล่อยออกมา เรียกมันว่า "อากาศที่ติดไฟได้" ในฐานะผู้สนับสนุนทฤษฎีของโฟลจิสตัน คาเวนดิชเชื่อว่าก๊าซนี้เป็นโฟลจิสตันบริสุทธิ์ ในปี ค.ศ. 1783 A. Lavoisier โดยการวิเคราะห์และสังเคราะห์น้ำ ได้พิสูจน์ความซับซ้อนขององค์ประกอบของน้ำ และในปี ค.ศ. 1787 เขาได้กำหนดให้ "อากาศที่ติดไฟได้" เป็นองค์ประกอบทางเคมีใหม่ (ไฮโดรเจน) และมอบให้ ชื่อทันสมัยไฮโดรเจน (จากภาษากรีก hydor - น้ำและ gennao - ให้กำเนิด) ซึ่งหมายถึง "การให้กำเนิดน้ำ"; รากนี้ใช้ในชื่อของสารประกอบไฮโดรเจนและกระบวนการที่มีส่วนร่วม (เช่นไฮไดรด์, ไฮโดรจิเนชัน) ชื่อรัสเซียสมัยใหม่ "ไฮโดรเจน" เสนอโดย M.F. Solovyov ในปี 1824
การกระจายไฮโดรเจนในธรรมชาติไฮโดรเจนมีการกระจายอย่างกว้างขวางในธรรมชาติ ปริมาณไฮโดรเจนในเปลือกโลก (ธรณีภาคและไฮโดรสเฟียร์) คือ 1% โดยมวล และ 16% โดยจำนวนอะตอม ไฮโดรเจนเป็นส่วนหนึ่งของสารที่พบมากที่สุดบนโลก - น้ำ (11.19% ไฮโดรเจนโดยมวล) ในสารประกอบที่ประกอบเป็นถ่านหิน น้ำมัน ก๊าซธรรมชาติ ดินเหนียว เช่นเดียวกับสิ่งมีชีวิตในสัตว์และพืช (นั่นคือในองค์ประกอบของ โปรตีน กรดนิวคลีอิก ไขมัน คาร์โบไฮเดรต ฯลฯ) ไฮโดรเจนมีน้อยมากในสภาวะอิสระ พบได้ในปริมาณเล็กน้อยในภูเขาไฟและก๊าซธรรมชาติอื่นๆ ปริมาณไฮโดรเจนอิสระจำนวนเล็กน้อย (0.0001% โดยจำนวนอะตอม) มีอยู่ในบรรยากาศ ในอวกาศใกล้โลก ไฮโดรเจนในรูปของกระแสโปรตอนจะสร้างแถบการแผ่รังสีภายใน ("โปรตอน") ของโลก ไฮโดรเจนเป็นองค์ประกอบที่มีมากที่สุดในอวกาศ ในรูปของพลาสมา มันประกอบด้วยมวลประมาณครึ่งหนึ่งของดวงอาทิตย์และดาวฤกษ์ส่วนใหญ่ ซึ่งส่วนใหญ่เป็นก๊าซของตัวกลางระหว่างดาวและเนบิวลาก๊าซ ไฮโดรเจนมีอยู่ในชั้นบรรยากาศของดาวเคราะห์จำนวนหนึ่งและอยู่ในดาวหางในรูปของ H . อิสระ 2, มีเทน CH 4, แอมโมเนีย NH 3, น้ำ H 2 O อนุมูลเช่น CH, NH, OH, SiH, PH เป็นต้น ในรูปของโปรตอน ไฮโดรเจนเป็นส่วนหนึ่งของรังสีคอสมิกของดวงอาทิตย์และรังสีคอสมิก
ไอโซโทป อะตอม และโมเลกุลของไฮโดรเจนไฮโดรเจนสามัญประกอบด้วยส่วนผสมของไอโซโทปที่เสถียร 2 ไอโซโทป: ไฮโดรเจนเบาหรือโปรเทียม ( 1 H) และไฮโดรเจนหนักหรือดิวเทอเรียม ( 2 H หรือ D) ที่ สารประกอบธรรมชาติไฮโดรเจนต่ออะตอม 2 H คิดเป็นเฉลี่ย 6800 อะตอม 1 N. ไอโซโทปกัมมันตภาพรังสีที่มีเลขมวล 3 เรียกว่า superheavy Hydrogen หรือ tritium ( 3 H หรือ T) โดยมีการแผ่รังสี β อ่อนและ T . ครึ่งชีวิต½ = 12.62 ปี ในธรรมชาติไอโซโทปเกิดขึ้นจากไนโตรเจนในบรรยากาศภายใต้การกระทำของนิวตรอนรังสีคอสมิก มันเล็กน้อยในชั้นบรรยากาศ (4 10-15 % ของจำนวนอะตอมไฮโดรเจนทั้งหมด) ได้รับไอโซโทปที่ไม่เสถียรมาก 4 H. มวลของไอโซโทป 1 N, 2 N, 3 N และ 4 H ตามลำดับ 1, 2, 3 และ 4 ระบุว่านิวเคลียสของอะตอมโปรเทียมมีโปรตอนเพียงตัวเดียว ดิวเทอเรียม - โปรตอนหนึ่งตัวและนิวตรอนหนึ่งตัว ทริเทียม - หนึ่งโปรตอนและ 2 นิวตรอน 4 H คือหนึ่งโปรตอนและ 3 นิวตรอน ความแตกต่างอย่างมากในมวลของไอโซโทปของไฮโดรเจนทำให้เกิดความแตกต่างที่เห็นได้ชัดเจนในคุณสมบัติทางกายภาพและทางเคมีของไอโซโทปมากกว่าในกรณีของไอโซโทปของธาตุอื่นๆ
อะตอมไฮโดรเจนมีโครงสร้างที่ง่ายที่สุดในบรรดาอะตอมของธาตุอื่นๆ ทั้งหมด ประกอบด้วยนิวเคลียสและอิเล็กตรอนหนึ่งตัว พลังงานยึดเหนี่ยวของอิเล็กตรอนที่มีนิวเคลียส (ศักย์อิออไนเซชัน) คือ 13.595 eV อะตอมที่เป็นกลาง ไฮโดรเจนสามารถเกาะกับอิเล็กตรอนตัวที่สอง ทำให้เกิดไอออนลบ H- ในกรณีนี้ พลังงานยึดเหนี่ยวของอิเล็กตรอนตัวที่สองที่มีอะตอมเป็นกลาง (สัมพรรคภาพอิเล็กตรอน) คือ 0.78 eV กลศาสตร์ควอนตัมทำให้สามารถคำนวณระดับพลังงานที่เป็นไปได้ทั้งหมดของอะตอมไฮโดรเจน และทำให้ตีความสเปกตรัมของอะตอมได้อย่างสมบูรณ์ อะตอมไฮโดรเจนถูกใช้เป็นอะตอมแบบจำลองในการคำนวณทางกลควอนตัมของระดับพลังงานของอะตอมอื่นที่ซับซ้อนกว่า
โมเลกุลไฮโดรเจนH 2 ประกอบด้วยอะตอมสองอะตอมที่เชื่อมกันด้วยโควาเลนต์ พันธะเคมี. พลังงานของการแตกตัว (นั่นคือสลายตัวเป็นอะตอม) คือ 4.776 eV ระยะทางระหว่างอะตอมที่ตำแหน่งสมดุลของนิวเคลียสคือ0.7414Å ที่อุณหภูมิสูง โมเลกุลไฮโดรเจนจะแยกตัวออกเป็นอะตอม (ระดับความแตกแยกที่ 2000 ° C คือ 0.0013 ที่ 5000 ° C เท่ากับ 0.95) อะตอมไฮโดรเจนยังก่อตัวขึ้นในรูปแบบต่างๆ ปฏิกริยาเคมี(เช่น ฤทธิ์ของ Zn ต่อกรดไฮโดรคลอริก) อย่างไรก็ตาม การมีอยู่ของไฮโดรเจนในสถานะอะตอมนั้นคงอยู่เท่านั้น เวลาอันสั้นอะตอมรวมตัวกันเป็นโมเลกุล H 2 .
คุณสมบัติทางกายภาพของไฮโดรเจนไฮโดรเจนเป็นสารที่เบาที่สุดในบรรดาสารที่รู้จักทั้งหมด (เบากว่าอากาศ 14.4 เท่า) ความหนาแน่น 0.0899 g/l ที่ 0°C และ 1 atm ไฮโดรเจนเดือด (ทำให้เป็นของเหลว) และละลาย (ทำให้แข็งตัว) ที่ -252.8°C และ -259.1°C ตามลำดับ (เฉพาะฮีเลียมเท่านั้นที่มีจุดหลอมเหลวและจุดเดือดต่ำกว่า) อุณหภูมิวิกฤตของไฮโดรเจนต่ำมาก (-240 องศาเซลเซียส) ดังนั้นการทำให้เป็นของเหลวจึงสัมพันธ์กับความยากลำบากอย่างมาก ความดันวิกฤต 12.8 kgf/cm 2 (12.8 atm) ความหนาแน่นวิกฤต 0.0312 g/cm 3 . ไฮโดรเจนมีค่าการนำความร้อนสูงสุดของก๊าซทั้งหมด เท่ากับ 0.174 W/(m K) ที่ 0°C และ 1 atm เช่น 4.16 10-4 แคลอรี/(s ซม. °C). ความจุความร้อนจำเพาะของไฮโดรเจนที่ 0 องศาเซลเซียสและ 1 atm Сพี 14.208 kJ / (kg K) นั่นคือ 3.394 cal / (g ° C) ไฮโดรเจนละลายได้เล็กน้อยในน้ำ (0.0182 มล. / ก. ที่ 20 ° C และ 1 atm) แต่ดี - ในโลหะหลายชนิด (Ni, Pt, Pa และอื่น ๆ ) โดยเฉพาะในแพลเลเดียม (850 ปริมาตรต่อ 1 ปริมาตรของ Pd) ความสามารถในการละลายของไฮโดรเจนในโลหะนั้นสัมพันธ์กับความสามารถในการแพร่กระจายผ่านพวกมัน การแพร่กระจายผ่านโลหะผสมคาร์บอน (เช่น เหล็กกล้า) บางครั้งอาจมาพร้อมกับการทำลายของโลหะผสมอันเนื่องมาจากปฏิกิริยาของไฮโดรเจนกับคาร์บอน (ที่เรียกว่าการลดคาร์บอน) ไฮโดรเจนเหลวมีน้ำหนักเบามาก (ความหนาแน่นที่ -253°C 0.0708 g/cm 3 ) และของเหลว (ความหนืดที่ -253°C 13.8 องศาเซลเซียส)
คุณสมบัติทางเคมีของไฮโดรเจนในสารประกอบส่วนใหญ่ ไฮโดรเจนจะแสดงค่าวาเลนซี (ที่แม่นยำกว่านั้น คือสถานะออกซิเดชัน) ที่ +1 เช่นโซเดียมและโลหะอัลคาไลอื่นๆ โดยปกติถือว่าเป็นอะนาลอกของโลหะเหล่านี้ หัวเรื่องกลุ่ม I ของระบบ Mendeleev อย่างไรก็ตาม ในโลหะไฮไดรด์ ไฮโดรเจนไอออนจะมีประจุลบ (สถานะออกซิเดชัน -1) นั่นคือ นาไฮไดรด์+H- สร้างเหมือนนาคลอไรด์+Cl- . สิ่งนี้และข้อเท็จจริงอื่น ๆ (ความใกล้เคียง คุณสมบัติทางกายภาพไฮโดรเจนและฮาโลเจนความสามารถของฮาโลเจนในการแทนที่ไฮโดรเจนในสารประกอบอินทรีย์) ให้เหตุผลในการจำแนกไฮโดรเจนเป็น กลุ่มปกเกล้าเจ้าอยู่หัวระบบเป็นระยะ ภายใต้สภาวะปกติ โมเลกุลไฮโดรเจนจะไม่ทำงาน โดยจะรวมโดยตรงกับอโลหะที่ออกฤทธิ์มากที่สุดเท่านั้น (ที่มีฟลูออรีน และในแสงยังมีคลอรีน) อย่างไรก็ตาม เมื่อถูกความร้อนจะทำปฏิกิริยากับหลายองค์ประกอบ อะตอมไฮโดรเจนมีกิจกรรมทางเคมีเพิ่มขึ้นเมื่อเทียบกับโมเลกุลไฮโดรเจน ไฮโดรเจนรวมกับออกซิเจนเพื่อสร้างน้ำ:
H 2 + 1/2 O 2 \u003d H 2 O
ด้วยการปล่อย 285.937 kJ / mol นั่นคือ 68.3174 kcal / mol ของความร้อน (ที่ 25 ° C และ 1 atm) ที่อุณหภูมิปกติ ปฏิกิริยาจะเกิดขึ้นช้ามาก สูงกว่า 550 ° C - ด้วยการระเบิด ขีดจำกัดการระเบิดของส่วนผสมของไฮโดรเจน-ออกซิเจนคือ (โดยปริมาตร) ตั้งแต่ 4 ถึง 94% H 2 และส่วนผสมของไฮโดรเจนกับอากาศ - ตั้งแต่ 4 ถึง 74% H 2 (ส่วนผสม 2 เล่ม H 2 และ 1 เล่ม O 2 เรียกว่าแก๊สระเบิด) ไฮโดรเจนถูกใช้เพื่อลดโลหะจำนวนมาก เนื่องจากเอาออกซิเจนออกจากออกไซด์ของพวกมัน:
CuO + H 2 \u003d ลูกบาศ์ก + H 2 O
Fe 3 O 4 + 4H 2 \u003d 3Fe + 4H 2 O เป็นต้น
ด้วยฮาโลเจน ไฮโดรเจนจะก่อตัวเป็นไฮโดรเจนเฮไลด์ ตัวอย่างเช่น
H 2 + Cl 2 \u003d 2HCl.
ไฮโดรเจนจะระเบิดด้วยฟลูออรีน (แม้ในที่มืดและที่อุณหภูมิ -252°C) จะทำปฏิกิริยากับคลอรีนและโบรมีนเมื่อได้รับแสงสว่างหรือให้ความร้อนเท่านั้น และกับไอโอดีนเมื่อถูกความร้อนเท่านั้น ไฮโดรเจนทำปฏิกิริยากับไนโตรเจนเพื่อสร้างแอมโมเนีย:
ZN 2 + N 2 \u003d 2NH 3
เฉพาะกับตัวเร่งปฏิกิริยาและที่อุณหภูมิและความดันที่สูงขึ้นเท่านั้น เมื่อถูกความร้อน ไฮโดรเจนจะทำปฏิกิริยาอย่างรุนแรงกับกำมะถัน:
H 2 + S \u003d H 2 S (ไฮโดรเจนซัลไฟด์)
ยากขึ้นมากกับซีลีเนียมและเทลลูเรียม ไฮโดรเจนสามารถทำปฏิกิริยากับคาร์บอนบริสุทธิ์ได้โดยไม่ต้องใช้ตัวเร่งปฏิกิริยาที่อุณหภูมิสูงเท่านั้น:
2H 2 + C (อสัณฐาน) = CH 4 (มีเทน).
ไฮโดรเจนทำปฏิกิริยาโดยตรงกับโลหะบางชนิด (อัลคาไล เอิร์ธและอื่น ๆ ) ก่อตัวเป็นไฮไดรด์:
H 2 + 2Li = 2LiH.
ความสำคัญในทางปฏิบัติอย่างยิ่งคือปฏิกิริยาของไฮโดรเจนกับคาร์บอนมอนอกไซด์ (II) ซึ่งขึ้นอยู่กับอุณหภูมิ ความดัน และตัวเร่งปฏิกิริยาต่างๆ สารประกอบอินทรีย์, เช่น HCHO, CH 3 OH และอื่นๆ ไฮโดรคาร์บอนไม่อิ่มตัวทำปฏิกิริยากับไฮโดรเจนเพื่อให้อิ่มตัว ตัวอย่างเช่น
C n H 2n + H 2 \u003d C n H 2n + 2
บทบาทของไฮโดรเจนและสารประกอบในทางเคมีนั้นยอดเยี่ยมมาก ไฮโดรเจนกำหนดคุณสมบัติที่เป็นกรดของกรดโปรติกที่เรียกว่า ไฮโดรเจนมีแนวโน้มที่จะก่อตัวที่เรียกว่าพันธะไฮโดรเจนกับองค์ประกอบบางอย่าง ซึ่งมีอิทธิพลอย่างเด็ดขาดต่อคุณสมบัติของสารประกอบอินทรีย์และอนินทรีย์หลายชนิด
รับไฮโดรเจนประเภทวัตถุดิบหลักสำหรับ การผลิตภาคอุตสาหกรรมไฮโดรเจน - ก๊าซธรรมชาติที่ติดไฟได้ ก๊าซเตาอบโค้ก และก๊าซกลั่นน้ำมัน ไฮโดรเจนได้มาจากน้ำด้วยกระแสไฟฟ้า (ในสถานที่ที่มีไฟฟ้าราคาถูก) วิธีที่สำคัญที่สุดในการผลิตไฮโดรเจนจาก ก๊าซธรรมชาติเป็นตัวเร่งปฏิกิริยาปฏิกิริยาของไฮโดรคาร์บอน ส่วนใหญ่เป็นมีเทน กับไอน้ำ (แปลง):
CH 4 + H 2 O \u003d CO + ZH 2,
และการเกิดออกซิเดชันที่ไม่สมบูรณ์ของไฮโดรคาร์บอนโดยออกซิเจน:
CH 4 + 1/2 O 2 \u003d CO + 2H 2
คาร์บอนมอนอกไซด์ที่เป็นผลลัพธ์ (II) ยังต้องถูกแปลง:
CO + H 2 O \u003d CO 2 + H 2
ไฮโดรเจนที่ผลิตจากก๊าซธรรมชาติมีราคาถูกที่สุด
ไฮโดรเจนถูกแยกออกจากก๊าซในเตาอบโค้กและก๊าซจากโรงกลั่นโดยการกำจัดส่วนประกอบที่เหลือของส่วนผสมของแก๊ส ซึ่งจะถูกทำให้เป็นของเหลวได้ง่ายกว่าไฮโดรเจน เมื่อเย็นตัวลงอย่างลึก อิเล็กโทรลิซิสของน้ำจะดำเนินการด้วยกระแสตรง ผ่านสารละลาย KOH หรือ NaOH (ไม่ใช้กรดเพื่อหลีกเลี่ยงการกัดกร่อนของอุปกรณ์เหล็ก) ไฮโดรเจนถูกผลิตขึ้นในห้องปฏิบัติการโดยอิเล็กโทรไลซิสของน้ำ เช่นเดียวกับปฏิกิริยาระหว่างสังกะสีและกรดไฮโดรคลอริก อย่างไรก็ตามบ่อยครั้งที่พวกเขาใช้ไฮโดรเจนสำเร็จรูปในกระบอกสูบ
การประยุกต์ใช้ไฮโดรเจนไฮโดรเจนเริ่มมีการผลิตในระดับอุตสาหกรรมเมื่อปลายศตวรรษที่ 18 เพื่อการเติม ลูกโป่ง. ในปัจจุบัน ไฮโดรเจนถูกใช้อย่างแพร่หลายในอุตสาหกรรมเคมี ซึ่งส่วนใหญ่ใช้สำหรับการผลิตแอมโมเนีย ผู้บริโภคไฮโดรเจนจำนวนมากยังเป็นการผลิตเมทิลและแอลกอฮอล์อื่น ๆ น้ำมันเบนซินสังเคราะห์และผลิตภัณฑ์อื่น ๆ ที่ได้จากการสังเคราะห์จากไฮโดรเจนและคาร์บอนมอนอกไซด์ (II) ไฮโดรเจนใช้สำหรับการเติมไฮโดรเจนของเชื้อเพลิงที่เป็นของแข็งและของเหลวหนัก ไขมัน และอื่นๆ สำหรับการสังเคราะห์ HCl สำหรับการบำบัดด้วยไฮโดรเจนของผลิตภัณฑ์ปิโตรเลียม ในการเชื่อมและการตัดโลหะด้วยเปลวไฟออกซิเจนไฮโดรเจน (อุณหภูมิสูงถึง 2800 ° C) และ ในการเชื่อมอะตอมไฮโดรเจน (สูงถึง 4000 ° C) . ไอโซโทปไฮโดรเจน ดิวเทอเรียม และทริเทียม พบการใช้งานที่สำคัญมากในด้านวิศวกรรมพลังงานนิวเคลียร์
คุณสมบัติทางเคมีขององค์ประกอบหน้า 13
"เคมี ป.9". ระบบปฏิบัติการ กาเบรียลยาน (gdz)
ลักษณะขององค์ประกอบทางเคมี กฎธาตุของ Mendeleev
คำถามที่ 1.
กฎธาตุของเมนเดเลเยฟเป็นหนึ่งในกฎพื้นฐานของเคมี เป็นที่ถกเถียงกันอยู่ว่าเคมีสมัยใหม่ทั้งหมดถูกสร้างขึ้นบนนั้น เขาอธิบายการพึ่งพาคุณสมบัติของอะตอมในโครงสร้างของพวกมัน สรุปการพึ่งพานี้สำหรับองค์ประกอบทั้งหมด แบ่งออกเป็น กลุ่มต่างๆและยังทำนายคุณสมบัติของพวกมันขึ้นอยู่กับโครงสร้างและโครงสร้างขึ้นอยู่กับคุณสมบัติ
มีกฎหมายอื่นๆ ที่มีหน้าที่อธิบาย สรุป และคาดการณ์ ตัวอย่างเช่น กฎการอนุรักษ์พลังงาน กฎการหักเหของแสง กฎทางพันธุกรรมของเมนเดล กฎความโน้มถ่วงสากล เป็นต้น
คำถามที่ 2
ตามระบบธาตุ เราจะพบองค์ประกอบที่มีการจัดเรียงอิเล็กตรอนที่ต้องการในระดับพลังงาน (2 และ 5) องค์ประกอบนี้คือไนโตรเจน: N: 1s 2 2s 2 2p 3
องค์ประกอบนี้สร้างสารอย่างง่าย - N 2, ไนโตรเจน สารประกอบไฮโดรเจนของไนโตรเจนคือ NH 3 แอมโมเนีย ออกไซด์สูงสุดไนโตรเจน - N 2 O 5 ออกไซด์นี้เป็นของกรดออกไซด์ เพราะเมื่อละลายในน้ำจะเปลี่ยนเป็นกรดไนตริกอย่างแรง HNO3
N 2 O 5 + H 2 O \u003d 2HNO 3;
N 2 O 5 + BaO \u003d Ba (OH) 2;
N 2 O 5 + Ba(OH) 2 = Ba(NO 3) 2 + H 2 O;
ไนโตรเจนในสถานะออกซิเดชัน +5 (N +5) มีคุณสมบัติในการออกซิไดซ์อย่างแรง:
2N 2 O 5 + 5C \u003d 2N 2 + 5CO 2
คำถามที่ 3
ก่อนหน้านี้ ธาตุเบริลเลียมถูกกำหนดอย่างผิดพลาดให้กับกลุ่มที่สาม เหตุผลก็คือการกำหนดมวลอะตอมของเบริลเลียมไม่ถูกต้อง (แทนที่จะเป็น 9 ก็ถือว่าเท่ากับ 13.5) ดี. Mendeleev แนะนำว่าเบริลเลียมอยู่ในกลุ่ม II โดยพิจารณาจากคุณสมบัติทางเคมีของธาตุ คุณสมบัติของเบริลเลียมมีความคล้ายคลึงกันมากกับแมกนีเซียม (Mg) และแคลเซียม (Ca) และค่อนข้างแตกต่างจากอะลูมิเนียม (Al) D.I. Mendeleev รู้ว่ามวลอะตอมของ Li และ B ซึ่งเป็นองค์ประกอบที่อยู่ใกล้เคียงคือ 7 และ 11 ตามลำดับ D.I. Mendeleev แนะนำว่ามวลอะตอมของเบริลเลียมคือ 9
คำถามที่ 4
Ca เป็นอะตอมที่มีการกระจายอิเล็กตรอนตามอนุกรม
หมายเลข 2, 8, 8, 2
รายการ #7-N,
องค์ประกอบหมายเลข 8 - O.
สมการปฏิกิริยา:
3Ca + N 2 \u003d Ca 3 N 2,
2Ca + O 2 \u003d 2CaO
ผลิตภัณฑ์ปฏิกิริยามีประเภทพันธะไอออนิก
ไนโตรเจนและออกซิเจนมีโครงสร้างโมเลกุลของผลึกขัดแตะ ในขณะที่แคลเซียมมีโครงผลึกที่เป็นโลหะ
ผลิตภัณฑ์ปฏิสัมพันธ์ - Ca 3 N 2 และ CaO มีโครงสร้างไอออนิกของโครงผลึก
คำถามที่ 5.
N, P, As, Sb, Bi - การเสริมความแข็งแกร่งของคุณสมบัติของโลหะ
คุณสมบัติของโลหะในกลุ่มได้รับการปรับปรุง
คำถามที่ 6
ท่ามกลางองค์ประกอบ: N, Mg, Al, Si, P, S, Cl - การเสริมความแข็งแกร่งของคุณสมบัติที่ไม่ใช่โลหะ
คุณสมบัติที่ไม่ใช่โลหะของธาตุในช่วงเวลาได้รับการปรับปรุง
คำถามที่ 7
Cl 2 O 7 , P 2 O 5 , SiO 2 , Al 2 O 3 , MgO, Na 2 O - คุณสมบัติที่เป็นกรดลดลง
คุณสมบัติของกรดในช่วงเวลาเพิ่มขึ้น
HClO 4 , H3PO 4 , H 2 SO 4 , Al(OH) 3 , NaOH - คุณสมบัติที่เป็นกรดลดลง
คำถามที่ 8
B 2 O 3 , BeO, Li 2 O - เพิ่มคุณสมบัติพื้นฐาน
B(OH) 3 , Be(OH) 2 , LiOH - เพิ่มคุณสมบัติพื้นฐาน
B(OH) 3 เป็นกรดอ่อน;
Be(OH) 2 - ฐานอ่อนแอ;
LiOH เป็นฐานที่แข็งแกร่ง
คำถามที่ 9
ระบบธาตุเป็นระยะสะท้อนถึงความสัมพันธ์ขององค์ประกอบทางเคมี เลขอะตอมของธาตุมีค่าเท่ากับประจุของนิวเคลียส ซึ่งเท่ากับจำนวนโปรตอน จำนวนนิวตรอนที่มีอยู่ในนิวเคลียสขององค์ประกอบหนึ่งซึ่งแตกต่างจากจำนวนโปรตอนอาจแตกต่างกัน อะตอมของธาตุเดียวกันซึ่งนิวเคลียสซึ่งมีจำนวนนิวตรอนต่างกันเรียกว่าไอโซโทป
องค์ประกอบทางเคมีแต่ละชนิดมีไอโซโทปหลายชนิด (ธรรมชาติหรือประดิษฐ์) มวลอะตอมขององค์ประกอบทางเคมีมีค่าเท่ากับค่าเฉลี่ยของมวลของไอโซโทปธรรมชาติทั้งหมดของมัน โดยคำนึงถึงความอุดมสมบูรณ์ของพวกมันด้วย
ด้วยการค้นพบไอโซโทป ประจุของนิวเคลียส แทนที่จะใช้มวลอะตอมของพวกมัน เริ่มถูกใช้เพื่อกระจายธาตุในระบบธาตุ
คำถามที่ 10.
เนื่องจากคุณสมบัติของธาตุและสารประกอบของธาตุเหล่านี้ไม่ได้ขึ้นอยู่กับจำนวนอิเล็กตรอนทั้งหมด แต่ขึ้นอยู่กับจำนวนเวเลนซ์ที่อยู่บนชั้นสุดท้ายเท่านั้น จำนวนของเวเลนซ์อิเล็กตรอนเปลี่ยนแปลงเป็นระยะ ดังนั้นคุณสมบัติของธาตุจึงเปลี่ยนแปลงเป็นระยะเช่นกัน
คำถามที่ 11
1. คุณสมบัติขององค์ประกอบทางเคมีและสารที่เกิดขึ้นนั้นขึ้นอยู่กับญาติเป็นระยะ มวลอะตอมองค์ประกอบ
2. คุณสมบัติขององค์ประกอบทางเคมีและสารที่เกิดขึ้นนั้นขึ้นอยู่กับประจุของนิวเคลียสอะตอมของธาตุเป็นระยะ
เคมีเป็นวิทยาศาสตร์ที่ศึกษาองค์ประกอบทางเคมี สารที่ง่ายและซับซ้อนที่พวกมันก่อตัว (องค์ประกอบ โครงสร้าง คุณสมบัติ) การเปลี่ยนแปลงของพวกมัน และกฎที่การเปลี่ยนแปลงเหล่านี้ปฏิบัติตาม มันถูกแบ่งออกเป็นอนินทรีย์, อินทรีย์, กายภาพ, การวิเคราะห์, คอลลอยด์ ฯลฯ เคมีสมัยใหม่มีความเกี่ยวข้องกับวิทยาศาสตร์อื่น ๆ อันเป็นผลมาจากวิทยาศาสตร์ที่เกิดขึ้น: ชีวเคมีเคมีเกษตรเคมีจักรวาลเคมีวิทยุ ฯลฯ ความสำเร็จของเคมีสมัยใหม่ เป็นตัวกระตุ้นการเติบโตอย่างเข้มข้นของอุตสาหกรรมเคมี มีบทบาทสำคัญในความก้าวหน้าทางวิทยาศาสตร์และเทคโนโลยีของทุกอุตสาหกรรม เศรษฐกิจของประเทศ. เคมีมีบทบาทสำคัญในการแก้ปัญหาเร่งด่วนและมีแนวโน้มมากที่สุด สังคมสมัยใหม่(เพิ่มประสิทธิภาพและความปลอดภัยของปุ๋ยเทียมเพื่อเพิ่มผลผลิตทางการเกษตรและปัญหาการสังเคราะห์ผลิตภัณฑ์อาหารจากวัตถุดิบที่ไม่ใช่อาหาร การพัฒนาแหล่งวัตถุดิบในมหาสมุทร การพัฒนาและการสร้างแหล่งพลังงานใหม่ การสังเคราะห์สารใหม่ และองค์ประกอบที่จำเป็นในการแก้ปัญหาในอนาคต การป้องกัน สิ่งแวดล้อม). ดู #2, หน้า 334
วัตถุประสงค์ของการศึกษาวิชาเคมีคือองค์ประกอบทางเคมีและสารประกอบของพวกมัน องค์ประกอบทางเคมีคือกลุ่มของอะตอมที่มีประจุนิวเคลียร์เท่ากัน ในทางกลับกัน อะตอมเป็นอนุภาคที่เล็กที่สุดขององค์ประกอบทางเคมีที่ยังคงคุณสมบัติทางเคมีทั้งหมดไว้ ดังนั้นองค์ประกอบทางเคมีแต่ละชนิดจึงสอดคล้องกับอะตอมบางประเภท ดู #3 หน้า 11
โมเลกุลเป็นอนุภาคที่เล็กที่สุดของสารแต่ละชนิดที่สามารถดำรงอยู่อย่างอิสระ โดยมีคุณสมบัติทางเคมีพื้นฐานและประกอบด้วยอะตอมที่เหมือนกันหรือต่างกัน โมเลกุลสามารถเป็น 1, 2 และ polyatomic พวกมันคืออนุภาคที่เป็นส่วนประกอบของสสาร หากโมเลกุลประกอบด้วยอะตอมที่เหมือนกัน สารจะเรียกว่า ง่าย หรือ พื้นฐาน เช่น He, Ar, H2, O2, O3, S4, P4 สารธรรมดาเป็นรูปแบบของการดำรงอยู่ขององค์ประกอบทางเคมีในสภาวะอิสระ ดู #3 หน้า 11 หน้า 12
ถ้าโมเลกุลของสารประกอบด้วยอะตอมที่แตกต่างกัน สารนั้นเรียกว่า สารเชิงซ้อน (หรือ สารประกอบเคมี) เช่น CO, H2O, NH3, H3PO4 สารใด ๆ มีลักษณะเฉพาะด้วยองค์ประกอบบางอย่าง (ธรรมชาติและจำนวนของอะตอมในโมเลกุลของมัน) โครงสร้าง (การจัดเรียงเชิงพื้นที่ของอะตอมในโมเลกุล) และคุณสมบัติทางกายภาพและทางเคมีบางอย่าง ดู #3, หน้า 12
คุณสมบัติทางเคมีของสารเป็นตัวกำหนดความสามารถในการมีส่วนร่วมในปฏิกิริยาเคมี กล่าวคือ ในกระบวนการเปลี่ยนสภาพของสารหนึ่งไปเป็นอีกสารหนึ่ง เพื่อให้เข้าใจถึงคุณสมบัติเหล่านี้ จำเป็นต้องทราบองค์ประกอบและโครงสร้างของสาร ดู #3, หน้า 12
ตารางธาตุทั้งหมดสามารถแบ่งออกเป็นโลหะ อโลหะ และสารแอมโฟเทอริก โลหะ- สารง่าย ๆ โดดเด่นด้วยความสามารถในการบริจาคอิเล็กตรอนที่ระดับพลังงานภายนอก (วาเลนซ์อิเล็กตรอน) และเปลี่ยนเป็นไอออนที่มีประจุบวก โลหะเกือบทั้งหมดมีค่าการนำไฟฟ้าและความร้อนสูง ความสามารถในการสะท้อนคลื่นแสงได้ดี (ซึ่งกำหนดความสว่างและความทึบแสง) ความเป็นพลาสติก ในสถานะของแข็งมักจะมี โครงสร้างคริสตัล. การเชื่อมต่อระหว่างอะตอมในโลหะทำได้โดยวาเลนซ์อิเล็กตรอน ซึ่งเคลื่อนที่อย่างอิสระในโครงผลึกที่เกิดขึ้นจากไอออนของโลหะที่มีประจุบวก จาก 107 องค์ประกอบในตารางธาตุ 83 องค์ประกอบเป็นโลหะ คุณสมบัติด้านประสิทธิภาพหลายอย่างของโลหะไม่เพียงขึ้นอยู่กับคุณสมบัติทางเคมีของโลหะเท่านั้น แต่ยังขึ้นกับโครงสร้างที่ได้รับจากวิธีการผลิตและการแปรรูปในภายหลังด้วย สิ่งนี้ทำให้เกิดการเปลี่ยนแปลงในวงกว้างในคุณสมบัติของโลหะ และทำให้พวกเขาเป็นวัสดุโครงสร้าง ไฟฟ้า เครื่องกล และวัสดุอื่นๆ ที่สำคัญที่สุด ปัจจุบันโลหะถูกนำมาใช้กันอย่างแพร่หลายใน สาขาต่างๆเทคโนโลยี. อโลหะ- สารธรรมดาที่ไม่มีความอ่อนตัว มีความมันวาวของโลหะ เป็นตัวนำความร้อนและไฟฟ้าที่ไม่ดี สำหรับอะตอมที่ไม่ใช่โลหะ ความสามารถในการยึดอิเล็กตรอนนั้นเป็นลักษณะเด่น กล่าวคือ กลายเป็นไอออนที่มีประจุลบ อโลหะประกอบด้วย 22 องค์ประกอบ: H, B, C, Si, N, P, As, O, S, Se, Te, ฮาโลเจนและก๊าซมีตระกูล อโลหะออกไซด์มีลักษณะเป็นกรดซึ่งสอดคล้องกับกรดที่มีออกซิเจน สารแอมโฟเทอริกสารที่มีคุณสมบัติเป็นกรดและด่าง สารแอมโฟเทอริกที่ทำปฏิกิริยาเช่นกับเบสแก่สามารถแสดงคุณสมบัติที่เป็นกรดได้ในขณะที่สารเดียวกันที่ทำปฏิกิริยากับกรดแก่สามารถแสดงคุณสมบัติพื้นฐานได้ ดู #2, p273, p279, p225.
พิจารณา ระบบเป็นระยะองค์ประกอบทางเคมี มันถูกสร้างขึ้นบนพื้นฐาน กฎหมายเป็นระยะ. ตารางประกอบด้วย 7 งวดและ 8 กลุ่ม
ช่วงเวลาเป็นแถวแนวนอนของตารางซึ่งแบ่งออกเป็นขนาดใหญ่และขนาดเล็ก ในยุคสบู่มีองค์ประกอบ 2 ธาตุ (ช่วงที่ 1) หรือ 8 องค์ประกอบ (ช่วงที่ 2 และ 3) ในช่วงเวลาขนาดใหญ่ 18 องค์ประกอบ (ช่วงที่ 4 และ 5) หรือ 32 องค์ประกอบ (ช่วงที่ 6) ยังไม่หมดช่วงที่ 7 ช่วงเวลาใดก็ตามเริ่มต้นด้วยโลหะทั่วไปและสิ้นสุดด้วยก๊าซที่ไม่ใช่โลหะและก๊าซมีตระกูลทั่วไป ดู #1, หน้า 271
คอลัมน์แนวตั้งเรียกว่ากลุ่มรายการ แต่ละกลุ่มแบ่งออกเป็นสองกลุ่มย่อยหลักและรอง กลุ่มย่อยคือชุดขององค์ประกอบที่เป็นแอนะล็อกทางเคมี บ่อยครั้งที่องค์ประกอบของกลุ่มย่อยมีสถานะออกซิเดชันสูงสุดที่สอดคล้องกับหมายเลขกลุ่ม ดู #1, หน้า 271
ในกลุ่มย่อยหลัก คุณสมบัติทางเคมีของธาตุอาจแตกต่างกันอย่างมาก


