อลูมิเนียมอยู่ในกลุ่มย่อยหลักของกลุ่ม III โครงร่างของระดับพลังงานมีดังนี้:
3 อัล 2e - , 8e - , 3e -
เนื่องจากอะตอมของอะลูมิเนียมมีอิเล็กตรอน 3 ตัวที่ระดับชั้นนอก อะลูมิเนียมในสารประกอบจึงมีสถานะออกซิเดชันที่ 4-3
เราได้ข้อสรุปแบบเดียวกันโดยได้รับคำแนะนำจากแนวคิดเกี่ยวกับธรรมชาติของการเคลื่อนที่ของอิเล็กตรอนในอะตอมและตำแหน่งของพวกมัน ไม่เพียงแต่ในระดับพลังงานเท่านั้น แต่ยังอยู่ในระดับย่อยด้วย ในอะตอมอะลูมิเนียม อิเล็กตรอน 3s 2 จะขาดออกอย่างง่ายดาย และอิเล็กตรอนหนึ่งตัวผ่านวงโคจร 3p:
ผลที่ได้คืออิเล็กตรอนสามตัวที่ไม่มีการจับคู่ ตอบคำถามข้อ 1 (น.138)
> ค้นหาอลูมิเนียมในธรรมชาติ การผลิต และคุณสมบัติ
อลูมิเนียมเป็นองค์ประกอบที่มีมากเป็นอันดับสามใน เปลือกโลก. มันเกิดขึ้นเฉพาะในสารประกอบ ที่สำคัญที่สุดของพวกเขาแสดงไว้ในรูปที่ 19
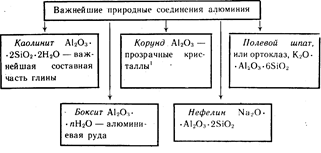
คริสตัลสีของ Al 2 O 3 สีแดง - ทับทิม สีฟ้า- ไพลิน
ใบเสร็จ
ในปี ค.ศ. 1827 นักเคมีชาวเยอรมันชื่อ F. Wöhler ได้อะลูมิเนียมโดยการให้ความร้อนกับอะลูมิเนียมคลอไรด์ด้วยโลหะอัลคาไลที่มีโพแทสเซียมหรือโซเดียมโดยไม่สามารถเข้าถึงอากาศ
AlCl 3 +3K 3KCl + อัล
สำหรับ การผลิตภาคอุตสาหกรรมอลูมิเนียม วิธีการเหล่านี้ไม่เป็นประโยชน์ทางเศรษฐกิจ ดังนั้นจึงมีการพัฒนาวิธีการไฟฟ้าเคมีเพื่อให้ได้อะลูมิเนียมจากอะลูมิเนียม
คุณสมบัติทางกายภาพ
อลูมิเนียมเป็นโลหะสีเงิน-ขาว น้ำหนักเบา (= 2.7 g / cm 3) ละลายที่ 660 ° C เป็นพลาสติกมาก ดึงเป็นลวดได้ง่าย และอบเป็นแผ่นและฟอยล์ ในแง่ของการนำไฟฟ้า อลูมิเนียมเป็นอันดับสองรองจากเงินและทองแดง (เป็น 2/3 ของค่าการนำไฟฟ้าของทองแดง)
คุณสมบัติทางเคมี
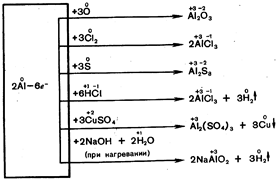
ในซีรีส์แรงดันไฟฟ้าเคมี อะลูมิเนียมจะอยู่ด้านหลังโลหะที่มีปฏิกิริยารุนแรงที่สุด อย่างไรก็ตาม จากประสบการณ์ในชีวิตประจำวัน เป็นที่ทราบกันดีว่าผลิตภัณฑ์อะลูมิเนียม (จาน ฯลฯ) ไม่ได้รับผลกระทบจากออกซิเจนหรือน้ำ แม้จะอยู่ในอุณหภูมิเดือดก็ตาม อลูมิเนียมยังไม่ได้รับผลกระทบจากกรดไนตริกเย็นเข้มข้น นี่เป็นเพราะการปรากฏตัวของฟิล์มออกไซด์บาง ๆ บนพื้นผิวอลูมิเนียมซึ่งช่วยป้องกันไม่ให้เกิดออกซิเดชันเพิ่มเติม หากพื้นผิวของอลูมิเนียมถูด้วยเกลือปรอทจะเกิดปฏิกิริยาต่อไปนี้:
2A1 + 3HgCl 2 2А1С1 3 + 3Hg
ปรอทที่ปล่อยออกมาจะละลายอะลูมิเนียมและโลหะผสมของปรอทกับปรอทจะก่อตัวขึ้น - อะลูมิเนียมอะมัลกัม ฟิล์มไม่เกาะบนพื้นผิวที่ผสมกัน ดังนั้นอะลูมิเนียมจะทำปฏิกิริยากับน้ำภายใต้สภาวะปกติ (รูปที่ 46):
2А1 + 6НОН 2А1(OH)3 + 3Н2
ที่อุณหภูมิสูง อะลูมิเนียมทำปฏิกิริยากับอโลหะและสารเชิงซ้อนจำนวนมากโดยไม่มีการควบรวมกัน:
แอปพลิเคชัน
อลูมิเนียมใช้ในการผลิตโลหะผสมต่างๆ ที่แพร่หลายที่สุดคือดูราลูมินที่มีทองแดงและแมกนีเซียม และซิลูมิน ซึ่งเป็นโลหะผสมของอะลูมิเนียมกับซิลิกอน ข้อได้เปรียบหลักของโลหะผสมเหล่านี้คือความเบาและความแข็งแรงสูง โลหะผสมดังกล่าวใช้กันอย่างแพร่หลายในการผลิตเครื่องบิน ยานยนต์ เรือและเครื่องมือ ในเทคโนโลยีจรวดและในการก่อสร้าง ในรูปของโลหะบริสุทธิ์ อลูมิเนียมใช้สำหรับการผลิตสายไฟและอุปกรณ์เคมีต่างๆ
อลูมิเนียมยังใช้สำหรับการทำให้เป็นอะลูมิเนียม เช่น ทำให้พื้นผิวของเหล็กและผลิตภัณฑ์เหล็กหล่ออิ่มตัวด้วยอะลูมิเนียม เพื่อป้องกันการกัดกร่อน
ในทางปฏิบัติมักใช้เทอร์โม (ส่วนผสมของ Fe 3 O 4 ออกไซด์กับผงอลูมิเนียม) หากส่วนผสมนี้ติดไฟ (โดยใช้เทปแมกนีเซียม) จะเกิดปฏิกิริยารุนแรงกับการปล่อย จำนวนมากความร้อน:
8Al + 3Fe 3 O 4 4Al 2 O 3 + 9Fe
กระบวนการนี้ใช้ในการเชื่อมที่เรียกว่าเทอร์ไมต์ รวมถึงการได้รับโลหะบางชนิดในรูปแบบอิสระ
ตอบคำถามข้อ 2-6 (น.138) แก้ปัญหา 1 - 2 (หน้า 138)
อลูมิเนียม ตำแหน่งในระบบธาตุกายภาพและ คุณสมบัติทางเคมี
บทนำ 3
1. คุณสมบัติทางกายภาพและเคมีของอะลูมิเนียม 5
2. รับอะลูมิเนียม 9
3. อลูมิเนียมในธรรมชาติ 10
4. การใช้อะลูมิเนียมและโลหะผสม 12
บทสรุป 16
อ้างอิง 18
บทนำ
สาธารณชนรู้จักอะลูมิเนียมเป็นครั้งแรกที่งาน World Exhibition ในกรุงปารีสในปี พ.ศ. 2398 โดยมีการนำเสนอโลหะใหม่จำนวนเล็กน้อย ประชาชนรู้สึกผิดหวัง หนังสือพิมพ์เขียนว่า: “นิทรรศการในปารีสถูกกำหนดให้ยุติเรื่องเงินจากดินเหนียว อลูมิเนียมถูกนำมาแสดงต่อสาธารณะ และในการทำเช่นนั้นก็เห็นได้ชัดว่า ที่สุดสิ่งที่พูดเกี่ยวกับเขาต้องมาจากจินตนาการและความง่ายของคนทั่วไป แทนที่จะเป็นภูเขาอลูมิเนียมที่คาดหวัง กลับกลายเป็นบล็อกขนาดเล็กเพียง 12 บล็อก โดยมีน้ำหนักรวมประมาณหนึ่งกิโลกรัม ซึ่งแน่นอนว่าไม่มากสำหรับการค้นพบที่ดูเหมือนจะพลิกโลกได้” อย่างไรก็ตาม ค่อยๆ จากความอยากรู้อยากเห็นที่หายากซึ่งครั้งหนึ่งเคยมีค่าพอๆ กับ โลหะมีค่าอะลูมิเนียมได้กลายเป็นวัสดุที่ขาดไม่ได้สำหรับสถาปนิก ผู้สร้าง และนักออกแบบ ดังนั้นในปี 1967 ดีไซเนอร์ชาวอเมริกัน ออสการ์ เดอ ลา เรนตา สร้างความตื่นเต้นให้กับโลกแฟชั่นด้วยการนำเสนอชุดว่ายน้ำที่ทำจากด้ายอะลูมิเนียมที่บางที่สุดต่อสาธารณชน
โลหะชนิดนี้มีคุณสมบัติที่หลากหลายอย่างน่าอัศจรรย์ในเวลาเพียงสองศตวรรษตั้งแต่เริ่มก่อตั้งสามารถพิชิตโลกได้ กลายเป็นความหมายเหมือนกันกับความก้าวหน้าทางเทคโนโลยี และศตวรรษที่ 21 โดยทั้งหมด สัญญาว่าจะเป็นศตวรรษของอะลูมิเนียม
วันนี้อลูมิเนียมมีราคาแพงกว่าเหล็กกล้าคาร์บอนธรรมดา แต่ราคาถูกกว่าเหล็กกล้าไร้สนิม หากเราคำนวณต้นทุนของผลิตภัณฑ์อะลูมิเนียมและเหล็กกล้า โดยคำนึงถึงน้ำหนักและความต้านทานการกัดกร่อนที่สัมพันธ์กัน ปรากฎว่าในปัจจุบันในหลายกรณี การใช้อะลูมิเนียมมีกำไรมากกว่าเหล็กกล้า
อลูมิเนียมเป็นโลหะของสหัสวรรษที่สาม ทนทาน ความแข็งแรงสูง และน้ำหนักเบา ทนต่อการกัดกร่อน การเสียรูปและอิทธิพลของสิ่งแวดล้อม ความสวยงามและดูแลรักษาง่าย อลูมิเนียมเป็นหนึ่งในโลหะที่เป็นที่ต้องการมากที่สุดในอุตสาหกรรมสมัยใหม่
1. คุณสมบัติทางกายภาพและเคมีของอะลูมิเนียม
ในระบบธาตุของ D.I. Mendeleev จาก 110 องค์ประกอบ 87 เป็นโลหะ พวกเขาอยู่ในกลุ่ม I, II, III ในกลุ่มย่อยรองของทุกกลุ่ม นอกจากนี้ โลหะยังเป็นธาตุที่หนักที่สุด IV, V, VI และ กลุ่ม VI. อย่างไรก็ตาม โลหะหลายชนิดมีลักษณะเป็นแอมโฟเทอริก และบางครั้งอาจมีพฤติกรรมเหมือนอโลหะ
อลูมิเนียมเป็นองค์ประกอบของช่วง III ของกลุ่มย่อยหลักของกลุ่ม III
ถูกกำหนดโดยสัญลักษณ์อัล (lat. Aluminium)
อยู่ในตระกูล p-elements เวเลนซ์อิเล็กตรอนของอะลูมิเนียมจะอยู่ที่ระดับย่อย s และ p ของชั้นอิเล็กตรอนชั้นนอก มีอิเล็กตรอนอยู่ 3 ตัว ดังนั้นอะลูมิเนียมจึงสามารถสร้างพันธะเวเลนซ์ได้ 3 พันธะ ซึ่งเป็นเรื่องปกติที่สุดสำหรับอิเล็กตรอน ดังนั้นสำหรับอะลูมิเนียม สถานะออกซิเดชันปกติคือ +3 ในสารประกอบบางชนิด มันมีสถานะออกซิเดชัน +2 และ +1
ตามสี อลูมิเนียมบริสุทธิ์ชวนให้นึกถึงเงิน เป็นโลหะที่เบามาก มีความหนาแน่นเพียง 2.7 g/cm3 เบากว่าอลูมิเนียมเป็นเพียงโลหะอัลคาไลและอัลคาไลน์เอิร์ท (ยกเว้นแบเรียม) เบริลเลียมและแมกนีเซียม อลูมิเนียมยังละลายได้ง่าย - ที่ 600 ° C (ลวดอลูมิเนียมบางสามารถละลายบนเตาในครัวธรรมดา) แต่เดือดที่ 2452 ° C เท่านั้น ในแง่ของการนำไฟฟ้า อลูมิเนียมอยู่ในอันดับที่ 4 รองจากเงินเท่านั้น (เป็นอันดับแรก) ทองแดงและทองคำซึ่งมีความสำคัญในทางปฏิบัติอย่างมากเนื่องจากอลูมิเนียมราคาถูก ค่าการนำความร้อนของโลหะเปลี่ยนแปลงในลำดับเดียวกัน การตรวจสอบค่าการนำความร้อนสูงของอะลูมิเนียมทำได้ง่ายโดยการจุ่มช้อนอลูมิเนียมลงในชาร้อน และอีกหนึ่งคุณสมบัติที่โดดเด่นของโลหะนี้: พื้นผิวที่เรียบและเป็นมันเงาสะท้อนแสงได้อย่างสมบูรณ์แบบ: จาก 80 ถึง 93% ในบริเวณที่มองเห็นได้ของสเปกตรัม ขึ้นอยู่กับความยาวคลื่น ในภูมิภาคอัลตราไวโอเลต อะลูมิเนียมไม่เท่ากันในส่วนนี้ และเฉพาะในแถบสีแดงเท่านั้นที่ด้อยกว่าสีเงินเล็กน้อย (ในรังสีอัลตราไวโอเลต เงินมีการสะท้อนแสงต่ำมาก) ............. .
รายชื่อวรรณกรรมที่ใช้แล้ว
1. Berdonosov S.S. คู่มือนักเรียนวิชาเคมี. - ม.: อควาเรียม, 2549. - 572 น.
2. Bushkov N.N. เคมี. เบี้ยเลี้ยงสำหรับผู้เข้าแข่งขัน - ม.: คนอรัส, 2550. 455 น.
3. Davidyants A.P. องค์ประกอบที่สิบสาม // เศรษฐศาสตร์กับชีวิต - 2545.- ก.พ. (น 7) - ส. 2-3.
4. Karapetyants M.Kh. ทั่วไปและ เคมีอนินทรีย์: หนังสือเรียนสำหรับนักเทคโนโลยีเคมี. ผู้เชี่ยวชาญ. มหาวิทยาลัย - ม.: เคมี, 2549. - 592 น.
5. Streltsov A. Winged metal // เศรษฐศาสตร์และชีวิต. - 2545.- ก.พ. (น 7) - ส.1
หน้า 1
อลูมิเนียมอยู่ในกลุ่มย่อยหลักของกลุ่ม III โครงร่างของระดับพลังงานมีดังนี้:
3Al 2e-, 8e-, 3e-
เนื่องจากอะตอมของอะลูมิเนียมมีอิเล็กตรอน 3 ตัวที่ระดับชั้นนอก อะลูมิเนียมในสารประกอบจึงมีสถานะออกซิเดชันที่ 4-3
เราได้ข้อสรุปแบบเดียวกันโดยได้รับคำแนะนำจากแนวคิดเกี่ยวกับธรรมชาติของการเคลื่อนที่ของอิเล็กตรอนในอะตอมและตำแหน่งของพวกมัน ไม่เพียงแต่ในระดับพลังงานเท่านั้น แต่ยังอยู่ในระดับย่อยด้วย ในอะตอมอะลูมิเนียม อิเล็กตรอน 3s2 จะเสื่อมสภาพได้ง่าย และอิเล็กตรอนหนึ่งตัวผ่านวงโคจร 3p:
ผลที่ได้คืออิเล็กตรอนสามตัวที่ไม่มีการจับคู่ ตอบคำถามที่ 1
ค้นหาอะลูมิเนียมในธรรมชาติ การผลิต และคุณสมบัติของอะลูมิเนียม
อลูมิเนียมเป็นองค์ประกอบที่มีมากเป็นอันดับสามในเปลือกโลก มันเกิดขึ้นเฉพาะในสารประกอบ ที่สำคัญที่สุดของพวกเขาแสดงไว้ในรูปที่ 19
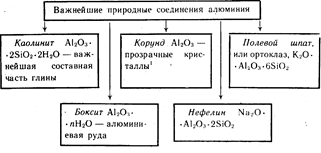
คริสตัลสี Al2O3 สีแดง - ทับทิม, น้ำเงิน - ไพลิน
ใบเสร็จ
ในปี ค.ศ. 1827 นักเคมีชาวเยอรมันชื่อ F. Wöhler ได้อะลูมิเนียมโดยการให้ความร้อนกับอะลูมิเนียมคลอไรด์ด้วยโลหะอัลคาไลที่มีโพแทสเซียมหรือโซเดียมโดยไม่สามารถเข้าถึงอากาศ
AlCl3 +3K 3KCl + อัล
สำหรับอุตสาหกรรมการผลิตอะลูมิเนียม วิธีการเหล่านี้ไม่สามารถประหยัดได้ ดังนั้นจึงมีการพัฒนาวิธีทางเคมีไฟฟ้าสำหรับการผลิตอะลูมิเนียมจากอะลูมิเนียม
คุณสมบัติทางกายภาพ
อะลูมิเนียมเป็นโลหะสีขาวเงิน น้ำหนักเบา (r = 2.7 g/cm3) ละลายที่อุณหภูมิ 660 องศาเซลเซียส เป็นพลาสติกมาก ดึงเป็นลวดได้ง่าย และอบเป็นแผ่นและฟอยล์ ในแง่ของการนำไฟฟ้า อลูมิเนียมเป็นอันดับสองรองจากเงินและทองแดง (เป็น 2/3 ของค่าการนำไฟฟ้าของทองแดง)
คุณสมบัติทางเคมี
ในซีรีส์แรงดันไฟฟ้าเคมี อะลูมิเนียมจะอยู่ด้านหลังโลหะที่มีปฏิกิริยารุนแรงที่สุด อย่างไรก็ตาม จากประสบการณ์ในชีวิตประจำวัน เป็นที่ทราบกันดีว่าผลิตภัณฑ์อะลูมิเนียม (จาน ฯลฯ) ไม่ได้รับผลกระทบจากออกซิเจนหรือน้ำ แม้จะอยู่ในอุณหภูมิเดือดก็ตาม อลูมิเนียมยังไม่ได้รับผลกระทบจากกรดไนตริกเย็นเข้มข้น นี่เป็นเพราะการปรากฏตัวของฟิล์มออกไซด์บาง ๆ บนพื้นผิวอลูมิเนียมซึ่งช่วยป้องกันไม่ให้เกิดออกซิเดชันเพิ่มเติม หากพื้นผิวของอลูมิเนียมถูด้วยเกลือปรอทจะเกิดปฏิกิริยาต่อไปนี้:
2A1 + 3HgCl2 ® 2А1С13 + 3Hg
ปรอทที่ปล่อยออกมาจะละลายอะลูมิเนียมและโลหะผสมของปรอทกับปรอทจะก่อตัวขึ้น - อะลูมิเนียมอะมัลกัม ฟิล์มไม่เกาะบนพื้นผิวที่ผสมกัน ดังนั้นอะลูมิเนียมจะทำปฏิกิริยากับน้ำภายใต้สภาวะปกติ (รูปที่ 46):
2А1 + 6НОН ® 2А1(ОН)3¯ + 3Н2
ที่อุณหภูมิสูง อะลูมิเนียมทำปฏิกิริยากับอโลหะและสารเชิงซ้อนจำนวนมากโดยไม่มีการควบรวมกัน:

แอปพลิเคชัน
อลูมิเนียมใช้ในการผลิตโลหะผสมต่างๆ ที่แพร่หลายที่สุดคือดูราลูมินที่มีทองแดงและแมกนีเซียม และซิลูมิน ซึ่งเป็นโลหะผสมของอะลูมิเนียมกับซิลิกอน ข้อได้เปรียบหลักของโลหะผสมเหล่านี้คือความเบาและความแข็งแรงสูง โลหะผสมดังกล่าวใช้กันอย่างแพร่หลายในการผลิตเครื่องบิน ยานยนต์ เรือและเครื่องมือ ในเทคโนโลยีจรวดและในการก่อสร้าง ในรูปของโลหะบริสุทธิ์ อลูมิเนียมใช้สำหรับการผลิตสายไฟและอุปกรณ์เคมีต่างๆ
อลูมิเนียมยังใช้สำหรับการทำให้เป็นอะลูมิเนียม เช่น ทำให้พื้นผิวของเหล็กและผลิตภัณฑ์เหล็กหล่ออิ่มตัวด้วยอะลูมิเนียม เพื่อป้องกันการกัดกร่อน
ในทางปฏิบัติมักใช้เทอร์โม (ส่วนผสมของออกไซด์ Fe3O4 กับผงอลูมิเนียม) หากส่วนผสมนี้ติดไฟ (โดยใช้เทปแมกนีเซียม) จะเกิดปฏิกิริยารุนแรงเมื่อปล่อยความร้อนจำนวนมาก:
8Al + 3Fe3O4 ® 4Al2O3 + 9Fe
กระบวนการนี้ใช้ในการเชื่อมที่เรียกว่าเทอร์ไมต์ รวมถึงการได้รับโลหะบางชนิดในรูปแบบอิสระ
ตอบคำถามข้อ 2-6 (น.138) แก้ปัญหา 1 - 2 (หน้า 138)
สารประกอบอะลูมิเนียมที่สำคัญที่สุด
อะลูมิเนียมออกไซด์
สามารถรับ Al2O3 ได้ด้วยวิธีต่อไปนี้:
1. ผงเผาไหม้โดยตรง โลหะอลูมิเนียม(โดยการเป่าผงอลูมิเนียมลงในเปลวไฟ):
4Al + 3O2 ® 2А12O3
2. โดยการแปลงตามรูปแบบด้านล่าง:
อะลูมิเนียมออกไซด์เป็นสารสีขาวที่แข็งและทนไฟ (อุณหภูมิ pl. 2050 ° C)
ตามคุณสมบัติทางเคมี มันคือแอมโฟเทอริกออกไซด์ (I, § 37) ทำปฏิกิริยากับกรด แสดงคุณสมบัติของออกไซด์พื้นฐาน:
A12O3 + 6HC1 2A1C13 + 3H2O
Al2O3 + 6H+ +6С1- 2Al3+ + 6С1- + 3Н2O
อัปเดตเกี่ยวกับการศึกษา:
องค์ประกอบ III-A ของกลุ่มของระบบธาตุ
Aluminium Al (lat. Aluminium จาก lat. alumen - alum) อัล - องค์ประกอบของกลุ่มที่สามของยุคที่ 3 ระบบเป็นระยะดี. ไอ. เมนเดเลเยฟ, พี. เอส. 13, มวลอะตอม 26.9815 มีไอโซโทปเสถียรหนึ่งตัว 27Al (100%) โลหะอัลได้รับในปี พ.ศ. 2370 วอห์เลอร์. ตามเนื้อหาในเปลือกโลก (8.8%) อัลครอบครอง ...
ระดับความแตกต่างของการฝึกอบรมตามผลบังคับ
เทคโนโลยีนี้เสนอให้นำมาตรฐานสองมาตรฐานมาใช้: เพื่อการศึกษา (ระดับที่โรงเรียนควรจัดให้สำหรับผู้สำเร็จการศึกษาที่มีความสนใจ มีความสามารถ และขยัน) และมาตรฐานการศึกษาภาคบังคับทั่วไป (ระดับที่ทุกคนควรบรรลุ) ช่องว่างระหว่างชั้น...
ระบบการศึกษาวิศวกรรมในสหรัฐอเมริกา
โดยทั่วไปแล้ว สหรัฐอเมริกาได้นำระบบหลายขั้นตอนมาใช้ อุดมศึกษาโดยแบ่งการฝึกออกเป็นหลายรอบ ครั้งแรก - ระดับปริญญาตรี - ใช้เวลาสี่ปีและสิ้นสุดด้วยปริญญาตรี ตั้งแต่สองปีแรกที่นักเรียนศึกษาสาขาวิชาการศึกษาทั่วไปเกี่ยวกับ ...
จุดประสงค์ของบทเรียน : เพื่อสร้างเงื่อนไขให้นักเรียนศึกษาคุณสมบัติทางกายภาพและเคมีของอะลูมิเนียมตามโครงสร้างของอะตอม
วัตถุประสงค์ของบทเรียน:
1. ให้ถือว่าอะลูมิเนียมเป็นองค์ประกอบทางเคมีและเป็นสารธรรมดา รวบรวมความรู้เกี่ยวกับโครงสร้างของโลหะ คุณสมบัติทางกายภาพและเคมีทั่วไปของพวกมัน ความสามารถในการเขียนสมการ ปฏิกริยาเคมี, อ่าน, กำหนดประเภท, พิจารณาตามแนวคิดเกี่ยวกับกระบวนการออกซิเดชันและการลดลง
2. พัฒนาการทำงานทางจิตของการวิเคราะห์ สังเคราะห์ เปรียบเทียบ ตลอดจนตรรกะ ความสนใจ และการสังเกต
3. เพื่อสร้างโลกทัศน์ทางวิทยาศาสตร์ ความสามารถในการแก้ไขปัญหาในชีวิตประจำวันด้วย จุดวิทยาศาสตร์วิสัยทัศน์ใช้ความรู้ของพวกเขา
วิธีการสอน: ปัญหา
รูปแบบองค์กร: การสนทนา งานอิสระ งานจริง
อุปกรณ์ช่วยสอน: แผนที่เส้นทาง, คำแนะนำ, อุปกรณ์เคมี, ตาราง
อุปกรณ์สาธิต: โต๊ะ, แท่นสาธิต, ลวดอลูมิเนียม, ตะปูเหล็ก, หลอดทดลองที่มีน้ำ, ตะเกียงวิญญาณ, ไม้ขีด, ดินน้ำมัน, แหล่งกระแส, กุญแจ, หลอดไฟ
อุปกรณ์บนโต๊ะนักเรียน: อะลูมิเนียม สารละลายโซเดียมไฮดรอกไซด์ กรดไฮโดรคลอริก ชั้นวางหลอดทดลอง หลอดทดลองสองหลอดที่มีน้ำประกอบด้วยลวดอะลูมิเนียมและตะปูเหล็ก ตะเกียงวิญญาณ ไม้ขีดไฟ ที่ยึดหลอดทดลอง
ระหว่างเรียน
I. ระยะโดยประมาณสร้างแรงบันดาลใจ (แรงจูงใจ การปรับปรุงความรู้)
1. กล่าวเปิดงานครูผู้สอน. ทักทาย.
- ตอนนี้ฉันจะอ่านบทกวีให้คุณฟังและฟังอย่างระมัดระวังและตั้งชื่อองค์ประกอบทางเคมีที่เป็นปัญหา
ไอเทมที่ซ่อนอยู่ในกล่อง
ไม่สามารถกินอาหารกลางวันโดยไม่ได้
สิ่งที่ไม่สามารถถูกแทนที่ได้
เป็นสิ่งที่จำเป็น
ถ้าเรานั่งกิน
เราต้องการรายการนั้นจริงๆ
รายการนี้มาจากอะไร?
สีขาวเงิน
คุณจะได้รับอนุญาตให้ตอบ
- หัวข้อคืออะไร? (ถูกต้อง เกี่ยวกับช้อนอลูมิเนียม.)
- ดังนั้น หัวข้อของบทเรียนคือ "อะลูมิเนียม: องค์ประกอบทางเคมีและสารธรรมดา"
คุณคิดอย่างไร คุณสามารถเรียนรู้อะไรเกี่ยวกับอะลูมิเนียมในบทเรียนได้บ้าง
2. ตรวจการบ้าน
แต่ก่อนที่เราจะเริ่มต้นเรียนรู้เนื้อหาใหม่ ให้จำสิ่งที่คุณได้เรียนรู้ในบทเรียนก่อนหน้านี้ และสำหรับสิ่งนี้ โปรดตอบคำถามต่อไปนี้ให้ฉันด้วย (เครื่องหมายดอกจันสำหรับคำตอบที่ถูกต้อง)
1. บอกตำแหน่งเหล็กใน D.I. เมนเดเลเยฟ.
2. เขียนโครงสร้างของอะตอมของเหล็กและการกำหนดค่าทางอิเล็กทรอนิกส์
3. มาฟังข้อความสั้นๆ เกี่ยวกับสารประกอบเหล็กกัน
4. รีเอเจนต์ใดบ้างที่สามารถใช้ตรวจวัดไอออนของเหล็ก Fe 2 + Fe 3 ในสารละลายได้ ( สองและไตรวาเลนต์.)
- ทำได้ดีมากเด็ก ๆ ! คุณเข้าใจเนื้อหาของบทเรียนที่แล้วเป็นอย่างดี เมื่อสิ้นสุดบทเรียน แสดงดวงดาวของคุณให้ฉันดู ไปที่การศึกษาวัสดุใหม่ เราแต่ละคนมีที่อยู่ของตัวเอง นั่นคือถนน บ้าน อพาร์ตเมนต์ องค์ประกอบทางเคมีก็มี "บ้าน" ของตัวเองเช่นกัน มันเรียกว่าอะไร? "ที่อยู่" อะไร องค์ประกอบทางเคมี? วันนี้เราจะมาทำความรู้จักกับหนึ่งใน "ผู้เช่า" บ้านหลังนี้ และสำหรับสิ่งนี้เราจะออกเดินทางเพื่อทำความคุ้นเคยกับองค์ประกอบทางเคมีที่น่าทึ่ง - อลูมิเนียมและสารธรรมดาที่เกิดขึ้น ในการดำเนินการนี้ คุณจะต้องมีแผนที่เส้นทาง
ครั้งที่สอง
เวทีปฏิบัติการและบริหาร(เรียนรู้สื่อใหม่ๆ)เขียนวันที่เดินทางและหัวข้อของบทเรียนลงในแผนที่เส้นทาง
1) คุณอยู่ที่สถานี “บัตรเข้าชมธาตุเคมี”. งานเป็นรายบุคคลสำหรับแต่ละคน: ค้นหาอลูมิเนียมใน PSCE และกรอกส่วนแรกของแผนที่เส้นทาง เวลาเสร็จสิ้นคือ 3 นาที ใครก็ตามที่เป็นคนแรกที่ทำภารกิจให้สำเร็จ - เครื่องหมายดอกจัน ตรวจสอบบันทึกย่อของคุณ (โปรดไปที่กระดานดำ...)
คุณมีปัญหาใด ๆ ในการวาดไดอะแกรมของการจัดเรียงอิเล็กตรอนของอะตอมอะลูมิเนียมในออร์บิทัลของอะตอมหรือไม่?
ไม่มีปัญหาในโครงการแรก และโครงการที่ 2 หมายถึงอะไร: Al *. เมื่ออะตอมเข้าสู่สภาวะตื่นเต้น อิเล็กตรอนจากระดับย่อย 3s จะผ่านไปยังวงโคจรอิสระของระดับย่อย 3p แล้ว สูตรอิเล็กทรอนิกส์การเปลี่ยนแปลงของอะตอมอะลูมิเนียม
สถานะออกซิเดชันของอลูมิเนียมคืออะไร? (+3)
- องค์ประกอบนี้มีคุณสมบัติอะไรบ้าง - โลหะหรืออโลหะ? ( โลหะ.)
สารอย่างง่ายใดเป็นองค์ประกอบที่มีคุณสมบัติเป็นโลหะ ( โลหะ.)
อลูมิเนียมจึงเป็นโลหะ ดูองค์ประกอบทางเคมีรอบๆ อลูมิเนียมใน PSCE ทางด้านซ้ายของมันคือโลหะที่ใช้งานทางด้านขวา - ไม่ใช่โลหะ
- ให้ข้อสรุปเกี่ยวกับกิจกรรมของอลูมิเนียม (อัล - โลหะที่ไม่ใช้งาน.)
ให้เราหันไปหาชุดไฟฟ้าเคมีของแรงดันไฟฟ้าของโลหะ ที่นี่อลูมิเนียมตั้งอยู่หลังโลหะแอคทีฟทันทีและด้านหลังก็เป็นโลหะที่ค่อนข้างแอคทีฟ
กิจกรรมของอลูมิเนียมคืออะไร? (อัล – โลหะที่ใช้งาน.)
มีน้ำสองแก้วอยู่บนโต๊ะของฉัน ตะปูเหล็กและลวดอลูมิเนียมถูกวางลงในน้ำเมื่อสัปดาห์ที่แล้ว
- เราเห็นอะไร? ( เหล็กทำปฏิกิริยากับน้ำ เปลี่ยนสี แต่ไม่มีอะไรเกิดขึ้นกับลวดอลูมิเนียม.)
- ดูอีกครั้งที่ชุดไฟฟ้าเคมีของแรงดันไฟฟ้าโลหะ
- โลหะใด - Al หรือ Fe - มีการใช้งานมากกว่า? ( ปรากฎว่าอัล.)
- ทำไมลวดอลูมิเนียมไม่ทำปฏิกิริยาและตะปูเหล็กทำปฏิกิริยากับมัน?
อลูมิเนียมเป็นโลหะที่ใช้งานหรือไม่? - นั่นคือปัญหาที่เราต้องแก้ไขในวันนี้
เนื่องจากข้อมูลที่ได้รับที่สถานี "องค์ประกอบทางเคมีของ Visitka" ไม่เพียงพอสำหรับข้อสรุปสุดท้ายเกี่ยวกับกิจกรรมของอลูมิเนียม เราจะไปยังสถานีถัดไป - “คุณสมบัติทางกายภาพของสารธรรมดา”.
2) ตอนนี้คุณต้องทำงานเป็นคู่ นำลวดอลูมิเนียมมาตรวจสอบลองเปลี่ยนรูปร่าง
ดังนั้นเราจึงเข้าใกล้สถานีที่สองของเส้นทางของเราอย่างมองไม่เห็นซึ่งเรียกว่า "คุณสมบัติทางกายภาพของสารธรรมดา"
ตอนนี้ พวกคุณต้องทำงานควบคู่ไปกับข้อความในหนังสือเรียน เปิดตำราของคุณที่หน้า 57 และอ่านเพียงย่อหน้าเดียวที่ขึ้นต้นด้วยคำว่า "อะลูมิเนียมเป็นสารธรรมดา"
จากข้อความและประสบการณ์ชีวิตของคุณ ให้อธิบายคุณสมบัติทางกายภาพของอะลูมิเนียมและจดไว้ ในกรณีที่มีปัญหา ให้ใส่เครื่องหมายคำถามไว้หน้าทรัพย์สินที่เกี่ยวข้องด้วยดินสอ (ใครทำก่อน - ยกมือ - สำหรับคำตอบที่ถูกต้อง - เครื่องหมายดอกจัน)
อลูมิเนียมเรียกว่าโลหะ "มีปีก" เนื่องจากมีความเบา ความแข็งแรงในโลหะผสม และความต้านทานการกัดกร่อน จึงใช้ในการผลิตเครื่องบินและจรวด
ดังที่คุณได้กล่าวไปแล้ว อลูมิเนียมยังคงมีการนำความร้อนสูง ฉันจะสาธิตการทดลองเพื่อพิสูจน์ค่าการนำความร้อนของอะลูมิเนียม (ฉันจะยึดลวดอลูมิเนียมในแนวนอนที่ขาของขาตั้งสาธิตซึ่งฉันจะติดดินน้ำมันสองไม้ขีด ฉันจะให้ความร้อนที่ปลายลวดในเปลวไฟของตะเกียงแอลกอฮอล์ หลังจากนั้นครู่หนึ่งไม้ขีดจะตกลงมา เปลี่ยน.)
- ความรู้ที่ได้รับจากสถานีนี้ทำให้เราสรุปเกี่ยวกับกิจกรรมของอลูมิเนียมได้หรือไม่? ( ไม่.)
3) สถานีต่อไปของการเดินทางของเราน่าสนใจไม่น้อยไปกว่าสถานีที่แล้วเรียกว่า “คุณสมบัติทางเคมีของสารธรรมดา”.
ในช่วงหยุดยาวที่สถานีนี้ คุณจะผ่านสองขั้นตอน ในขั้นแรก คุณจะได้ศึกษาปฏิสัมพันธ์ของอะลูมิเนียมกับ สารง่ายๆในวินาที - กับสิ่งที่ซับซ้อน
ดังนั้นขั้นตอนแรก เขียนสามสมการสำหรับปฏิกิริยาของอะลูมิเนียมกับสารธรรมดาที่มีออกซิเจน กำมะถัน และคลอรีน และแสดงการเปลี่ยนแปลงในสถานะออกซิเดชันของธาตุ กรอกตารางในแผนที่เส้นทาง
(ปฏิกิริยานี้สามารถสังเกตได้ระหว่างการเผาไหม้ของดอกไม้ไฟและดอกไม้ไฟ - ผงอะลูมิเนียมจะติดไฟและเผาไหม้ด้วยเปลวไฟที่ทำให้ไม่เห็นเมื่อถูกความร้อนอย่างแรง)
- อลูมิเนียมในปฏิกิริยาเหล่านี้คืออะไร - ตัวออกซิไดซ์หรือตัวรีดิวซ์? ( ตัวรีดิวซ์แบบแอคทีฟ.)
ปฏิกิริยาทั้งหมดนี้เกิดขึ้นเมื่อถูกความร้อน
ในขั้นตอนที่สอง เราศึกษาปฏิกิริยาของอะลูมิเนียมกับสารที่ซับซ้อน: กรดไฮโดรคลอริกและสารละลายโซเดียมไฮดรอกไซด์
พวกอลูมิเนียมทำปฏิกิริยากับน้ำหรือไม่? ฉันเห็นว่าคุณกำลังสูญเสียที่จะตอบคำถามนี้
– ปฏิกิริยาเคมีเกิดขึ้นเมื่อคุณเทน้ำลงในชามอลูมิเนียมหรือไม่? ฝนตกแล้วเกิดอะไรขึ้นกับสายไฟอลูมิเนียม?
- ผลิตภัณฑ์ที่อยู่ในรายการไม่เปลี่ยนแปลงภายใต้อิทธิพลของน้ำ เนื่องจากอะลูมิเนียมเคลือบด้วยฟิล์มออกไซด์ที่แข็งแรง หากเอาฟิล์มนี้ออก อลูมิเนียมจะทำปฏิกิริยากับน้ำ (และสารธรรมดาบางชนิด) แม้ในสภาวะปกติ
ฟิล์มนี้สามารถลบออกได้นั่นคือทำลายด้วยกระดาษทรายหรือทางเคมี (เช่นด้วยสารละลายอัลคาไล) หรือถูด้วยเกลือปรอทบนพื้นผิวอลูมิเนียมแล้วเกิดปฏิกิริยาต่อไปนี้:
2Al + 3HqCl 2 –> AlCl 3 + 3Hq
ปรอทที่ปล่อยออกมาจะละลายอะลูมิเนียมและสร้างโลหะผสมกับปรอท - อะลูมิเนียมอะมัลกัม. ฟิล์มจะไม่สะสมบนพื้นผิวที่ผสมกัน ดังนั้นอะลูมิเนียมจะทำปฏิกิริยากับน้ำภายใต้สภาวะปกติ:
2Al + 6HOH –> 2Al(OH) 3 + 3H 2
อลูมิเนียมละลายได้ดีในกรด HCl และ H 2 SO4 เจือจาง แต่กรด H 2 SO 4 และ HN0 3 เข้มข้นจะทำให้กรดเกิดฟิล์มออกไซด์ขึ้นบนพื้นผิวโลหะ กล่าวคือ ป้องกันไม่ให้เกิดปฏิกิริยาต่อไป ดังนั้นกรดเหล่านี้จึงถูกขนส่งในถังอลูมิเนียม
ประสบการณ์ I. ปฏิกิริยาระหว่างอะลูมิเนียมกับสารละลายกรด HCl
ใส่อลูมิเนียมสองชิ้นและหนึ่งมิลลิลิตรลงในหลอดทดลอง สารละลายกรด หากไม่มีปฏิกิริยาเกิดขึ้น ให้อุ่นเนื้อหาของหลอดเล็กน้อย
2Al + 6HCl \u003d 2AlO 3 + 3H 2
(2Al + 3H 2 SO 4 = อัล 2 (SO 4) 3 + 3H 2)
ประสบการณ์ครั้งที่สอง ปฏิกิริยาระหว่างอะลูมิเนียมกับสารละลายอัลคาไล
ใส่อลูมิเนียมสองชิ้นและหนึ่งมิลลิลิตรลงในหลอดทดลอง สารละลายด่าง หากไม่มีปฏิกิริยาเกิดขึ้น ให้ร้อนขึ้น
ในการทดลองทั้ง I และ II ปฏิกิริยาจะไม่เกิดขึ้นทันที แม้ว่าอะลูมิเนียมจะเป็นโลหะแอคทีฟ เนื่องจากฟิล์มออกไซด์เข้าไปรบกวน ปฏิกิริยารุนแรงจึงเกิดขึ้น เนื่องจากฟิล์มจะถูกทำลาย
(2Al + 2NaOH + 2H 2 O \u003d 2NaAlO 2 + 3H 2) - โซเดียมอะลูมิเนต
สร้างแผนภาพสมการปฏิกิริยา
- ข้อสรุปใดที่สามารถสรุปเกี่ยวกับกิจกรรมของโลหะได้? ( โลหะที่ใช้งาน.)
อลูมิเนียมมีปฏิกิริยาทางเคมี สามารถทำปฏิกิริยากับอโลหะ น้ำ กรดได้
นักวิทยาศาสตร์ได้พิสูจน์แล้วว่า:
อลูมิเนียมทำให้เราเป็นตะคริว
และความจำที่คนลดลง
ยับยั้งการทำงานของเอ็นไซม์หลายชนิด
โดยเฉพาะศูนย์เม็ดเลือด
และภาวะสมองเสื่อมเป็นงานของเขา!
เหตุใดจานจึงทำจากอลูมิเนียม?
ปรากฎว่าไม่สามารถใช้เครื่องใช้อลูมิเนียมได้? เป็นไปได้เพราะสิ่งที่ก่อตัวขึ้นบนพื้นผิวของมัน? ฟิล์มออกไซด์! ซึ่งปกป้องอลูมิเนียมจากผลกระทบของปัจจัยแวดล้อม เป็นไปไม่ได้ที่จะปรุงอาหารที่เป็นกรดและด่างซึ่งหมายความว่ามันฝรั่ง (ซึ่งมีแป้ง) สามารถทำได้
เพื่อให้อะลูมิเนียมเริ่มทำปฏิกิริยา ต้องลอกฟิล์มออกไซด์ออกจากพื้นผิว บางครั้งในกระทะอลูมิเนียมที่ด้านล่างเราเห็นจุดดำ ฟิล์มออกไซด์ถูกทำลาย นี่คือชนิดของจานที่คุณไม่สามารถใช้
สาม. แบบทดสอบความรู้เบื้องต้น
สถานีต่อไป - “เลือกงาน”. ภายใน 4 นาที คุณต้องทำงานหนึ่งในสามตัวเลือกให้เสร็จสมบูรณ์ (ไม่บังคับ) เลือกเฉพาะงานที่คุณสามารถจัดการได้ (ดูแผนที่เส้นทาง)
เติมสมการปฏิกิริยาให้สมบูรณ์ เขียนในรูปไอออนิกแบบเต็มและย่อ:
Al + HCl –> ... (ตัวเลือก I);
Al + H 2 SO 4 –> ... (ตัวเลือก II)
เขียนสมการปฏิกิริยาตามแบบแผน:
อัล –> อัล 2 O 3 –> อัล (NO 3) 3 (ตัวเลือก I);
อัล –> AlCl 3 –> อัล (NO 3) 3 (ตัวเลือก II)
กำหนดสารที่ไม่รู้จักและเขียนสมการปฏิกิริยาตามรูปแบบ:
อัล –> ... –> อัล (OH) 3 (ตัวเลือก I);
อัล –> ... –> AlCl 3 (ตัวเลือก II)
IV.
การรวมความรู้เบื้องต้นคุณมาถึงสถานีสุดท้ายแล้ว ในสมุดบันทึกของคุณกลายเป็น อ้างอิงบทคัดย่อบทเรียน.
– ถ้าเราเดินทางต่อ คุณยังต้องไปที่สถานีไหน? ( “ค้นหาในธรรมชาติ”, “ได้”, “ใช้”.)
อลูมิเนียมเป็นโลหะที่มีมากที่สุดในเปลือกโลก คิดเป็น 8.8% ของมวลทั้งหมด อย่างไรก็ตามวิธีการผลิตทางอุตสาหกรรมถูกค้นพบค่อนข้างเร็ว ในปี พ.ศ. 2429 วิศวกรชาวอเมริกันชื่อชาร์ลส์ มาร์ติน ฮอลล์ วิ่งไปหาศาสตราจารย์อีเวตต์ โดยถือลูกบอลอะลูมิเนียม 12 ลูกเล็กๆ บนฝ่ามือ ซึ่งได้มาจากอิเล็กโทรไลซิสเป็นครั้งแรก ...
แต่คุณจะได้ศึกษาเนื้อหานี้ในบทต่อไป
วี
สรุปบทเรียน. การสะท้อนกลับไปที่หัวข้อบทเรียนของวันนี้
เรามีปัญหาอะไรในตอนต้นของเรื่องนี้?
เราจัดการเพื่อแก้ปัญหาหรือไม่?
- เราได้ข้อสรุปอะไรบ้าง?
แอปพลิเคชัน
องค์ประกอบและอะตอม
ในวงกลมของ Mendeleev
ทำให้วิชาเคมีรวยที่สุด
และวิทยาศาสตร์ที่สร้างสรรค์ที่สุด
(ก.ซานนิคอฟ)
แผนที่เส้นทาง
วัตถุประสงค์: เพื่อศึกษาตำแหน่งของอลูมิเนียมในระบบธาตุ โครงสร้างอะตอมของธาตุ คุณสมบัติทางกายภาพและเคมีของสารอย่างง่าย
สถานีที่ 1 “นามบัตรองค์ประกอบทางเคมี”
เวลาจอดรถ 3 นาที ทำงานเป็นรายบุคคลกำหนดตำแหน่งขององค์ประกอบในระบบธาตุสร้างสูตรอิเล็กทรอนิกส์ของอะตอม จดบันทึก:
อลูมิเนียม
องค์ประกอบทางเคมี
เครื่องหมายทางเคมี: มวลอะตอม Ar(Al) =
หมายเลขซีเรียล:
ระยะเวลา:
กลุ่ม:
กลุ่มย่อย-แถว:
โครงสร้างอะตอม:
การกำหนดค่าทางอิเล็กทรอนิกส์:
เรื่องง่ายๆ
สูตรเคมี:
น้ำหนักโมเลกุล Mr(Al) –
สถานีที่ 2 “คุณสมบัติทางกายภาพของสารธรรมดา”
เวลาจอดรถ 5 นาที ทำงานเป็นคู่. เขียนคุณสมบัติทางกายภาพของสารในแผนที่เส้นทาง
สี:
สถานะของการรวมตัว:
พลาสติก:
เงาโลหะ:
การนำความร้อน:
การนำไฟฟ้า:
ความหนาแน่น:
อุณหภูมิหลอมเหลว:
โลหะผสม:
สถานีที่ 3 “คุณสมบัติทางเคมีของสารธรรมดา”
เวลาจอดรถ 10 นาที ทำงานในกลุ่ม 4 เขียนสมการปฏิกิริยาเคมีระหว่างอะลูมิเนียมกับสาร วาดข้อสรุปของคุณเอง เขียนสมการปฏิกิริยาเคมีหนึ่งสมการในรูปรีดอกซ์ แสดงการเปลี่ยนแปลงของอิเล็กตรอน
ปฏิกิริยาอลูมิเนียม |
|
ด้วยสารง่ายๆ |
ด้วยสารที่ซับซ้อน อัล –> A1 2 O 3 –> อัล (HO 3) 3 (ตัวเลือก I); อัล –> AlCl 3 –> อัล (HO 3) 3 (ตัวเลือก II) กำหนดสารที่ไม่รู้จักและเขียนสมการปฏิกิริยาตามรูปแบบ: อัล –> ... –> อัล (OH) 3 (ตัวเลือก I); อัล –> ... –> AlCl 3 (ตัวเลือก II) ขอบคุณสำหรับการทำงานของคุณ! ของคุณ การบ้าน. จากเนื้อหาในตำราเรียนและบันทึกอ้างอิง ให้เขียนเรื่องราวในหัวข้อนี้ “ฉันควรใช้เครื่องครัวอะลูมิเนียมหรือไม่” ให้ข้อโต้แย้งและต่อต้าน |


