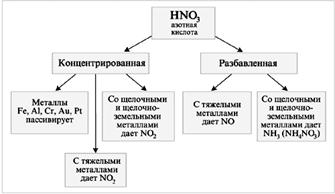
3 หลัก กำหนดลักษณะองค์ประกอบโดยการแทรกคำที่หายไป 1. อลูมิเนียมเป็นองค์ประกอบของกลุ่ม III ซึ่งเป็นกลุ่มย่อยหลัก 2. ประจุของนิวเคลียสของอะตอมอะลูมิเนียมคือ 13 โปรตอนในนิวเคลียสของอะตอมอะลูมิเนียม 4. มี 14 นิวตรอนในนิวเคลียสของอะตอมอะลูมิเนียม 5. มีอิเล็กตรอน 13 ตัวในอะตอมอะลูมิเนียม 6. อะตอมอะลูมิเนียมมีพลังงาน 3 ระดับ 7. เปลือกอิเล็กตรอนมีโครงสร้าง 2e, 8e, 3e 8. ที่ระดับชั้นนอกของอะตอมมีอิเล็กตรอน 3 ตัว 9. สถานะออกซิเดชันของอะตอมในสารประกอบ เท่ากับ อะลูมิเนียมสารอย่างง่ายคือโลหะ 11. อะลูมิเนียมออกไซด์และไฮดรอกไซด์มีลักษณะเป็นแอมโฟเทอริก ไกลออกไป
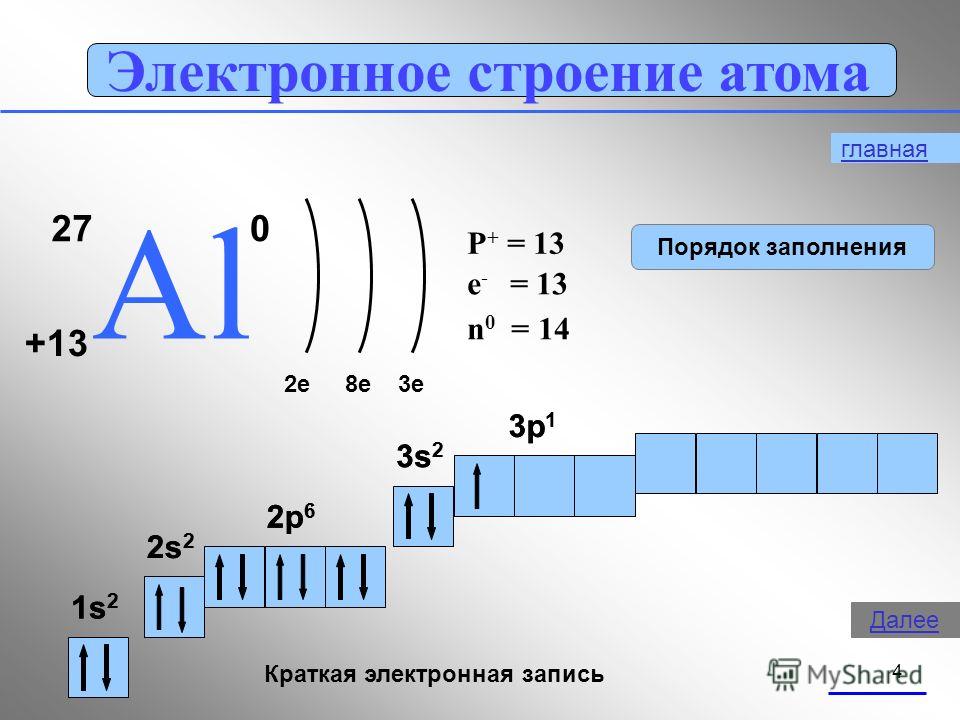
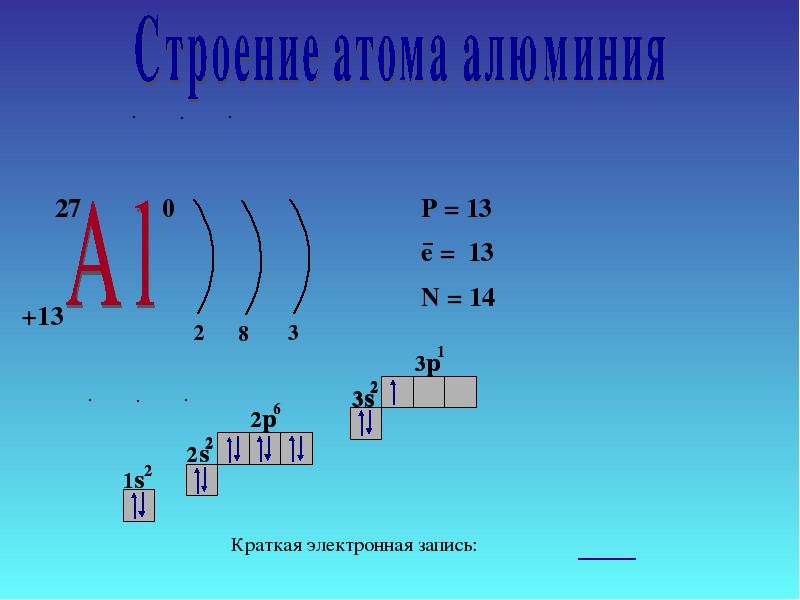
4 โครงสร้างอิเล็กทรอนิกส์ของอะตอม 27 AlAl e8e3e P + = 13 n 0 = 14 e - = 13 1s21s2 2s22s2 2p 6 3s 2 3p 1 บันทึกอิเล็กทรอนิกส์แบบสั้น 1s21s2 2s22s2 2p 6 3s 2 3p 1 การสั่งซื้อหลัก ถัดไป

7 จากประวัติศาสตร์การค้นพบ Main Next ระหว่างการค้นพบอลูมิเนียม - โลหะมีราคาแพงกว่าทองคำ ชาวอังกฤษต้องการให้เกียรตินักเคมีชาวรัสเซียผู้ยิ่งใหญ่ D.I. Mendeleev ด้วยของกำนัลมากมายพวกเขาให้สมดุลทางเคมีแก่เขาซึ่งถ้วยหนึ่งทำจากทองคำและอีกถ้วยหนึ่งเป็นอลูมิเนียม ถ้วยอลูมิเนียมมีราคาแพงกว่าทองคำ ผลลัพธ์ที่ได้คือ "เงินจากดินเหนียว" ไม่เพียงแต่สนใจนักวิทยาศาสตร์เท่านั้น แต่ยังรวมถึงนักอุตสาหกรรมและแม้แต่จักรพรรดิแห่งฝรั่งเศสด้วย ไกลออกไป



12 1. โลหะเงิน-ขาว 2. ความมันวาวของโลหะ 3. โลหะที่แข็งที่สุด 4. จุดหลอมเหลว +660 ° C 5. พลาสติก 6. มีดตัดง่าย 7. ตัวนำ ไฟฟ้า 8. น้ำหนักเบา 9. นำความร้อน 10. ง่ายต่อการดึงดูดและล้างอำนาจแม่เหล็ก 11. ซอฟต์เลือกและจดตัวเลขของคุณสมบัติเหล่านั้นที่เกี่ยวข้องกับคุณสมบัติทางกายภาพของอลูมิเนียม




วัตถุประสงค์ของบทเรียน:
เกี่ยวกับการศึกษา -เรียนกายภาพและ คุณสมบัติทางเคมีอลูมิเนียมและการใช้งาน พิจารณาลักษณะ องค์ประกอบทางเคมีอลูมิเนียมและศึกษาโครงสร้างของอะตอม
กำลังพัฒนา -พัฒนาทักษะในการทดลองถ่ายโอนเนื้อหาของข้อความทางวิทยาศาสตร์และการศึกษาในรูปแบบของไดอะแกรม การพัฒนาทักษะการสื่อสาร ทักษะการฟัง ความสามารถในการแสดงความคิดเห็นอย่างถูกต้อง
เกี่ยวกับการศึกษา -ส่งเสริมวัฒนธรรมการทำงานด้วย เคมีภัณฑ์การปฏิบัติตามกฎระเบียบด้านความปลอดภัย ปลูกฝังระเบียบวินัยอย่างมีสติ ความชัดเจน และองค์กรในการทำงาน
นักเรียนควรรู้:
โครงสร้างอะตอมอะลูมิเนียม คุณสมบัติทางกายภาพและเคมีของอะลูมิเนียมเป็นสารอย่างง่าย พื้นที่ใช้งาน
นักเรียนควรจะสามารถ:
เพื่อกำหนดลักษณะอลูมิเนียมทั้งองค์ประกอบทางเคมีและสารธรรมดา เขียนสมการปฏิกิริยาที่พิสูจน์คุณสมบัติทางเคมีของอะลูมิเนียมในรูปแบบโมเลกุลและรีดอกซ์
ประเภทบทเรียน:
การเรียนรู้วัสดุใหม่
รูปแบบองค์กร กิจกรรมการเรียนรู้นักเรียน:
งานกลุ่ม, รายบุคคล, การทดลองทางเคมี.
วิธีการสอนและเทคนิค:
ค้นคว้า วิจัยบางส่วน สาธิตการทดลองทางเคมี งานกลุ่ม ตอบปากเปล่าที่กระดานดำ งานอิสระด้วยข้อความ การควบคุมซึ่งกันและกัน
อุปกรณ์การเรียน:
ตำราวิทยาศาสตร์และการศึกษาในหัวข้อของบทเรียนการ์ดงานสำหรับ คำถามส่วนตัวแผนการศึกษาวัสดุสำหรับแต่ละกลุ่ม PSCE
คอลเลกชัน "อลูมิเนียมและสารประกอบ", อลูมิเนียมฟอยล์, กรดไฮโดรคลอริกและโซเดียมไฮดรอกไซด์, อลูมิเนียม, อุปกรณ์ห้องปฏิบัติการ
1. เวลาจัดงาน.
ครูกล่าวทักทายนักเรียน
2. การทำให้ความรู้พื้นฐานเป็นจริง การสื่อสารหัวข้อ งาน และโครงสร้างของบทเรียน:
คำพูดแนะนำตัวของอาจารย์
ทำงานเองทำทุกอย่าง
ทั้งเพื่อคนที่คุณรักและเพื่อตัวคุณเอง
และถ้าแรงงานไม่ประสบผลสำเร็จ
ความล้มเหลวไม่ใช่ปัญหา ลองอีกครั้ง
ดี.ไอ.เมนเดเลเยฟ
เรายังคงศึกษาขนาดใหญ่และ หัวข้อสำคัญ"โลหะ". วันนี้ที่บทเรียนเราต้องทำความคุ้นเคยกับโลหะที่รู้จักกันดีมาตั้งแต่เด็ก บทเรียนนี้ฉันต้องการเริ่มต้นด้วยตำนาน
“วันหนึ่งมีคนแปลกหน้ามาหาจักรพรรดิแห่งโรมันไทเบริอุส เพื่อเป็นของขวัญแด่จักรพรรดิ เขานำถ้วยที่เขาทำมาจากโลหะที่แวววาวราวกับเงิน แต่เบามาก อาจารย์บอกว่าเขาได้รับโลหะนี้จากดินเหนียว แต่จักรพรรดิด้วยเกรงว่าทองคำและเงินของเขาจะอ่อนค่าลง จึงสั่งให้เจ้านายถูกตัดศีรษะและทำลายโรงปฏิบัติงานของเขา เรากำลังพูดถึงโลหะอะไร?
(เกี่ยวกับอลูมิเนียม)
ครู:
ดังนั้น หัวข้อของบทเรียนของเราคือ "อะลูมิเนียมเป็นองค์ประกอบทางเคมีและเป็นสารธรรมดา"
วัตถุประสงค์ของบทเรียนได้รับการกำหนดขึ้น
แผนการศึกษาหัวข้อในกลุ่ม:
- คุณสมบัติทางกายภาพอลูมิเนียม
- คุณสมบัติทางเคมีของอะลูมิเนียม
- การใช้อลูมิเนียมและการมีอยู่ของมันในธรรมชาติ
แผนงานกลุ่ม:
ศึกษาข้อความและเน้นข้อมูลที่เกี่ยวข้องกับคำถามของคุณ
- ทำงานที่เสนอให้เสร็จสมบูรณ์
- เตรียมการนำเสนอเกี่ยวกับปัญหาของคุณโดยพิจารณาจากความสั้น ความชัดเจน และความชัดเจนของการนำเสนอ
การทำงานกลุ่มในการศึกษาเนื้อหา
การเตรียมการนำเสนอในหัวข้อของคุณ
กลุ่มที่ 1
ลักษณะของอะลูมิเนียมองค์ประกอบทางเคมีตามตำแหน่งใน PSCE
ออกกำลังกาย:
- ตรวจสอบข้อความ
- ให้คำอธิบายอลูมิเนียมตามตำแหน่งใน PSCE ตามแผน:
ก) หมายเลขซีเรียล
B) มวลอะตอม
C) ระยะเวลา (เล็ก, ใหญ่)
D) กลุ่ม (กลุ่มย่อย: หลักหรือรอง)
ง) เครื่องหมายทางเคมี
E) โครงสร้างของอะตอม (ประจุนิวเคลียส จำนวนโปรตอน อิเล็กตรอน นิวตรอน สูตรอิเล็กทรอนิกส์)
I) ออกไซด์
K) สารประกอบไฮโดรเจนระเหยง่าย
2. อภิปรายผลในกลุ่มและตอบคำถาม:
- มีอิเล็กตรอนกี่ตัวที่ระดับชั้นนอกของอะตอมอะลูมิเนียม?
- อลูมิเนียมจะบริจาคหรือรับอิเล็กตรอนเหล่านี้หรือไม่?
- สถานะออกซิเดชันใดที่อลูมิเนียมไอออนจะได้รับในกรณีนี้?
- สรุป: อลูมิเนียมเป็นสารประกอบประเภทใด (โลหะหรืออโลหะ)
- เปรียบเทียบกิจกรรมของอะลูมิเนียมองค์ประกอบทางเคมีกับธาตุกลุ่มที่ 1 และ 2 ในช่วงเวลาเดียวกัน
- เตรียมการนำเสนอเกี่ยวกับเรื่องนี้โดยอ้างอิงจาก เรื่องความสั้น ความชัดเจน และความชัดเจนของการนำเสนอ
กลุ่ม 2
คุณสมบัติทางกายภาพของอะลูมิเนียม
ออกกำลังกาย:
- ตรวจสอบข้อความ
- เน้นเนื้อหาที่เกี่ยวข้องกับคำถามของคุณ
- พิจารณาคอลเลคชัน "อลูมิเนียมและโลหะผสม"
- สนทนาคำถามต่อไปนี้ในกลุ่ม:
- ก) สถานะโดยรวม, สี, ความมันวาว, ความหนาแน่น (เบาหรือหนัก), หลอมได้ (ง่ายหรือทนไฟ), การนำไฟฟ้าและความร้อน, พลาสติก
- b) วาดข้อมูลที่ได้รับในรูปแบบของไดอะแกรม
5. เตรียมนำเสนอในประเด็นตาม เกี่ยวกับความสั้นและชัดเจน
กลุ่มที่ 3
คุณสมบัติทางเคมีของอะลูมิเนียม
ออกกำลังกาย:
- ตรวจสอบข้อความ
- เน้นเนื้อหาที่เกี่ยวข้องกับคำถามของคุณ
- ศึกษาว่าอลูมิเนียมมีพฤติกรรมสัมพันธ์กับสารที่ซับซ้อนอย่างไร?
- ทำแล็บให้สมบูรณ์โดยใช้คำแนะนำ
ออกกำลังกาย:
ก) ทำการทดลอง
b) อภิปรายปรากฏการณ์ที่สังเกตได้ในกลุ่ม
C) เขียนสมการปฏิกิริยา
D) สรุปผล
5. เตรียมนำเสนอประเด็นนี้ ขึ้นอยู่กับความสั้น ความชัดเจน และความชัดเจนของการนำเสนอ
กลุ่ม 4
การใช้อะลูมิเนียม
ออกกำลังกาย:
- ตรวจสอบข้อความ
- เน้นเนื้อหาที่เกี่ยวข้องกับคำถามของคุณ
- สนทนาคำถามต่อไปนี้ในกลุ่มของคุณ:
ก) บทบาทของอลูมิเนียมในชีวิตมนุษย์คืออะไร?
ข) การใช้อะลูมิเนียมเป็นสารธรรมดา
- ทำไดอะแกรมที่ระบุขอบเขตของอะลูมิเนียม
- เตรียมสุนทรพจน์ในประเด็นนี้ ขึ้นอยู่กับความสั้น ความชัดเจน และความชัดเจนของการนำเสนอ
- รายงานกลุ่มในประเด็นที่ศึกษา
แต่ละกลุ่มเมื่อทำงานทั้งหมดเสร็จแล้วนำเสนอแผนผังของคำถามพร้อมการอภิปรายและแสดงความคิดเห็นนักเรียนจดบันทึกโอนโครงร่างที่เสนอไปยังสมุดบันทึกอันเป็นผลมาจากทุกกลุ่ม บทคัดย่ออ้างอิงในเรื่องของบทเรียน
ข้อสรุปในหัวข้อของบทเรียน:
มีอิเล็กตรอนกี่ตัวที่ระดับพลังงานภายนอกของอะตอมอะลูมิเนียม
อะตอมอะลูมิเนียมมีเลขออกซิเดชันเท่าใด ทำไม แล้วไอออนล่ะ?
- ด้วยความช่วยเหลือของการทดลองใดที่เราได้พิสูจน์ว่าอลูมิเนียมเป็นโลหะที่ใช้งานได้?
สารอะไรเรียกว่าแอมโฟเทอริก?
- แอพพลิเคชั่นต่อไปนี้ใช้คุณสมบัติอะไรบ้าง?
อลูมิเนียมพบมากที่สุดในร่างกายอยู่ที่ไหน?
- เป็นไปได้ไหม เวลานานเก็บอาหารในภาชนะอลูมิเนียม?
ครูขอบคุณนักเรียนที่ให้ความร่วมมือ ทำเครื่องหมายผู้พูดที่กระดานดำ
อ้างอิง.
อลูมิเนียม
กลุ่มย่อยหลักของกลุ่ม III ประกอบด้วยองค์ประกอบ: โบรอน อะลูมิเนียม แกลเลียม อินเดียม แทลเลียม บนชั้นอิเล็กตรอนชั้นนอก อะตอมของธาตุเหล่านี้ประกอบด้วยอิเล็กตรอนสามตัว (…ns2np1) พวกมันคือองค์ประกอบ p ในปฏิกิริยา อะตอมของธาตุเหล่านี้เป็นตัวรีดิวซ์ ยกเว้นโบรอนที่ไม่ใช่โลหะ ซึ่งสามารถเป็นตัวออกซิไดซ์ได้ องค์ประกอบทั้งหมดของกลุ่มย่อยนี้แสดงสถานะออกซิเดชันสูงสุด +3 พวกมันก่อตัว ออกไซด์ที่สูงขึ้นไฮดรอกไซด์ E2O3 และ E(OH)3 ซึ่งแสดงคุณสมบัติแอมโฟเทอริก อลูมิเนียมเป็นที่สนใจมากที่สุดในกลุ่มย่อยนี้
อลูมิเนียมในรูปแบบอิสระเป็นโลหะสีขาวเงิน มีความมันวาว การนำความร้อนและไฟฟ้าสูง (ด้อยกว่าทองแดง) แสง (ความหนาแน่น 2.7 ก. / ซม. 3) และในขณะเดียวกันก็เป็นโลหะที่ทนทาน เป็นโลหะอ่อน เหนียว สามารถรีดเป็นกระดาษฟอยล์ ดึงเป็นเส้นลวดได้ ละลายที่ 6600C ที่อุณหภูมิ 6000C อะลูมิเนียมจะเปราะและสามารถบดเป็นเม็ดหรือผงได้
อะลูมิเนียมเป็นโลหะที่พื้นผิวมักเคลือบด้วยฟิล์มออกไซด์ที่บางและทนทาน ในรูปแบบของขี้กบและผง มันเผาไหม้อย่างสดใสในอากาศ ปล่อยความร้อนจำนวนมาก
ที่อุณหภูมิห้อง มันทำปฏิกิริยาอย่างแข็งขันกับฮาโลเจน เมื่อถูกความร้อน มันจะทำปฏิกิริยากับกำมะถัน (2000C), ไนโตรเจน (8000C) และอโลหะอื่นๆ
อัตราส่วนของอะลูมิเนียมต่อสารที่ซับซ้อน:
อลูมิเนียมละลายในกรดไฮโดรคลอริกทุกความเข้มข้น:
อลูมิเนียมละลายในสารละลายด่าง:
อลูมิเนียมมีบทบาทสำคัญในชีวิตมนุษย์ เขามีส่วนร่วมในการก่อสร้างเยื่อบุผิวและเนื้อเยื่อเกี่ยวพัน ปริมาณอลูมิเนียมในร่างกายมนุษย์ (ต่อน้ำหนักตัว 70 กก.) คือ 61 มก. พบได้ในทุกอวัยวะและเนื้อเยื่อ โดยส่วนใหญ่พบในตับ ปอด กระดูกในสมอง การบริโภคอลูมิเนียมหลักในร่างกายคืออาหาร - นี่คือผลิตภัณฑ์ขนมปัง, ชา (จาก 20 - 200 มก. ต่อผลิตภัณฑ์ 100 กรัม), มันฝรั่ง - 4 มก. ต่อ 100 กรัม ผลิตภัณฑ์หัวผักกาดเหลือง - 46 มก. ต่อผลิตภัณฑ์ 100 กรัม
เมื่อปรุงอาหารและจัดเก็บอาหารในภาชนะอะลูมิเนียม ปริมาณอะลูมิเนียมในผลิตภัณฑ์จะเพิ่มขึ้นเป็นสองเท่า การเพิ่มขึ้นของเนื้อหาของอลูมิเนียมในเลือดทำให้เกิดการกระตุ้นของส่วนกลาง ระบบประสาท. ด้วยอลูมิเนียมส่วนเกินในร่างกาย การทำงานของมอเตอร์ อาการชัก ความจำเสื่อม โรคตับและไตจะถูกรบกวน ด้วยปริมาณอลูมิเนียมที่ลดลงทำให้ระบบประสาทส่วนกลางถูกยับยั้ง
ขอบเขตการใช้งานอลูมิเนียมมีมากมาย เนื่องจากความเบาและความแข็งแรง อลูมิเนียมและโลหะผสมจึงถูกนำมาใช้ในการสร้างเครื่องบินและจรวด (อะลูมิเนียมเรียกว่าโลหะมีปีก) การก่อสร้างเรือและรถยนต์ ในการก่อสร้าง - สำหรับการผลิตกรอบหน้าต่างและประตู ความเบาและการนำไฟฟ้าที่ดีของอลูมิเนียมถูกนำมาใช้ในการผลิตสายไฟสำหรับสายไฟ การนำความร้อนและการไม่เป็นพิษมีความสำคัญในการผลิตเครื่องครัวอลูมิเนียมและฟอยล์จัดเก็บ ผลิตภัณฑ์อาหาร. ผงอลูมิเนียมเป็นพื้นฐานสำหรับการผลิตสีเงินเพื่อป้องกันผลิตภัณฑ์เหล็กจากการกัดกร่อน ความสามารถของอลูมิเนียมในการเผาในอากาศด้วยเปลวไฟที่สว่างสดใสนั้นใช้ในการเตรียมดอกไม้ไฟหลากสีและการผลิตดอกไม้ไฟ
สถาบันการศึกษางบประมาณเทศบาล
โรงเรียนการศึกษาทั่วไป № 81
อลูมิเนียม ตำแหน่งของอลูมิเนียมใน ระบบเป็นระยะและโครงสร้างของอะตอม ค้นหาในธรรมชาติ คุณสมบัติทางกายภาพและเคมีของอะลูมิเนียม
ครูสอนเคมี
โรงเรียนมัธยม MBOU №81
2013
หัวข้อบทเรียน: อะลูมิเนียม. ตำแหน่งของอลูมิเนียมในระบบธาตุและโครงสร้างของอะตอม ค้นหาในธรรมชาติ คุณสมบัติทางกายภาพและเคมีของอะลูมิเนียม
วัตถุประสงค์ของบทเรียน:
พิจารณาการกระจายตัวของอะลูมิเนียมในธรรมชาติ คุณสมบัติทางกายภาพและทางเคมีของอะลูมิเนียม ตลอดจนคุณสมบัติของสารประกอบที่ก่อตัว
ขั้นตอนการทำงาน
1. ช่วงเวลาขององค์กรของบทเรียน 2. การเรียนรู้เนื้อหาใหม่ อลูมิเนียมกลุ่มย่อยหลักสาม กลุ่มของระบบธาตุประกอบขึ้นเป็นโบรอน (B), (Aล.), แกลเลียม (Ga), อินเดียม (ใน) และแทลเลียม (T ล.) ดังจะเห็นได้จากข้อมูลที่ให้มา องค์ประกอบทั้งหมดเหล่านี้ถูกเปิดในศตวรรษที่สิบเก้าการค้นพบโลหะของกลุ่มย่อยหลัก
สาม
กลุ่ม

ที่
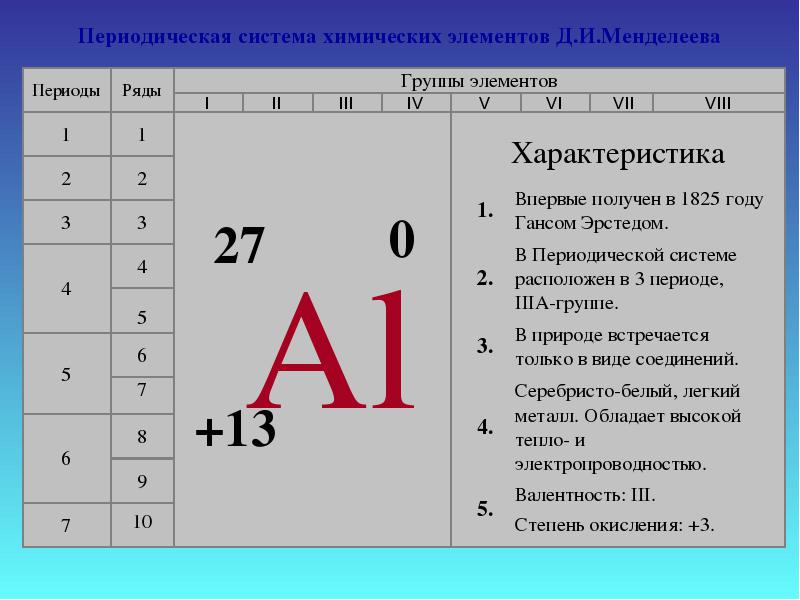
โบรอนเป็นอโลหะ อลูมิเนียมเป็นโลหะทรานซิชัน ในขณะที่แกลเลียม อินเดียม และแทลเลียมเป็นโลหะทั้งหมด ดังนั้น ด้วยการเพิ่มขึ้นของรัศมีอะตอมของธาตุในแต่ละกลุ่มของระบบธาตุ คุณสมบัติของโลหะ สารง่ายๆกระชับ.ในการบรรยายนี้ เราจะเจาะลึกถึงคุณสมบัติของอะลูมิเนียม1. ตำแหน่งของอลูมิเนียมในตารางของ D.I. Mendeleev โครงสร้างของอะตอม แสดงสถานะออกซิเดชัน ส่วนประกอบอลูมิเนียมอยู่ในสาม กลุ่ม, กลุ่มย่อยหลัก "A", ช่วงที่ 3 ของระบบธาตุ, หมายเลขซีเรียลหมายเลข 13, มวลอะตอมสัมพัทธ์อาร์(อัล ) = 27. เพื่อนบ้านทางด้านซ้ายของตารางคือแมกนีเซียม ซึ่งเป็นโลหะทั่วไป และทางด้านขวาคือซิลิกอน ซึ่งไม่ใช่โลหะอีกต่อไป ดังนั้นอลูมิเนียมจึงต้องมีคุณสมบัติที่เป็นกลางบางอย่างและสารประกอบของอะลูมิเนียมนั้นมีลักษณะเป็นแอมโฟเทอริกAl +13) 2 ) 8 ) 3 , p เป็นองค์ประกอบ
สถานะพื้นฐาน
1 วินาที 2 2 วินาที 2 2 หน้า 6 3 วินาที 2 3 หน้า 1
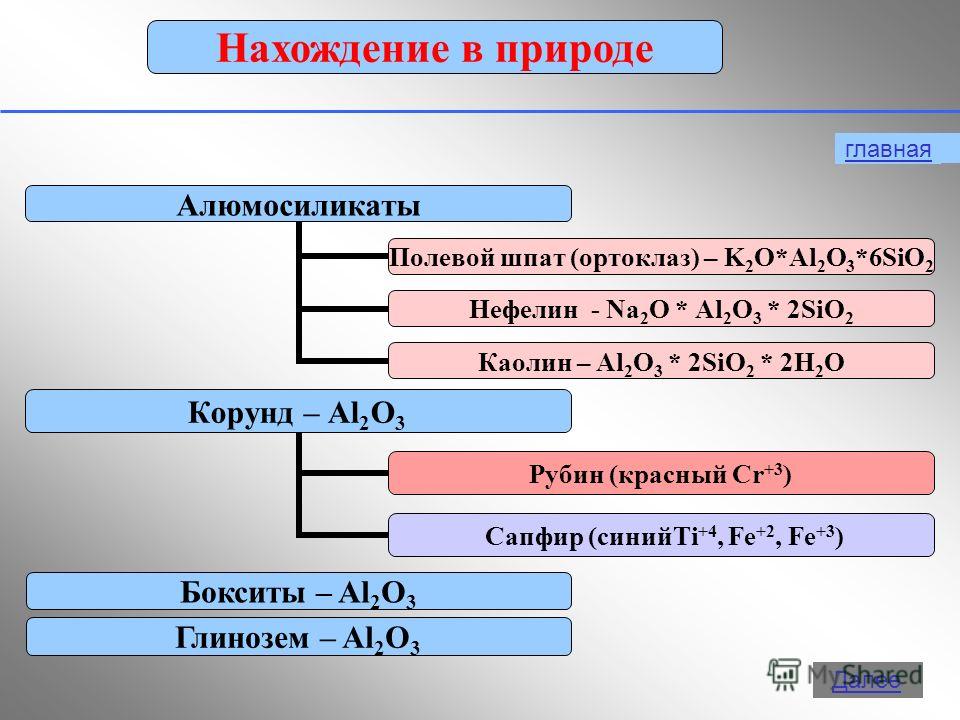
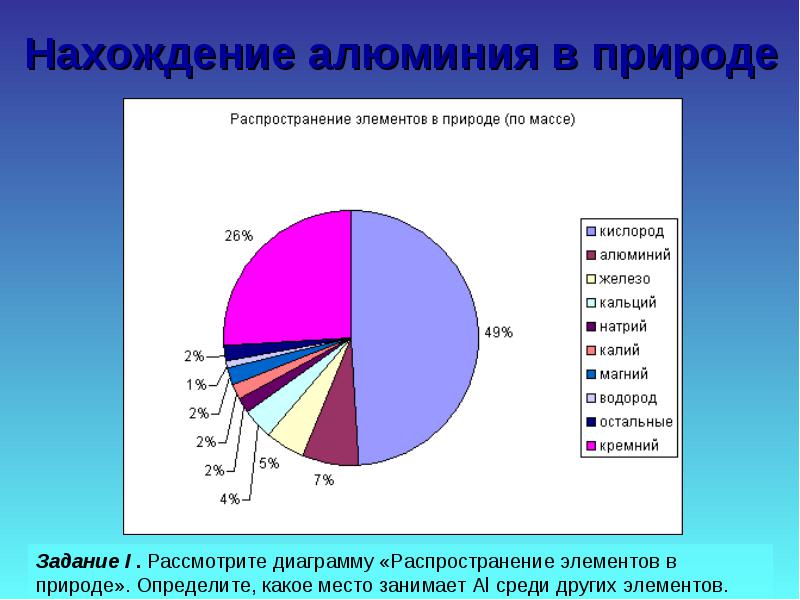
อลูมิเนียมแสดงสถานะออกซิเดชันของ +3 ในสารประกอบ:อัล 0 - 3 e - → Al +3 2. คุณสมบัติทางกายภาพ อะลูมิเนียมแบบอิสระเป็นโลหะสีขาวเงินที่มีค่าการนำความร้อนและไฟฟ้าสูง จุดหลอมเหลว 650เกี่ยวกับ ค. อะลูมิเนียมมีความหนาแน่นต่ำ (2.7 g/cm 3 ) - น้อยกว่าเหล็กหรือทองแดงประมาณสามเท่าและในขณะเดียวกันก็เป็นโลหะที่ทนทาน3. อยู่ในธรรมชาติ ในแง่ของความชุกในธรรมชาติก็ครอบครองที่ 1 ในหมู่โลหะ และที่ 3 ในหมู่ธาตุ รองจากออกซิเจนและซิลิกอนเท่านั้น เปอร์เซ็นต์ของอลูมิเนียมใน เปลือกโลกตามที่นักวิจัยหลายคนระบุว่ามีมวล 7.45 ถึง 8.14% ของมวลเปลือกโลกโดยธรรมชาติแล้ว อลูมิเนียมเกิดขึ้นเฉพาะในสารประกอบ (แร่ธาตุ). บางคน: อะลูมิเนียม - Al 2 O 3 H 2 O (มีสิ่งเจือปน SiO 2 , Fe 2 O 3 , CaCO 3 ) Nephelines - KNa 3 4 Alunites - KAl(SO 4 ) 2 2Al(OH) 3 อลูมินา (ส่วนผสมของดินขาวกับทราย SiO 2 , หินปูน CaCO 3 , แมกนีเซียม MgCO 3 ) คอรันดัม - อัล 2 O 3 เฟลด์สปาร์ (orthoclase) - K 2 O×Al 2 O 3 ×6SiO 2 Kaolinite - Al 2 O 3 ×2SiO 2 × 2H 2 O อะลูไนต์ - (Na,K) 2 SO 4 ×Al 2 (SO 4 ) 3 ×4Al(OH) 3 เบริล - 3BeO อัล 2 O 3 6SiO 2อะลูมิเนียม
4. คุณสมบัติทางเคมีของอะลูมิเนียมและสารประกอบต่างๆ อลูมิเนียมทำปฏิกิริยากับออกซิเจนได้ง่ายภายใต้สภาวะปกติและเคลือบด้วยฟิล์มออกไซด์ความหนาของมันคือ 0.00001 มม. แต่ด้วยเหตุนี้ อลูมิเนียมจึงไม่เป็นสนิม เพื่อศึกษาคุณสมบัติทางเคมีของอะลูมิเนียม ฟิล์มออกไซด์จะถูกลบออก (โดยใช้กระดาษทรายหรือในทางเคมี: ขั้นแรกจุ่มลงในสารละลายอัลคาไลเพื่อเอาฟิล์มออกไซด์ออก จากนั้นจึงจุ่มลงในสารละลายเกลือปรอทเพื่อสร้างโลหะผสมอะลูมิเนียมปรอท - อะมัลกัม)ฉัน . ปฏิสัมพันธ์กับสารอย่างง่าย อลูมิเนียมที่อุณหภูมิห้องจะทำปฏิกิริยากับฮาโลเจนทั้งหมดอย่างแข็งขันทำให้เกิดเฮไลด์ เมื่อถูกความร้อนจะทำปฏิกิริยากับกำมะถัน (200 °C), ไนโตรเจน (800 °C), ฟอสฟอรัส (500 °C) และคาร์บอน (2000 °C) กับไอโอดีนต่อหน้าตัวเร่งปฏิกิริยา - น้ำ: 2A l + 3 S \u003d A l 2 S 3 (อะลูมิเนียมซัลไฟด์), 2A l + N 2 \u003d 2A lN (อะลูมิเนียมไนไตรด์), A l + P = A ล พี (อะลูมิเนียมฟอสไฟด์) 4A l + 3C \u003d A l 4 C 3 (อะลูมิเนียมคาร์ไบด์). 2 อัล + 3 ฉัน 2 \u003d 2 A lI 3 (อะลูมิเนียมไอโอไดด์)สารประกอบทั้งหมดเหล่านี้ถูกไฮโดรไลซ์อย่างสมบูรณ์ด้วยการก่อตัวของอะลูมิเนียมไฮดรอกไซด์และตามนั้น ไฮโดรเจนซัลไฟด์ แอมโมเนีย ฟอสฟีนและมีเทน: อัล 2 ส 3 + 6H 2 O = 2Al(OH) 3 + 3H 2 สอัล 4 ค 3 + 12H 2 O = 4Al(OH) 3 + 3CH 4 ในรูปแบบของขี้กบหรือผง มันเผาไหม้อย่างสดใสในอากาศ ปล่อยความร้อนจำนวนมาก: 4A l + 3 O 2 \u003d 2A l 2 O 3 + 1676 kJ
II. ปฏิกิริยากับสารที่ซับซ้อน ปฏิสัมพันธ์กับน้ำ : 2 อัล + 6 H 2 O \u003d 2 อัล (OH) 3 + 3 H 2 ไม่มีฟิล์มออกไซด์ ปฏิกิริยากับโลหะออกไซด์: อะลูมิเนียมเป็นสารรีดิวซ์ที่ดี เนื่องจากเป็นโลหะออกฤทธิ์ชนิดหนึ่ง อยู่ในชุดกิจกรรมหลังจากโลหะอัลคาไลน์เอิร์ท ดังนั้นฟื้นฟูโลหะจากออกไซด์ของพวกมัน . ปฏิกิริยาดังกล่าว - ความร้อนจากอะลูมิเนียม - ใช้เพื่อให้ได้โลหะหายากบริสุทธิ์ เช่น ทังสเตน วานาเดียม ฯลฯ 3 Fe 3 O 4 + 8 Al \u003d 4 Al 2 O 3 + 9 Fe + Q ส่วนผสมเทอร์ไมต์ Fe 3 อู๋ 4 และอัล (ผง) - ยังใช้ในการเชื่อมเทอร์โม C r 2 O 3 + 2A l \u003d 2C r + A l 2 O 3 ปฏิกิริยากับกรด : ด้วยสารละลายกรดซัลฟิวริก: 2 Al + 3 H 2 SO 4 \u003d อัล 2 (SO 4) 3 + 3 H 2 ไม่ทำปฏิกิริยากับซัลฟิวริกเข้มข้นและไนโตรเจนที่เย็นจัด (พาสซิเวต) ดังนั้นกรดไนตริกจึงถูกขนส่งในถังอลูมิเนียม เมื่อถูกความร้อน อะลูมิเนียมสามารถลดกรดเหล่านี้ได้โดยไม่ปล่อยไฮโดรเจน: 2A l + 6H 2 SO 4 (conc) \u003d A l 2 (SO 4) 3 + 3 SO 2 + 6H 2 O, A l + 6H NO 3 (conc) \u003d A l (NO 3) 3 + 3 NO 2 + 3H 2 O. ปฏิกิริยากับด่าง . 2 Al + 2 NaOH + 6 H 2 O \u003d 2 Na Al (OH) 4 + 3 H 2 นา[แต่ l(เขาคือ) 4 ] – โซเดียม เตตระไฮดรอกโซอะลูมิเนต ตามคำแนะนำของนักเคมี Gorbov ในช่วงสงครามรัสเซีย-ญี่ปุ่น ปฏิกิริยานี้ถูกใช้เพื่อผลิตไฮโดรเจนสำหรับลูกโป่ง ด้วยสารละลายเกลือ: 2 อัล + 3 CuSO 4 \u003d อัล 2 (SO 4) 3 + 3 Cu หากพื้นผิวของอลูมิเนียมถูด้วยเกลือปรอทจะเกิดปฏิกิริยาต่อไปนี้: 2 อัล + 3 HgCl 2 = 2 AlCl 3 + 3 hgปรอทที่ปล่อยออกมาจะละลายอะลูมิเนียมกลายเป็นส่วนผสม 5. การใช้อะลูมิเนียมและสารประกอบต่างๆ

คุณสมบัติทางกายภาพและทางเคมีของอะลูมิเนียมนำไปสู่การใช้เทคโนโลยีอย่างแพร่หลายอุตสาหกรรมการบินเป็นผู้บริโภคอลูมิเนียมรายใหญ่ : 2/3 เครื่องบินทำจากอลูมิเนียมและโลหะผสม เครื่องบินที่ทำจากเหล็กจะหนักเกินไปและสามารถบรรทุกผู้โดยสารได้น้อยกว่ามากดังนั้นอลูมิเนียมจึงเรียกว่าโลหะมีปีก สายไฟและสายไฟทำจากอลูมิเนียม : ด้วยค่าการนำไฟฟ้าเท่ากัน มวลของพวกมันจะน้อยกว่าผลิตภัณฑ์ทองแดงที่สอดคล้องกัน 2 เท่าเมื่อพิจารณาถึงความทนทานต่อการกัดกร่อนของอะลูมิเนียมแล้วผลิตชิ้นส่วนเครื่องมือและภาชนะสำหรับกรดไนตริก . ผงอะลูมิเนียมเป็นพื้นฐานในการผลิตสีเงินเพื่อป้องกันผลิตภัณฑ์เหล็กจากการกัดกร่อน เช่นเดียวกับการสะท้อนรังสีความร้อน สีดังกล่าวใช้ปิดโรงเก็บน้ำมันและชุดนักดับเพลิงอะลูมิเนียมออกไซด์ใช้ในการผลิตอะลูมิเนียมและเป็นวัสดุทนไฟอะลูมิเนียมไฮดรอกไซด์เป็นส่วนประกอบหลักของยา Almagel ซึ่งเป็นที่รู้จักกันดีซึ่งช่วยลดความเป็นกรดของน้ำย่อย เกลืออะลูมิเนียมถูกไฮโดรไลซ์สูง คุณสมบัตินี้ใช้ในกระบวนการทำน้ำให้บริสุทธิ์ เติมอะลูมิเนียมซัลเฟตและปูนขาวเล็กน้อยลงในน้ำเพื่อทำให้บริสุทธิ์เพื่อทำให้กรดเป็นกลาง เป็นผลให้มีการตกตะกอนของอะลูมิเนียมไฮดรอกไซด์เชิงปริมาตรซึ่งตกตะกอนนำอนุภาคของความขุ่นและแบคทีเรียที่แขวนลอยไปด้วยดังนั้นอะลูมิเนียมซัลเฟตจึงเป็นตัวตกตะกอน6. รับอะลูมิเนียม 1) วิธีการผลิตอะลูมิเนียมที่ประหยัดต้นทุนสมัยใหม่ถูกคิดค้นโดย American Hall และ Frenchman Héroux ในปี 1886 ประกอบด้วยอิเล็กโทรไลซิสของสารละลายอะลูมิเนียมออกไซด์ในไครโอไลต์หลอมเหลว ไครโอไลต์หลอมเหลว Na 3 AlF 6 ละลาย Al 2 O 3 วิธีที่น้ำละลายน้ำตาล อิเล็กโทรลิซิสของ "สารละลาย" ของอะลูมิเนียมออกไซด์ในไครโอไลต์หลอมเหลวดำเนินการราวกับว่าไครโอไลต์เป็นเพียงตัวทำละลาย และอะลูมิเนียมออกไซด์เป็นอิเล็กโทรไลต์ 2Al 2 O 3 กระแสไฟฟ้า → 4Al + 3O 2 ในสารานุกรมภาษาอังกฤษสำหรับเด็กชายและเด็กหญิง บทความเกี่ยวกับอะลูมิเนียมเริ่มต้นด้วยคำต่อไปนี้: “ในวันที่ 23 กุมภาพันธ์ พ.ศ. 2429 ยุคโลหะใหม่เริ่มต้นขึ้นในประวัติศาสตร์ของอารยธรรม - ยุคของอะลูมิเนียม ในวันนี้ ชาร์ลส์ ฮอลล์ นักเคมีอายุ 22 ปี ได้ปรากฏตัวในห้องทดลองของครูคนแรกพร้อมกับลูกบอลอลูมิเนียมสีเงิน-ขาวจำนวนหนึ่งโหลในมือของเขา และด้วยข่าวว่าเขาได้ค้นพบวิธีที่จะผลิตโลหะชนิดนี้ ราคาถูกและในปริมาณมาก ดังนั้น Hall จึงเป็นผู้ก่อตั้ง American อุตสาหกรรมอลูมิเนียมและแองโกล-แซกซอน วีรบุรุษของชาติในฐานะผู้ชายที่สร้างธุรกิจที่ยิ่งใหญ่ด้วยวิทยาศาสตร์ 2) 2Al 2 O 3 + 3 C \u003d 4 Al + 3 CO 2 มันน่าสนใจ:
- อลูมิเนียมเมทัลลิกถูกแยกออกครั้งแรกในปี พ.ศ. 2368 โดยนักฟิสิกส์ชาวเดนมาร์ก Hans Christian Oersted โดยการส่งผ่านก๊าซคลอรีนผ่านชั้นของอลูมินาร้อนผสมกับถ่านหิน อะลูมิเนียมคลอไรด์ที่แยกได้ของ Oersted โดยไม่มีความชื้นแม้แต่น้อย ในการคืนสภาพอะลูมิเนียมที่เป็นโลหะ Oersted จำเป็นต้องบำบัดอะลูมิเนียมคลอไรด์ด้วยโพแทสเซียมอะมัลกัม 2 ปีผ่านไป ฟรีดริช โวลเลอร์ นักเคมีชาวเยอรมัน เขาปรับปรุงวิธีการโดยแทนที่โพแทสเซียมอะมัลกัมด้วยโพแทสเซียมบริสุทธิ์
ในศตวรรษที่ 18 และ 19 อะลูมิเนียมเป็นโลหะเครื่องประดับหลัก ในปี พ.ศ. 2432 ในลอนดอน D.I. Mendeleev ได้รับรางวัลของขวัญล้ำค่าสำหรับบริการของเขาในการพัฒนาเคมี - ตาชั่งที่ทำจากทองคำและอลูมิเนียม
ในปี ค.ศ. 1855 นักวิทยาศาสตร์ชาวฝรั่งเศส Saint-Clair Deville ได้พัฒนาวิธีการได้มาซึ่ง โลหะอลูมิเนียมในระดับเทคนิค แต่วิธีการนั้นมีราคาแพงมาก Deville เพลิดเพลินกับการอุปถัมภ์พิเศษของนโปเลียนที่ 3 จักรพรรดิแห่งฝรั่งเศส เพื่อเป็นการแสดงความจงรักภักดีและความกตัญญู Deville ได้ทำเพื่อลูกชายของนโปเลียนซึ่งเป็นเจ้าชายแรกเกิดซึ่งเป็นเสียงคำรามที่แกะสลักอย่างหรูหราซึ่งเป็น "ผลิตภัณฑ์สำหรับผู้บริโภค" ตัวแรกที่ทำจากอลูมิเนียม นโปเลียนถึงกับตั้งใจจะจัดเกราะป้องกันให้กับทหารยามของเขา แต่ราคาก็ถูกห้ามปราม ตอนนั้น อลูมิเนียม 1 กก. ราคา 1,000 มาร์ค ราคาแพงกว่าเงินถึง 5 เท่า จนกระทั่งการประดิษฐ์กระบวนการอิเล็กโทรไลต์อลูมิเนียมมีค่าเท่ากับโลหะทั่วไป
คุณรู้หรือไม่ว่าอลูมิเนียมที่เข้าสู่ร่างกายมนุษย์ทำให้เกิดความผิดปกติของระบบประสาท ด้วยส่วนเกินการเผาผลาญจะถูกรบกวน และสารป้องกันคือ วิตามินซี แคลเซียม สารประกอบสังกะสี
เมื่ออะลูมิเนียมเผาไหม้ออกซิเจนและฟลูออรีน ความร้อนจำนวนมากจะถูกปล่อยออกมา ดังนั้นจึงใช้เป็นสารเติมแต่งสำหรับเชื้อเพลิงจรวด จรวดของดาวเสาร์เผาผงอลูมิเนียม 36 ตันระหว่างการบิน F.A. Zander เสนอแนวคิดในการใช้โลหะเป็นส่วนประกอบของเชื้อเพลิงจรวด
คิด! เหตุใดจึงไม่สามารถทำปฏิกิริยานี้ในสารละลายที่เป็นน้ำได้? №2. ทำสมการปฏิกิริยาเคมีให้สมบูรณ์:
Al + H 2 SO 4 (สารละลาย) ->
อัล + CuCl 2 ->
Al + HNO 3 (conc) - t ->
Al + NaOH + H 2 O -> ไม่ใช่ 3. แก้ปัญหา:
โลหะผสมอะลูมิเนียม-ทองแดงสัมผัสกับสารละลายโซเดียมไฮดรอกไซด์เข้มข้นมากเกินไปขณะถูกให้ความร้อน ปล่อยก๊าซ 2.24 ลิตร (n.o.s.) คำนวณเปอร์เซ็นต์องค์ประกอบของโลหะผสมถ้ามวลรวมของมันคือ 10 g?4. การบ้าน หมายเหตุ: สามารถใช้การนำเสนอในบทเรียนได้“อลูมิเนียม ตำแหน่งของอลูมิเนียมในระบบธาตุและโครงสร้างของอะตอม ค้นหาในธรรมชาติ คุณสมบัติทางกายภาพและเคมีของอะลูมิเนียม»
2.1.1 ตำแหน่งของอลูมิเนียมในระบบธาตุและโครงสร้างของอะตอม
อลูมิเนียมอยู่ในกลุ่มย่อยหลักของกลุ่ม III โครงร่างของระดับพลังงานมีดังนี้:
3 อัล 2e - , 8e - ,3e -
เนื่องจากอะตอมของอะลูมิเนียมมีอิเล็กตรอน 3 ตัวที่ระดับชั้นนอก อะลูมิเนียมในสารประกอบจึงมีสถานะออกซิเดชันที่ 4-3
เราได้ข้อสรุปแบบเดียวกันโดยได้รับคำแนะนำจากแนวคิดเกี่ยวกับธรรมชาติของการเคลื่อนที่ของอิเล็กตรอนในอะตอมและตำแหน่งของพวกมัน ไม่เพียงแต่ในระดับพลังงานเท่านั้น แต่ยังอยู่ในระดับย่อยด้วย ในอะตอมอะลูมิเนียม อิเล็กตรอน 3s 2 จะขาดออกอย่างง่ายดาย และอิเล็กตรอนหนึ่งตัวผ่านออร์บิทัล 3p:
ผลที่ได้คืออิเล็กตรอนสามตัวที่ไม่มีการจับคู่ ตอบคำถามข้อ 1 (น.138)
2.1.2 การหาอะลูมิเนียมในธรรมชาติ การผลิต และคุณสมบัติของอะลูมิเนียม
อลูมิเนียมเป็นองค์ประกอบที่มีมากเป็นอันดับสามในเปลือกโลก มันเกิดขึ้นเฉพาะในสารประกอบ ที่สำคัญที่สุดของพวกเขาแสดงไว้ในรูปที่ 19
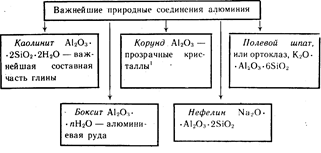
สีแดง Al 2 O 3 คริสตัล - ทับทิม สีฟ้า- ไพลิน
ใบเสร็จ
ในปี ค.ศ. 1827 นักเคมีชาวเยอรมันชื่อ F. Wöhlerได้รับอะลูมิเนียมโดยการให้ความร้อนกับอะลูมิเนียมคลอไรด์ด้วยโลหะอัลคาไลที่มีโพแทสเซียมหรือโซเดียมโดยไม่มีอากาศ
AlCl 3 +3K 3KCl + อัล
สำหรับ การผลิตภาคอุตสาหกรรมอะลูมิเนียม วิธีการเหล่านี้ไม่เป็นประโยชน์ในเชิงเศรษฐกิจ ดังนั้นจึงมีการพัฒนาวิธีทางเคมีไฟฟ้าเพื่อให้ได้อะลูมิเนียมจากอะลูมิเนียม
คุณสมบัติทางกายภาพ
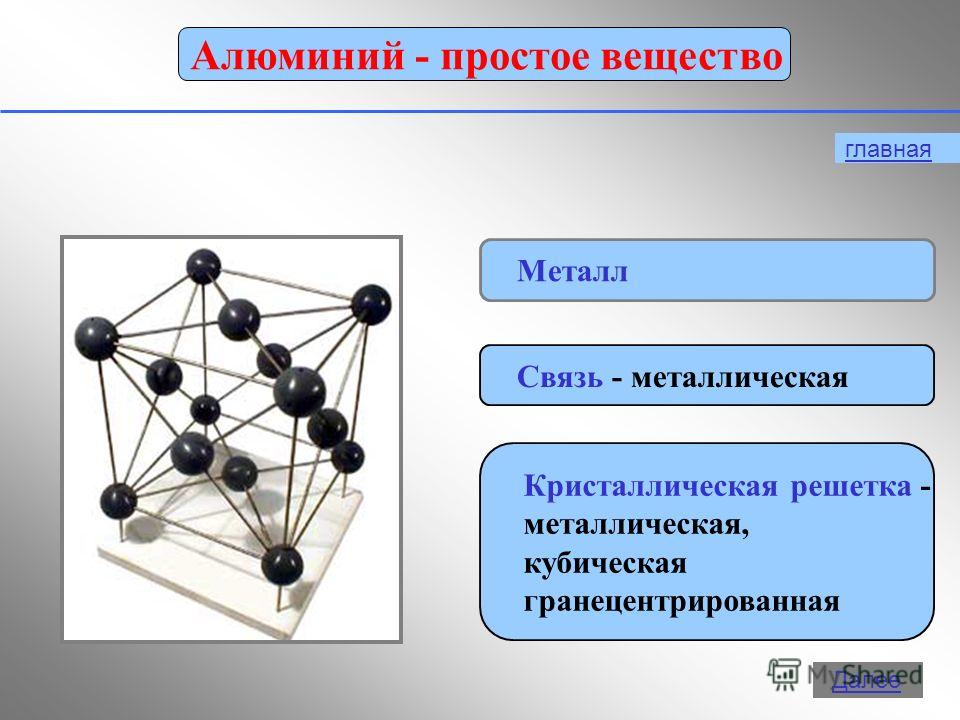
อลูมิเนียมเป็นโลหะสีเงิน-ขาว น้ำหนักเบา (r = 2.7 g / cm 3) ละลายที่ 660 ° C เป็นพลาสติกมาก ดึงเป็นลวดได้ง่าย และอบเป็นแผ่นและฟอยล์ ในแง่ของการนำไฟฟ้า อลูมิเนียมเป็นอันดับสองรองจากเงินและทองแดง (เป็น 2/3 ของค่าการนำไฟฟ้าของทองแดง)
คุณสมบัติทางเคมี
ในซีรีส์แรงดันไฟฟ้าเคมี อะลูมิเนียมจะอยู่ด้านหลังโลหะที่มีปฏิกิริยารุนแรงที่สุด อย่างไรก็ตาม จากประสบการณ์ในชีวิตประจำวัน เป็นที่ทราบกันดีว่าผลิตภัณฑ์อะลูมิเนียม (จาน ฯลฯ) ไม่ได้รับผลกระทบจากออกซิเจนหรือน้ำ แม้จะอยู่ในอุณหภูมิเดือดก็ตาม อลูมิเนียมยังไม่ได้รับผลกระทบจากกรดไนตริกเย็นเข้มข้น เนื่องจากการมีอยู่ของฟิล์มออกไซด์บาง ๆ บนพื้นผิวอลูมิเนียม ซึ่งช่วยป้องกันไม่ให้เกิดออกซิเดชันเพิ่มเติม หากพื้นผิวของอลูมิเนียมถูด้วยเกลือปรอทจะเกิดปฏิกิริยาต่อไปนี้:
2A1 + 3HgCl 2 ® 2А1С1 3 + 3Hg
ปรอทที่ปล่อยออกมาจะละลายอะลูมิเนียมและโลหะผสมของปรอทกับปรอทนั้นก่อตัวขึ้น - อะลูมิเนียมอะมัลกัม ฟิล์มไม่เกาะบนพื้นผิวที่ผสมกัน ดังนั้นอะลูมิเนียมจะทำปฏิกิริยากับน้ำภายใต้สภาวะปกติ (รูปที่ 46):
2А1 + 6НОН ® 2А1(ОН) 3 ¯ + 3Н 2
ที่อุณหภูมิสูง อะลูมิเนียมทำปฏิกิริยากับอโลหะและสารเชิงซ้อนจำนวนมากโดยไม่มีการควบรวมกัน:

แอปพลิเคชัน
อลูมิเนียมใช้ในการผลิตโลหะผสมต่างๆ ที่แพร่หลายที่สุดคือดูราลูมินที่ประกอบด้วยทองแดงและแมกนีเซียม และซิลูมิน ซึ่งเป็นโลหะผสมของอะลูมิเนียมกับซิลิกอน ข้อได้เปรียบหลักของโลหะผสมเหล่านี้คือความเบาและความแข็งแรงสูง โลหะผสมดังกล่าวมีการใช้กันอย่างแพร่หลายในการผลิตเครื่องบิน ยานยนต์ เรือและเครื่องมือ ในเทคโนโลยีจรวดและในการก่อสร้าง ในรูปของโลหะบริสุทธิ์ อลูมิเนียมใช้สำหรับการผลิตสายไฟและอุปกรณ์เคมีต่างๆ
อลูมิเนียมยังใช้สำหรับการทำให้เป็นอะลูมิเนียม เช่น ทำให้พื้นผิวของเหล็กและผลิตภัณฑ์เหล็กหล่ออิ่มตัวด้วยอะลูมิเนียม เพื่อป้องกันการกัดกร่อน
ในทางปฏิบัติมักใช้เทอร์โม (ส่วนผสมของ Fe 3 O 4 ออกไซด์กับผงอลูมิเนียม) หากส่วนผสมนี้ติดไฟ (โดยใช้เทปแมกนีเซียม) จะเกิดปฏิกิริยารุนแรงกับการปล่อย จำนวนมากความร้อน:
8Al + 3Fe 3 O 4 ® 4Al 2 O 3 + 9Fe
กระบวนการนี้ใช้ในการเชื่อมที่เรียกว่าเทอร์ไมต์ รวมถึงการได้รับโลหะบางชนิดในรูปแบบอิสระ
ตอบคำถามข้อ 2-6 (น.138) แก้ปัญหา 1 - 2 (หน้า 138)
2.1.3 สารประกอบอะลูมิเนียมที่สำคัญที่สุด
อะลูมิเนียมออกไซด์
สามารถรับ Al 2 O 3 ได้ด้วยวิธีต่อไปนี้:
1. โดยการเผาไหม้โดยตรงของผงโลหะอลูมิเนียม (โดยการเป่าผงอลูมิเนียมลงในเปลวไฟ):
4Al + 3O 2 ® 2A1 2 O 3
2. โดยการแปลงตามโครงการด้านล่าง:
อะลูมิเนียมออกไซด์เป็นสารแข็ง ทนไฟ (อุณหภูมิ pl. 2050 ° C) สีขาว.
ตามคุณสมบัติทางเคมี มันคือแอมโฟเทอริกออกไซด์ (I, § 37) ทำปฏิกิริยากับกรด แสดงคุณสมบัติของออกไซด์พื้นฐาน:
A1 2 O 3 + 6HC1 2A1C1 3 + 3H 2 O
อัล 2 O 3 + 6H + + 6С1 - 2Al 3+ + 6С1 - + 3Н 2 O
A1 2 O 3 + 6H + 2A1 3+ + 3H 2 O
อะลูมิเนียมออกไซด์ทำปฏิกิริยากับด่างและแสดงคุณสมบัติของกรดออกไซด์ นอกจากนี้ ในระหว่างการหลอมรวม จะเกิดเกลือของกรดเมตาอะลูมินัม HA1O 2 ขึ้น กล่าวคือ เมตาอะลูมิเนต:
อัล 2 O 3 + 2NaOH 2NaA10 2 + H 2 0
ในที่ที่มีน้ำ ปฏิกิริยาจะแตกต่างกัน:
A1 2 O 3 + 2NaOH + H 2 O ® 2
เนื่องจากในสารละลายที่เป็นน้ำ โซเดียม อะลูมิเนต NaA1O 2 จะเกาะติดโมเลกุลของน้ำหนึ่งหรือสองโมเลกุล ซึ่งสามารถอธิบายได้ดังนี้
ก) NaA1O 2 -H 2 O หรือ NaH 2 A1O 3; b) NaA1O 2 -2H 2 O หรือ NaAl (OH) 4
อะลูมิเนียมไฮดรอกไซด์
อะลูมิเนียมไฮดรอกไซด์ A1 (OH) 3 ได้มาจากการทำปฏิกิริยากับสารละลายอัลคาไลกับสารละลายของเกลืออะลูมิเนียม (ไม่สามารถใช้สารละลายอัลคาไลเกินได้):
AlCl 3 + NaOH ® Al(OH) 3 ¯ + 3NaCl
A1 3+ + 3Cl - + 3Na + + 3OH - ® Al(OH) 3 ¯ + 3Na + + 3С1 -
อัล 3+ + 3OH - ® A1 (OH) 3 ¯
หากมวลของอะลูมิเนียมไฮดรอกไซด์ที่มีลักษณะคล้ายวุ้นสีขาวถูกแยกออกจากสารละลายและทำให้แห้ง จะได้สารผลึกสีขาวซึ่งแทบไม่ละลายในน้ำ
อะลูมิเนียมไฮดรอกไซด์ (เช่น ออกไซด์) มีคุณสมบัติแอมโฟเทอริก เช่นเดียวกับเบสทั้งหมด อะลูมิเนียมไฮดรอกไซด์ทำปฏิกิริยากับกรด เมื่ออะลูมิเนียมไฮดรอกไซด์หลอมรวมกับด่าง จะเกิดเมตาลูมิเนตและใน สารละลายน้ำ- ไฮเดรตของ metaaluminates:
А1(OH) 3 + NaOH NaA1O 2 + 2Н 2 O
A1 (OH) 3 + NaOH ® NaH 2 A1O 3 + H 2 O
เกลืออะลูมิเนียมได้มาจากปฏิกิริยาของอะลูมิเนียมที่เป็นโลหะกับกรดเป็นหลัก ตามคุณสมบัติทางกายภาพ สารเหล่านี้เป็นสารผลึกที่เป็นของแข็ง ละลายได้ง่ายในน้ำ คุณสมบัติทางเคมีของเกลืออะลูมิเนียมคล้ายกับเกลือชนิดอื่นๆ (, หน้า 98-99) เนื่องจากเกลืออะลูมิเนียมก่อตัวขึ้นจากเบสอ่อนและกรดแก่ พวกมันจึงถูกไฮโดรไลซิสในสารละลายที่เป็นน้ำ (หน้า 18)
ตอบคำถาม 7-10 (หน้า 138) แก้ปัญหาที่ 3 (หน้า 138)
ความสัมพันธ์ทางพันธุกรรมระหว่างอะลูมิเนียมกับสารประกอบที่สำคัญที่สุด (แบบที่ 20)
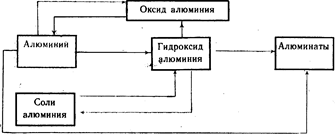
จากที่กล่าวมาสรุปได้ว่า หลักสูตรโรงเรียนมีเวลาไม่กี่ชั่วโมงในการศึกษาหัวข้อนี้ และนอกเหนือจากนี้ แทบไม่มีข้อมูลเกี่ยวกับแง่มุมด้านสิ่งแวดล้อมของหัวข้อนี้เลย
ไนโตรเจนก่อให้เกิดออกไซด์จำนวนหนึ่งที่สอดคล้องกับสถานะออกซิเดชันที่เป็นไปได้ทั้งหมดตั้งแต่ +1 ถึง +5: N 2 O, NO, N 2 O 3, NO 2, N 2 O 5 อย่างไรก็ตาม มีเพียงสองในนั้นเท่านั้นที่เป็นไนตริกออกไซด์ ( II) และออกไซด์ไนโตรเจน (IV) ไม่เพียงเสถียรภายใต้สภาวะปกติ แต่ยังมีส่วนร่วมอย่างแข็งขันในวัฏจักรไนโตรเจนทางธรรมชาติและทางอุตสาหกรรม
2.2.1 สารประกอบไนโตรเจนบางชนิดและคุณสมบัติของพวกมัน 1.2.1.1 ไนโตรเจนออกไซด์
N 2 +1 O - ไนตริกออกไซด์ (I), ไนตรัสออกไซด์, แก๊ส "หัวเราะ", ออกไซด์ที่ไม่ก่อให้เกิดเกลือ รับ N 2 O โดยการสลายตัวของแอมโมเนียมไนเตรต:
N 2 O มีกลิ่นหอมเล็กน้อยและมีรสหวาน ไม่ทำปฏิกิริยากับออกซิเจน น้ำ สารละลายของกรดและด่าง มันสลายตัวเป็นองค์ประกอบที่อุณหภูมิสูงกว่า 500 ° C กล่าวอีกนัยหนึ่งคือค่อนข้างเสถียร
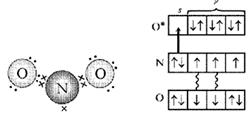
โครงสร้าง: ออกซิเจนมีอิเลคตรอน 2 ตัวที่ไม่มีคู่ ไนโตรเจนมี 3 ตัว - พันธะคู่ก่อตัวขึ้น และอิเล็กตรอนที่เหลืออีก 1 ตัวในส่วนที่เหลือ สามารถสันนิษฐานได้ว่าไม่มีโมเลกุลใดจะจับคู่และสร้างโมเลกุล ONNO แบบไดเมอร์ โครงสร้างโมเลกุล: โมเลกุลเชิงเส้น O=N=N โดยที่อะตอม N ตรงกลางเป็นเตตระวาเลนต์ มันสร้างพันธะคู่สองอัน: อันหนึ่งมีออกซิเจนตามแบบแผนทั่วไปสำหรับการสร้างพันธะโควาเลนต์ (อิเล็กตรอนไนโตรเจน 2 อิเล็กตรอน อิเล็กตรอนออกซิเจน 2 อะตอม) อีกอันที่มีอะตอมไนโตรเจน ด้วยเหตุนี้) หนึ่งในพันธะคือโควาเลนต์ส่วนที่สองคือผู้บริจาค - ผู้รับ (รูปที่ 1)
การติดตั้งสำหรับการผลิตไนตริกออกไซด์ (I) ประกอบด้วยชั้นวาง หลอดทดลอง ปลั๊กพร้อมท่อจ่ายแก๊ส เครื่องตกผลึก กระบอกสูบ และตะเกียงแอลกอฮอล์ (รูปที่ 2) วาง NH 4 NO 3 ลงในหลอดทดลอง ปิดด้วยจุกที่มีท่อจ่ายก๊าซและให้ความร้อน ก๊าซถูกรวบรวมในถังบรรจุน้ำ

ข้าว. 1. โมเลกุลของไนตริกออกไซด์ (I) - N 2 O
ออกไซด์ N 2 O สลายตัวเมื่อถูกความร้อน:
ออกไซด์ N 2 O ทำปฏิกิริยากับไฮโดรเจน:
N +2 O - ไนตริกออกไซด์ (II), ออกไซด์ที่ไม่ก่อให้เกิดเกลือ NO ได้มาจากปฏิกิริยาของทองแดงกับกรด HNO 3 (แตกต่าง) (รูปที่ 3)
คริสตัลเซลล์โมเลกุล; โมเลกุลนั้นเบาและมีขั้วอ่อน (อิเล็กโตรเนกาติวีตี้ของออกซิเจนสูงกว่าไนโตรเจนเล็กน้อย) สามารถสันนิษฐานได้ว่าจุดหลอมเหลวและจุดเดือดจะต่ำ แต่สูงกว่าจุดของไนโตรเจน เนื่องจากขั้วของโมเลกุลทำให้สามารถเชื่อมต่อแรงดึงดูดของไฟฟ้าสถิตกับแรงระหว่างโมเลกุลอย่างง่ายได้ การก่อตัวของไดเมอร์ยังช่วยเพิ่มจุดเดือด โครงสร้างของโมเลกุลยังแสดงให้เห็นความสามารถในการละลายน้ำต่ำ ไนตริกออกไซด์ (II) ไม่มีสีและไม่มีกลิ่น
เพื่อให้ได้ไนตริกออกไซด์ (II) จะมีการใส่ขี้กบทองแดงสองสามอันลงในหลอดทดลองและเทกรดไนตริกเจือจางลงไป ปิดหลอดทดลองด้วยจุกที่มีท่อจ่ายก๊าซและยึดเข้ากับขาตั้ง ปลายท่อระบายแก๊สถูกหย่อนลงในแม่พิมพ์ด้วยน้ำแล้วจึงเข้าไปในกระบอกสูบ (รูปที่ 3) เมื่อถูกความร้อน NO จะถูกปล่อยออกมา NO ถูกออกซิไดซ์ได้ง่ายโดยออกซิเจนในอากาศ เช่น ทำหน้าที่เป็นตัวรีดิวซ์:
![]()
ในการทำปฏิกิริยากับ แก๊สเปรี้ยวออกไซด์ NO - ตัวออกซิไดซ์:
![]()
N +2 2 O 3 - ไนตริกออกไซด์ (III), ไนตรัสแอนไฮไดรด์ (สอดคล้องกับกรดไนตรัส HNO 2 และเกลือไนไตรต์); มันเป็นกรดออกไซด์มีคุณสมบัติทั้งหมดของกรดออกไซด์ รับออกไซด์ N 2 O 3 โดยปฏิกิริยา:
NO 2 + NO N 2 O 3
N +4 O 2 - ไนตริกออกไซด์ (IV), ไนโตรเจนไดออกไซด์, ก๊าซสีน้ำตาล (เป็นพิษ)
พิจารณาอิเล็กตรอนไนโตรเจนในโมเลกุล NO นี่คืออิเล็กตรอนแบบไม่มีคู่ อิเล็กตรอนอิสระ และอิเล็กตรอนอีก 2 ตัวที่ผูกมัดกับออกซิเจน รวมเป็น 5 ตัว และอะตอมของออกซิเจน "สัมผัสกัน" มีอิเล็กตรอน 6 ตัวใน 4 ออร์บิทัล หากคุณจัดเรียงพวกมันทีละตัว หนึ่งออร์บิทัลจะยังคงว่างอยู่ เป็นพื้นที่นี้ที่ครอบครองโดยอิเล็กตรอนคู่หนึ่งของอะตอมไนโตรเจน (รูปที่ 4, 5)
ข้าว. 4. โครงการ โครงสร้างอิเล็กทรอนิกส์ NO 2 โมเลกุล (ตัวเลือกแรก) (จุดแสดงถึงอิเล็กตรอนของอะตอม O เครื่องหมายกากบาทแสดงถึงอิเล็กตรอนของอะตอม N)
ข้าว. 5. แผนผังโครงสร้างอิเล็กทรอนิกส์ของโมเลกุล NO 2 (รุ่นที่สอง) (เครื่องหมายดอกจันแสดงถึงอะตอม O ที่ถูกกระตุ้น ลูกศรแสดงถึงพันธะของผู้บริจาค-ผู้รับ
เนื่องจากอิเล็กตรอนคู่หนึ่งที่อยู่ใน s-orbital "ได้เชื่อมต่อ" มันจึงต้องผ่านการผสมข้ามพันธุ์ คำถามเกิดขึ้น: อะตอมใช้การผสมพันธุ์แบบใด? คำตอบ: ออร์บิทัลอิเล็กทรอนิกส์ของไนโตรเจนสามออร์บิทัลอยู่ในสถานะของการผสมแบบ sp 2 โมเลกุล NO 2 เป็นเชิงมุม มุมคือ 134° (มุมนั้นมากกว่า 120° เนื่องจากอิเล็กตรอน 1 ตัวขับไล่อิเล็กตรอนจากพันธะที่อ่อนแอกว่าอิเล็กตรอนคู่หนึ่ง) (รูปที่ 6, 7)
โครงตาข่ายคริสตัลเป็นโมเลกุล อย่างไรก็ตาม เนื่องจากตัวโมเลกุลเองนั้นหนักกว่า NO และแนวโน้มที่จะทำให้เกิดไดเมอไรเซชันสูงขึ้นอย่างเห็นได้ชัด สารนี้ควรละลายและเดือดที่อุณหภูมิสูงขึ้นอย่างเห็นได้ชัด จุดเดือดคือ 21 ° C ดังนั้นภายใต้สภาวะปกติ - 20 ° C และ 760 mm Hg ศิลปะ. – ของเหลวไนตริกออกไซด์ (IV)
ไนตริกออกไซด์ (IV) ละลายในน้ำ ทำปฏิกิริยากับมันพร้อมกัน และในกรณีนี้ จะได้กรดสองชนิดในคราวเดียว


ข้าว. 6. NO 2 โมเลกุล - มุมมองด้านบน
ข้าว. 7. NO 2 โมเลกุล - มุมมองด้านข้างจากด้านข้างของพันธะผู้บริจาค - ผู้รับ (อะตอมออกซิเจนที่สองไม่สามารถมองเห็นได้เกินออร์บิทัลของอะตอมไนโตรเจน วงกลมที่แรเงาคือออร์บิทัลของอะตอมแบบผสมที่ชี้ไปทางเครื่องอ่าน)
ไนตริกออกไซด์ (IV) มีทั้งกลิ่นฉุนเฉพาะตัวและสีน้ำตาลแดง ซึ่งเฉดสีจะแตกต่างกันไปตามความเข้มข้น สำหรับสีนี้เองที่การปล่อยไนโตรเจนออกไซด์สู่ชั้นบรรยากาศเรียกว่า "หางจิ้งจอก"
NO 2 ปฏิกิริยาออกไซด์
1) ด้วยน้ำ:
2NO 2 + H 2 O \u003d HNO 3 + HNO 2
2) ด้วยด่าง:
2NO 2 + 2NaOH \u003d NaNO 3 + NaNO 2 + H 2 O
3) Dimerization เมื่อทำความเย็น:
![]()
ที่อุณหภูมิ -11 °C สมดุลจะถูกเลื่อนไปทางขวาโดยสมบูรณ์ และที่ +140 °C สมดุลจะเลื่อนไปทางซ้ายโดยสมบูรณ์
N +5 2 O 5 - ไนตริกออกไซด์ (V), ไนตริกแอนไฮไดรด์, กรดออกไซด์, ตัวออกซิไดซ์ที่แรง ออกไซด์ N 2 O 5 สลายตัวได้ง่าย:
2N 2 O 5 \u003d 4NO 2 + O 2
2.2.1.2 กรดไนตริก
ของไนโตรเจนไฮดรอกไซด์เราจะพิจารณากรดไนตริกที่มีหลายน้ำหนักมากที่สุด
โมเลกุลของกรดไนตริกมีขั้ว (เนื่องจากสภาพอิเล็กโตรเนกาติวีตี้ที่แตกต่างกันของออกซิเจนและไฮโดรเจน เนื่องจากไนโตรเจนซ่อนอยู่ภายในโมเลกุลอย่างที่เป็นอยู่) และไม่สมมาตร ทั้งสามมุมอยู่ในนั้นระหว่างพันธะของไนโตรเจนและออกซิเจนนั้นแตกต่างกัน สถานะออกซิเดชันอย่างเป็นทางการของไนโตรเจนมีค่าสูงสุด (+5) แต่ในขณะเดียวกัน อะตอมไนโตรเจนกับอะตอมอื่นมีพันธะเพียง 4 พันธะ - ความจุของไนโตรเจนคือ 4
โครงสร้างของโมเลกุลจะเข้าใจได้ง่ายขึ้นหากเราพิจารณาถึงกระบวนการได้มาซึ่งโมเลกุลนั้น กรดไนตริกได้มาจากปฏิกิริยาของไนตริกออกไซด์ (IV) กับน้ำ (ในที่ที่มีออกซิเจน): โมเลกุล NO 2 สองตัวพร้อมกัน "โจมตี" โมเลกุลของน้ำด้วยอิเล็กตรอนที่ไม่คู่กัน เป็นผลให้พันธะระหว่างไฮโดรเจนและออกซิเจนคือ ไม่แตกตามปกติ (อิเล็กตรอนคู่หนึ่งในออกซิเจนและ "โปรตอนเปล่า") และโมเลกุล NO 2 ตัวหนึ่งได้รับไฮโดรเจนพร้อมกับอิเล็กตรอน อีกตัวหนึ่ง - อนุมูล OH (รูปที่ 8) กรดทั้งสองก่อตัวขึ้น: กรดทั้งสองมีความแรง โดยทั้งสองจะบริจาคโปรตอนของพวกมันอย่างรวดเร็วไปยังโมเลกุลของน้ำที่ใกล้ที่สุด และสุดท้ายยังคงอยู่ในรูปของไอออน NO 2 และ NO 3 ไอออน NO 2 ไม่เสถียร โมเลกุล HNO 2 สองโมเลกุลสลายตัวเป็นน้ำ NO 2 และ NO NO ออกไซด์ทำปฏิกิริยากับออกซิเจน กลายเป็น NO 2 ไปเรื่อยๆ จนกว่าจะได้กรดไนตริกเท่านั้น
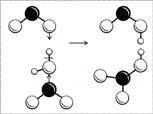
ข้าว. 8. แผนผังการก่อตัวของโมเลกุลของกรดไนตริกและไนตรัส (ลูกบอลสีดำคืออะตอม N ลูกบอลสีขาวขนาดใหญ่คืออะตอม O ลูกบอลสีขาวขนาดเล็กคืออะตอม H)
อย่างเป็นทางการ ปรากฎว่าอะตอมไนโตรเจนจับกับอะตอมออกซิเจนหนึ่งอะตอมด้วยพันธะคู่ และอีกพันธะหนึ่งผูกมัดด้วยพันธะเดี่ยวธรรมดา (อะตอมออกซิเจนนี้จับกับอะตอมไฮโดรเจนด้วย) ไนโตรเจนใน HNO 3 เชื่อมโยงกับออกซิเจนอะตอมที่สามโดยพันธะของผู้ให้-ผู้รับ โดยมีอะตอมไนโตรเจนทำหน้าที่เป็นผู้ให้ การผสมพันธุ์ของอะตอมไนโตรเจนในกรณีนี้ควรเป็น sp 2 เนื่องจากมีพันธะคู่ซึ่งกำหนดโครงสร้าง - สามเหลี่ยมแบน ในความเป็นจริง ปรากฎว่าชิ้นส่วนของอะตอมไนโตรเจนและออกซิเจนสามอะตอมเป็นสามเหลี่ยมแบน เฉพาะในโมเลกุลกรดไนตริกรูปสามเหลี่ยมนี้ไม่ถูกต้อง - มุม ONO ทั้งสามมุมต่างกัน ดังนั้นด้านต่างๆ ของรูปสามเหลี่ยม เมื่อโมเลกุลแยกตัวออก สามเหลี่ยมจะกลายเป็นรูปสามเหลี่ยมด้านเท่า ซึ่งหมายความว่าอะตอมของออกซิเจนในนั้นจะมีค่าเท่ากัน การเชื่อมต่อทั้งหมดจะเหมือนกัน
คุณสมบัติทางกายภาพของกรดไนตริก
สารประกอบที่แตกตัวเป็นไอออน แม้ว่าเพียงบางส่วนเท่านั้น แต่ก็แปลงเป็นก๊าซได้ยาก ดังนั้นจุดเดือดควรสูงเพียงพอ แต่ด้วยน้ำหนักโมเลกุลที่น้อย จุดหลอมเหลวไม่ควรสูง ดังนั้น สถานะของการรวมกลุ่มที่ 20°C จึงเป็นของเหลว สำหรับความสามารถในการละลาย เช่นเดียวกับของเหลวที่มีขั้วอื่นๆ กรดไนตริกสามารถผสมกับน้ำได้อย่างง่ายดายในทุกอัตราส่วน กรดไนตริกบริสุทธิ์ไม่มีสีและไม่มีกลิ่น อย่างไรก็ตาม เนื่องจากการสลายตัวเป็นออกซิเจนและไนตริกออกไซด์ (IV) ซึ่งละลายอยู่ในนั้น เราสามารถพูดได้ว่ากรดไนตริกเข้มข้นธรรมดามีสีเหลืองน้ำตาลและมีกลิ่นฉุนของ NO 2 เรามาดูกันว่าโครงสร้างของโมเลกุลกรดไนตริกส่งผลต่อคุณสมบัติทางเคมีอย่างไร
HNO 3 เป็นสารออกซิไดซ์ที่แรง
เมื่อ HNO 3 ทำปฏิกิริยากับโลหะ (M) ไฮโดรเจนจะไม่ถูกปล่อยออกมา:
M + HNO 3 ® เกลือ + น้ำ + แก๊ส
ส่วนผสมของ HNO 3 (conc.) กับ HCl (conc.) ในอัตราส่วนปริมาตร 1:3 (1V HNO 3 + 3V HCl) เรียกว่า "aqua regia"
Au + HNO 3 + 3HCl = AuCl 3 + NO + 2H 2 O.
กรดไนตริกไม่ทำปฏิกิริยากับกรดอื่น ๆ ในรูปของปฏิกิริยาการแลกเปลี่ยนหรือปฏิกิริยาสารประกอบ อย่างไรก็ตาม มันค่อนข้างสามารถทำปฏิกิริยาได้ในฐานะตัวออกซิไดซ์ที่แรง ในส่วนผสมของกรดไนตริกและกรดไฮโดรคลอริกเข้มข้น ปฏิกิริยาย้อนกลับสาระสำคัญซึ่งสามารถสรุปได้โดยสมการ:
คลอรีนของอะตอมที่เป็นผลลัพธ์จะทำงานได้มากและดึงอิเล็กตรอนจากอะตอมของโลหะได้อย่างง่ายดาย และคลอไรด์ไอออนจะสร้างไอออนเชิงซ้อนที่เสถียรพร้อมกับไอออนของโลหะที่เป็นผลลัพธ์ ทั้งหมดนี้ทำให้สามารถโอนแม้แต่ทองคำไปเป็นสารละลายได้ เข้มข้น H 2 SO 4 เป็นสารขจัดน้ำออกอย่างแรงส่งเสริมการสลายตัวของกรดไนตริกเป็นไนตริกออกไซด์ (IV) และออกซิเจน กรดไนตริกเป็นกรดอนินทรีย์ที่แรงชนิดหนึ่งและทำปฏิกิริยากับด่างตามธรรมชาติ นอกจากนี้ยังทำปฏิกิริยากับไฮดรอกไซด์ที่ไม่ละลายน้ำและออกไซด์พื้นฐาน
เมื่อศึกษาหัวข้อ “ไนโตรเจน สารประกอบไนโตรเจน” ใช้ตำราเคมีที่แก้ไขโดย G.E. Rudzitis, F.G. Feldman ซึ่งเป็นหนังสือเรียนสำหรับชั้นประถมศึกษาปีที่ 9 เช่นกัน แก้ไขโดย N.S. อัคเมตอฟ สื่อการสอนทำหน้าที่เป็นหนังสือเคมีสำหรับเกรด 8-9 แก้ไขโดย A. M. Radetsky, V. P. Gorshkov; ใช้สำหรับงานอิสระในวิชาเคมีสำหรับเกรด 9 แก้ไขโดย R.P. Surovtseva, S.V. โซโฟรโนวา; ชุดของปัญหาในวิชาเคมีใช้สำหรับ มัธยมและสำหรับผู้สมัครเข้ามหาวิทยาลัย เรียบเรียงโดย จี.พี. Khomchenko, I.G. โคมเชนโก. จัดสรรเวลา 7 ชั่วโมงสำหรับการศึกษาหัวข้อนี้
บทที่ 3 ความสัมพันธ์ระหว่างวิชาเมื่อศึกษากลุ่ม III และ V ของ D.I.
โบรอนไม่เคยพบในธรรมชาติในสภาวะอิสระ แต่กลับกลายเป็นว่าเกี่ยวข้องกับออกซิเจนเสมอ ในรูปแบบนี้มีอยู่ในกรดบอริก H 3 BO 3 ซึ่งพบได้ในน้ำพุร้อนในบริเวณภูเขาไฟ นอกจากนี้เกลือบอริกจำนวนมากยังพบได้ทั่วไปในธรรมชาติ เกลือเหล่านี้เป็นที่รู้จักกันดีที่สุดคือบอแรกซ์หรือทินคัล Na 2 B 4 O 7 . 10H 2 O. Boracite 2Mg 3 B 8 O 15 มีความสำคัญทางเทคนิค MgCl 2, pandermite Ca 2 B 6 O 11 3H 2 O, โคลแมไนต์ Ca 2 B 6 O 11 5H 2 O, kernite นา 2 B 4 O 7. 4H 2 O.
จำเป็นต้องระบุแร่ธาตุต่อไปนี้ซึ่งเป็นอนุพันธ์ของกรดบอริก: borocalsite CaB 4 O 7 4H 2 O, โบรอน-นาโทรแคลไซต์ NaCaB 5 O 9 6H 2 O, ไฮโดรบอราไซต์ MgCaB 6 O 11 6H 2 O, โบโรแมกนีไซต์ 2Mg 5 B 4 O 11 5H 2 O, singalite MgAlBO 4 และอื่นๆ
3.1.1.2 บทบาททางชีวเคมี
โบรอนและสารประกอบของโบรอนมี สำคัญมากใน เศรษฐกิจของประเทศ. ไอโซโทป 5 10 B ซึ่งดูดซับนิวตรอน ใช้ในเทคโนโลยีนิวเคลียร์เพื่อชะลอปฏิกิริยาลูกโซ่นิวเคลียร์ บอแรกซ์และกรดบอริกถูกนำมาใช้เป็นยาฆ่าเชื้อมานานแล้ว
กิจกรรมทางสรีรวิทยาและชีวภาพของโบรอนนั้นสูงมาก โบรอนสามารถมีอิทธิพล กระบวนการที่สำคัญชีวเคมีของสัตว์และพืช เมื่อใช้ร่วมกับ Mn, Cu, Zn และ Mo โบรอนเป็นหนึ่งในห้าธาตุที่จำเป็น โบรอนมีความเข้มข้นในกระดูกและฟัน ในกล้ามเนื้อ ในไขกระดูก ตับ และต่อมไทรอยด์ มีแนวโน้มว่าจะเร่งการเจริญเติบโตและการพัฒนาของสิ่งมีชีวิต เห็นได้จากผลของโบรอนต่อพืช ด้วยความอดอยากโบรอน ผลผลิตและโดยเฉพาะอย่างยิ่งจำนวนเมล็ดจะลดลงอย่างมาก สำหรับชีวิตของสัตว์นั้น สิ่งสำคัญคือต้องหามันในนม (วัว) และในไข่แดง ไข่ไก่. พืชบางชนิด (หญ้าอาหารสัตว์และหัวบีทน้ำตาล) เก็บโบรอนหลายกรัมต่อเฮกตาร์ของที่ดิน โบรอนพบได้ในปริมาณมากในเนื้อเยื่อไขมันของสัตว์บางชนิดที่เล็มหญ้าบนทุ่งหญ้าที่อุดมด้วยโบรอน ไม่ทราบองค์ประกอบของสารประกอบโบรอนในร่างกาย เป็นที่ยอมรับแล้วว่าโบรอนยับยั้งอะไมเลสในลำไส้และโปรตีเอสในลำไส้เพิ่มการทำงานของอินซูลินและยับยั้งการเกิดออกซิเดชันของอะดรีนาลีนทำให้วิตามินบี 2 และบี 12 อ่อนแอลง ด้วยโบรอนที่มากเกินไปจะทำให้เกิดโรคลำไส้อักเสบจากเชื้อบอริก ปริมาณโบรอนที่มากเกินไปทำให้เกิดโรคพืช ข้าวสาลีและข้าวโอ๊ตต้องทนทุกข์ทรมานเมื่อมีดิน 0.7 - 0.8 มก. / กก. การต่อสู้กับความเค็มของดินด้วยโบรอนนั้นดำเนินการโดยการล้างดินบอริก
และรากฐานการสอนขององค์กรการศึกษาทำให้สามารถอธิบายเนื้อหาที่กำลังศึกษาในบทเรียนฟิสิกส์ได้ง่ายขึ้นเมื่อศึกษาหัวข้อ "พื้นฐานของไฟฟ้าไดนามิก" การวิเคราะห์ เทคโนโลยีต่างๆทำให้สามารถร่างเทคโนโลยีของผู้เขียนเพื่อพัฒนาความสนใจของนักเรียนในการสื่อสารแบบโต้ตอบในรูปแบบกลุ่มของการศึกษา จากความแม่นยำของกระบวนการเรียนรู้จะถูกสร้างขึ้นเมื่อใช้ ...
ด้วยเหตุนี้ จึงจำเป็นต้องพิจารณาประเด็นความสัมพันธ์ระหว่างโมเลกุลฟิสิกส์และเคมีในหลักสูตรระดับมัธยมศึกษา ในการศึกษาโมเลกุลฟิสิกส์ ความสัมพันธ์กับเคมีแสดงออกในสองทิศทางหลัก ประการแรกคือการใช้ความรู้ของนักเรียนที่ได้รับในกระบวนการศึกษาเคมีเป็นสื่อในการพิสูจน์บทบัญญัติหลักของฟิสิกส์ระดับโมเลกุล ที่สอง...
วัตถุประสงค์ของบทเรียน:
อธิบายอะลูมิเนียมตามตำแหน่งในตารางธาตุของธาตุเคมี
ตามโครงสร้างของอะตอม ให้พิจารณาคุณสมบัติทางกายภาพและทางเคมีของอะตอม
ทำความคุ้นเคยกับวิธีอุตสาหกรรมในการผลิตอลูมิเนียมและระบุขอบเขตการใช้งาน

จากประวัติการค้นพบอลูมิเนียม ... "เงินจากดินเหนียว"
ระหว่างการค้นพบอะลูมิเนียม โลหะนี้มีราคาแพงกว่าทองคำ ชาวอังกฤษต้องการให้เกียรตินักเคมีชาวรัสเซียผู้ยิ่งใหญ่ด้วยของกำนัลมากมาย
D.I. Mendeleev นำเสนอสมดุลทางเคมีแก่เขาโดยในถ้วยหนึ่งทำจากทองคำและอีกถ้วยเป็นอลูมิเนียม ถ้วยอลูมิเนียมมีราคาแพงกว่าทองคำ ผลลัพธ์ที่ได้คือ "เงินจากดินเหนียว" ไม่เพียงแต่สนใจนักวิทยาศาสตร์เท่านั้น แต่ยังรวมถึงนักอุตสาหกรรมและแม้แต่จักรพรรดิแห่งฝรั่งเศสด้วย


การประยุกต์ใช้อลูมิเนียม






อุตสาหกรรมการทหาร

การก่อสร้าง

หาอลูมิเนียมในธรรมชาติ
สารประกอบอะลูมิเนียมธรรมชาติ
ภารกิจที่สอง พิจารณาตัวอย่างสารประกอบธรรมชาติ เปรียบเทียบในแง่ของความแข็ง ความแข็งแรง สี คำนวณปริมาณอัลในบางส่วน
Nephelines-KNa34
- อลูมินา (ส่วนผสมของดินขาวกับทราย SiO2, หินปูน CaCO3, แมกนีเซียม MgCO3)
- คอรันดัม (ไพลิน, ทับทิม, มรกต) - Al2O3
- เฟลด์สปาร์ - (K, Na)2O Al2O3 6SiO2, Ca
- ดินขาว - Al2O3 2SiO2 2H2O
- Beryl (มรกต, พลอยสีฟ้า) - 3BeO Al2O3 6SiO2

คุณสมบัติทางกายภาพของอะลูมิเนียม งานห้องปฏิบัติการ.
บัตรคำแนะนำ
2. กำหนดสถานะของการรวมตัวของอลูมิเนียม
3. จานสีอะไร?
4. ตรวจสอบว่าจานนี้มีความมันวาวหรือไม่?
5. จุ่มบันทึกความยาว ¼ ลงในแก้วน้ำร้อนประมาณ 10-15 วินาที
นำจานขึ้นจากน้ำ เช็ดด้วยผ้าเช็ดปาก และตรวจสอบว่าอะลูมิเนียมมีค่าการนำความร้อนหรือไม่
6. จับอลูมิเนียมฟอยล์ ตรวจสอบว่าอลูมิเนียมมีความเหนียวหรือไม่? มันเป็นโลหะเบาหรือไม่?
7. วางแผ่นอลูมิเนียมในแก้วน้ำเย็น พลิกหลาย ๆ ครั้ง มีการสังเกตการละลายของอลูมิเนียมหรือไม่?
8. จดข้อสังเกตของคุณสั้น ๆ ตามแผน:
- สถานะของการรวมตัว
- สี,
- ส่องแสง,
- การนำความร้อน
- ความเป็นพลาสติก
- การละลายในน้ำ.


งานห้องปฏิบัติการ: "คุณสมบัติทางเคมีของอะลูมิเนียม".
บัตรคำแนะนำ
1. ใช้หลอดทดลองสองหลอด ใส่อลูมิเนียมชิ้นละชิ้น เทสารละลายกรดไฮโดรคลอริก 1-2 มล. ลงในอันใดอันหนึ่ง และเทสารละลายกรดซัลฟิวริกในปริมาณเท่ากันอีกอันหนึ่ง คุณกำลังดูอะไร? อุ่นหลอดทดลองเล็กน้อย เขียนสมการของปฏิกิริยาที่สอดคล้องกัน
2. ใส่อลูมิเนียมชิ้นหนึ่งลงในหลอดทดลอง เติมกรดซัลฟิวริกเข้มข้น 1.5 มล. คุณกำลังดูอะไร? เขียนสมการปฏิกิริยา.
3. วางชิ้นอะลูมิเนียมลงในหลอดทดลองแล้วเติมสารละลายอัลคาไล อุ่นเนื้อหาของหลอดทดลอง เกิดอะไรขึ้น? เขียนสมการปฏิกิริยา.
4. ใส่ผลงานที่ทำในตาราง:


การได้มาซึ่งอะลูมิเนียมในอุตสาหกรรม

ทดสอบ
1. การกำหนดค่าทางอิเล็กทรอนิกส์ของอะตอมอลูมิเนียมคืออะไร?
ก) 1s22s22p1 ข) 1s22s22p3
ข) 1s22s22p63s23p1 ง) 1s22s22p63s23p63d14s2
2. อลูมิเนียมทำปฏิกิริยากับสารใดต่อไปนี้
A) CaO B) HCl
B) Cl2 D) NaOH
3. โลหะใดที่ระบุมีการใช้งานมากกว่า
กว่าอลูมิเนียม?
A) Na B) Cu
B) Ca D) Fe
4. สถานะออกซิเดชันของอลูมิเนียมที่มีลักษณะเฉพาะมากที่สุด:
A) +1 B) +2
ค) +3 ง) +4
5. อลูมิเนียมในปฏิกิริยาเคมีมีคุณสมบัติดังต่อไปนี้:
A) ตัวออกซิไดซ์ B) สารประกอบเฉื่อย
C) ตัวรีดิวซ์ D) ตัวออกซิไดซ์และตัวรีดิวซ์
6. ในอุตสาหกรรม ได้รับอลูมิเนียม:
ก) ใช้โลหะโซเดียมเป็นตัวรีดิวซ์
B) อิเล็กโทรไลซิสของอะลูมิเนียมออกไซด์หลอมเหลว
C) โดยใช้คาร์บอนมอนอกไซด์ (P) เป็นตัวรีดิวซ์
D) อิเล็กโทรไลซิสของสารละลายของเกลืออลูมิเนียม



