Определение
Да бъдеш сред природата
Метални свойства
Характерни свойства метали
Физически свойства метали
Химични свойстваметали
Микроскопска структура
алкални метали
Обща характеристика на алкалните метали
Химични свойства на алкалните метали
Получаване на алкални метали
Хидроксиди
Карбонати
Рубидий
алкалоземни метали
калций
Стронций
преходни метали
Обща характеристика на преходните елементи
Приложение на метали
Строителни материали
Електрически материали
Инструментални материали
История
Минен металургия
Металът е(името идва от латинското metallum - мина) - група елементи с характерни метални свойства, като висока топло- и електропроводимост, положителен температурен коефициент на съпротивление, висока пластичност и др. Около 70% от всички химически елементи.
Метал (Метал) е











![]()





















![]()


![]()





Да бъдеш сред природата
Повечето от металите присъстват в природата под формата на руди и съединения. Те образуват оксиди, сулфиди, карбонати и др химични съединения. За получаване на чисти метали и тяхното по-нататъшно използване е необходимо да се отделят от рудите и да се извърши пречистване. При необходимост се извършва легиране и друга обработка на металите. Науката изучава това. металургия. Металургията разграничава рудите на черни метали (на базата на жлеза) и цветни (не включват желязо, общо около 70 елемента). , и платината също са скъпоценни метали. Освен това те присъстват в малки количества в морската вода, растенията, живите организми (като играят важна роля).
Известно е, че 3% от човешкото тяло се състои от метали. Най-много в нашите клетки има калций и натрий, концентрирани в лимфните системи. Магнезият се съхранява в мускулите и нервна система, медв черния дроб, в кръвта.
Метални свойства
Метал (Метал) е
Характерни свойства на металите
Метален блясък (с изключение на йод и въглерод под формата на графит. Въпреки металния си блясък кристалният йод и графитът са неметали.)
Добра електропроводимост (с изключение на въглерод).
Възможност за лека машинна обработка.
Висока плътност (обикновено металите са по-тежки от неметалите.)
Висока точка на топене (изключения: живак, галий и алкални метали.)
Голяма топлопроводимост
В реакциите те винаги са редуциращи агенти.
Физични свойства на металите
Всички метали (с изключение на живака и условно) са в твърдо състояние при нормални условия, но имат различна твърдост. Така че алкалните метали лесно се режат с кухненски нож, а метали като ванадий, волфрам и хром лесно надраскат най-твърдото и стъклото. По-долу е дадена твърдостта на някои метали по скалата на Моос.
Точките на топене варират от -39°C (живак) до 3410°C (волфрам). Точката на топене на повечето метали (с изключение на основите) е висока, но някои "нормални" метали, като напр. калайи водя, може да се разтопи на обикновена електрическа или газова печка.
В зависимост от плътността металите се делят на леки (плътност 0,53 h 5 g/cm³) и тежки (5 h 22,5 g/cm³). Най-лекият метал е литият (плътност 0,53 g/cm³). Понастоящем е невъзможно да се назове най-тежкият метал, тъй като плътностите на осмий и иридий - двата най-тежки метала - са почти еднакви (около 22,6 g / cm3 - точно два пъти плътността водя), и е изключително трудно да се изчисли точната им плътност: за това трябва да пречистите напълно металите, тъй като всякакви примеси намаляват тяхната плътност.
Повечето метали са пластични, което означава, че металната жица може да се огъне, без да се счупи. Това се дължи на разместването на слоевете от метални атоми без прекъсване на връзката между тях. Най-пластмасовите са злато, среброи мед. от златоМоже да се изработи фолио с дебелина 0,003 мм, което се използва за позлатяване на търговски артикули. Не всички метали обаче са пластмаса. Тел от цинкили калайкоремни преси при навеждане; манганът и бисмутът изобщо не се огъват по време на деформация, но веднага се счупват. Пластичността зависи и от чистотата на метала; По този начин много чистият хром е много пластичен, но замърсен дори с незначителни примеси, той става чуплив и по-твърд.
Всички метали водят добре електричество; това се дължи на наличието в техните кристални решетки на подвижни електрони, движещи се под действието на електрическо поле. Сребро, мед и алуминийимат най-висока електропроводимост; поради тази причина последните два метала най-често се използват като материал за жици. Натрият също има много висока електрическа проводимост; известни са опити за използване на натриеви проводници под формата на тънкостенни тръби от неръждаема стомана, пълни с натрий в експериментално оборудване. Поради ниското специфично тегло на натрия, при еднакво съпротивление, натриевите "жици" са много по-леки от медните и дори малко по-леки от алуминиевите.
Високата топлопроводимост на металите зависи и от подвижността на свободните електрони. Следователно серията от топлопроводимости е подобна на серията от електрическа проводимост и е най-добрият проводник на топлина, като електричеството. Натрият намира приложение и като добър проводник на топлина; Широко известно е например използването на натрий в клапаните на автомобилните двигатели за подобряване на тяхното охлаждане.
Гладката повърхност на металите отразява много светлина - това явление се нарича метален блясък. В прахообразно състояние обаче повечето метали губят блясъка си; алуминийи магнезият обаче запазват блясъка си на прах. Среброто отразява най-добре светлината и от тези метали се правят огледала. Родият понякога се използва и за направата на огледала, въпреки изключително високата си цена: поради много по-голямата си твърдост и химическа устойчивост от среброто или дори от паладия, родиевият слой може да бъде много по-тънък от среброто.
Цветът на повечето метали е приблизително еднакъв - светлосив със синкав оттенък. , мед и цезий, съответно, жълто, червено и светложълто.
Химични свойства на металите
Метал (Метал) е
На външния електронен слой повечето метали имат малък брой електрони (1-3), така че в повечето реакции те действат като редуциращи агенти (т.е. „отдават“ своите електрони)
1. Реакции с прости вещества
Всички метали реагират с кислород с изключение на златото и платината. Реакцията със сребро протича при високи температури, но сребърен (II) оксид практически не се образува, тъй като е термично нестабилен. В зависимост от метала, изходът може да бъде оксиди, пероксиди, супероксиди:
4Li + O2 = 2Li2O литиев оксид
2Na + O2 = Na2O2 натриев пероксид
K + O2 = KO2 калиев супероксид
За да се получи оксид от пероксид, пероксидът се редуцира с метал:
Na2O2 + 2Na = 2Na2O
При средно и ниско активни метали реакцията протича при нагряване:
3Fe + 2O2 = Fe3O4
Само най-активните метали реагират с азот, само литий взаимодейства при стайна температура, образувайки нитриди:
6Li + N2 = 2Li3N
При нагряване:
3Ca + N2 = Ca3N2
Всички метали реагират със сярата с изключение на златото и платина:
Желязото взаимодейства с сивопри нагряване, образувайки сулфид:
Само най-активните метали реагират с водород, т.е. метали от групи IA и IIA, с изключение на Be. Реакциите протичат при нагряване и се образуват хидриди. В реакциите металът действа като редуциращ агент, степента на окисление на водорода е -1:
Само най-активните метали реагират с въглерода. В този случай се образуват ацетилениди или метаниди. Ацетилидите реагират с вода, за да дадат ацетилен, метанидите дават метан.
2Na + 2C = Na2C2
Na2C2 + 2H2O = 2NaOH + C2H2
Легирането е въвеждането на допълнителни елементи в стопилката, които променят механичните, физичните и химичните свойства на основния материал.

Микроскопска структура
Характерните свойства на металите могат да бъдат разбрани от техните вътрешна структура. Всички те имат слаба връзка на електроните от външното енергийно ниво (с други думи валентни електрони) с ядрото. Поради това потенциалната разлика, създадена в проводника, води до лавинообразно движение на електрони (наречени електрони на проводимост) в кристалната решетка. Колекция от такива електрони често се нарича електронен газ. В допълнение към електроните, приносът към топлопроводимостта се прави от фонони (трептения на решетката). Пластичността се дължи на малка енергийна бариера за движението на дислокациите и изместването на кристалографските равнини. Твърдостта може да се обясни с голям брой структурни дефекти (интерстициални атоми и др.).
Поради лесното връщане на електрони е възможно окисляване на металите, което може да доведе до корозия и допълнително влошаване на свойствата. Способността да се окислява може да се намери от стандартен редметална дейност. Този факт потвърждава необходимостта от използване на метали в комбинация с други елементи (сплав, най-важният от които е стомана), тяхното легиране и използването на различни покрития.
За по-правилно описание електронни свойстваметалите е необходимо да се използва квантовата механика. Във всички твърди тела с достатъчна симетрия енергийните нива на електроните на отделните атоми се припокриват и образуват разрешени ленти, а лентата, образувана от валентни електрони, се нарича валентна зона. Слабата връзка на валентните електрони в металите води до факта, че валентната лента в металите се оказва много широка и всички валентни електрони не са достатъчни, за да я запълнят напълно.
Основната характеристика на такава частично запълнена лента е, че дори при минимално приложено напрежение, пренареждането на валентните електрони започва в пробата, т.е. протича електрически ток.
Същата висока мобилност на електроните води до висока топлопроводимост, както и до способността за огледално отразяване електромагнитно излъчване(което придава на метала характерен блясък).
алкални метали
Метал (Метал) е
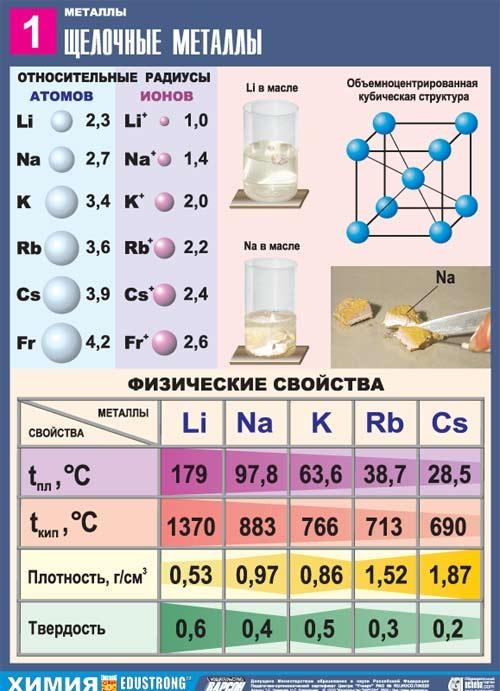
Алкалните метали са елементи от основната подгрупа на група I на периодичната таблица на химичните елементи на Д. И. Дмитрий Иванович Менделеев: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Тези метали се наричат алкални, защото повечето от техните съединения са разтворими във вода. На славянски „излужвам“ означава „разтварям“ и това определя името на тази група метали. Когато алкалните метали се разтварят във вода, се образуват разтворими хидроксиди, наречени алкали.
Обща характеристика на алкалните метали
В периодичната таблица те следват непосредствено инертните газове, така че структурната характеристика на атомите на алкални метали е, че те съдържат един електрон на ново енергийно ниво: тяхната електронна конфигурация е ns1. Очевидно е, че валентните електрони на алкалните метали могат лесно да бъдат отстранени, тъй като за атома е енергийно изгодно да отдаде електрон и да придобие конфигурацията на инертен газ. Следователно всички алкални метали се характеризират с редуциращи свойства. Това се потвърждава от ниските стойности на техните йонизационни потенциали (йонизационният потенциал на цезиевия атом е един от най-ниските) и електроотрицателност (EO).
Всички метали от тази подгрупа са сребристо-бели (с изключение на сребристо-жълтия цезий), те са много меки, могат да се режат със скалпел. Литият, натрият и калият са по-леки от водата и плуват на повърхността й, реагирайки с нея.
Алкалните метали се срещат естествено под формата на съединения, съдържащи еднократно заредени катиони. Много минерали съдържат метали от основната подгрупа на I група. Например ортоклазата или фелдшпатът се състои от калиев алумосиликат K2, подобен на минерал, съдържащ натрий - албит - има състав Na2. Морската вода съдържа натриев хлорид NaCl, а почвата съдържа калиеви соли - силвин KCl, силвинит NaCl. KCl, карналит KCl. MgCl2. 6H2O, полихалит K2SO4. MgSO4. CaSO4. 2H2O.
Химични свойства на алкалните метали
Метал (Метал) е
Поради високата химическа активност на алкалните метали по отношение на водата, кислорода, азота, те се съхраняват под слой керосин. За да се извърши реакцията с алкален метал, парче с желания размер се изрязва внимателно със скалпел под слоя керосин, в аргонова атмосфера, почистете добре металната повърхност от продуктите на нейното взаимодействие с въздуха и едва след това поставете пробата в реакционния съд.
1. Взаимодействие с вода. Важно свойство на алкалните метали е тяхната висока активност по отношение на водата. Литият реагира най-спокойно (без експлозия) с вода.
При извършване на подобна реакция натрият гори с жълт пламък и възниква малка експлозия. Калият е още по-активен: в този случай експлозията е много по-силна и пламъкът е оцветен в лилаво.
2. Взаимодействие с кислород. Продуктите от горенето на алкални метали във въздуха имат различен съставв зависимост от активността на метала.
Само литият изгаря във въздуха, за да образува оксид със стехиометричен състав.
При изгарянето на натрий се образува главно пероксид Na2O2 с малка добавка на супероксид NaO2.
Продуктите от горенето на калий, рубидий и цезий съдържат главно супероксиди.
За да се получат оксиди на натрий и калий, смеси от хидроксид, пероксид или супероксид се нагряват с излишък от метал в отсъствие на кислород.
За кислородните съединения на алкални метали е характерна следната закономерност: с увеличаване на радиуса на катиона на алкалния метал се увеличава стабилността на кислородните съединения, съдържащи пероксиден йон O22- и супероксиден йон O2-.
Тежките алкални метали се характеризират с образуването на доста стабилни озониди от състава на EO3. Всички кислородни съединения имат различни цветове, чийто интензитет се задълбочава в серията от Li до Cs.
Оксидите на алкалните метали имат всички свойства на основните оксиди: реагират с вода, киселинни оксиди и киселини.
Пероксидите и супероксидите проявяват свойствата на силни окислители.
Пероксидите и супероксидите реагират интензивно с вода, образувайки хидроксиди.
3. Взаимодействие с други вещества. Алкалните метали реагират с много неметали. При нагряване те се свързват с водород, за да образуват хидриди, с халогени, сиво, азот, фосфор, въглерод и силиций, за да образуват съответно халогениди, сулфиди, нитриди, фосфиди, карбиди и силициди.
При нагряване алкалните метали могат да реагират с други метали, образувайки интерметални съединения. Алкалните метали реагират активно (с експлозия) с киселини.
Алкалните метали се разтварят в течен амоняк и неговите производни - амини и амиди.
Когато се разтвори в течен амоняк, алкален метал губи електрон, който се солватира от молекулите на амоняка и придава на разтвора син цвят. Получените амиди лесно се разлагат с вода с образуване на основи и амоняк.
Алкалните метали взаимодействат с органични вещества, алкохоли (с образуване на алкохолати) и карбоксилни киселини (с образуване на соли).
4. Качествено определяне на алкални метали. Тъй като йонизационните потенциали на алкалните метали са малки, когато метал или неговите съединения се нагреят в пламък, атомът се йонизира, оцветявайки пламъка в определен цвят.
Получаване на алкални метали
1. За получаване на алкални метали те използват главно електролизата на стопилките на техните халогениди, най-често хлориди, които образуват естествени минерали:
катод: Li+ + e → Li
анод: 2Cl- - 2e → Cl2
2. Понякога за получаване на алкални метали се извършва електролиза на стопилки на техните хидроксиди:
катод: Na+ + e → Na
анод: 4OH- - 4e → 2H2O + O2
Тъй като алкалните метали са отляво на водорода в електрохимичната серия от напрежения, е невъзможно да се получат електролитно от солеви разтвори; в този случай се образуват съответните алкали и водород.
Хидроксиди
За производството на хидроксиди на алкални метали се използват главно електролитни методи. Най-мащабното е производството на натриев хидроксид чрез електролиза на концентриран воден разтвор на готварска сол.
Преди това алкалите се получават чрез обменна реакция.
Получената по този начин основа е силно замърсена с Na2CO3 сода.
Хидроксидите на алкални метали са бели хигроскопични вещества, чиито водни разтвори са силни основи. Те участват във всички реакции, характерни за основите - реагират с киселини, киселинни и амфотерни оксиди, амфотерни хидроксиди.
Хидроксидите на алкални метали се сублимират без разлагане при нагряване, с изключение на литиевия хидроксид, който, подобно на хидроксидите на металите от основната подгрупа на II група, се разлага на оксид и вода при калциниране.
Натриевият хидроксид се използва за производство на сапуни, синтетични детергенти, изкуствени влакна, органични съединениякато фенол.
Карбонати
Важен продукт, съдържащ алкален метал, е содата Na2CO3. Основното количество сода в света се произвежда по метода на Солвей, предложен в началото на 20 век. Същността на метода е следната: воден разтвор на NaCl, към който се добавя амоняк, се насища с въглероден диоксид при температура 26 - 30 ° C. В този случай се образува слабо разтворим натриев бикарбонат, наречен сода бикарбонат.
Добавя се амоняк, за да се неутрализира киселинната среда, която възниква, когато въглеродният диоксид преминава в разтвора, и да се получи HCO3-бикарбонатният йон, необходим за утаяването на натриевия бикарбонат. След отделяне на содата за хляб, разтворът, съдържащ амониев хлорид, се нагрява с вар и се отделя амоняк, който се връща в реакционната зона.
По този начин, при амонячния метод за производство на сода, единственият отпадък е калциевият хлорид, който остава в разтвор и има ограничена употреба.
При калциниране на натриев бикарбонат се получава калцинирана сода или промиване, Na2CO3 и въглероден диоксид, които се използват в процеса на получаване на натриев бикарбонат.
Основният купувач на сода е стъклото.
За разлика от неразтворимите кисела сол NaHCO3, калиев бикарбонат KHCO3 е силно разтворим във вода, следователно калиевият карбонат или поташ, K2CO3 се получава чрез действието на въглероден диоксид върху разтвор на калиев хидроксид.
Поташът се използва в производството на стъкло и течен сапун.
Литият е единственият алкален метал, за който не е получен бикарбонат. Причината за това явление е много малкият радиус на литиевия йон, който не му позволява да задържа доста голям HCO3- йон.
литий
Метал (Метал) е
Литият е елемент от основната подгрупа на първата група, вторият период периодична системахимически елементи D.I. Менделеев Дмитрий Иванович, с атомен номер 3. Означава се със символа Li (лат. Lithium). Простото вещество литий (CAS номер: 7439-93-2) е мек, сребристо-бял алкален метал.
Литият е открит през 1817 г. от шведския химик и минералог А. Арфведсон, първо в минерала петалит (Li,Na), а след това в сподумена LiAl и в лепидолита KLi1.5Al1.5(F,OH)2. Литиевият метал е открит за първи път от Хъмфри Дейви през 1825 г.
Литият получи името си, защото се намираше в "камъни" (гръцки λίθος - камък). Първоначално наречен "литион", съвременно имепредложен от Берцелиус.
Литият е сребристобял метал, мек и пластичен, по-твърд от натрия, но по-мек от оловото. Може да се обработва чрез пресоване и валцуване.
При стайна температура металният литий има кубична центрирана решетка (координационно число 8), която при студена обработка се трансформира в кубична плътно опакована решетка, където всеки атом с двойна кубоктаедрична координация е заобиколен от 12 други. Под 78 К, стабилната кристална форма е хексагонална плътно опакована структура, в която всеки литиев атом има 12 най-близки съседи, разположени във върховете на кубоктаедъра.
От всички алкални метали литият има най-високите точки на топене и кипене (съответно 180,54 и 1340°C) и най-ниската плътност при стайна температура от всички метали (0,533 g/cm³, почти половината от тази на водата).
Малкият размер на литиевия атом води до появата на специални свойства на метала. Например, той се смесва с натрий само при температури под 380 ° C и не се смесва с разтопен калий, рубидий и цезий, докато други двойки алкални метали се смесват помежду си във всяко съотношение.
Алкален метал, нестабилен на въздух. Литият е най-малко активният алкален метал, той практически не реагира със сух въздух (и дори сух кислород) при стайна температура.
Във влажен въздух бавно се окислява, превръщайки се в Li3N нитрид, LiOH хидроксид и Li2CO3 карбонат. В кислорода, когато се нагрява, той изгаря, превръщайки се в оксид Li2O. Има интересна функцияче в температурния диапазон от 100 °C до 300 °C литият се покрива с плътен оксиден филм и не се окислява допълнително.
През 1818 г. немският химик Леополд Гмелин установява, че литият и неговите соли оцветяват пламъка в карминово червено, което е качествен признак за определяне на литий. Температурата на запалване е около 300 °C. Продуктите от горенето дразнят лигавицата на назофаринкса.
Спокойно, без експлозия и запалване, реагира с вода, образувайки LiOH и H2. Реагира и с етилов алкохол, образувайки алкохолат, с амоняк и с халогени (с йод - само при нагряване).
Литият се съхранява в петролев етер, парафин, бензин и/или минерално масло в херметически затворени кутии. Металният литий причинява изгаряния при контакт с кожата, лигавиците и очите.
В черната и цветната металургия литият се използва за деоксидиране и повишаване на пластичността и здравината на сплавите. Литият понякога се използва за редукция на редки метали чрез металотермични методи.
Литиевият карбонат е най-важното спомагателно вещество (добавено към електролита) при топенето на алуминий и потреблението му нараства всяка година пропорционално на обема на световното производство на алуминий (цената на литиевия карбонат е 2,5-3,5 kg на тон разтопен алуминий).
Литиевите сплави със сребро и злато, както и мед, са много ефективни спойки. Сплави на литий с магнезий, скандий, мед, кадмий и алуминий са нови обещаващи материали в авиацията и космонавтиката. На базата на литиев алуминат и силикат е създадена керамика, която се втвърдява при стайна температура и се използва в военна техника, металургията, а в бъдеще и в термоядрената енергетика. Стъклото на базата на литиево-алуминиев силикат, подсилено с влакна от силициев карбид, има огромна здравина. Литият е много ефективен за укрепване на оловни сплави и им придава пластичност и устойчивост на корозия.
Литиевите соли имат психотропно действие и се използват в медицината за профилактика и лечение на редица психично заболяване. Литиевият карбонат е най-често срещаният в това качество. използва се в психиатрията за стабилизиране на настроението на хора, страдащи от биполярно разстройство и честа смяна на настроението. Той е ефективен при предотвратяване на депресивна мания и намалява самоубийствата.Лекарите многократно са наблюдавали, че някои литиеви съединения (в подходящи дози, разбира се) имат положително влияниепри пациенти с маниакална депресия. Този ефект се обяснява по два начина. От една страна, установено е, че литият може да регулира активността на някои ензими, участващи в преноса на натриеви и калиеви йони от интерстициалната течност към мозъчните клетки. От друга страна, наблюдавано е, че литиевите йони пряко влияят върху йонния баланс на клетката. И състоянието на пациента зависи до голяма степен от баланса на натрий и калий: излишъкът на натрий в клетките е характерен за пациенти с депресия, дефицит - за тези, страдащи от мания. Подравнявайки натриево-калиевия баланс, литиевите соли имат положителен ефект и върху двете.
Натрий
Метал (Метал) е
Натрият е елемент от основната подгрупа на първата група, третата месечен цикълпериодична система от химични елементи D.I. Дмитрий Иванович Менделеев, с атомен номер 11. Означава се със символа Na (лат. Natrium). Простото вещество натрий (CAS номер: 7440-23-5) е мек, сребристо-бял алкален метал.
Във водата натрият се държи почти по същия начин като лития: реакцията протича с бързо освобождаване на водород, в разтвора се образува натриев хидроксид.
Натрият (или по-скоро неговите съединения) се използва от древни времена. Например содата (натрон), открита естествено във водите на содовите езера в Египет. Древните египтяни са използвали естествена сода за балсамиране, избелване на платна, готвене на храна, правене на бои и глазури. Плиний Стари пише, че в делтата на Нил содата (съдържаща достатъчно количество примеси) е изолирана от речната вода. Той се продаваше под формата на големи парчета, поради примеса на въглища, боядисани в сиво или дори черно.
Натрият е получен за първи път от английския химик Хъмфри Дейви през 1807 г. чрез електролиза на твърд NaOH.
Името "натрий" (натрий) идва от арабското натрун (на гръцки - нитрон) и първоначално се е отнасяло за естествената сода. Самият елемент по-рано се е наричал натрий (лат. Sodium).

Натрият е сребристо-бял метал, в тънки слоеве с лилав оттенък, пластмаса, дори мека (лесно се реже с нож), пресен резен натрий блести. Стойностите на електрическата и топлопроводимостта на натрия са доста високи, плътността е 0,96842 g/cm³ (при 19,7°C), точката на топене е 97,86°C, а точката на кипене е 883,15°C.
Алкален метал, лесно се окислява във въздуха. За защита от атмосферния кислород метален натрийсъхранявани отдолу керосин. Натрият е по-малко активен от лития, поради което реагира с азот само при нагряване:
При голям излишък на кислород се образува натриев пероксид
2Na + O2 = Na2O2
Металният натрий се използва широко в препаративната химия и индустриякато силен редуциращ агент, включително в металургията. Натрият се използва в производството на високо енергоемки натриево-серни батерии. Използва се и в изпускателните клапани на камиони като радиатор. Понякога металният натрий се използва като материал за електрически проводници, предназначени за много високи токове.
В сплав с калий, както и с рубидий и цезий, той се използва като високоефективен охладител. По-специално, сплав със състав натрий 12%, калий 47%, цезий 41% има рекордно ниска точка на топене от -78 °C и е предложена като работна течност за йонни ракетни двигатели и като охладител за атомни електроцентрали.
Натрият се използва и в газоразрядни лампи с високо и ниско налягане (HLD и HLD). Лампите NLVD тип DNaT (Arc Sodium Tubular) са много широко използвани в уличното осветление. Те излъчват ярка жълта светлина. Срокът на експлоатация на лампите HPS е 12-24 хиляди часа. Ето защо газоразрядните лампи от типа DNaT са незаменими за градско, архитектурно и индустриално осветление. Има и лампи DNaS, DNaMT (Arc Sodium Matte), DNaZ (Arc Sodium Mirror) и DNaTBR (Arc Sodium Tubular Without Mercury).
Металният натрий се използва в качествен анализ органична материя. Сплавта на натрий и тестваното вещество се неутрализира с етанол, добавят се няколко милилитра дестилирана вода и се разделят на 3 части, J. Lassen (1843), насочени към определяне на азот, сяра и халогени ( опитвамБайлщайн)
Натриевият хлорид (готварска сол) е най-старият използван ароматизатор и консервант.
Натриевият азид (Na3N) се използва като азотиращ агент в металургията и при производството на оловен азид.
Натриевият цианид (NaCN) се използва в хидрометалургичния метод за извличане на злато от скали, както и в нитрокарбонизирането на стомана и в галванопластиката (сребро, позлата).
Натриевият хлорат (NaClO3) се използва за унищожаване на нежелана растителност по железопътните релси.
калий
Калият е елемент от основната подгрупа на първата група, четвъртата месечен цикълот периодичната система на химичните елементи на Д. И. Менделеев Дмитрий Иванович, с атомен номер 19. Означава се със символа К (лат. Kalium). Простото вещество калий (CAS номер: 7440-09-7) е мек, сребристо-бял алкален метал.
В природата калият се среща само в съединения с други елементи, например в морската вода, както и в много минерали. Той се окислява много бързо на въздух и реагира много лесно, особено с вода, образувайки основа. В много отношения химичните свойства на калия са много подобни на натрия, но по отношение на биологичната функция и използването им от клетките на живите организми, те все още са различни.
Калият (по-точно неговите съединения) се използва от древни времена. И така, производството на поташ (който се използва като перилен препарат) съществува още през 11 век. Пепелта, образувана по време на изгарянето на слама или дърво, се третира с вода и полученият разтвор (ликьор) се изпарява след филтриране. Сухият остатък, освен калиев карбонат, съдържа калиев сулфат K2SO4, сода и калиев хлорид KCl.
През 1807 г. английският химик Дейви изолира калия чрез електролиза на твърд поташ каустик (KOH) и го нарече "калий" (лат. калий; това име все още се използва често на английски, френски, испански, португалски и полски). През 1809 г. Л. В. Гилбърт предлага името "калий" (лат. kalium, от арабски al-kali - поташ). Това име е включено в Немски, оттам до повечето езици на Северна и на Източна Европа(включително руски) и "спечели" при избора на символ за този елемент - К.
Калият е сребристо вещество с характерен блясък върху прясно оформена повърхност. Много лек и лек. Сравнително добре разтворим в живак, образувайки амалгами. Въведен в пламъка на горелката, калият (както и неговите съединения) оцветява пламъка в характерен розово-виолетов цвят.
Калият, подобно на други алкални метали, проявява типични метални свойства и е много реактивен, лесно отдава електрони.
Той е силен редуциращ агент. Той се свързва с кислорода толкова активно, че не се образува оксид, а калиев супероксид KO2 (или K2O4). При нагряване във водородна атмосфера се образува калиев хидрид KH. Взаимодейства добре с всички неметали, като образува халогениди, сулфиди, нитриди, фосфиди и др., както и със сложни вещества като вода (реакцията протича с експлозия), различни оксиди и соли. В този случай те редуцират други метали до свободно състояние.
Калият се съхранява под слой керосин.
Сплав от калий и натрий, течна при стайна температура, се използва като охлаждаща течност в затворени системи, например в атомни електроцентрали с бързи неутрони. В допълнение, неговите течни сплави с рубидий и цезий са широко използвани. Сплав със състав натрий 12%, калий 47%, цезий 41% има рекордно ниска точка на топене от -78 °C.
Калиеви съединения са най-важният биогенен елемент и затова се използват като торове.
Калиевите соли се използват широко в галванопластиката, тъй като въпреки относително високата им цена, те често са по-разтворими от съответните натриеви соли и следователно осигуряват интензивна работа на електролитите при повишена плътност на тока.
Калият е най-важният биогенен елемент, особено в растителния свят. При липса на калий в почвата растенията се развиват много слабо, той намалява, следователно около 90% от извлечените калиеви соли се използват като торове.
Калият, заедно с азота и фосфора, са сред основните хранителни вещества за растенията. Функцията на калия в растенията, както и на другите необходими за тях елементи, е строго специфична. В растенията калият е в йонна форма. Калият се намира главно в цитоплазмата и вакуолите на клетките. Около 80% от калия се съдържа в клетъчния сок.
Функциите на калия са много разнообразни. Установено е, че той стимулира нормалното протичане на фотосинтезата, засилва изтичането на въглехидрати от листните плочи към други органи, както и синтеза на захари.
Калият подобрява натрупването на монозахариди в плодовите и зеленчуковите култури, повишава съдържанието на захари в кореноплодните, нишесте в картофите, удебелява клетъчните стени на сламата на зърнените култури и повишава устойчивостта на полягане на хляба, подобрява качеството на влакната в лена и коноп.
Насърчавайки натрупването на въглехидрати в растителните клетки, калият повишава осмотичното налягане на клетъчния сок и по този начин повишава студоустойчивостта и устойчивостта на замръзване на растенията.
Калият се абсорбира от растенията под формата на катиони и очевидно остава в клетките в тази форма, активирайки най-важните биохимични процесив клетките на растенията калият повишава устойчивостта им към различни заболявания, както по време на вегетационния период, така и след прибиране на реколтата, значително подобрява съхраняемостта на плодовете и зеленчуците.
Недостигът на калий причинява много метаболитни нарушения в растенията, активността на редица ензими е отслабена, метаболизмът на въглехидратите и протеините е нарушен и разходидъх въглехидрати. В резултат на това производителността на растенията пада, качеството на продуктите намалява.



Рубидий
Рубидий е елемент от главната подгрупа на първа група, пети период от периодичната таблица на химичните елементи на Д. И. Дмитрий Иванович Менделеев, с атомен номер 37. Означава се със символа Rb (лат. Rubidium). Простото вещество рубидий (CAS номер: 7440-17-7) е мек, сребристо-бял алкален метал.
През 1861 г. немските учени Робърт Вилхелм Бунзен и Густав Роберт Кирхоф, изучавайки естествени алумосиликати чрез спектрален анализ, откриват нов елемент в тях, по-късно наречен рубидий по цвета на най-силните линии на спектъра.
Рубидият образува сребристо-бели меки кристали, които имат метален блясък върху пресен отрязък. Твърдост по Бринел 0,2 MN/m² (0,02 kgf/mm²). Кристалната решетка на рубидий е кубична, центрирана в тялото, a = 5,71 E (при стайна температура). Атомен радиус 2,48 Е, радиус на Rb+ йон 1,49 Е. Плътност 1,525 g/cm³ (0 °C), т.т. 38,9 °C, tbp 703 °C. Специфичен топлинен капацитет 335,2 J/(kg K), топлинен коефициент на линейно разширение 9,0 10-5 deg-1 (0-38 °C), модул на еластичност 2,4 H/m² (240 kgf/mm²), специфично обемно електрическо съпротивление 11,29 10-6 ohm cm (20 °C); рубидият е парамагнитен.
Алкален метал, изключително нестабилен на въздух (реагира с въздуха в присъствието на следи от вода, запалим). Образува всякакви соли - предимно лесноразтворими (хлоратите и перхлоратите са слабо разтворими). Рубидиевият хидроксид е много агресивно вещество към стъкло и други конструктивни и контейнерни материали, а разтопеният унищожава повечето метали (дори платината).
Употребата на рубидий е разнообразна и въпреки факта, че в редица области на приложение той отстъпва по най-важните си физически характеристики на цезия, въпреки това този рядък алкален метал играе важна роля в модерни технологии. Могат да се отбележат следните приложения на рубидия: катализа, електроника индустрия, специална оптика, атомна, медицина.
Рубидият се използва не само в чист вид, но и под формата на редица сплави и химични съединения. Важно е да се отбележи, че рубидият има много добра и благоприятна суровинна база, но в същото време ситуацията с наличието на ресурси е много по-благоприятна, отколкото в случая с цезия, и рубидият може да играе още по-голяма роля. важна роля, например, в катализата (където успешно се доказа).
Изотопът рубидий-86 се използва широко в гама-лъчева дефектоскопия, измервателна технология, както и в стерилизацията на редица важни лекарства и хранителни продукти. Рубидият и неговите сплави с цезий са много обещаващ охладител и работна среда за високотемпературни турбинни агрегати (в това отношение рубидий и цезий в последните годинистанаха важни и изключително високата цена на металите избледнява на заден план по отношение на възможностите за драстично увеличаване на ефективността на турбинните агрегати и следователно намаляване разходигориво и замърсяване на околната среда). Системите на базата на рубидий, най-широко използвани като охлаждащи течности, са тройни сплави: натрий-калий-рубидий и натрий-рубидий-цезий.
В катализа рубидият се използва както в органичния, така и в неорганичния синтез. Каталитичната активност на рубидия се използва главно в рафинирането на нефт за редица важни продукти. Рубидиевият ацетат например се използва за синтезиране на метанол и редица висши алкохоли от воден газ, което от своя страна е изключително важно във връзка с подземната газификация на въглища и производството на изкуствено течно гориво за автомобили и реактивно гориво. Редица рубидиево-телурови сплави имат по-висока чувствителност в ултравиолетовата област на спектъра от цезиевите съединения и следователно в този случай могат да се конкурират с цезий-133 като материал за фотопреобразуватели. Като част от специални смазочни състави (сплави), рубидият се използва като високоефективна смазка във вакуум (ракетна и космическа техника).
Рубидиевият хидроксид се използва за приготвяне на електролит за нискотемпературен CPS, както и като добавка към разтвор на калиев хидроксид за подобряване на работата му при ниски температури и повишаване на електрическата проводимост на електролита. Металният рубидий се използва в хидридни горивни клетки.
Рубидиевият хлорид в сплав с меден хлорид се използва за измерване на високи температури (до 400 °C).
Рубидиевата плазма се използва за възбуждане на лазерно лъчение.
Рубидиевият хлорид се използва като електролит в горивните клетки и същото може да се каже за рубидиевия хидроксид, който е много ефективен като електролит в горивните клетки, използвайки директно оксидиране на въглища.
Цезий
Цезият е елемент от главната подгрупа на първата група, шестия период от периодичната система на химичните елементи на Д. И. Менделеев Дмитрий Иванович, с атомен номер 55. Означава се със символа Cs (лат. Caesium). Простото вещество цезий (CAS номер: 7440-46-2) е мек, сребристо-жълт алкален метал. Цезият получи името си за наличието на две ярко сини линии в емисионния спектър (от латински caesius - небесно синьо).
Цезият е открит през 1860 г. от немските учени R. W. Bunsen и G. R. Kirchhoff във водите на минералния извор Durchheim в Република Германия чрез оптична спектроскопия, като по този начин се превръща в първия елемент, открит чрез спектрален анализ. В чиста форма цезият е изолиран за първи път през 1882 г. от шведския химик К. Сетерберг по време на електролиза на стопилка от смес от цезиев цианид (CsCN) и барий.
Основните цезиеви минерали са полуцит и много редкият авогадрит (K,Cs). В допълнение, под формата на примеси, цезият е включен в редица алумосиликати: лепидолит, флогопит, биотит, амазонит, петалит, берил, цинвалдит, левцит, карналит. Като промишлени суровини се използват полуцит и лепидолит.
При промишлено производствоцезият под формата на съединения се извлича от минерала полуцит. Това става чрез хлоридно или сулфатно отваряне. Първият включва третиране на оригиналния минерал със загрята солна киселина, добавяне на антимонов хлорид SbCl3 за утаяване на съединението Cs3 и промиване с гореща вода или амонячен разтвор за образуване на цезиев хлорид CsCl. Във втория случай се обработва с нагрята сярна киселина, за да се образува цезиева стипца CsAl(SO4)2 · 12H2O.
AT Руска федерацияслед разпадането на СССР промишленото производство на полуцит не е извършено, въпреки че в тундрата Вороня близо до Мурманск през г. съветско времебяха открити колосални запаси от минерала. Докато руската индустрия успя да стъпи на краката си, се оказа, че лицензът за разработване на това поле е купен от канадци. Понастоящем обработката и извличането на цезиеви соли от полуцита се извършва в Новосибирск в ZAO Rare Metals Plant.
Има няколко лабораторни метода за получаване на цезий. Може да се получи:
нагряване във вакуум на смес от цезиев хромат или дихромат с цирконий;
разлагане на цезиев азид във вакуум;
нагряване на смес от цезиев хлорид и специално приготвен калций.
Всички методи са трудоемки. Вторият метод дава възможност за получаване на метал с висока чистота, но е експлозивен и изисква няколко дни, за да се реализира.
Цезият намира приложение едва в началото на 20 век, когато са открити неговите минерали и е разработена технологията за получаването му в чист вид. В момента цезият и неговите съединения се използват в електрониката, радиото, електротехниката, рентгеновото инженерство, химическата промишленост, оптиката, медицината и ядрената енергетика. Използва се предимно стабилен природен цезий-133 и в ограничена степен - неговият радиоактивен изотоп цезий-137, изолиран от сумата от фрагменти на делене на уран, плутоний, торий в реакторите на атомни електроцентрали.
алкалоземни метали
Алкалоземните метали са химични елементи: калций Ca, стронций Sr, барий Ba, радий Ra (понякога берилий Be и магнезий Mg също погрешно се наричат алкалоземни метали). Те са наречени така, защото техните оксиди - "земи" (по терминологията на алхимиците) - придават на водата алкална реакция. Солите на алкалоземните метали, с изключение на радия, са широко разпространени в природата под формата на минерали.
калций
Калцият е елемент от главната подгрупа на втората група, четвъртия период от периодичната таблица на химичните елементи на Д. И. Дмитрий Иванович Менделеев, с атомен номер 20. Означава се със символа Ca (лат. Calcium). Простото вещество калций (CAS номер: 7440-70-2) е мек, реактивен, сребристо-бял алкалоземен метал.
Калциевият метал съществува в две алотропни модификации. До 443 °C α-Ca с кубична лицево-центрирана решетка е стабилна (параметър a = 0,558 nm), над β-Ca е стабилна с кубична тялоцентрирана решетка от типа α-Fe (параметър a = 0,448 nm). Стандартната енталпия ΔH0 на прехода α → β е 0,93 kJ/mol.
Калцият е типичен алкалоземен метал. Химическата активност на калция е висока, но по-ниска от тази на всички други алкалоземни метали. Той лесно реагира с кислорода, въглеродния диоксид и влагата във въздуха, поради което повърхността на калциевия метал обикновено е тъмно сива, така че калцият обикновено се съхранява в лабораторията, подобно на други алкалоземни метали, в плътно затворен буркан под слой керосин или течен парафин.
В серията от стандартни потенциали калцият е разположен отляво на водорода. Стандартният електроден потенциал на двойката Ca2+/Ca0 е −2,84 V, така че калцият реагира активно с вода, но без запалване:
Ca + 2H2O \u003d Ca (OH) 2 + H2 + Q.
С активни неметали (кислород, хлор, бром) калцият реагира при нормални условия:
2Ca + O2 = 2CaO, Ca + Br2 = CaBr2.
При нагряване във въздух или кислород калцият се запалва. С по-малко активни неметали (водород, бор, въглерод, силиций, азот, фосфор и други), калцият взаимодейства при нагряване, например:
Ca + H2 = CaH2, Ca + 6B = CaB6,
3Ca + N2 = Ca3N2, Ca + 2C = CaC2,
3Ca + 2P = Ca3P2 (калциев фосфид), известни са и калциевите фосфиди от CaP и CaP5 състави;
2Ca + Si = Ca2Si (калциев силицид), известни са също калциеви силициди от състави CaSi, Ca3Si4 и CaSi2.
Ходът на горните реакции, като правило, е придружен от освобождаване Голям бройтоплина (т.е. тези реакции са екзотермични). Във всички съединения с неметали степента на окисление на калция е +2. Повечето от калциевите съединения с неметали лесно се разграждат от вода, например:
CaH2 + 2H2O \u003d Ca (OH) 2 + 2H2,
Ca3N2 + 3H2O = 3Ca(OH)2 + 2NH3.
Ca2+ йонът е безцветен. Когато към пламъка се добавят разтворими калциеви соли, пламъкът става керемиденочервен.
Калциевите соли като CaCl2 хлорид, CaBr2 бромид, CaI2 йодид и Ca(NO3)2 нитрат са силно разтворими във вода. CaF2 флуорид, CaCO3 карбонат, CaSO4 сулфат, Ca3(PO4)2 ортофосфат, CaC2O4 оксалат и някои други са неразтворими във вода.
От голямо значение е фактът, че за разлика от калциевия карбонат CaCO3, киселият калциев карбонат (хидрокарбонат) Ca(HCO3)2 е разтворим във вода. В природата това води до следните процеси. Когато студена дъждовна или речна вода, наситена с въглероден диоксид, прониква под земята и пада върху варовици, се наблюдава тяхното разтваряне:
CaCO3 + CO2 + H2O \u003d Ca (HCO3) 2.
На същите места, където водата, наситена с калциев бикарбонат, излиза на повърхността на земята и се нагрява от слънчевите лъчи, възниква обратната реакция:
Ca (HCO3) 2 \u003d CaCO3 + CO2 + H2O.
Така че в природата има пренос на големи маси вещества. В резултат на това под земята могат да се образуват огромни празнини, а в пещерите се образуват красиви каменни "ледени висулки" - сталактити и сталагмити.
Наличието на разтворен калциев бикарбонат във водата до голяма степен определя временната твърдост на водата. Нарича се временен, защото при кипене на водата бикарбонатът се разлага и CaCO3 се утаява. Това явление води например до факта, че с времето в чайника се образува котлен камък.
Стронций
Стронций е елемент от главната подгрупа на втората група, петия период от периодичната система на химичните елементи на Д. И. Менделеев Дмитрий Иванович, с атомен номер 38. Означава се със символа Sr (лат. Strontium). Простото вещество стронций (CAS номер: 7440-24-6) е мек, ковък и пластичен сребристо-бял алкалоземен метал. Има висока химическа активност, във въздуха бързо реагира с влага и кислород, покривайки се с жълт оксиден филм.
Новият елемент е открит в минерала стронцианит, намерен през 1764 г. в оловна мина близо до шотландското село Строншиан, което по-късно дава името на новия елемент. Наличието на нов метален оксид в този минерал е установено почти 30 години по-късно от Уилям Круикшанк и Адер Крауфорд. Изолиран в най-чистата си форма от сър Хъмфри Дейви през 1808 г.
Стронцийът е мек, сребристо-бял метал, ковък и ковък и лесно се реже с нож.
Полиморфин - известни са три негови модификации. До 215°C стабилна е кубичната гранецентрирана модификация (α-Sr), между 215 и 605°C - хексагонална (β-Sr), над 605°C - кубична телецентрирана модификация (γ-Sr).
Точка на топене - 768oC, Точка на кипене - 1390oC.
Стронций в своите съединения винаги проявява +2 валентност. По свойства стронцийът е близък до калция и бария, заемайки междинна позиция между тях.
В електрохимичната серия от напрежения стронцийът е сред най-активните метали (нормалният му електроден потенциал е −2,89 V. Той реагира енергично с вода, образувайки хидроксид:
Sr + 2H2O = Sr(OH)2 + H2
Взаимодейства с киселини, измества тежките метали от техните соли. Реагира слабо с концентрирани киселини (H2SO4, HNO3).
Металният стронций бързо се окислява във въздуха, образувайки жълтеникав филм, в който освен SrO оксид винаги присъстват SrO2 пероксид и Sr3N2 нитрид. При нагряване на въздух се запалва; прахообразният стронций във въздуха е склонен към самозапалване.
Реагира енергично с неметали - сяра, фосфор, халогени. Взаимодейства с водород (над 200°C), азот (над 400°C). Практически не реагира с алкали.
При високи температури той реагира с CO2, за да образува карбид:
5Sr + 2CO2 = SrC2 + 4SrO
Лесно разтворими соли на стронция с аниони Cl-, I-, NO3-. Солите с аниони F-, SO42-, CO32-, PO43- са слабо разтворими.
Стронций се използва за легиране на мед и някои от неговите сплави, за въвеждане в акумулаторни оловни сплави, за десулфуриране на чугун, мед и стомани.
Барий
Барият е елемент от главната подгрупа на втората група, шестия период на периодичната таблица на химичните елементи на Д. И. Дмитрий Иванович Менделеев, с атомен номер 56. Означава се със символа Ba (лат. Barium). Простото вещество барий (CAS номер: 7440-39-3) е мек, ковък, сребристо-бял алкалоземен метал. Притежава висока химична активност.
Барият е открит под формата на оксид BaO през 1774 г. от Карл Шееле. През 1808 г. английският химик Хъмфри Дейви получава чрез електролиза мокър бариев хидроксид с живачен катод амалгамабарий; след като изпари живака при нагряване, той изолира металния барий.
Барият е сребристо-бял ковък метал. Чупи се при рязък удар. Има две алотропни модификации на бария: α-Ba с кубична центрирана решетка е стабилен до 375 °C (параметър a = 0,501 nm), β-Ba е стабилен по-горе.
Твърдост по минералогична скала 1,25; по скалата на Моос 2.
Металният барий се съхранява в керосин или под слой парафин.
Барият е алкалоземен метал. Той се окислява интензивно на въздух, образувайки бариев оксид BaO и бариев нитрид Ba3N2 и се запалва при леко нагряване. Реагира енергично с вода, образувайки бариев хидроксид Ba (OH) 2:
Ba + 2H2O \u003d Ba (OH) 2 + H2
Активно взаимодейства с разредени киселини. Много бариеви соли са неразтворими или слабо разтворими във вода: бариев сулфат BaSO4, бариев сулфит BaSO3, бариев карбонат BaCO3, бариев фосфат Ba3(PO4)2. Бариевият сулфид BaS, за разлика от калциевия сулфид CaS, е силно разтворим във вода.
Лесно реагира с халогени за образуване на халогениди.
При нагряване с водород той образува бариев хидрид BaH2, който от своя страна с литиев хидрид LiH дава Li комплекса.
Реагира при нагряване с амоняк:
6Ba + 2NH3 = 3BaH2 + Ba3N2
При нагряване бариевият нитрид Ba3N2 реагира с CO, за да образува цианид:
Ba3N2 + 2CO = Ba(CN)2 + 2BaO
С течен амоняк дава тъмносин разтвор, от който може да се изолира амоняк, който има златист блясък и лесно се разлага с елиминирането на NH3. В присъствието на платинов катализатор амонякът се разлага до образуване на бариев амид:
Ba(NH2)2 + 4NH3 + H2
Бариевият карбид BaC2 може да се получи чрез нагряване на BaO с въглища в дъгова пещ.
С фосфора той образува фосфида Ba3P2.
Барият редуцира оксидите, халидите и сулфидите на много метали до съответния метал.
Металният барий, често в сплав с алуминий, се използва като геттер (гетер) във високовакуумни електронни устройства и също се добавя заедно с цирконий към течни метални охладители (сплави на натрий, калий, рубидий, литий, цезий) за намаляване на агресивността към тръбопроводите и в металургията.
преходни метали
Преходните метали (преходни елементи) са елементи от странични подгрупи на периодичната таблица на химичните елементи на Д. И. Менделеев Дмитрий Иванович, в чиито атоми се появяват електрони на d- и f-орбитали. AT общ изглед електронна структурапреходните елементи могат да бъдат представени по следния начин: . Ns-орбиталата съдържа един или два електрона, останалите валентни електрони са в -орбиталата. Тъй като броят на валентните електрони е значително по-малък от броя на орбиталите, простите вещества, образувани от преходни елементи, са метали.
Обща характеристика на преходните елементи
Всички преходни елементи имат следните общи свойства:
Малки стойности на електроотрицателност.
Променливи степени на окисление. За почти всички d-елементи, в атомите на които има 2 валентни електрона на външното ns-подниво, е известно степента на окисление +2.
Започвайки от d-елементите от група III на периодичната таблица на химичните елементи на D. I. Дмитрий Иванович Менделеев, елементите в най-ниското състояние на окисление образуват съединения, които проявяват основни свойства, в най-високото - киселинно, в междинното - амфотерно
Желязо
Желязото е елемент от вторична подгрупа на осма група от четвъртия период на периодичната система от химични елементи на Д. И. Менделеев Дмитрий Иванович, атомен номер 26. Означава се със символа Fe (лат. Ferrum). Един от най-разпространените в земната кораметали (на второ място след алуминия).
Простото вещество желязо (CAS номер: 7439-89-6) е ковък сребристо-бял метал с висока химическа реактивност: желязото корозира бързо при високи температури или висока влажност на въздуха. В чист кислород желязото гори, а във фино диспергирано състояние се запалва спонтанно във въздуха.
Всъщност желязото обикновено се нарича неговите сплави с ниско съдържание на примеси (до 0,8%), които запазват мекотата и пластичността на чист метал. Но на практика по-често се използват сплави на желязо с въглерод: (до 2% въглерод) и (повече от 2% въглерод), както и неръждаема (легирана) стомана с добавяне на легиращи метали (хром, манган, Ni и т.н.). Комбинацията от специфичните свойства на желязото и неговите сплави го правят "метал No1" по значимост за човека.
В природата желязото рядко се среща в чиста форма, най-често се среща като част от желязо-никелови метеорити. Разпространението на желязото в земната кора е 4,65% (4-то място след O, Si, Al). Смята се също, че желязото съставлява по-голямата част от земното ядро.




Желязото е типичен метал, в свободно състояние е сребристо-бял цвят със сивкав оттенък. Чистият метал е пластичен, различни примеси (по-специално въглерод) увеличават неговата твърдост и крехкост. Има произнесени магнитни свойства. Често се разграничава така наречената "желязна триада" - група от тримаметали (желязо Fe, кобалт Co, Ni Ni), които имат подобни физични свойства, атомни радиуси и стойности на електроотрицателност.
Желязото се характеризира с полиморфизъм, има четири кристални модификации:
до 769 °C има α-Fe (ферит) с обемно центрирана кубична решетка и свойствата на феромагнетик (769 °C ≈ 1043 K е точката на Кюри за желязото)
в температурния диапазон 769–917 °C съществува β-Fe, което се различава от α-Fe само по параметрите на обемно-центрираната кубична решетка и магнитните свойства на парамагнетика
в температурния диапазон 917–1394 °C има γ-Fe (аустенит) с гранецентрирана кубична решетка
над 1394 °C, δ-Fe е стабилен с обемно центрирана кубична решетка
Науката за металите не разграничава β-Fe като отделна фаза и го разглежда като разновидност на α-Fe. Когато желязото или стоманата се нагреят над точката на Кюри (769 °C ≈ 1043 K), топлинното движение на йони нарушава ориентацията на спиновите магнитни моменти на електроните, феромагнетикът става парамагнетик - възниква фазов преход от втори ред, но фазов преход от първи род не се получава при промяна на основните физични параметри на кристалите.
За чистото желязо при нормално налягане, от гледна точка на металургията, има следните стабилни модификации:
От абсолютна нула до 910 ºC, α-модификацията с обемно центрирана кубична (bcc) кристална решетка е стабилна. Твърд разтвор на въглерод в α-желязо се нарича ферит.
От 910 до 1400 ºC γ-модификацията с лицево-центрирана кубична (fcc) кристална решетка е стабилна. Твърд разтвор на въглерод в γ-желязо се нарича аустенит.
От 910 до 1539 ºC δ-модификацията с обемно центрирана кубична (bcc) кристална решетка е стабилна. Твърд разтвор на въглерод в δ-желязо (както и в α-желязо) се нарича ферит. Понякога се прави разлика между високотемпературен δ-ферит и нискотемпературен α-ферит (или просто ферит), въпреки че техните атомни структури са еднакви.
Наличието на въглерод и легиращи елементи в стоманата значително променя температурите на фазовите преходи.
В областта на високите налягания (над 104 MPa, 100 хиляди атм.) се появява модификация на ε-желязо с хексагонална плътно опакована (hcp) решетка.
Явлението полиморфизъм е изключително важно за металургията на стоманата. Благодарение на α-γ преходите на кристалната решетка се извършва термичната обработка на стоманата. Без това явление желязото, като основа на стоманата, не би получило толкова широко приложение.
Желязото е огнеупорно, принадлежи към металите със средна активност. Точката на топене на желязото е 1539 °C, точката на кипене е около 3200 °C.
Желязото е един от най-използваните метали, което представлява до 95% от световното металургично производство.
Желязото е основният компонент на стоманите и чугуните, най-важните конструкционни материали.
Желязото може да бъде включено в сплави на базата на други метали, като никел.
Магнитният железен оксид (магнетит) е важен материал в производството на устройства с дълготрайна компютърна памет: твърди дискове, флопи дискове и др.
Ултрафиният прах от магнетит се използва в черно-бели лазерни принтери като тонер.
Уникалните феромагнитни свойства на редица сплави на основата на желязо допринасят за широкото им използване в електротехниката за магнитните сърцевини на трансформатори и електродвигатели.
Железен (III) хлорид (железен хлорид) се използва в радиолюбителската практика за ецване на печатни платки.
Железен сулфат (железен сулфат), смесен с меден сулфат, се използва за борба с вредните гъбички в градинарството и строителството.
Желязото се използва като анод в желязо-никелови батерии, желязо-въздушни батерии.
Мед
Медта е елемент от странична подгрупа на първа група, четвърти период от периодичната таблица на химичните елементи на Д. И. Дмитрий Иванович Менделеев, с атомен номер 29. Означава се със символа Cu (лат. Cuprum). Простото вещество мед (CAS номер: 7440-50-8) е пластичен преходен метал със златист цвят. Розов цвят(розово при липса на оксиден филм). Той е широко използван от човека от древни времена.



Медта е златисто-розов пластичен метал, който във въздуха бързо се покрива с оксиден филм, което му придава характерен интензивен жълтеникаво-червен оттенък. Медта има висока топло- и електрическа проводимост (на второ място по електрическа проводимост след среброто). Има два стабилни изотопа - 63Cu и 65Cu, както и няколко радиоактивни изотопа. Най-дълготрайният от тях, 64Cu, има полуживот от 12,7 часа и два разпада с различни продукти.
Плътност — 8,94*10і kg/mі
Специфичен топлинен капацитет при 20 °C - 390 J/kg*K
Електрическо съпротивление при 20-100 °C - 1,78 10−8 Ohm m
Точка на топене - 1083 ° C
Точка на кипене - 2600 ° C
Съществуват редица медни сплави: месинг - сплав от мед с цинк, - сплав от мед с калай, никелово сребро - сплав от мед и никел и някои други.
Цинк
Цинкът е елемент от странична подгрупа на втората група, четвъртия период от периодичната таблица на химичните елементи на Д. И. Менделеев Дмитрий Иванович, с атомен номер 30. Означава се със символа Zn (лат. Zinkum). Едно просто вещество (CAS номер: 7440-66-6) при нормални условия е крехък синкаво-бял преходен метал (потъмнява във въздуха, покривайки се с тънък слой цинков оксид).
В чистата си форма той е доста пластичен сребристо-бял метал. Има шестоъгълна решетка с параметри a = 0,26649 nm, c = 0,49468 nm. Той е крехък при стайна температура; когато плочата се огъне, се чува пукащ звук от триенето на кристалитите (обикновено по-силен от „плака на калай“). При 100–150°C цинкът е пластичен. Примесите, дори незначителни, рязко увеличават крехкостта на цинка.
Типичен амфотерен метал. Стандартният електроден потенциал е -0,76 V, в серията от стандартни потенциали той се намира преди желязото.
Във въздуха цинкът е покрит с тънък слой ZnO оксид. При силно нагряване той изгаря с образуването на амфотерен бял оксид ZnO:
2Zn + O2 = 2ZnO.
Цинковият оксид реагира както с киселинни разтвори:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
и основи:
ZnO + 2NaOH = Na2ZnO2 + H2O,
Цинкът с обикновена чистота реагира активно с киселинни разтвори:
Zn + 2HCl = ZnCl2 + H2,
Zn + H2SO4 (разреден) = ZnSO4 + H2
и алкални разтвори:
Zn + 2NaOH + 2H2O = Na2 + H2,
образувайки хидроксоцинкати. Много чистият цинк не реагира с разтвори на киселини и основи. Взаимодействието започва с добавяне на няколко капки разтвор на меден сулфат CuSO4.
При нагряване цинкът реагира с халогени, за да образува ZnHal2 халогениди. С фосфора цинкът образува фосфиди Zn3P2 и ZnP2. Със сярата и нейните аналози - селен и телур - различни халкогениди, ZnS, ZnSe, ZnSe2 и ZnTe.
Цинкът не реагира директно с водород, азот, въглерод, силиций и бор. Нитрид Zn3N2 се получава чрез взаимодействие на цинк с амоняк при 550-600 ° C.
AT водни разтворицинковите йони Zn2+ образуват аквакомплекси 2+ и 2+.
Чистият метален цинк се използва за възстановяване на благородни метали, добити чрез подземно извличане (злато, сребро). Освен това цинкът се използва за извличане на сребро, злато (и други метали) от сурово олово под формата на интерметални съединения цинк-сребро-злато (така наречената „сребърна пяна“), които след това се обработват конвенционални методирафиниране.
Използва се за защита на стоманата от корозия (поцинковане на повърхности, които не подлежат на механични въздействия, или метализация - за мостове, резервоари, метални конструкции). Използва се и като материал за отрицателни електроди в химически източници на ток, т.е. батерии и акумулатори, например: манганово-цинкова клетка, сребърно-цинкова батерия dmi, ниско съпротивление и колосални разрядни токове, живачно-цинков елемент (EMF 1,35 V, 135 W h / kg, 550-650 Wh / dmi), диоксисулфатно-живачен елемент, йодат-цинков елемент, галваничен елемент от меден оксид (EMF 0,7-1,6 волта, 84-127 Wh/kg, 410-570 Wh/dmi), хром-цинк клетка, клетка от цинк-сребърен хлорид, никел-цинкова батерия (EMF 1, 82 волта, 95-118 Wh/kg, 230-295 Wh/dmi), оловно-цинкова клетка, цинк-хлорна батерия, цинк-бромна батерия и др. .). Ролята на цинка в цинково-въздушните батерии е много важна, през последните години те се развиват интензивно на базата на цинково-въздушната система - батерии за компютри (лаптопи) и в тази област са постигнати значителни успехи (по-големи от литиевите батерии, капацитет и ресурс, по-малко от 3 пъти цената), тази система също е много обещаваща за стартиране на двигатели (оловна батерия - 55 W h / kg, цинк-въздух - 220-300 W h / kg) и за електрически превозни средства ( пробег до 900 км). Използва се в много припои за понижаване на точката им на топене. Цинкът е важен компонент на месинга. Цинковият оксид се използва широко в медицината като антисептично и противовъзпалително средство. Цинковият оксид се използва и за производството на боя - цинкова бяла.
Цинковият хлорид е важен флюс за спояване на метали и компонент в производството на влакна.
Телурид, селенид, фосфид, цинков сулфид са широко използвани полупроводници.
Цинковият селенид се използва за направата на оптични стъкла с много ниски коефициентиабсорбция в средния инфрачервен диапазон, например в лазери с въглероден диоксид.
живак
Живакът е елемент от странична подгрупа на втора група, шести период от периодичната таблица на химичните елементи на Д. И. Дмитрий Иванович Менделеев, с атомен номер 80. Означава се със символа Hg (лат. Hydrargyrum). Простото вещество живак (CAS номер: 7439-97-6) е преходен метал, при стайна температура е тежка, сребристо-бяла, забележимо летлива течност, чиито пари са изключително токсични. Живакът е един от двата химични елемента (и единственият метал), чиито прости вещества при нормални условия са в течно агрегирано състояние (вторият елемент е бром). В природата се среща както в самороден вид, така и образува редица минерали. Най-често живакът се получава чрез редукция от най-разпространения му минерал – цинобъра. Използва се за производството на измервателни уреди, вакуумни помпи, източници на светлина и в други области на науката и технологиите.
Живакът е единственият метал, който е течен при стайна температура. Има свойствата на диамагнетик. Образува течни сплави с много метали амалгами. Само желязо, манган и Ni.
Живакът е неактивен метал.
При нагряване до 300 °C живакът реагира с кислорода: 2Hg + O2 → 2HgO Образува се червен живачен (II) оксид. Тази реакция е обратима: при нагряване над 340 °C оксидът се разлага до прости вещества. Реакцията на разлагане на живачен оксид исторически е един от първите начини за производство на кислород.
Когато живакът се нагрява със сяра, се образува живачен (II) сулфид.
Живакът не се разтваря в разтвори на киселини, които нямат окислителни свойства, но се разтваря в царска вода и азотна киселина, образувайки двувалентни живачни соли. Когато излишъкът от живак се разтвори в азотна киселина на студено, се образува Hg2(NO3)2 нитрат.
От елементите от група IIB, живакът има възможността да разруши много стабилна 6d10 - електронна обвивка, което води до възможността за съществуване на живачни съединения (+4). Така че, в допълнение към слабо разтворимите Hg2F2 и HgF2, разлагащи се с вода, има и HgF4, получен чрез взаимодействието на живачни атоми и смес от неон и флуор при температура 4K.
Живакът се използва в производството на термометри, живачните пари се пълнят с живачно-кварцови и флуоресцентни лампи. Живачните контакти служат като сензори за положение. В допълнение, металният живак се използва за получаване на редица важни сплави.
Преди това различни метални амалгами, особено златни и сребърни амалгами, бяха широко използвани в бижутата, в производството на огледала и зъбни пломби. В инженерството живакът се използва широко за барометри и манометри. Живачните съединения се използват като антисептик (сублимат), слабително (каломел), в производството на шапки и др., но поради високата си токсичност до края на 20 век те практически са изместени от тези области (замяна на амалгамацията чрез пулверизиране и електроотлагане на метали, полимерни пломби в стоматологията).
За нискотемпературни термометри се използва сплав от живак с талий.
Металният живак служи като катод за електролитно производстворедица активни метали, хлор и основи, в някои химически източници на ток (например живачно-цинкови - тип RT), в източници на еталонно напрежение (елемент на Weston). Елементът живак-цинк (емф 1,35 волта) има много висока енергия по отношение на обем и маса (130 W/h/kg, 550 W/h/dm).
Живакът се използва за рециклиране на вторичен алуминий и добив на злато (виж амалгама).
Живакът също понякога се използва като работна течност в силно натоварени хидродинамични лагери.
Живакът е съставка в някои биоцидни бои за предотвратяване на замърсяването на корабните корпуси в морската вода.
Меркурий-203 (T1/2 = 53 сек) се използва в радиофармацевтиката.
Използват се и живачни соли:
Живачният йодид се използва като полупроводников радиационен детектор.
Живачният фулминат („Експлозивен живак“) отдавна се използва като иницииращ експлозив (детонатори).
Живачният бромид се използва при термохимичното разлагане на водата на водород и кислород (атомна водородна енергия).
Някои живачни съединения се използват като лекарства (например мертиолат за консервиране на ваксини), но главно поради токсичност, живакът беше изтласкан от медицината (сублимат, живачен оксицианид - антисептици, каломел - слабително и др.) в средата до края на 20 век.

Алуминий
Алуминият е елемент от главната подгрупа на третата група от третия период на периодичната система от химични елементи на Д. И. Менделеев Дмитрий Иванович, атомен номер 13. Означава се със символа Al (лат. Aluminium). Принадлежи към групата на леките метали. Най-разпространеният метал и третият по разпространение (след кислорода и силиция) химичен елемент в земната кора.
Просто вещество Алуминият (CAS номер: 7429-90-5) е лек, немагнитен сребристо-бял метал, който лесно се формова, отлива и обработва машинно. Алуминият има висока топло- и електрическа проводимост, устойчивост на корозия поради бързото образуване на силни оксидни филми, които предпазват повърхността от по-нататъшно взаимодействие.
Според някои биологични изследвания приемът на алуминий в човешкото тяло се счита за фактор за развитието на болестта на Алцхаймер, но по-късно тези изследвания бяха критикувани и заключението за връзката на едното с другото беше опровергано.
Сребристо-бял метал, лек, плътност 2,7 g/cm³, точка на топене технически 658 °C, за алуминий висока чистота 660 °C, точка на кипене 2500 °C, якост на опън на отливка 10-12 kg/mm², деформируема 18-25 kg/mm², сплави 38-42 kg/mm².
Твърдост по Бринел 24-32 kgf / mm², висока пластичност: технически 35%, чист 50%, навит на тънък лист и равномерно фолио.
Алуминият има висока електрическа и топлопроводимост, 65% от електрическата проводимост на Cuprum, има висока светлоотразителна способност.
Алуминият образува сплави с почти всички метали.
При нормални условия алуминият е покрит с тънък и здрав оксиден филм и следователно не реагира с класическите окислители: с H2O (t°); O2, HNO3 (без нагряване). Поради това алуминият практически не е подложен на корозия и следователно е широко търсен. модерна индустрия. Въпреки това, когато оксидният филм се разруши (например при контакт с разтвори на амониеви соли NH4 +, горещи алкали или в резултат на амалгамиране), алуминият действа като активен редуциращ метал.
Лесно реагира с прости вещества:
с кислород:
4Al + 3O2 = 2Al2O3
с халогени:
2Al + 3Br2 = 2AlBr3
реагира с други неметали при нагряване:
със сяра за образуване на алуминиев сулфид:
2Al + 3S = Al2S3
с азот, образувайки алуминиев нитрид:
с въглерод, образувайки алуминиев карбид:
4Al + 3С = Al4С3
Алуминиевият сулфид и алуминиевият карбид са напълно хидролизирани:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
Със сложни вещества:
с вода (след отстраняване на защитния оксиден филм, например чрез амалгамиране или горещи алкални разтвори):
2Al + 6H2O = 2Al(OH)3 + 3H2
с алкали (с образуване на тетрахидроксоалуминати и други алуминати):
2Al + 2NaOH + 6H2O = 2Na + 3H2
2(NaOH.H2O) + 2Al = 2NaAlO2 + 3H2
Лесно разтворим в солна и разредена сярна киселина:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(razb) = Al2(SO4)3 + 3H2
При нагряване се разтваря в киселини - окислители, които образуват разтворими алуминиеви соли:
2Al + 6H2SO4(конц.) = Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3(конц.) = Al(NO3)3 + 3NO2 + 3H2O
възстановява металите от техните оксиди (алуминотермия):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + Cr2O3 = Al2O3 + 2Cr
Широко използван като конструктивен материал. Основните предимства на алуминия в това качество са лекота, ковкост за щамповане, устойчивост на корозия(Алуминият незабавно се покрива със силен филм от Al2O3 във въздуха, което предотвратява по-нататъшното му окисление), висока топлопроводимост, нетоксичност на неговите съединения. По-специално, тези свойства са направили алуминия изключително популярен в производството на съдове за готвене, алуминиево фолиов хранително-вкусовата промишленост и за опаковане.
Основният недостатък на алуминия като конструктивен материал е неговата ниска якост, така че обикновено се легира с малко количество мед и магнезий (сплавта се нарича дуралуминий).
Електрическата проводимост на алуминия е само 1,7 пъти по-малка от тази на Cuprum, докато алуминият е приблизително 2 пъти по-евтин. Поради това той се използва широко в електротехниката за производство на проводници, тяхното екраниране и дори в микроелектрониката за производство на проводници в чипове. По-ниската електропроводимост на алуминия (37 1/ohm) в сравнение с Cuprum (63 1/ohm) се компенсира от увеличаване на напречното сечение на алуминиевите проводници. Недостатъкът на алуминия като електрически материал е силният оксиден филм, който затруднява запояването.
Благодарение на комплекса от свойства, той се използва широко в топлинното оборудване.
Алуминият и неговите сплави запазват здравината си при ултраниски температури. Поради това той се използва широко в криогенната технология.
Високата отразяваща способност, съчетана с ниската цена и лекотата на отлагане, прави алуминия идеален материалза изработка на огледала.
В производство строителни материаликато агент, генериращ газ.
Алуминизирането дава устойчивост на корозия и котлен камък на стомана и други сплави, например клапани на бутални двигатели с вътрешно горене, лопатки на турбини, нефтени платформи, топлообменно оборудване и също така замества поцинковане.
Алуминиевият сулфид се използва за получаване на сероводород.
Провеждат се изследвания за разработване на алуминиева пяна като особено здрав и лек материал.
Когато алуминият беше много скъп, от него се правеха различни бижута. Модата за тях веднага премина, когато се появиха Нови технологии (разработки) за производството му, които го намалиха многократно. Сега алуминият понякога се използва в производството на бижута.


Други метали
Водя
Оловото е елемент от главната подгрупа на четвъртата група, шестия период от периодичната система на химичните елементи на Д. И. Дмитрий Иванович Менделеев, с атомен номер 82. Означава се със символа Pb (лат. Plumbum). Простото вещество Олово (CAS номер: 7439-92-1) е ковък, относително нискотопим сив метал.
Оловото има доста ниска топлопроводимост от 35,1 W/(m K) при 0°C. Металът е мек и се реже лесно с нож. На повърхността обикновено е покрит с повече или по-малко дебел филм от оксиди; когато се нарязва, се отваря лъскава повърхност, която избледнява с времето във въздуха.
Точка на топене: 327,4 °C
Точка на кипене: 1740 °C
Оловният нитрат се използва за производството на мощни смесени експлозиви. Оловният азид се използва като най-широко използваният детонатор (иницииращ експлозив). Оловният перхлорат се използва за приготвяне на тежка течност (плътност 2,6 g/cm3), използвана при флотационното обогатяване на руди; понякога се използва в мощни смесени експлозиви като окислител. Оловният флуорид, както и заедно с бисмут, мед, сребърен флуорид, се използва като катоден материал в химически източници на ток. Оловен бисмутат, оловен сулфид PbS, оловен йодид се използват като катоден материал в литиеви акумулаторни батерии. Оловен хлорид PbCl2 като катоден материал в резервни източници на ток. Оловен телурид PbTe се използва широко като термоелектричен материал (термо-емф с 350 μV/K), най-широко използваният материал в производството на термоелектрически генератори и термоелектрически хладилници. Оловният диоксид PbO2 се използва широко не само в оловни батерии, но и много резервни химически източници на ток се произвеждат на негова основа, например оловно-хлорен елемент, оловно-флуорен елемент и др.
Бяло олово, основен карбонат Pb(OH)2.PbCO3, плътен бял прах, се получава от олово във въздуха под действието на въглероден диоксид и оцетна киселина. Използването на оловно бяло като оцветяващ пигмент сега не е толкова разпространено, колкото беше, поради тяхното разлагане под действието на сероводород H2S. Оловната бяла се използва и за производство на шпакловка, в технологията на циментовата и оловно-карбонатната хартия.
Оловен арсенат и арсенит се използват в технологията на инсектицидите за унищожаване на насекоми вредители селско стопанство(цигарски молец и памукова гъба). Оловен борат Pb(BO2)2H2O, неразтворим бял прах, се използва за изсушаване на картини и лакове и заедно с други метали като покрития върху стъкло и порцелан. Оловен хлорид PbCl2, бял кристален прах, разтворим в гореща вода, разтвори на други хлориди и особено амониев хлорид NH4Cl. Използва се за приготвяне на мехлеми при лечение на тумори.
Оловен хромат PbCrO4, известен като хромово жълто, е важен пигмент за приготвяне на бои, за боядисване на порцелан и текстил. В промишлеността хроматът се използва главно за производството на жълти пигменти. Оловен нитрат Pb(NO3)2 е бяло кристално вещество, силно разтворимо във вода. Това е свързващо вещество с ограничена употреба. В промишлеността се използва при сватовство, боядисване и пълнене на текстил, боядисване на еленови рога и гравиране. Оловен сулфат Pb(SO4)2, неразтворим във вода бял прах, се използва като пигмент в батерии, литография и технология за печатни тъкани.
Оловен сулфид PbS, черен, неразтворим във вода прах, се използва при изпичане на керамика и за откриване на оловни йони.
Тъй като оловото абсорбира добре гама-лъчението, то се използва за защита от радиация в рентгенови машини и в ядрени реактори. Освен това оловото се разглежда като охлаждаща течност в проектите за модерни ядрени реактори с бързи неутрони.
Значително приложение намират оловните сплави. Калайът (калаено-олово сплав), съдържащ 85-90% калай и 15-10% Pb, може да се формова, евтин е и се използва в производството на домакински съдове. В електротехниката се използва припой, съдържащ 67% Pb и 33% калай. Сплави от олово с антимон се използват при производството на куршуми и типографски тип, а сплави от олово, антимон и калай се използват за отливане на фигури и лагери. Сплави на олово с антимон обикновено се използват за обвивка на кабели и плочи на електрически акумулатори. Оловните съединения се използват в производството на багрила, бои, инсектициди, стъкло Търговски артикулии като добавки към бензина под формата на тетраетил олово (C2H5) 4Pb (умерено летлива течност, парите в малки концентрации имат сладка плодова миризма, в големи концентрации, неприятна миризма; Tm = 130 ° C, Tbp = 80 ° C / 13 mm Hg .st.; плътност 1,650 g/cm³; nD2v = 1,5198; неразтворим във вода, смесим с органични разтворители; силно токсичен, лесно прониква през кожата; MPC = 0,005 mg/m³; LD50 = 12,7 mg/m³ kg ( плъхове, орално)) за повишаване на октановото число.

Калай
Калаят е елемент от главната подгрупа на четвъртата група, петият период от периодичната система на химичните елементи на Д. И. Менделеев Дмитрий Иванович, с атомен номер 50. Означава се със символа Метален калай (лат. Stannum). При нормални условия простото вещество е пластичен, ковък и топим лъскав метал със сребристо-бял цвят. Калайът образува няколко алотропни модификации: под 13,2 °C стабилен α-калай (сив калай) с решетка от кубичен диамант, над 13,2 °C стабилен β-калай (бял калай) с тетрагонална кристална решетка.
Калайът се използва предимно като безопасно, нетоксично, устойчиво на корозия покритие в чист вид или в сплави с други метали. Основните промишлени приложения на калай са в ламарина (калайдисано желязо) за производството на контейнери за храна, в спойки за електроника, в домашни водопроводни инсталации, в сплави за лагери и в покрития от калай и неговите сплави. Най-важната сплав на калай е бронз(с Cuprum). Друга добре позната сплав - калайът, се използва за производството на съдове за хранене. AT последно времеима възраждане на интереса към използването на метала, тъй като той е най-„екологичният” сред тежките цветни метали. Използва се за създаване на свръхпроводящи проводници на базата на интерметално съединение Nb3Sn.
цениза метален калай през 2006 г. е средно $12-18/kg, калаен диоксид с висока чистота около $25/kg, монокристален калай с висока чистота около $210/kg.
Интерметалните съединения на калай и цирконий имат високи точки на топене (до 2000 °C) и устойчивост на окисляване при нагряване на въздух и имат редица приложения.
Калайът е най-важният легиращ компонент при производството на структурни титанови сплави.
Калаеният диоксид е много ефективен абразивен материал, използван при "завършване" на повърхността на оптично стъкло.
Смес от калаени соли - "жълт състав" - преди това се използва като боя за вълна.
Калайът се използва и в химически източници на ток като аноден материал, например: елемент манган-калай, елемент оксид-живак-калай. Използването на калай в оловно-калаена батерия е обещаващо; така, например, при еднакво напрежение с оловна батерия, оловно-калаена батерия има 2,5 пъти по-голям капацитет и 5 пъти по-голяма енергийна плътност на единица обем, нейното вътрешно съпротивление е много по-ниско.
Металният калай е нетоксичен, което позволява да се използва в хранително-вкусовата промишленост. Вредните примеси, съдържащи се в калай, при нормални условия на съхранение и употреба, включително в стопилката при температури до 600 ° C, не се отделят във въздуха на работната зона в обеми, надвишаващи максимално допустимата концентрация в съответствие с GOST. Продължителното (15-20 години) излагане на калаен прах има фиброгенен ефект върху белите дробове и може да причини пневмокониоза при работниците.
Приложение на металите
Строителни материали
Металите и техните сплави са едни от основните структурни материали съвременна цивилизация. Това се определя преди всичко от тяхната висока якост, еднородност и непропускливост за течности и газове. В допълнение, чрез промяна на формулировката на сплавите, можете да промените техните свойства в много широк диапазон.
Електрически материали
Металите се използват и като добри проводници Електричество(Мед, Алуминий), и като материали с висока устойчивост за резистори и електрически нагревателни елементи (нихром и др.).
Инструментални материали
Металите и техните сплави се използват широко за производството на инструменти (работната им част). Това са предимно инструментални стомани и твърди сплави. Диамантът, борният нитрид и керамиката също се използват като инструментални материали.
Металургия
Металургията или металургията е област от науката за материалите, която изучава физическото и химичното поведение на металите, интерметалните съединения и сплавите. Металургията също включва практическа употребасъществуващи знания за металите - от добива на суровини до паричната емисия на готови продукти.
Изследването на структурата и физични и химични свойстваметални и оксидни стопилки и твърди разтвори, развитие на теорията за кондензираното състояние на материята;
Изследване на термодинамиката, кинетиката и механизма на металургичните реакции;
Разработване на научно-технически и икономически основи за интегрирано използване на полиметални минерални суровини и техногенни отпадъци с решаване на екологични проблеми;
Развитие на теорията за основите на пирометалургичната, електротермичната, хидрометалургичната и газовата фаза процесипроизводство на метали, сплави, метални прахове и композитни материали и покрития.
Черните метали включват желязо, манган, хром, ванадий. Всички останали са цветни. от физични свойстваи предназначение, цветните метали условно се разделят на тежки (мед, олово, цинк, калай, никел) и леки (алуминий, магнезий).
Основен Технологичен процесПодразделя се на пирометалургия (топене) и хидрометалургия (извличане на метали в химически разтвори). Разновидност на пирометалургията е плазмената металургия.
Плазмена металургия - добив от руди, топене и обработка на метали и сплави под въздействието на плазма.
Обработката на руди (оксиди и др.) се извършва чрез тяхното термично разлагане в плазма. За предотвратяване на обратни реакции се използва редуциращ агент (въглерод, водород, метан и др.) Или рязко охлаждане на плазмения поток, което нарушава термодинамичното равновесие.
Плазмената металургия позволява директно възстановяване на метал от руда, значително ускорява металургичните процеси, получава чисти материали, намаляване на разходите за гориво (редуктор). Недостатъкът на плазмената металургия е високата консумация на електроенергия, използвана за генериране на плазмата.

История
Първите свидетелства, че човек се е занимавал с металургия, датират от 5-6 хилядолетия преди новата ера. д. и са открити в Майданпек, Плочник и други места в Сърбия (включително медна брадва от 5500 г. пр. н. е., принадлежаща на културата Винча), България (5000 г. пр. н. е.), Палмела (), Испания, Стоунхендж (). Въпреки това, както често се случва с такива дългогодишни явления, възрастта не винаги може да бъде точно определена.
В ранната култура присъстват сребро, мед, калай и метеоритно желязо, което позволява ограничена обработка на метали. Така „Небесните кинжали“ били високо ценени – египетски оръжия, създадени от метеоритно желязо 3000 г. пр.н.е. д. Но след като се научи да извлича мед и калай от скално образуваниеи получават сплав, наречена бронз, хората през 3500 г. пр.н.е. д. навлезе в бронзовата епоха.
Получаването на желязо от руда и топенето на метал беше много по-трудно. Смята се, че технологията е изобретена от хетите около 1200 г. пр.н.е. д., което бележи началото на желязната епоха. Тайната на добива и производството на желязо се превърна в ключов фактор във владението на филистимците.
Следи от развитието на черната металургия могат да бъдат проследени в много минали култури и цивилизации. Това включва древните и средновековни кралства и империи от Близкия изток и Близкия изток, древен Египет и Анатолия (), Картаген, гърците и римляните от древността и средновековието Европа, Китай и др. Трябва да се отбележи, че много методи, устройства и технологии на металургията първоначално са изобретени в Древен Китай, а след това европейците усвоиха този занаят (изобретяване на доменни пещи, Излято желязо, стомана, хидравлични чукове и др.). Въпреки това, последните изследвания показват, че римската технология е била много по-напреднала, отколкото се смяташе досега, особено в минното дело и коването.
Минна металургия
Минната металургия се състои в извличане на ценни метали от рудата и претопяване на извлечените суровини в чист метал. За да се превърне метален оксид или сулфид в чист метал, рудата трябва да бъде отделена чрез физични, химични или електролитни средства.
Металурзите работят с три основни компонента: суровини, концентрат (ценен метален оксид или сулфид) и отпадъци. След добива големите парчета руда се раздробяват до такава степен, че всяка частица е или ценен концентрат, или отпадък.
планина Върши работане се изисква, ако рудата и околната среда позволяват извличане. По този начин е възможно да се разтвори и да се получи разтвор, обогатен с Минерала.
Често рудата съдържа няколко ценни метала. В такъв случай отпадъците от един процес могат да се използват като суровина за друг процес.
Сплав
Сплавта е макроскопски хомогенна смес от две или Повече ▼химични елементи с преобладаване на метални компоненти. Основната или единствената фаза на сплавта, като правило, е твърд разтвор на легиращи елементи в метала, който е в основата на сплавта.
Сплавите имат метални свойства, като метален блясък, висока електрическа и топлопроводимост. Понякога компонентите на сплавта могат да бъдат не само химични елементи, но и химични съединения с метални свойства. Например основните компоненти твърди сплависа волфрамови или титаниеви карбиди. Макроскопичните свойства на сплавите винаги се различават от свойствата на техните компоненти, а макроскопската хомогенност на многофазните (хетерогенни) сплави се постига благодарение на равномерното разпределение на примесните фази в металната матрица.
Сплавите обикновено се получават чрез смесване на компонентите в разтопено състояние, последвано от охлаждане. При високи температури на топене на компонентите сплавите се получават чрез смесване на метални прахове, последвано от синтероване (така се получават например много волфрамови сплави).
Сплавите са едни от основните структурни материали. Между тях най-висока стойностимат сплави на основата на желязо и алуминий. В състава на много сплави могат да бъдат въведени и неметали, като въглерод, силиций, бор и др.. В технологията се използват повече от 5 хиляди сплави.
Източници
http://ru.wikipedia.org/
Енциклопедия на инвеститора. 2013 .
Синоними:- - МЕТАЛ, метален мъж, лат. трошачка; и в малка форма, в топене: царче. В ежедневието, ценни, скъпи метали: злато, платина, сребро; прости: желязо, мед, цинк, калай, олово; химията е открила такива начала на почти всички вкаменелости, състоящи се от ... ... РечникДалия
И други химични съединения. За получаване на чисти метали и тяхното по-нататъшно използване е необходимо да се отделят от рудите и да се извърши пречистване. При необходимост се извършва легиране и друга обработка на металите. С изучаването на това се занимава науката металургия. Металургията прави разлика между руди на черни метали (на базата на желязо) и руди на цветни метали (желязото не е включено в състава им, само около 70 елемента). Златото, среброто и платината също са благородни (благородни) метали. Освен това те присъстват в малки количества в морската вода, растенията, живите организми (като играят важна роля).
Известно е, че човешкото тяло е 3% съставено от метали. Най-много в нашите клетки има калций и натрий, концентрирани в лимфните системи. Магнезият се натрупва в мускулите и нервната система, медта - в черния дроб, желязото - в кръвта.
Минен
Металите често се извличат от земята чрез минната промишленост, резултатът - добитите руди - служат като относително богат източник на необходимите елементи. За да се установи местоположението на рудите, се използват специални методи за търсене, включително проучване на руди и проучване на находища. Депозитите обикновено се разделят на кариери (разработване на руди на повърхността), в които добивът се извършва чрез извличане на почвата с помощта на тежко оборудване, както и подземни мини.
От добитата руда металите се извличат, като правило, чрез химична или електролитна редукция. В пирометалургията високите температури се използват за превръщане на рудата в метални суровини; в хидрометалургията химията на водата се използва за същата цел. Използваните методи зависят от вида на метала и вида на замърсяването.
Когато металната руда е йонно съединение на метал и неметал, тя обикновено се подлага на топене - нагряване с редуциращ агент - за извличане на чистия метал. Много обикновени метали, като желязо, се топят с помощта на въглерод (получен от изгаряне на въглища) като редуциращ агент. Някои метали, като алуминий и натрий, нямат никакви икономически изгодни редуциращи агенти и се възстановяват чрез електролиза.
Твърдостта на някои метали по скалата на Моос:
| твърдост | Метал |
|---|---|
| 0.2 | Цезий |
| 0.3 | Рубидий |
| 0.4 | калий |
| 0.5 | Натрий |
| 0.6 | литий |
| 1.2 | Индий |
| 1.2 | Талий |
| 1.25 | Барий |
| 1.5 | Стронций |
| 1.5 | Галий |
| 1.5 | Калай |
| 1.5 | Водя |
| 1.5 | |
| 1.75 | калций |
| 2.0 | Кадмий |
| 2.25 | Бисмут |
| 2.5 | Магнезий |
| 2.5 | Цинк |
| 2.5 | лантан |
| 2.5 | Сребро |
| 2.5 | злато |
| 2.59 | Итрий |
| 2.75 | Алуминий |
| 3.0 | Мед |
| 3.0 | Антимон |
| 3.0 | Торий |
| 3.17 | скандий |
| 3.5 | Платина |
| 3.75 | Кобалт |
| 3.75 | Паладий |
| 3.75 | Цирконий |
| 4.0 | Желязо |
| 4.0 | никел |
| 4.0 | Хафний |
| 4.0 | Манган |
| 4.5 | Ванадий |
| 4.5 | Молибден |
| 4.5 | Родий |
| 4.5 | Титан |
| 4.75 | Ниобий |
| 5.0 | Иридий |
| 5.0 | Рутений |
| 5.0 | Тантал |
| 5.0 | Технеций |
| 5.0 | хром |
| 5.5 | Берилий |
| 5.5 | Осмий |
| 5.5 | Рений |
| 6.0 | Волфрам |
| 6.0 | β-уран |
Поради лесното връщане на електрони е възможно окисляване на металите, което може да доведе до корозия и допълнително влошаване на свойствата. Способността за окисление може да бъде разпозната от стандартната серия от активност на металите. Този факт потвърждава необходимостта от използване на метали в комбинация с други елементи (сплав, най-важната от които е стоманата), тяхното легиране и използването на различни покрития.
За по-правилно описание на електронните свойства на металите е необходимо да се използва квантовата механика. Във всички твърди тела с достатъчна симетрия енергийните нива на електроните на отделните атоми се припокриват и образуват разрешени ленти, а лентата, образувана от валентни електрони, се нарича валентна зона. Слабата връзка на валентните електрони в металите води до факта, че валентната лента в металите се оказва много широка и всички валентни електрони не са достатъчни, за да я запълнят напълно.
Основната характеристика на такава частично запълнена зона е, че дори при минимално приложено напрежение в пробата започва пренареждането на валентните електрони, т.е. протича електрически ток.
Същата висока подвижност на електроните води до висока топлопроводимост, както и до способността за отразяване на електромагнитното излъчване (което придава на металите характерен блясък).
Някои метали
- Бели дробове:
- Други:
Приложение на метали
Строителни материали
Инструментални материали
Историята на развитието на идеите за металите
Запознаването на човека с металите започва със златото, среброто и медта, тоест с металите, намиращи се в свободно състояние на земната повърхност; впоследствие към тях се присъединяват метали, които са широко разпространени в природата и лесно се изолират от техните съединения: калай, олово, желязо и. Тези седем метала са били познати на човечеството в древността. Сред древните египетски артефакти има златни и медни предмети, които според някои източници принадлежат към епоха, отдалечена с 3000-4000 години преди новата ера. д.
Цинк, бисмут, антимон са добавени към седемте известни метала едва през Средновековието, а през началото на XVIIIвек арсен. От средата на 18 век броят на откритите метали нараства бързо и в началото на 20 век достига 65, а през началото на XXIвек - до 96г.
Нито една от химическите индустрии не е допринесла толкова много за развитието на химическите познания, колкото процесите, свързани с производството и обработката на метали; свързани с тяхната история акцентиистория на химията. Свойствата на металите са толкова характерни, че още в самото начало ранна еразлато, сребро, мед, олово, калай, желязо и живак са били една естествена група от хомогенни вещества, а понятието "метал" принадлежи към най-древните химически понятия. Но възгледите за тяхната природа в повече или по-малко определена форма се появяват едва през Средновековието сред алхимиците. Вярно е, че идеите на Аристотел за природата: формирането на всичко, което съществува от четирите елемента (огън, земя, вода и въздух) вече показват сложността на металите; но тези идеи бяха твърде неясни и абстрактни. За алхимиците концепцията за сложността на металите и в резултат на това вярата в способността да се трансформира един метал в друг, да се създават изкуствено, е основната концепция на техния мироглед. Тази концепция е естествен извод от масата факти, свързани с химичните трансформации на металите, натрупани дотогава. Всъщност превръщането на метал в оксид, напълно различен от тях чрез просто калциниране във въздуха и обратното производство на метал от оксид, отделянето на някои метали от други, образуването на сплави с други свойства, различни от първоначално взетите метали, и така нататък - всичко това като че ли показваше сложността на тяхната природа.
Що се отнася до действителното превръщане на металите в злато, вярата във възможността за това се основаваше на много хора видими факти. Първоначално образуването на сплави, подобни на цвят на златото, например от мед и цинк, в очите на алхимиците вече беше тяхното превръщане в злато. Струваше им се, че трябва да се промени само цветът и свойствата на метала също ще станат различни. По-специално, зле организирани експерименти допринесоха много за това вярване, когато вещества, съдържащи примес от това злато, бяха взети, за да превърнат неблагороден метал в злато. Например, вече в края на XVIIIВ продължение на векове един копенхагенски фармацевт уверява, че химически чистото сребро, когато се слее с арсен, частично се превръща в злато. Този факт беше потвърден от известния химик Гитон де Морво и вдигна много шум. Скоро след това беше показано, че арсенът, използван за експеримента, съдържа следи от сребро със злато.
Тъй като от седемте известни тогава метала едни се поддават на химични трансформации по-лесно, други по-трудно, алхимиците ги разделят на благородни – съвършени и неблагородни – несъвършени. Първият включва злато и сребро, вторият мед, калай, олово, желязо и живак. Последният, притежаващ свойствата на благородните метали, но същевременно рязко отличаващ се от всички метали по своето течно състояние и летливост, изключително занимаваше тогавашните учени, а някои го открояваха в специална група; привлеченото внимание към него е толкова голямо, че живакът започва да се счита за един от елементите, от които се образуват самите метали, и именно в него виждат носител на метални свойства. Приемайки съществуването в природата на прехода на едни метали към други, несъвършени към съвършени, алхимиците приемат, че при нормални условия тази трансформация протича изключително бавно, в продължение на векове и може би не без мистериозното участие на небесни тела, към които такова голяма роля се приписва по това време.и в съдбата на човека. По стечение на обстоятелствата тогава е имало седем известни метала, както и известните тогава планети, което още повече показва мистериозна връзка между тях. Сред алхимиците металите често се наричат планети; златото се нарича Слънцето, среброто - Луната, медта - Венера, калайът - Юпитер, оловото - Сатурн, желязото - Марс и живакът - Меркурий. Когато бяха открити цинк, бисмут, антимон и арсен, тела, които във всички отношения са подобни на металите, но в които едно от най-характерните свойства на метала, пластичността, е слабо развито, те бяха отделени в специална група - полуметали. Разделението на металите на собствени метали и полуметали съществува още през средата на осемнадесетивекове.
Определянето на състава на метала първоначално е било чисто спекулативно. Първоначално алхимиците приемат, че са образувани от два елемента - и сяра. Произходът на този възглед е неизвестен, той съществува още през 8 век. Според Гебер доказателството за наличието на живак в металите е, че той ги разтваря и в тези разтвори тяхната индивидуалност изчезва, абсорбира се от живака, което не би се случило, ако те нямаха един общ принцип с живака. Освен това живакът с оловото даде нещо подобно на калая. Що се отнася до сярата, може да се окаже, че е взета, защото серните съединения са били известни, според външен видподобно на металите. В бъдеще тези прости идеи, вероятно поради неуспешни опити за изкуствено получаване на метали, стават изключително сложни и объркани. В концепциите на алхимиците, например, от X-XIII век, живакът и сярата, от които се образуват металите, не са същите живак и сяра, които алхимиците са имали в ръцете си. Беше само нещо подобно на тях, със специални свойства; нещо, което наистина съществуваше в обикновената сяра и живак, беше изразено в тях в по-голяма степен, отколкото в други тела. Под живака, който е част от металите, те представляват нещо, което определя тяхната неизменност, метален блясък, ковкост, с една дума носител на метален вид; сярата означаваше носител на променливост, разпадимост, горимост на металите. Тези два елемента се намират в металите в различни пропорции и, както казаха тогава, по различни начинификсирани; освен това те могат да бъдат с различна степен на чистота. Според Гебер, например, златото се състои от голямо количество живак и малко количество сяра с най-висока чистота и най-фиксираната; в калай, напротив, те приемат много сяра и малко живак, които не са чисти, лошо фиксирани и т.н. С всичко това, разбира се, те искаха да изразят различното отношение на металите към единствения по онова време мощен химичен агент - огъня. При по-нататъчно развитиетези възгледи за два елемента - живак и сяра - изглеждаха на алхимиците недостатъчни, за да обяснят състава на металите; към тях се добавя сол и малко арсен. С това те искаха да посочат, че при всички трансформации на металите остава нещо нелетливо, постоянно. Ако в природата „превръщането на неблагородните метали в благородни отнема векове“, тогава алхимиците се стремят да създадат условия, при които този процес на усъвършенстване и съзряване да протича бързо и лесно. Поради тясната връзка на химията с тогавашната медицина и биология на времето, идеята за трансформацията на металите естествено се идентифицира с идеята за растежа и развитието на организирани тела: преходът, напр. олово в злато, образуването на растение от зърно, хвърлено в земята и сякаш разложено, ферментация, излекуване на болен орган в човек - всичко това бяха частни явления на един общ мистериозен жизнен процес, подобрение и са причинени от едни и същи стимули. Оттук се разбира, че мистериозното начало, което прави възможно получаването на злато, е трябвало да лекува болести, да обръща старото човешкото тялов младостта и така нататък. Така се формира представата за чудодейния философски камък.
Що се отнася до ролята на философския камък при превръщането на неблагородните метали в благородни, има най-много индикации за превръщането им в злато, малко се говори за получаването на сребро. От същите автори, същото философски камъкпревръща металите в сребро и злато; според други има два вида това вещество: едното е съвършено, другото е по-малко съвършено и последното се използва за получаване на сребро. По отношение на количеството философски камък, необходимо за трансформацията, инструкциите също са различни. Според някои 1 част от него е в състояние да превърне 10 000 000 части метал в злато, според други - 100 части и дори само 2 части. За да се получи злато, се топил някакъв неблагороден метал или се вземал живак и в него се хвърлял философският камък; някои увериха, че трансформацията настъпва мигновено, докато други - малко по малко. Тези възгледи за природата на металите и за способността им да се трансформират обикновено се поддържат в продължение на много векове до 17 век, когато те започват рязко да отричат всичко това, още повече че тези възгледи предизвикаха появата на много шарлатани, които експлоатираха надеждата на лековерните да получат злато. Бойл особено се бореше с идеите на алхимиците: „Бих искал да знам“, казва той на едно място, „как можете да разложите златото на живак, сяра и сол; Готов съм да платя цената на това преживяване; що се отнася до мен, никога не съм успявал да го постигна.
След векове на безплодни опити за изкуствено производство на метали и с количеството факти, натрупани до XVII век, например за ролята на въздуха по време на горенето, увеличаването на теглото на метала по време на окисляването, което обаче Гебер знае още през VIII век, въпросът за елементарния състав на метала изглеждаше много близък до край; но в химията се появи нова тенденция, резултатът от която беше теорията на флогистона, и решението на този проблем все още се отлагаше дълго време.
Учените от това време са силно заети с феномена на горенето. Въз основа на основната идея на тогавашната философия, че сходството в свойствата на телата трябва да идва от еднаквостта на началата, елементите, които ги съставят, се приемаше, че горимите тела заключават общ елемент. Актът на изгаряне се смяташе за акт на разлагане, разпадане на елементи; в този случай горимият елемент се освобождава под формата на пламък, а останалите остават. Признаване на възгледа на алхимиците за образуването на метали от трите елемента живак, сяра и сол и приемането им реално съществуванев метала горимият принцип в тях трябваше да бъде разпознат като сярата. Тогава, очевидно, е било необходимо да се разпознае остатъкът от калцинирането на метала - "земята", както казаха тогава, като друг компонент на метала; следователно живакът няма нищо общо с това. От друга страна, сярата изгаря в сярна киселина, която, по силата на казаното, се смяташе от мнозина за по-просто тяло от сярата и се причисляваше към елементарните тела. Имаше объркване и противоречие. Бехер, за да хармонизира старите концепции с новите, приема съществуването на три вида пръст в метала: самата "земя", "горима пръст" и "живачна пръст". При тези условия Щал предлага своята теория. Според него началото на горимостта не е сярата или друго известно вещество, а нещо неизвестно, което той нарича флогистон. Металите изглежда са образувани от флогистон и пръст; калцинирането на метала във въздуха е придружено от освобождаване на флогистон; обратното производство на метали от неговата земя с помощта на въглища - вещество, богато на флогистон - е актът на комбиниране на флогистон със земята. Въпреки че имаше няколко метала и всеки от тях, когато се калцинира, даде своя земя, последният като елемент беше един, така че този компонент на метала беше от същата хипотетична природа като флогистона; въпреки това, последователите на Стал понякога приемаха толкова много "елементни земи", колкото имаше метали. Когато Кавендиш, чрез разтваряне на метали в киселини, получава водород и изследва свойствата му (неспособност да поддържа горене, неговата експлозивност в смес с въздух и т.н.), той разпознава в него флогистона на Щал; металите, според неговите концепции, се състоят от водород и "земя". Тази гледна точка беше приета от много последователи на теорията на флогистона.
Въпреки привидната хармония на теорията за флогистона, имаше големи фактикоито не биха могли да бъдат свързани с нея по никакъв начин. Гебер също знаеше, че металите увеличават теглото си при изпичане; междувременно, според Щал, те трябва да загубят флогистона: когато флогистонът се прикрепи отново към „земята“, теглото на получения метал е по-малко от теглото на „земята“. Така се оказа, че флогистонът трябва да има някакво специално свойство - отрицателна гравитация. Въпреки всички гениални хипотези, издигнати за обяснение на този феномен, той беше неразбираем и озадачаващ.
Когато Лавоазие изясни ролята на въздуха по време на горенето и показа, че увеличаването на теглото на металите по време на изпичането идва от добавянето на кислород от въздуха към металите и по този начин установи, че актът на изгаряне на металите не е разпадане на елементи, а на напротив, акт на комбинация, въпросът за сложността на металите беше решен отрицателно. Металите са причислени към прости химични елементи, поради основната идея на Лавоазие, че простите тела са тези, от които не е възможно да се изолират други тела. Със създаването на периодичната система на химичните елементи от Менделеев елементите на металите заемат своето достойно място в нея.
Вижте също
Бележки
Връзки
- С. П. Вуколов: // Енциклопедичен речник на Брокхаус и Ефрон: В 86 тома (82 тома и 4 допълнителни). - Санкт Петербург. , 1890-1907.(историческа част)
| Периодичната таблица | |
|---|---|
| Дмитрий Иванович Менделеев Периодичен закон Групи елементи | |
| Формати | Къси блокови Разширени Разширени електронни конфигурации Електроотрицателност Алтернативни изотопи на елементи |
| Списъци с артикули по | Име · Етимология (в чест на места, в чест на откриватели) · Време на откриване Състояния на окисление Изобилие (при хора) Изотопна стабилност |
По-голямата част (93 от 117) от известните в момента химични елементи са метали.
Атомите на различни метали имат много общо в структурата, а образуваните от тях прости и сложни вещества имат сходни свойства (физични и химични).
Позиция в периодичната система и структурата на металните атоми.
В периодичната таблица металите са разположени отляво и под условната прекъсната линия, преминаваща от бор към астат (виж таблицата по-долу). Металите включват почти всички s-елементи (с изключение на H, He), около половината Р- елементи, всички д- и f-елементи ( лантанидии актиниди).
Повечето метални атоми имат външно енергийно ниво, съдържащо малък брой(до 3) електрона, само някои p-елементи атоми (Sn, Pb, Bi, Po) имат повече от тях (от четири до шест). Валентните електрони на металните атоми са слабо (в сравнение с неметалните атоми) свързани с ядрото. Следователно металните атоми относително лесно даряват тези електрони на други атоми, действайки в химични реакции само като редуциращи агенти и в същото време се превръщат в положително заредени катиони:
Аз - ne - \u003d Me n +.
За разлика от неметалите, за металните атоми са характерни само положителни степени на окисление от +1 до +8.
Лекотата, с която металните атоми даряват своите валентни електрони на други атоми, характеризира редуциращата активност на даден метал. Колкото по-лесно един метален атом се отказва от своите електрони, толкова по-силен е той като редуциращ агент. Ако подредим металите в ред по ред на намаляване на тяхната редукционна способност във водни разтвори, получаваме известното ни серия от изместване на метали, което също се нарича електрохимична серия от напрежения (или дейност наблизо) метали (вижте таблицата по-долу).
Разпространение mметали в природата.
Първите три най-често срещани метала в земната кора (това е повърхностният слой на нашата планета с дебелина около 16 km) включват алуминий, желязо и калций. По-рядко срещани са натрий, калий и магнезий. Таблицата по-долу показва масовите фракции на някои метали в земната кора.
желязо и калций. По-рядко срещани са натрий, калий и магнезий. Таблицата по-долу показва масовите фракции на някои метали в земната кора.
Разпространението на металите в земната кора
| Метал | Метал | Масова част в земната кора,% | |
|---|---|---|---|
| Ал | 8,8 | Кр | 8,3 ∙ 10 -3 |
| Fe | 4,65 | Zn | 8,3 ∙ 10 -3 |
| ок | 3,38 | Ni | 8 ∙ 10 -3 |
| Na | 2,65 | Cu | 4,7 ∙ 10 -3 |
| К | 2,41 | Pb | 1,6 ∙ 10 -3 |
| мг | 2,35 | Ag | 7 ∙ 10 -6 |
| Ти | 0,57 | hg | 1,35 ∙ 10 -6 |
| Мн | 0,10 | Au | 5 ∙ 10 -8 |
Наричат се елементи, чиято масова част в земната кора е по-малка от 0,01%. редки. Редките метали включват, например, всички лантаниди. Ако даден елемент не може да се концентрира в земната кора, тоест не образува собствени руди, а се среща като смес с други елементи, тогава той се класифицира като разпръснатиелементи. Разпръснати са например следните метали: Sc, Ga, In, Tl, Hf.
През 40-те години на ХХ век. Германските учени Валтер и Ида Нола предполагат това. че всеки калдъръм върху настилката съдържа всички химични елементи от периодичната система. Първоначално тези думи бяха посрещнати далеч от единодушно одобрение от колегите им. С появата на все по-точни методи за анализ обаче учените все повече се убеждават в истинността на тези думи.
Тъй като всички живи организми са в близък контакт с околен свят, тогава всеки от тях трябва да съдържа, ако не всички, то повечето от химичните елементи на периодичната система. Например, в тялото на възрастен, масовата част неорганични веществае 6%. От металите в тези съединения има Mg, Ca, Na, K. Много ензими и други биологично активни органични съединения в нашето тяло съдържат V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Cr и някои други метали .
Тялото на възрастен човек съдържа средно около 140 g калиеви йони и около 100 g натриеви йони. С храната ежедневно приемаме от 1,5 g до 7 g калиеви йони и от 2 g до 15 g натриеви йони. Нуждата от натриеви йони е толкова голяма, че те трябва да се добавят специално към храната. Значителна загуба на натриеви йони (под формата на NaCl с урина и пот) се отразява неблагоприятно на човешкото здраве. Затова в горещо време лекарите препоръчват да се пие минерална вода. Въпреки това, излишното съдържание на сол в храната се отразява негативно на работата на нашите вътрешни органи (предимно сърцето и бъбреците).
Трябва да активирате JavaScript, за да гласуватеОт ранно детствосе сблъскваме с фразата, че такъв и такъв предмет е направен от метал. Какво е метал?
Металите са определена група химични елементи (както и техните сплави), които имат свойства, общи за цялата група, като повишена якост, добра топло- и електропроводимост, ковкост, пластичност и метален блясък.
Почти 80% от всички известни химични елементи принадлежат към металите (96 от 118).
Физични свойства на металите
Всички метали, с изключение на живака, са в твърдо състояние при нормални условия. По отношение на твърдостта най-мекият метал е цезият (0,2 точки по 10-степенната скала на Моос). Най-твърд е волфрамът. Твърдостта му е 6 точки. Твърдостта на желязото е 4 точки.
Точките на топене (преход към течно състояние) за металите варират: от -39º за живак до 3410º за волфрам. Всички алкални метали имат ниски точки на топене, а от обикновените - калайът и оловото. Те могат да се разтопят дори у дома на газова горелка. Повечето метали се топят в специални пещи при високи температури.
Благодарение на присъствието в кристални решеткиметали на свободни подвижни електрони, всички те провеждат електричество и топлина много добре. Най-добрите проводници на електричество от метали са среброто, медта и алуминият. Неслучайно електрическите кабели са направени от последните два метала.
С отличната топлопроводимост на металите също често се сблъскваме в ежедневието. За да заври вода, я изсипваме в метална тенджера и я слагаме на котлона. Десет загрява метала, а металът предава почти всичко Термална енергиявода.
Химични свойства на металите
По време на химична реакцияВсички метали лесно отдават своите електрони и действат като редуциращи агенти.
Почти всички метали се окисляват от кислород. Алкалните метали (литий, калций) взаимодействат с кислорода при нормални условия. За да се окислят други метали с кислород, е необходима повишена температура. Например, ако нагреете медна жица над огън, медта ще взаимодейства с кислорода от въздуха и ще се покрие с черен филм (меден оксид):
- 2Сu +O 2 → 2CuO
Златото и платината не реагират с кислорода.
От другите окислители хлорът и сярата реагират с металите. Ако смесим железни стружки и сяра на прах и загреем сместа, тогава пред очите ни се получава железен сулфид:
- Fe+S → FeS
Редукционната активност на различните метали е различна. Според дейността си металите се разпределят както следва:
- Li - K - Ba - Sr - Ca - Na - Mg - Al - Mn - Zn - Cr - Fe - Ca - Co - Ni - Sn - Pb - (H2) - Cu - Hg - Ag - Pt - Au.
Колкото по-наляво в този ред е металът, толкова по-активен е той. Предишният елемент може да измести метала надясно. Например, ако парче желязо се постави в епруветка с разтвор на меден сулфат, тогава то ще бъде покрито с кафяво покритие (меден филм):
- Fe + CuSO4 → FeSO4 + Cu
Металите отляво на водорода (H2) могат да го изместят от солната киселина. Ако парче цинк се потопи в солна киселина, ще започне да се отделя водород:
- HCl + Zn → ZnCl2 + H2
Алкалните метали лесно реагират с вода. Ако парче натрий се постави в съд с вода, тогава водородът ще започне активно да се развива и ще се образуват алкали:
- 2Na + 2H2O → 2NaOH + H2
Приложение на метали
Благодарение на техните полезни свойстваметалите са навлезли здраво в човешкия живот. Човек използва силата на металите, като ги прави рамки на сгради (от малки павилиони до огромни небостъргачи), корпуси на машини (автомобили, вагони, кораби, машини), както и работни части на различни инструменти.


