Първо метален алуминийе получен химически от немския химик F. Wöhler през 1821 г. (редукция от алуминиев хлорид с метален калий при нагряване). През 1854 г. френският учен Сен-Клер Девил предлага електрохимичен метод за производство на алуминий чрез редуциране на алуминиево-натриев двоен хлорид с натрий.
Производство и производство на алуминий
Металният алуминий се получава на три етапа:
- Получаване на алуминиев оксид (Al 2 O 3) от алуминиеви руди;
- Получаване на алуминий от алуминий;
- рафиниране на алуминий.
Получаване на алуминиев оксид
Около 95% от целия двуалуминиев оксид се получава от бокситни руди.
Боксит(Френски боксит) (по името на района Baux в южната част на Франция) - алуминиева руда, състояща се от алуминиеви хидроксиди, оксиди на желязо и силиций, суровини за производството на алуминиев оксид и огнеупорни материали, съдържащи алуминий. Съдържанието на алуминиев оксид в търговските боксити варира от 40% до 60% и повече. Използва се и като флюс в черната металургия.
Снимка 1 - Бокситна руда
Обикновено бокситът е земна, подобна на глина маса, която може да има ивична, пизолитна (подобна на грах) или еднородна текстура. При нормални атмосферни условия фелдшпатите (минерали, които съставляват повечето земната кораи като алумосиликати) се разлагат с образуването на глини, но при горещ климат и висока влажност бокситът може да се окаже краен продукт от тяхното разлагане, тъй като такава среда благоприятства отстраняването на основи и силициев диоксид, особено от сиенити или габро. Бокситите се преработват в алуминий на етапи: първо се получава алуминиев оксид (алуминиев оксид), а след това метален алуминий (електролитно в присъствието на криолит).
Основните примеси в бокситите са Fe 2 O 3 , SiO 2 , TiO 2 . Малките примеси на бокситите включват: Na 2 O, K 2 O, CaO, MgO, редкоземни елементи, Cr, P, V, F, органични вещества.
Обикновено бокситите се класифицират:
- по цвят;
- по основния минерал (по-често се смесват);
- според възрастта.
Основни критерии качествата на алуминиевата руда са:
- Силициев модул (Msi = Al 2 O 3 /SiO 2 (% тегл.)). Колкото по-голям е силициевият модул, толкова по-добро качество(Msi = 7);
- Съдържание на желязо по отношение на Fe 2 O 3 . Ако съдържанието на Fe 2 O 3 е около 18 тегл.%, тогава бокситът се счита за високо съдържание на желязо. Колкото по-голямо е съдържанието на желязо, толкова по-трудно е да се добиват боксити;
- Съдържание на сяра. Наличието на голямо количество сяра усложнява обработката на боксит;
- Съдържанието на карбонати по отношение на CO 3 (2-) . Наличието на голямо количество карбонати усложнява преработката на боксит.
Използват се боксити:
- в производството на алуминиев оксид;
- в производството на абразивни материали;
- в производството на огнеупорни материали;
- като флюс за топене на мартенова стомана;
- за изсушаване на газове и почистване на масло от сяра;
- като багрило.
Към днешна дата основните доставчици на боксит са:
- Австралия - има и огромни залежи на Fe, Au, U, Ni, Co, Cu и др. По-изгодно е да купувате суровини от Австралия, отколкото да преработвате свои собствени.
- Гвинея - Русия има няколко закупени места.
- Централна Америка: Гвиана, Ямайка, Суриман.
- Бразилия.
В Европа всички залежи са изчерпани. Бокситите се доставят от Гърция, но тази суровина е с лошо качество.

Фигура 2 - Запаси от боксит в света
По-долу са основните находища на алуминиеви руди в Русия.
- Първото находище е открито през 1914 г. близо до Санкт Петербург, близо до град Тихвин. На това находище са построени 6 завода. Най-големият е Волховският алуминиев завод. Към днешна дата находището Тихвинское е изчерпано и работи главно с вносни суровини.
- През 1931 г. е открито уникалното Северо-Уралское находище на висококачествен боксит (СУБР). Той послужи като основа за изграждането през 1939 г. на Уралския алуминиев завод (УАЗ). И на базата на бокситната мина Южен Урал (YUBR) е построен Богословският алуминиев завод (BAZ).
- Североонежското поле се намира по пътя към Колския полуостров. Има го в плана, но датата на построяване е неизвестна.
- Висловското находище е чисто глинено находище от типа на каолита. Не се използва за алуминий.
- Тиманское поле (Република Коми, Варкута). Канадците се интересуват от това поле, така че планират да строят заводи (Komi Sual е холдингова компания).
Получаване на алуминиев оксид от бокситни руди
Тъй като алуминият е амфотерен, алуминият се произвежда по три начина:
- алкален,
- киселина;
- електролитен.
Най-разпространеният е алкалният метод (методът на K. I. Bayer, разработен в Русия в края на предишния век и използван за обработка на висококачествени боксити с малко количество (до 5-6%) силициев диоксид). От техническо изпълнениетой е значително подобрен. Схемата за производство на алуминиев оксид по метода на Байер е показана на фигура 3.
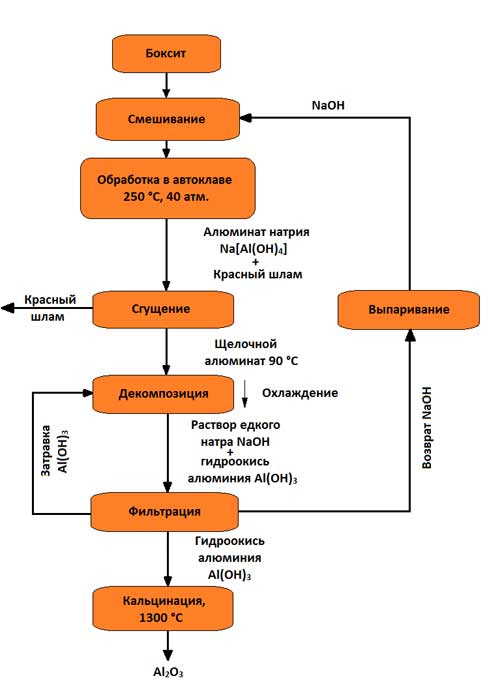
Фигура 3 - Схема за получаване на алуминиев оксид по метода на Байер
Същността на метода е, че алуминиевите разтвори бързо се разпадат, когато в тях се въведе алуминиев хидроксид, а разтворът, останал от разлагането след изпаряването му при условия на интензивно смесване при 169–170 ° C, може отново да разтвори алуминиевия оксид, съдържащ се в бокситите. Този метод се състои от следните основни операции:
1. Приготвяне на боксит, което се състои в неговото раздробяване и смилане в мелници; мелниците се доставят с боксит, каустик и др голям бройвар, който подобрява разпределението на Al 2 O 3; получената целулоза се подава за излугване;
2. Излужване на боксит (в последно времеизползваните досега автоклавни блокове с кръгла форма са частично заменени от тръбни автоклави, в които излужването става при температури 230–250 ° C (500–520 K), което се състои в химичното му разлагане от взаимодействие с воден разтворалкали; хидратите на алуминиевия оксид, когато взаимодействат с алкали, преминават в разтвор под формата на натриев алуминат:
AlOOH+NaOH→NaAlO2 +H2O
Al(OH)3 +NaOH→NaAlO2 +2H2O;
SiO 2 +2NaOH→Na 2 SiO 3 +H2O;
в разтвор натриевият алуминат и натриевият силикат образуват неразтворим натриев алумосиликат; титанови и железни оксиди преминават в неразтворимия остатък, придавайки на остатъка червен цвят; този остатък се нарича червена кал. След завършване на разтварянето, полученият натриев алуминат се разрежда с воден разтвор на алкали, докато температурата се понижава със 100 ° C;
3. Отделяне на алуминатен разтвор от червена кал, обикновено се извършва чрез промиване в специални сгъстители; в резултат на това червената кал се утаява, а алуминатният разтвор се отцежда и след това се филтрира (избистря). В ограничени количества утайката се използва например като добавка към цимента. В зависимост от класа на боксита на 1 тон произведен двуалуминиев оксид се падат 0,6 - 1,0 тона червена кал (сух остатък);
4. Разлагане на алуминатния разтвор. Филтрира се и се изпомпва в големи контейнери с бъркалки (разлагатели). Алуминиевият хидроксид Al(OH) 3 се екстрахира от свръхнаситен разтвор при охлаждане до 60 °C (330 K) и постоянно разбъркване. Тъй като този процес протича бавно и неравномерно, образуването и растежът на кристали от алуминиев хидроксид са голямо значениепо време на по-нататъшната му обработка голямо количество твърд хидроксид се добавя към разложителите - семена:
Na2O Al2O3 + 4H2O→Al(OH)3 + 2NaOH;
5. Разпределяне на алуминиев хидроксид и неговата класификация; това се случва в хидроциклони и вакуумни филтри, където утайка, съдържаща 50 - 60% частици Al(OH) 3, се отделя от алуминатния разтвор. Значителна част от хидроксида се връща в процеса на разлагане като зародишен материал, който остава в обращение в непроменени количества. Остатъкът след измиване с вода отива за калциниране; филтратът също се връща в циркулация (след концентриране в изпарители - за излугване на нови боксити);
6. Дехидратация на алуминиев хидроксид (калциниране); това е крайната операция на производството на алуминиев оксид; извършва се в тръбни ротационни пещи, а напоследък и в пещи с турбулентно движение на материала при температура 1150 - 1300 °С; суров алуминиев хидроксид, преминаващ през ротационна пещ, изсушен и дехидратиран; при нагряване се извършват последователно следните структурни трансформации:
Al(OH) 3 → AlOOH → γ-Al 2 O 3 → α-Al 2 O 3
200 °C - 950 °C - 1200 °C.
Крайният калциниран двуалуминиев оксид съдържа 30 - 50% α-Al2O3 (корунд), останалото е γ-Al 2 O 2 .
Този метод извлича 85 - 87% от целия произведен алуминиев оксид. Полученият двуалуминиев оксид е силен химическо съединениес точка на топене 2050 ° C.
Получаване на алуминий чрез електролиза
Електролитната редукция на алуминиев оксид, разтворен в стопилка на основата на криолит, се извършва при 950–970 °C в електролитна клетка. Електролизерът се състои от вана, облицована с въглеродни блокове, към дъното на която a електричество. Течният алуминий, отделен на дъното, служещ като катод, е по-тежък от стопилката на електролитната сол, поради което се събира върху въглищна основа, откъдето периодично се изпомпва (Фигура 4). Отгоре въглеродните аноди са потопени в електролита, които изгарят в атмосферата на кислород, отделен от алуминиев оксид, освобождавайки въглероден оксид (CO) или въглероден диоксид (CO 2). На практика се използват два вида аноди:
- самоизпичащи се аноди Zederberg, състоящи се от брикети, така наречените "хлябове" от масата Zederberg (ниско пепелни въглища с 25 - 35% каменовъглен катран), пълнени в алуминиева обвивка; под действието на висока температура анодната маса се изпича (синтерира);
- изгорени или "непрекъснати" аноди, направени от големи въглеродни блокове (например 1900 × 600 × 500 mm, тежащи около 1,1 тона).

Фигура 4 - Схема на електролизера
Силата на тока на електролизаторите е 150 000 А. Те са свързани към мрежата последователно, т.е. получава се система (серия) - дълъг ред електролизатори.
Работното напрежение на ваната, което е 4 - 5 V, е много по-високо от напрежението, при което се разлага алуминиевият оксид, тъй като загубите на напрежение в процеса са неизбежни. различни частисистеми. Балансът на суровините и енергията при получаване на 1 тон алуминий е показан на фигура 5.
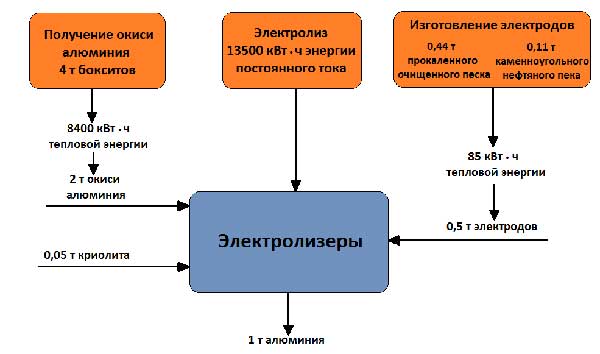
Снимка 5 - Баланс на суровини и енергия при производството на 1 тон алуминий
В реакционния съд алуминиевият оксид първо се превръща в алуминиев хлорид. След това в плътно изолирана баня се извършва електролизата на AlCl3, разтворен в разтопените соли на KCl, NaCl. Освободеният при този процес хлор се изсмуква и се подава за рециклиране; алуминият се отлага върху катода.
Предимствата на този метод пред съществуващата електролиза на течна криолитно-алуминиева стопилка (Al 2 O 3 , Na 3 AlF 6 разтворен в криолит) са: спестяване на до 30% енергия; възможността за използване на алуминиев оксид, който не е подходящ за традиционна електролиза (например Al 2 O 3 с високо съдържание на силиций); замяна на скъпия криолит с по-евтини соли; елиминиране на опасността от отделяне на флуор.
Получаване на рафиниран алуминий
За алуминия не е възможно рафиниране на електролиза с разлагане на водни солеви разтвори. Тъй като за някои цели степента на пречистване на промишления алуминий (Al 99.5 - Al 99.8), получен чрез електролиза на стопилка от криолит-алуминий, е недостатъчна, дори по-чист алуминий (Al 99.99 R) се получава от промишлен алуминий или метални отпадъци чрез рафиниране . Най-известният метод за рафиниране е трислойната електролиза.
Рафиниране чрез трислойна електролиза
Облицована със стоманена ламарина, работеща на постоянен ток (Фигура 6), рафиниращата вана се състои от въглищно огнище с токопроводи и топлоизолираща облицовка от магнезит. За разлика от електролизата на стопилка от криолит-алуминиев оксид, тук анодът обикновено е разтопен рафиниран метал (долен аноден слой). Електролитът се състои от чисти флуориди или смес от бариев хлорид и алуминиев и натриев флуорид (среден слой). Алуминият, който се разтваря от анодния слой в електролита, се отделя над електролита (горния катоден слой). Чистият метал служи като катод. Токът се подава към катодния слой от графитен електрод.

Фигура 6 - Диаграма на електролитна клетка с предно огнище за рафиниране на алуминий (според Fulda - Ginzberg)
1 - алуминиева стопилка; 2 – електролит; 3 - високочестотен рафиниран алуминий; 4 – графитен катод; 5 - стена от магнезит; 6 - преден рог; 7 - изолационен слой; 8 - странична изолация; 9 - въглищно огнище; 10 – аноден проводник; 11 - изолация на огнището; 12 - желязна кутия; 13 - капак
Ваната работи при 750 - 800 ° C, консумацията на енергия е 20 kWh на 1 kg чист алуминий, т.е. малко по-висока, отколкото при конвенционалната електролиза на алуминий.
Анодният метал съдържа 25–35% Cu; 7 – 12% Zn; 6 – 9% Si; до 5% Fe и малко количество манган, никел, олово и калай, останалото (40 - 55%) е алуминий. Всички тежки метали и силиций остават в анодния слой по време на рафинирането. Наличието на магнезий в електролита води до нежелани промени в състава на електролита или до неговото силно зашлаковане. За отстраняване на магнезий шлаките, съдържащи магнезий, се обработват с флюсове или газообразен хлор.
В резултат на рафинирането се получават чист алуминий (99,99%) и продукти на сегрегация (продукт на Ziger), които съдържат тежки метали и силиций и се изолират под формата на алкален разтвор и кристален остатък. Алкалният разтвор е отпадък, а твърдият остатък се използва за обезкисляване.
Рафинираният алуминий обикновено има следния състав, %: Fe 0,0005 - 0,002; Si 0,002 - 0,005; Cu 0,0005 - 0,002; Zn 0,0005 - 0,002; Mg следи; Ал почивка.
Рафинираният алуминий се преработва в полуготов продукт в определения състав или се легира с магнезий (таблица 1).
Маса 1 - Химичен съставалуминий с висока чистота и първичен алуминий съгласно DIN 1712 лист 1
|
Допустими примеси*, % |
||||||||
|
включително |
||||||||
* Доколкото е възможно да се определи конвенционални методиизследвания.
** Чистият алуминий за електротехниката (алуминиеви проводници) се доставя под формата на първичен алуминий 99,5, съдържащ не повече от 0,03% (Ti + Cr + V + Mn); обозначен в този случай като E-A1, номер на материала 3.0256. В противен случай отговаря на VDE-0202.
Рафиниране чрез органоалуминиеви комплексни съединения и зонно топене
Алуминий с по-висок клас на чистота A1 99,99 R може да бъде получен чрез рафиниране на електролиза на чист или търговски чист алуминий, като се използват сложни органоалуминиеви съединения на алуминия като електролит. Електролизата протича при температура около 1000°C между твърди алуминиеви електроди и по принцип е подобна на рафиниращата електролиза на мед. Естеството на електролита диктува необходимостта от работа без въздух и при ниска плътност на тока.
Този вид рафинираща електролиза, използван първоначално само в лабораторен мащаб, вече се извършва в малък индустриален мащаб - произвеждат се няколко тона метал годишно. Номиналната степен на пречистване на получения метал е 99,999 -99,9999%. Потенциалните области на приложение на метал с такава чистота са криогенната електротехника и електрониката.
Възможно е да се използва разглежданият метод за рафиниране в галванопластиката.
Дори повече висока чистота- номинално до A1 99.99999 - може да се получи чрез последващо зоново топене на метала. При преработката на алуминий с висока чистота в полуготов продукт, лист или тел е необходимо, предвид ниската температура на рекристализация на метала, да се вземат специални предпазни мерки. Забележително свойство на рафинирания метал е неговата висока електропроводимост в областта на криогенните температури.
Въведение
Алуминият е най-важният метал, обемът на неговото производство далеч надхвърля производството на всички останали цветни метали и е на второ място след производството на стомана. Високите темпове на растеж на производството на алуминий се дължат на неговата уникална физични и химични свойстваблагодарение на което намери широко приложение в електротехниката, самолето- и автостроенето, транспорта, битовата техника, строителството, опаковките хранителни продуктии т.н.
Алуминиевата промишленост на Русия, създадена през съветско време, заема доминиращо място в производството на цветни метали в страната и е на второ място в света по производство на метали. AT последните години, посредством известни причини, оборудването за производство на алуминий практически не е модернизирано, технологията на електролизата не е подобрена, обемът на научните изследвания е неприемливо намален и забележимо изостава от напредналите страни. В същото време оборудването се модернизира широко в чужбина, технологията се подобрява, което позволи рязко увеличаване икономическа ефективности екологична безопасност на производството на алуминий.
Напоследък машиностроенето все повече изисква леки метали, особено в самолетостроенето и железопътния транспорт. Поради това разработването на нови и по-икономични методи за получаване на алуминий и подобряването на съществуващите методи е от голямо значение.
1. Историята на развитието на алуминиевата промишленост
В момента алуминият е на първо място сред цветните метали по обем на производство и производството му непрекъснато се разширява.
Исторически погледнато, първото споменаване на метален алуминий е в писанията на римляните от първи век. AT известна енциклопедия"Historia naturalis" можете да намерите следната история. Един ден на един римски бижутер било позволено да покаже на император Тиберий чиния за хранене, направена от нов метал. Чинията беше много лека и блестеше като сребро. Бижутерът казал на императора, че е извлякъл метала от обикновена глина. Той също така увери императора, че само той и боговете знаят как да получат метал от глината. Императорът беше много заинтересован. Той обаче веднага разбра, че цялата му съкровищница, състояща се от злато и сребро, ще се разпадне, ако хората започнат да произвеждат този лек метал от глина. Затова вместо очакваната от бижутера награда, той бил обезглавен.
Не е известно колко вярна е тази история, но описаните събития са се случили 2000 години преди откриването на метода за производство на алуминий от човечеството. Това се случва през 1825 г., когато датският физик Х. Ерстед получава няколко милиграма метален алуминий чрез термична редукция на алуминиев хлорид с калиева амалгама.
Значителни трудности при получаването на алуминий възникнаха поради следните фактори:
Високият афинитет на алуминия към кислорода. Алуминият може да се редуцира с въглероден оксид при температура около 2000°C. Въпреки това, вече при 1200°C въглеродът взаимодейства с алуминия, давайки карбид;
Висок електрохимичен потенциал на алуминия (-1.67V). Невъзможно е да се получи алуминий от водни разтвори, тъй като процесът на отделяне на водород (разлагане на водата) практически ще продължи на катода;
Високата точка на топене на алуминиевия оксид (2050 ° C), което изключва възможността за електролиза на разтопен алуминиев оксид.
Индустриалното производство на алуминий се свързва с името на французина Анри Сен Клер Девил. Той беше добре запознат с експериментите на G. Oersted и друг учен, F. Wehler, който през 1827 г. успя да изолира зърна от алуминий. Причината за провала на F. Wöhler е, че тези зърна във въздуха веднага се покриват с най-тънкия филм от алуминиев оксид.
На първо място А.С.-К. Девил, в процеса на получаване на метала, заменя калия с по-евтин натрий и провежда лабораторни експерименти в голям мащаб. Полученият алуминиев хлорид се зарежда в голяма стоманена тръба, в която се пълнят съдове натриев метал. По време на нагряване алуминиевият хлорид взаимодейства с натрия в газовата фаза и алуминиевите частици се утаяват на дъното на тръбата. Зърната, образувани в резултат на реакцията, бяха внимателно събрани, разтопени и получени метални слитъци.
Новият начин за производство на алуминий се оказа много трудоемък. В допълнение, взаимодействието на парите на алуминиевия хлорид с натрия често протича с експлозия. В лабораторни условия това не представляваше сериозна опасност, но в заводски условия можеше да причини катастрофа. ПИТАМ. Девил заменя алуминиевия хлорид със смес от AlCl3 с NaCl. Сега участниците в реакцията бяха в разтопено състояние. Експлозиите спряха, но най-важното е, че вместо малки метални топчета, които трябваше да се събират на ръка, те получиха значително количество течен алуминий.
Експериментите в завода Javel бяха увенчани с успех. През 1855 г. е получен първият метален слитък с тегло 6–8 kg.
Щафетата на производството на алуминий по химически методи е продължена от руския учен Н. Н. Бекетов. Той провежда реакция на взаимодействие между криолит (Na 3 AlF 6) и магнезий. Методът на Н. Н. Бекетов се различава малко от метода на А. С.-К. Девил, но беше по-лесно. В германския град Гмелингем през 1885 г. е построен завод по метода на Н. Н. Бекетов, където за пет години са получени 58 тона алуминий - повече от една четвърт от цялото световно производство на метали по химически начин в периода от 1854 г. до 1890г.
Получаването на алуминий чрез химически средства не може да осигури на индустрията евтин метал. Той беше непродуктивен и не даде чист алуминий без примеси. Това накара изследователите различни странисветът да търси нови начини за производство на алуминий.
На помощ на учените дойде електрически ток. Още през 1808 г. Г. Дейви се опитва да разложи алуминиев оксид с помощта на мощна електрическа батерия, но безуспешно. Почти 50 години по-късно Р. Бунзен и А.С.-К. Девил независимо извършва електролиза на смес от алуминиев и натриев хлорид. Те имаха повече късмет от своя предшественик и успяха да получат малки капчици алуминий. Но в онези дни все още нямаше евтини и достатъчно мощни източници на електроенергия. Поради това електролизата на алуминия представляваше само чисто теоретичен интерес.
През 1867 г. е изобретено динамо и скоро се научили как да предават електричество на дълги разстояния. Електричеството започна да нахлува в индустрията.
През 1886 г. P. Héroult във Франция и C. Hall в САЩ почти едновременно полагат основите на съвременния метод за производство на алуминий, като предлагат да го получат чрез електролиза на алуминиев оксид, разтворен в разтопен криолит (методът на Hall-Hérault). От сега нататък нов начинпроизводството на алуминий започва да се развива бързо, което беше улеснено от подобряването на електротехниката, както и разработването на методи за извличане на алуминиев оксид от алуминиеви руди. Значителен принос за развитието на производството на алуминиев оксид имат руски учени К. И. Байер, Д. А. Пеняков, А. Н. Кузнецов, Е. И. Жуковски, А. А. Яковкин и др.. Царска Русия не е имала собствена алуминиева индустрия. Но първите теоретични изследвания в областта на електролизата на алуминий принадлежат на изключителния руски учен, основателят на електрометалургията на цветните метали в нашата страна, проф. П. П. Федотиев. През 1912 г. заедно с V.P. Илински публикува работата "Експериментално; Изследване на електрометалургията на алуминия", която веднага е преведена на много езици. чужди езиции се превърна в справочник за металурзите от цял свят. П.П. Федотиев и Илински от Санкт Петербургския политехнически институт (Санкт Петербургски държавен технически университет) проведоха задълбочени изследвания за избора на оптималния състав на електролита и също така установиха как разтворимостта на алуминиевия оксид в криолита и температурата на кристализация на добавянето на натриев, алуминиев и калциев флуорид.
На 28 март 1929 г. във вестник "Ленинградская правда" е публикувана статия, в която се съобщава, че за първи път в пилотната инсталация на завода "Красни выборжец" от една баня са получени 8 кг метален алуминий. Това бележи началото на нашата алуминиева индустрия.
През 1931г Изследователският институт за алуминиево-магнезиева промишленост (VAMI) е организиран през 1932 г. Волховски е пуснат на вода, а през 1933г. - Алуминиеви заводи в Днепър. От алуминиева индустриязапочва да процъфтява в различни части на страната.
2. Основи на електролизата на криолитно-алуминиеви стопилки
Електролизата на криолитно-алуминиева стопилка е основният метод за получаване на алуминий, въпреки че някои алуминиеви сплавипроизведени чрез електротермичен процес.
Първите промишлени електролизатори са били за токове до 0,6 kA и през следващите 100 години са се увеличили до 300 kA. Това обаче не доведе до значителни промени в основите на производствения процес.
Общата схема на производство на алуминий е показана на фиг. 2.1. Основният възел е електролизаторът. Електролитът е криолитна стопилка с лек излишък от алуминиев флуорид, в който е разтворен алуминиев оксид. Процесът се провежда при променливи концентрации на алуминиев оксид от около 1 до 8% (тегл.). Отгоре във ваната се спуска въглероден анод, частично потопен в електролита. Има два основни типа жертвени аноди: самоизпечени и предварително изпечени. Първите използват топлината на електролизата за изпичане на анодната маса, която се състои от смес от добавъчен кокс и свързващо вещество, катран. Печените аноди са предварително изпечена смес от кокс и катран. Технологията за производство на анодна маса и изпечени аноди е описана подробно в литературата (виж например).
Ориз. 2.1. Схема за производство на алуминий от алуминий.
Разтопеният алуминий при температура на електролиза (950–960°C) е по-тежък от електролита и се намира на дъното на електролизера. Криолитно-алуминиевите стопилки са много агресивни, на които могат да се противопоставят въглеродните и някои нови материали. От тях е направена вътрешната облицовка на електролизера.
За да преобразувате AC в DC на модерни фабрикиизползват се полупроводникови токоизправители с напрежение 850V и коефициент на преобразуване 98,5%, инсталирани в силициева преобразувателна подстанция (KPP). Един токоизправител дава ток до 63 kA. Броят на тези единици зависи от необходимата сила на тока, тъй като всички те са свързани паралелно.
Процесът, протичащ в електролизера, се състои в електролитно разлагане на алуминиев оксид, разтворен в електролита. Алуминият се освобождава върху течен алуминиев катод, който периодично се излива с помощта на вакуумна черпак и се изпраща в леярния отдел за изливане или смесител, където в зависимост от по-нататъшното предназначение на метала се сплави със силиций, магнезий, манган, мед се приготвят или се извършва рафиниране. На анода въглеродът се окислява от освободения кислород. Отработеният аноден газ е смес от CO2 и CO.
Електролизерите обикновено са оборудвани със заслони, които отстраняват отработените газове и система за почистване. Това намалява отделянето на вредни вещества в атмосферата. Технологичният процес изисква укритието да бъде херметично затворено, за да се осигури засмукване на газ в колектора с помощта на вентилатори. Газовете, отстранени от електролизерите, са доминирани от въглероден диоксид (по-голямата част от въглеродния оксид се изгаря над електролита или в специални горелки след колектора за газ), азот, кислород, газообразни и твърди флуориди и частици от алуминиев прах. Използват се различни технологични схеми за отстраняването им и връщането им в процеса.
Съвременните електролизери са оборудвани с автоматична система за подаване на алуминиев оксид (AAF) с период на зареждане от 10–30 минути.
Цялостната реакция, протичаща в електролизера, може да бъде представена с уравнението
Така теоретично за процеса на електролиза се изразходват алуминиев оксид и аноден въглен, както и електрическата енергия, необходима не само за осъществяване на електролитния процес - разлагането на алуминиевия оксид, но и за поддържане на висока работна температура. На практика се изразходват и известно количество флуорни соли, които се изпаряват и се абсорбират в лигавицата. За да получите 1 тон алуминий, трябва:
Производството на алуминий е един от най-енергоемките процеси, така че заводите за топене на алуминий се изграждат близо до енергийни източници.
Всички материали, влизащи в електролизата, трябва да имат минимално количествопримеси, по-електроположителни от алуминия (желязо, силиций, мед и др.), тъй като тези примеси почти напълно преминават в метала по време на електролиза.
3. Алтернативни начини за получаване на алуминий
Промишленият метод за производство на алуминий чрез електролиза на криолитно-алуминиев оксид, въпреки дългосрочната си употреба, има редица съществени недостатъци: висока специфична консумация на енергия, ниско специфично отстраняване на метала и експлоатационен живот на електролизери, високи разходи за труд и капитал, изпускане на вредни вещества в атмосферата и редица други. В тази връзка се предлагат други методи за производство на алуминий. Нека разгледаме някои от тях.
3.1. Електротермично производство на алуминиево-силициеви сплави.
Невъзможно е да се получи чист алуминий чрез директна редукция на неговия оксид. Карботермичните процеси изискват високи температури (около 2000°C), за да се редуцира алуминиевият оксид, а при липса на компоненти, образуващи сплав, металът се свързва с въглерод, давайки алуминиев карбид (A1 4 C 3). Известно е, че алуминиевият карбид и алуминият са разтворими един в друг и образуват много огнеупорни смеси. В допълнение, A1 4 C 3 се разтваря в A1 2 O 3, следователно в резултат на редукция на алуминиев оксид с въглерод се получават смеси от алуминий, карбид и оксид с високи точки на топене. Обикновено не е възможно да се освободи такава маса от пещта. Дори това да може да стане, цената на раздялата ще бъде висока.
У нас за първи път в света е разработен и внедрен в промишлен мащаб метод за производство на силикоалуминий (алуминиево-силициеви сплави) с достатъчно високи технико-икономически показатели.
Общата технологична схема за производство на алуминиево-силициеви сплави е показана на фиг. 3.1. В допълнение към каолините (Al 2 O 3 × 2 SiO 2 × 2H 2 O), кианити (Al 2 O 3 × SiO 2), дистензилиманити (Al 2 O 3 × SiO 2) и боксити с ниско съдържание на желязо могат да се използват като суровина.
Сплавта след електрическо топене се доставя за пречистване от неметални примеси. За да направите това, се доставя флюс, състоящ се от смес от криолит и натриев хлорид, който намокря тези примеси и ги "събира". Рафинираният силикоалуминий има среден състав (%): А1 - 61; Si - 36; Fe - 1,7; Ti - 0,6; Zr - 0,5; Ca - 0,7. Тази сплав не е подходяща за производството на силумин и изисква пречистване от желязо. Най-разпространеният метод за пречистване е манганът, който образува огнеупорни интерметални съединения с желязото.

Ориз. 3.1. Обща схема за производство на алуминиево-силициеви сплави.
Получената сплав се разрежда с технически електролитен алуминий или вторичен алуминий до състав, съответстващ на различни степени на силумин, и се отлива в блокове.
Предимствата на този метод за получаване на силумин пред синтеза електролитен алуминийс кристален силиций са следните: висока мощност на единична единица - съвременните пещи имат мощност от 22,5 MB × A, което е около 30 пъти по-високо от мощността на електролизатор със 160 kA и, следователно, намаляване на товарния трафик , намаляване на капиталовите разходи и разходите за труд; използването на суровини с нисък силициев модул, чиито запаси са доста големи в природата.
Теоретично, чистият алуминий може да бъде изолиран от алуминиево-силиконова сплав по различни методи. Въпреки това, поради сложността на хардуера и технологичния дизайн в промишлеността, тези методи в момента не се прилагат.
3.2. Субхалогенен процес
Известно е, че ако се нагрее смес от халогенид и замърсен алуминий, тогава при понижаване на температурата се освобождава чист алуминий. Това откритие предизвика интерес към системите алуминий-алуминиев халид. Установено е, че металният алуминий реагира с AlX 3 (където X е халоген) при висока температура, образувайки алуминиев субхалогенид:
![]()
Тъй като алуминиевият субхалид е газообразен продукт, равновесието се измества наляво с понижаване на температурата. Например, A1C1(G) може да се получи от Al и AlC1 3 в реакционна зона при относително високи температури и след това да се прехвърли като пара в по-студена зона, където се диспропорционира в чист алуминий и алуминиев хлорид. Константата на равновесие за системата A1 - A1C1 3 е по-висока, отколкото за системата A1 - A1F 3 и следователно хлоридната система може да се използва за промишлени процеси. Температурата на образуване на субхлорид е около 1300°C при атмосферно налягане. Този процес е особено привлекателен за отделяне на алуминий от сплави, тъй като алуминиевият халид реагира с алуминий и практически не взаимодейства с повечето други метали. Трудности възникват само с някои летливи амониеви халиди, като FeCl3, MnCl2 и някои други. Те могат да образуват смеси с AlCl3 и да замърсят получения алуминий.
Alcan разработи технология, която включва пет етапа:
1. Производство на необработена сплав, като желязо-силиций-алуминий, в карботермална редукционна пещ.
2. Взаимодействие между A1 и AJC1, в конвертор при температура 1300 °C.
3. Разделяне на парообразни халогениди и субхалогениди в дестилационни колони.
4. AICI връщане, за реакцията между хлорид и богата на алуминий течна сплав.
5. Разлагане на A1C1, производство на алуминий и връщане на A1C1 3 за ректификация.
Субхлоридният метод е от най-голям интерес за промишлено рафиниране на алуминиеви сплави.
3.3. Този процес
Схемата за получаване на алуминий по метода на Тот е показана на фиг. 3.2. Съдържащите алуминий суровини след подходяща подготовка се хлорират в кипящ слой в присъствието на кокс и SiCl4. Последният се използва за потискане на реакцията на хлориране на SiO 2 . В резултат на хлориране в пещи с кипящ слой (BF) се получава смес газ-пара (VGM), която включва AlCl3, FeCl3, TiCl4 и SiCl4. В първия кондензатор около 75% от FeCl3 в твърдо състояние се освобождава от PGM и се изпраща в реактора на окислителя, където взаимодейства с атмосферния кислород, което води до образуването на Fe2O3 и C12. Хлорът се връща за хлориране. Във втория кондензатор останалият FeCl3 се освобождава и A1C13 кондензира. В третия кондензатор се кондензират титанови и силициеви хлориди. Разделянето на тези хлориди се извършва в дестилационна колона.
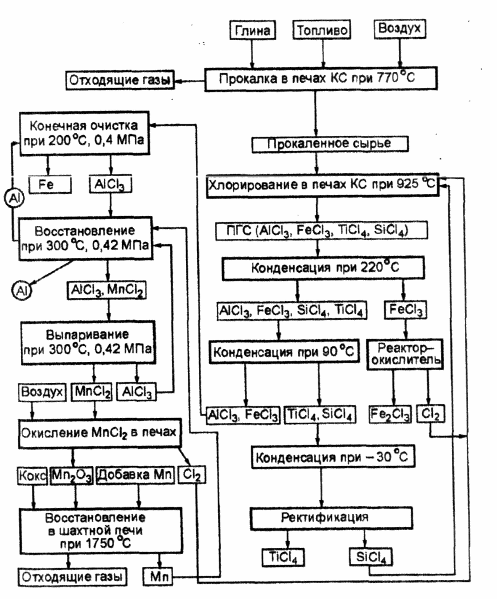
Ориз. 3.2. Схема за получаване на алуминий по метода на Тот.
Хлоридите на алуминия и желязото, разтоварени от втория кондензатор, се нагряват, изпомпват в контактен очистващ апарат, където контактуват в противоток с движещ се слой от твърди алуминиеви частици. Тук протича реакцията:
Пречистен алуминиев хлорид се подава към металотермична редукция. Технически достъпни редуциращи агенти, които имат по-голям афинитет към хлора от алуминия, са натрий, магнезий и манган. Въпреки това, първите два елемента на пътя и тяхното производство са много енергоемки. Следователно, според разработчиците на процеса, използването на манган има определени предимства, които могат да бъдат регенерирани от хлорид чрез карботермичен метод с много по-ниска консумация на енергия. При редукция на алуминиев хлорид с манган протичат следните реакции:
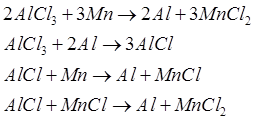
Алуминият от смес на MnCl 2 с нереагиралия AlCl 3 се отделя в циклонни сепаратори, докато мангановите и алуминиеви хлориди се отделят в изпарител. Алуминиевият хлорид се връща в реактора, за да се получи алуминий, а мангановият хлорид реагира с кислорода, за да образува твърди оксиди на манган и хлор. Мангановият оксид се редуцира до метал чрез карботермичен метод в шахтови пещи, където се зареждат кокс и варовик. Манганът се добавя към пещта, за да се компенсират загубите му по време на процеса.
Към недостатъците този процес, както и други металотермични методи, включват замърсяване на получения продукт с редуциращ метал, необходимост от организиране на производство за регенериране на редуциращия агент и увеличаване на капиталовите разходи.
През 1966-1973 г. в лаборатория и разширен мащаб са проведени изследвания за получаване на алуминий чрез редукция с манган. Впоследствие в литературата няма съобщения за индустриално развитие тази посока, което, очевидно, се дължи на значителни трудности при техническото изпълнение на този сложен многоетапен процес.
3.4. Електролиза на хлоридни стопилки
През януари 1973 г. Alcoa обяви разработването на нов метод за производство на алуминий. Фирмата работи върху процеса в продължение на 15 години и е похарчила 23 милиона долара.
Този метод включва производството на алуминиев хлорид и последващата му електролиза. През 1976 г. се появи информация за прехода на компанията "Alcoa" към промишлено внедряване на хлоридната технология за производство на алуминий. В град Палестина (Тексас, САЩ) работи завод с проектен капацитет от 30 хиляди тона производство на алуминий годишно по този метод.
Принципната технологична схема е показана на фиг. 2.4.

Ориз. 3.3. Технологична системаполучаване на алуминий от хлорид.
Алуминиевият хлорид има висок афинитет към водата и склонност към образуване на оксиди и хидрооксихлориди. В тази връзка получаването му в чиста формае трудна задача. Наличието на влага причинява корозия, а наличието на кислородсъдържащи съединения води до утаяване и окисляване на анодите. Фирмата "Алкоа" предложи хлориране на пречистен двуалуминиев оксид, което частично решава тези проблеми. Въпреки това е необходимо да се спазват повишените изисквания за чистота на въглерода по време на хлориране по отношение на водород или влага.
Наскоро имаше съобщения, че Toth Aluminium Corporation е успяла да произведе алуминиев хлорид, съдържащ най-малко 99,97% от основния компонент в голям индустриален мащаб.
Полученият алуминиев хлорид в гранулирано или парообразно състояние се подава за електролиза. Електролизерът, използван в тази технология, се състои от стоманен корпус, облицован с шамотни тухли и допълнително диатомични тухли в долната част, т.е. топлоизолационен непроводим огнеупорен материал, който слабо взаимодейства с хлоридни стопилки. На дъното на ваната има графитно отделение за събиране на течен алуминий. Капакът на електролитната клетка има отвори за зареждане на алуминиев хлорид, периодично засмукване на алуминий и непрекъснато извеждане на газообразен хлор, използван при производството на алуминиев хлорид. Страничните стени и капака на електролизера са с водно охлаждане.
Електролизата използва графитни неконсумируеми електроди. Това предимство (в сравнение с електролизата на криолитно-алуминиевите стопилки), заедно с относително ниската температура на процеса (около 700ºС), прави възможно пълното запечатване на електролизерите.
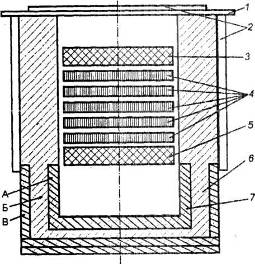
Ориз. 2.5. Схема на електролитна клетка с биполярни електроди за електролиза на алуминиев хлорид.
1 - капак: 2 - водно охлаждане: 3 - анод; 4 - биполярни електроди; 5 - катод; 6 - подплата; 7 - отделение за събиране на алуминий. Материал: А - графит; B - шамот; B - диатом.
Електролитното разлагане на алуминиев хлорид теоретично изисква по-високо напрежение от електролизата на криолитно-алуминиев триоксид, тъй като напрежението на разлагане на алуминиевия хлорид е много по-високо. По този начин недостатъците на процеса могат да включват необходимостта от подаване на голямо количество топлина към електролизера и значителни загуби на напрежение. Въпреки това, високите омични и термични загуби са значително намалени при използване на биполярна електродна система. В клетката горният електрод е анодът, долният е катодът, а между тях има графитни електроди, горният от които е катодът, а долният е анодът. В същото време резултатите от изчисленията показват, че с увеличаване на броя на биполярните електроди и намаляване на тяхната площ на напречното сечение, токовете на утечка се увеличават, т.е. част от тока протича през импрегнираната с електролит част на облицовката и каналите между облицовката и биполюсите, без да извършва електрохимична работа. Тези токове на утечка водят до намаляване на изходящия ток.
Поради близостта на точките на топене и кипене при атмосферно налягане, алуминиевият хлорид сублимира практически без да се топи. Температурата на сублимация е 180,2°C. Тройната точка съответства на температура от 192,6°C и абсолютно налягане от 0,23 MPa. В това отношение като електролит се използва разтопена смес от алуминиев хлорид (5 ± 2% (маса)), литиев хлорид (~28% (маса)) и натриев хлорид (67% (маса)). В тези стопилки активността на A1C1 3 намалява. Това до голяма степен се дължи на факта, че в разтопени смеси от хлориди A1C1 3 се свързва например с комплексни аниони.
Междуполюсното разстояние е 1,0 - 1,5 cm, температурата е 700 ± 30ºС, плътността на тока е -0,8 - 2,5 A / cm 2.
Изводи.
Основните предимства, предвидени и потвърдени по време на промишленото прилагане в Съединените щати на метода Alcoa за производство на алуминий чрез електролиза на неговия хлорид в сравнение с електролизата на криолитно-алуминиеви стопилки, са възможността за използване на нискокачествени суровини, съдържащи алуминий, намаляване на специфична консумация на енергия по време на електролиза с около 30% и елиминиране на потреблението на висококачествени електродни материали, съдържащи въглерод, използване на по-малко оскъдни и агресивни хлориди вместо флуориди, повишаване на производителността на труда, намаляване на капиталовите инвестиции, намалени разходи, цена на крайни продукти и вредни емисии в околната среда.
Напоследък предимствата на хлоридния метод за производство на алуминий станаха по-осезаеми поради повишаването на цената на електроенергията, суровините за съществуващия индустриален метод за производство на алуминий и повишените изисквания за защита. околен святи липсата досега на положителни резултати при получаване на чист двуалуминиев оксид от нискокачествени небокситни суровини.
По този начин най-обещаващият от алтернативни начинипроизводството на алуминий е електролиза на алуминиев хлорид в електролизери с биполярни електроди.
Библиография
1. Розен Б. М., Розен Я. Б. Метал със специална стойност. - М.: Металургия, 1975. - 128 с.
2. Колодин Е. А., Свердлин В. А., Свобода Р. В. Производство на изгорени аноди на алуминиеви електролизатори. - М.: Металургия, 1980, - 84 с.
3. Янхо Е. А., Воробьов Д. Н. Производство на анодна маса. - М.: Металургия, 1975. - 128 с.
4. М. М. Веткжов, А. М. Ц’шлаков и С. Н. Школников, Електрометалургия на алуминий и магнезий. - М.: Металургия, 1987. - 320 с.
5. Шченков В.В., Литвак С.Н. Разработване на нов технологични процесипроизводство на алуминий // Цв. металургия: Бюл. NTI / Цветна информация. - 1974. - № 9. - С. 38 - 41.
6. Сандлър Р. А., Рапиер А. Х. Електрометалургия на алуминий и магнезий. - L: LGI, 1983. - 94 с.
 Алуминият е най-често срещаният химичен елементНа земята. Той е на трето място след кислорода и силиция. Съдържанието му е 8,8 процента от всички природни ресурси.
Алуминият е най-често срещаният химичен елементНа земята. Той е на трето място след кислорода и силиция. Съдържанието му е 8,8 процента от всички природни ресурси.
Как се получава чист алуминий?
Но знаете ли, че свободният алуминий не се среща в природата. Няма алуминиеви мини. Добива се от мини, съдържащи боксит, алунит и нефилин. За да се получи алуминий в неговата чиста форма, е необходимо да се измине дълъг път за отделяне на метала от други химични елементи.
Технологичен процес за получаване на алуминийсе състои от два етапа:
1 .Бокситната руда се раздробява, получава се двуалуминиев оксид.
2 .Извличане на алуминий от алуминий.
Двуалуминиевият оксид се нарича кристален алуминиев оксид.
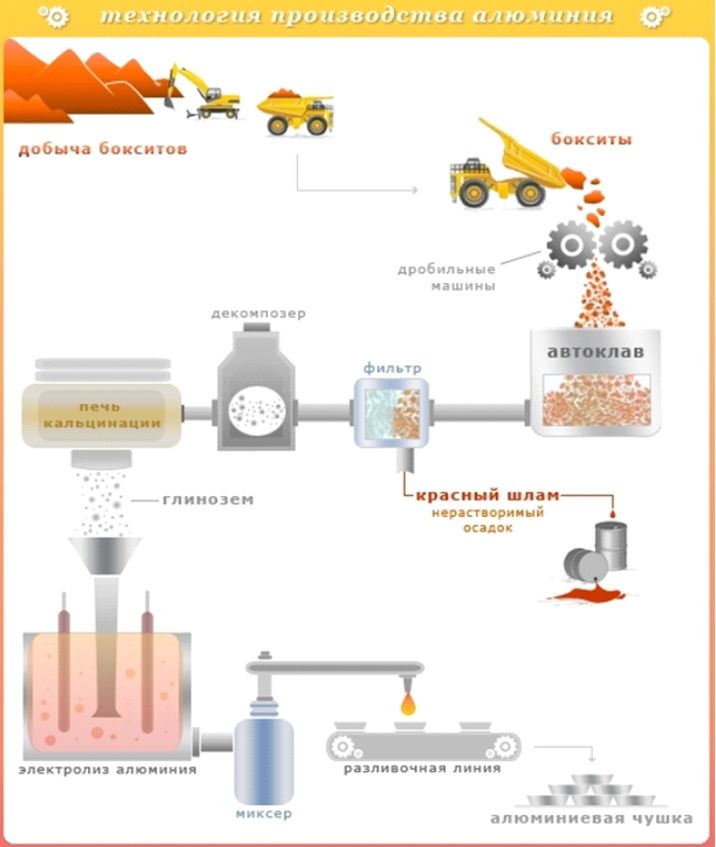
Двуалуминиевият оксид се подлага на процедурата на електролиза в криолит. При температура 960-970 0 C в специални вани се активира ниско напрежение от 4,5 волта, но при много висока якостток 250 хиляди ампера. В резултат на това течният алуминий се концентрира на дъното на ваната около катода, докато кислородът се натрупва около анода. След това алуминият се рафинира и се излива във форми. Впоследствие се изработват различни продукти.
Производството на алуминий е трудоемък процес, изискващ лъвския пай от електроенергия. Следователно алуминиевите заводи най-често могат да бъдат намерени в близост до големи водноелектрически централи, за да се получи евтина електроенергия.

Какво е бъдещето на алуминия?
В миналото:По заповед на Наполеон III приборите за хранене са направени от алуминий. Те били сервирани на тържества на императора и най-почетните гости, останалите се задоволявали със златни и сребърни прибори.
В средата на деветнадесети век парижките модници са били задължени да имат поне едно парче алуминий в своите тоалети.
Днес:Какво не е от алуминий; самолети, ракетно гориво, парникови профили, електронни продукти. Производството на алуминий в металургията представлява 2% от производството на метали, в бъдеще, според прогнозите, ще нарасне до 4-5%.
В бъдеще:производителите вече създават плат, покрит с тънък слой от този метал. Нарича се "алуминизирана тъкан". Например, ако тъканта се използва като завеса в горещ ден, тъканта ще свърши добра работа по два начина: топлината ще се отразява и светлината лесно ще прониква в стаята. Така апартаментът ще бъде лек и в същото време прохладен.
В продължение на два века лекият метал успя да завладее света.А двадесет и първи век, по всичко личи, обещава да бъде векът на алуминия.
1. Възстановяване на алуминиев оксид с водород
2. Електролитен
3. Металотермичен
4. Пирометалургичен
5. Хидрометалургични
181. Изходните суровини за производството на чугун са:
1. Железни руди
2. Скрап, флюсове
3. Желязни руди, флюси, горива
4. Желязни руди, кокс
5. Боксити
182. Чугунът се топи в:
1. Доменна пещ
3. Шахтови пещи
4. Тунелна пещ
5. Камерна пещ
183. Сплав от черни метали е:
1. Никелин
2. Електрон
5. Сив чугун
184. Желязните сплави със съдържание на въглерод от 0,2 до 2% се наричат:
5. Циментити
185. Желязните сплави със съдържание на въглерод над 2% се наричат:
5. Никелин
186. Алуминият се получава чрез електролиза:
1. Бокстов
2. Разтопена смес от алуминиев оксид с криолит
3. Алунити
4. Алуминиев хидроксид
5. Нефелин
187. Алуминиеви сплави със силиций се наричат:
1. Дуралуминий
3. Силумини
188. Алуминиевите сплави с мед, магнезий, манган се наричат:
1. Дуралуминий
3. Силумини
189. Сплав на желязо с въглерод (до 2%) се състои от:
1. Аустенит
2. Аустенит и ледебурит
3. Циментит
4. Цементит и ледебурит
5. Ледебурита
190. Чугунът със съдържание на въглерод (2-4%) се състои от:
1. Аустенит
2. Аустенит и ледебурит
3. Циментит
4. Цементит и ледебурит
5. Ледебурита
191. Чугунът със съдържание на въглерод над 4% се състои от:
1. Аустенит
2. Аустенит и ледебурит
3. Циментит
4. Цементит и ледебурит
5. Ледебурита
192. Никелът се прикрепя към стоманата:
193. Манганът дава стомана:
1. Червена твърдост, здравина, устойчивост на корозия при висока температура
2. Якост, пластичност, устойчивост на корозия
3. Якост при нормални условия
4. Твърдост и устойчивост на корозия
5. Твърдост, устойчивост на износване, устойчивост на удар
194. Ниобият дава стомана:
1. Повишена пластичност и вискозитет
2. Издръжливост
3. Твърдост и устойчивост на корозия
4. Киселинна устойчивост
5. Якост при високи температури
195. Молибденът дава стомана:
1. Червена твърдост, здравина, устойчивост на корозия при висока температура
2. Якост, пластичност, устойчивост на корозия
3. Якост при нормални условия
4. киселинна устойчивост
5. Твърдост, устойчивост на износване, устойчивост на удар
Суровината за производство на нефтен кокс е
2. Тежки петролни продукти
За първи път металният алуминий е получен химически от немския химик Ф. Вьолер през 1821 г. (чрез редукция от алуминиев хлорид с метален калий при нагряване). През 1854 г. френският учен Сен-Клер Девил предлага електрохимичен метод за производство на алуминий чрез редуциране на алуминиево-натриев двоен хлорид с натрий.
Производство и производство на алуминий
Металният алуминий се получава на три етапа:
- Получаване на алуминиев оксид (Al 2 O 3) от алуминиеви руди;
- Получаване на алуминий от алуминий;
- рафиниране на алуминий.
Получаване на алуминиев оксид
Около 95% от целия двуалуминиев оксид се получава от бокситни руди.
Боксит(Френски боксит) (по името на района Baux в южната част на Франция) - алуминиева руда, състояща се от алуминиеви хидроксиди, оксиди на желязо и силиций, суровини за производството на алуминиев оксид и огнеупорни материали, съдържащи алуминий. Съдържанието на алуминиев оксид в търговските боксити варира от 40% до 60% и повече. Използва се и като флюс в черната металургия.
Снимка 1 - Бокситна руда
Обикновено бокситът е земна, подобна на глина маса, която може да има ивична, пизолитна (подобна на грах) или еднородна текстура. При нормални атмосферни условия фелдшпатите (минерали, които изграждат по-голямата част от земната кора и са алумосиликати) се разлагат, за да образуват глини, но при горещ климат и висока влажност бокситът може да бъде крайният продукт на тяхното разлагане, тъй като такава среда благоприятства отстраняването от алкали и силициев диоксид, особено от сиенити или габро. Бокситите се преработват в алуминий на етапи: първо се получава алуминиев оксид (алуминиев оксид), а след това метален алуминий (електролитно в присъствието на криолит).
Основните примеси в бокситите са Fe 2 O 3 , SiO 2 , TiO 2 . Малките примеси на бокситите включват: Na 2 O, K 2 O, CaO, MgO, редкоземни елементи, Cr, P, V, F, органични вещества.
Обикновено бокситите се класифицират:
- по цвят;
- по основния минерал (по-често се смесват);
- според възрастта.
Основни критерии качествата на алуминиевата руда са:
- Силициев модул (Msi = Al 2 O 3 /SiO 2 (% тегл.)). Колкото по-голям е силициевият модул, толкова по-добро е качеството (Msi = 7);
- Съдържание на желязо по отношение на Fe 2 O 3 . Ако съдържанието на Fe 2 O 3 е около 18 тегл.%, тогава бокситът се счита за високо съдържание на желязо. Колкото по-голямо е съдържанието на желязо, толкова по-трудно е да се добиват боксити;
- Съдържание на сяра. Наличието на голямо количество сяра усложнява обработката на боксит;
- Съдържанието на карбонати по отношение на CO 3 (2-) . Наличието на голямо количество карбонати усложнява преработката на боксит.
Използват се боксити:
- в производството на алуминиев оксид;
- в производството на абразивни материали;
- в производството на огнеупорни материали;
- като флюс за топене на мартенова стомана;
- за изсушаване на газове и почистване на масло от сяра;
- като багрило.
Към днешна дата основните доставчици на боксит са:
- Австралия - има и огромни залежи на Fe, Au, U, Ni, Co, Cu и др. По-изгодно е да купувате суровини от Австралия, отколкото да преработвате свои собствени.
- Гвинея - Русия има няколко закупени места.
- Централна Америка: Гвиана, Ямайка, Суриман.
- Бразилия.
В Европа всички залежи са изчерпани. Бокситите се доставят от Гърция, но тази суровина е с лошо качество.

Фигура 2 - Запаси от боксит в света
По-долу са основните находища на алуминиеви руди в Русия.
- Първото находище е открито през 1914 г. близо до Санкт Петербург, близо до град Тихвин. На това находище са построени 6 завода. Най-големият е Волховският алуминиев завод. Към днешна дата находището Тихвинское е изчерпано и работи главно с вносни суровини.
- През 1931 г. е открито уникалното Северо-Уралское находище на висококачествен боксит (СУБР). Той послужи като основа за изграждането през 1939 г. на Уралския алуминиев завод (УАЗ). И на базата на бокситната мина Южен Урал (YUBR) е построен Богословският алуминиев завод (BAZ).
- Североонежското поле се намира по пътя към Колския полуостров. Има го в плана, но датата на построяване е неизвестна.
- Висловското находище е чисто глинено находище от типа на каолита. Не се използва за алуминий.
- Тиманское поле (Република Коми, Варкута). Канадците се интересуват от това поле, така че планират да строят заводи (Komi Sual е холдингова компания).
Получаване на алуминиев оксид от бокситни руди
Тъй като алуминият е амфотерен, алуминият се произвежда по три начина:
- алкален,
- киселина;
- електролитен.
Най-разпространеният е алкалният метод (методът на K. I. Bayer, разработен в Русия в края на предишния век и използван за обработка на висококачествени боксити с малко количество (до 5-6%) силициев диоксид). Оттогава техническите му характеристики са значително подобрени. Схемата за производство на алуминиев оксид по метода на Байер е показана на фигура 3.

Фигура 3 - Схема за получаване на алуминиев оксид по метода на Байер
Същността на метода е, че алуминиевите разтвори бързо се разпадат, когато в тях се въведе алуминиев хидроксид, а разтворът, останал от разлагането след изпаряването му при условия на интензивно смесване при 169–170 ° C, може отново да разтвори алуминиевия оксид, съдържащ се в бокситите. Този метод се състои от следните основни операции:
1. Приготвяне на боксит, което се състои в неговото раздробяване и смилане в мелници; мелниците се доставят с боксит, каустик и малко количество вар, което подобрява отделянето на Al 2 O 3; получената целулоза се подава за излугване;
2. Излужване на боксит (напоследък използваните досега кръгли автоклавни блокове са частично заменени от тръбни автоклави, в които излугването се извършва при температури от 230–250 ° C (500–520 K), което се състои в неговото химично разлагане от взаимодействие с воден разтвор алкали; хидратите на алуминиевия оксид, когато взаимодействат с алкали, преминават в разтвор под формата на натриев алуминат:
AlOOH+NaOH→NaAlO2 +H2O
Al(OH)3 +NaOH→NaAlO2 +2H2O;
SiO 2 +2NaOH→Na 2 SiO 3 +H2O;
в разтвор натриевият алуминат и натриевият силикат образуват неразтворим натриев алумосиликат; титанови и железни оксиди преминават в неразтворимия остатък, придавайки на остатъка червен цвят; този остатък се нарича червена кал. След завършване на разтварянето, полученият натриев алуминат се разрежда с воден разтвор на алкали, докато температурата се понижава със 100 ° C;
3. Отделяне на алуминатен разтвор от червена кал, обикновено се извършва чрез промиване в специални сгъстители; в резултат на това червената кал се утаява, а алуминатният разтвор се отцежда и след това се филтрира (избистря). В ограничени количества утайката се използва например като добавка към цимента. В зависимост от класа на боксита на 1 тон произведен двуалуминиев оксид се падат 0,6 - 1,0 тона червена кал (сух остатък);
4. Разлагане на алуминатния разтвор. Филтрира се и се изпомпва в големи контейнери с бъркалки (разлагатели). Алуминиевият хидроксид Al(OH) 3 се екстрахира от свръхнаситен разтвор при охлаждане до 60 °C (330 K) и постоянно разбъркване. Тъй като този процес протича бавно и неравномерно и образуването и растежът на кристали от алуминиев хидроксид са от голямо значение при по-нататъшната му обработка, голямо количество твърд хидроксид се добавя към разлагащите вещества - семена:
Na2O Al2O3 + 4H2O→Al(OH)3 + 2NaOH;
5. Разпределяне на алуминиев хидроксид и неговата класификация; това се случва в хидроциклони и вакуумни филтри, където утайка, съдържаща 50 - 60% частици Al(OH) 3, се отделя от алуминатния разтвор. Значителна част от хидроксида се връща в процеса на разлагане като зародишен материал, който остава в обращение в непроменени количества. Остатъкът след измиване с вода отива за калциниране; филтратът също се връща в циркулация (след концентриране в изпарители - за излугване на нови боксити);
6. Дехидратация на алуминиев хидроксид (калциниране); това е крайната операция на производството на алуминиев оксид; извършва се в тръбни ротационни пещи, а напоследък и в пещи с турбулентно движение на материала при температура 1150 - 1300 °С; суров алуминиев хидроксид, преминаващ през ротационна пещ, изсушен и дехидратиран; при нагряване се извършват последователно следните структурни трансформации:
Al(OH) 3 → AlOOH → γ-Al 2 O 3 → α-Al 2 O 3
200 °C - 950 °C - 1200 °C.
Крайният калциниран двуалуминиев оксид съдържа 30 - 50% α-Al2O3 (корунд), останалото е γ-Al 2 O 2 .
Този метод извлича 85 - 87% от целия произведен алуминиев оксид. Полученият алуминиев оксид е силно химично съединение с точка на топене 2050 ° C.
Получаване на алуминий чрез електролиза
Електролитната редукция на алуминиев оксид, разтворен в стопилка на основата на криолит, се извършва при 950–970 °C в електролитна клетка. Клетката се състои от баня, облицована с въглеродни блокове, към дъното на която се подава електрически ток. Течният алуминий, отделен на дъното, служещ като катод, е по-тежък от стопилката на електролитната сол, поради което се събира върху въглищна основа, откъдето периодично се изпомпва (Фигура 4). Отгоре въглеродните аноди са потопени в електролита, които изгарят в атмосферата на кислород, отделен от алуминиев оксид, освобождавайки въглероден оксид (CO) или въглероден диоксид (CO 2). На практика се използват два вида аноди:
- самоизпичащи се аноди Zederberg, състоящи се от брикети, така наречените "хлябове" от масата Zederberg (ниско пепелни въглища с 25 - 35% каменовъглен катран), пълнени в алуминиева обвивка; под действието на висока температура анодната маса се изпича (синтерира);
- изгорени или "непрекъснати" аноди, направени от големи въглеродни блокове (например 1900 × 600 × 500 mm, тежащи около 1,1 тона).

Фигура 4 - Схема на електролизера
Силата на тока на електролизаторите е 150 000 А. Те са свързани към мрежата последователно, т.е. получава се система (серия) - дълъг ред електролизатори.
Работното напрежение на ваната, което е 4 - 5 V, е много по-високо от напрежението, при което се разлага алуминиевият оксид, тъй като загубите на напрежение в различни части на системата са неизбежни по време на работа. Балансът на суровините и енергията при получаване на 1 тон алуминий е показан на фигура 5.

Снимка 5 - Баланс на суровини и енергия при производството на 1 тон алуминий
В реакционния съд алуминиевият оксид първо се превръща в алуминиев хлорид. След това в плътно изолирана баня се извършва електролизата на AlCl3, разтворен в разтопените соли на KCl, NaCl. Освободеният при този процес хлор се изсмуква и се подава за рециклиране; алуминият се отлага върху катода.
Предимствата на този метод пред съществуващата електролиза на течна криолитно-алуминиева стопилка (Al 2 O 3 , Na 3 AlF 6 разтворен в криолит) са: спестяване на до 30% енергия; възможността за използване на алуминиев оксид, който не е подходящ за традиционна електролиза (например Al 2 O 3 с високо съдържание на силиций); замяна на скъпия криолит с по-евтини соли; елиминиране на опасността от отделяне на флуор.
Получаване на рафиниран алуминий
За алуминия не е възможно рафиниране на електролиза с разлагане на водни солеви разтвори. Тъй като за някои цели степента на пречистване на промишления алуминий (Al 99.5 - Al 99.8), получен чрез електролиза на стопилка от криолит-алуминий, е недостатъчна, дори по-чист алуминий (Al 99.99 R) се получава от промишлен алуминий или метални отпадъци чрез рафиниране . Най-известният метод за рафиниране е трислойната електролиза.
Рафиниране чрез трислойна електролиза
Облицована със стоманена ламарина, работеща на постоянен ток (Фигура 6), рафиниращата вана се състои от въглищно огнище с токопроводи и топлоизолираща облицовка от магнезит. За разлика от електролизата на стопилка от криолит-алуминиев оксид, тук анодът обикновено е разтопен рафиниран метал (долен аноден слой). Електролитът се състои от чисти флуориди или смес от бариев хлорид и алуминиев и натриев флуорид (среден слой). Алуминият, който се разтваря от анодния слой в електролита, се отделя над електролита (горния катоден слой). Чистият метал служи като катод. Токът се подава към катодния слой от графитен електрод.

Фигура 6 - Диаграма на електролитна клетка с предно огнище за рафиниране на алуминий (според Fulda - Ginzberg)
1 - алуминиева стопилка; 2 – електролит; 3 - високочестотен рафиниран алуминий; 4 – графитен катод; 5 - стена от магнезит; 6 - преден рог; 7 - изолационен слой; 8 - странична изолация; 9 - въглищно огнище; 10 – аноден проводник; 11 - изолация на огнището; 12 - желязна кутия; 13 - капак
Ваната работи при 750 - 800 ° C, консумацията на енергия е 20 kWh на 1 kg чист алуминий, т.е. малко по-висока, отколкото при конвенционалната електролиза на алуминий.
Анодният метал съдържа 25–35% Cu; 7 – 12% Zn; 6 – 9% Si; до 5% Fe и малко количество манган, никел, олово и калай, останалото (40 - 55%) е алуминий. Всички тежки метали и силиций остават в анодния слой по време на рафинирането. Наличието на магнезий в електролита води до нежелани промени в състава на електролита или до неговото силно зашлаковане. За отстраняване на магнезий шлаките, съдържащи магнезий, се обработват с флюсове или газообразен хлор.
В резултат на рафинирането се получават чист алуминий (99,99%) и продукти на сегрегация (продукт на Ziger), които съдържат тежки метали и силиций и се изолират под формата на алкален разтвор и кристален остатък. Алкалният разтвор е отпадък, а твърдият остатък се използва за обезкисляване.
Рафинираният алуминий обикновено има следния състав, %: Fe 0,0005 - 0,002; Si 0,002 - 0,005; Cu 0,0005 - 0,002; Zn 0,0005 - 0,002; Mg следи; Ал почивка.
Рафинираният алуминий се преработва в полуготов продукт в определения състав или се легира с магнезий (таблица 1).
Таблица 1 - Химичен състав на алуминий с висока чистота и първичен алуминий съгласно DIN 1712, лист 1
|
Допустими примеси*, % |
||||||||
|
включително |
||||||||
* Доколкото е възможно да се определи чрез конвенционални методи на изследване.
** Чистият алуминий за електротехниката (алуминиеви проводници) се доставя под формата на първичен алуминий 99,5, съдържащ не повече от 0,03% (Ti + Cr + V + Mn); обозначен в този случай като E-A1, номер на материала 3.0256. В противен случай отговаря на VDE-0202.
Рафиниране чрез органоалуминиеви комплексни съединения и зонно топене
Алуминий с по-висок клас на чистота A1 99,99 R може да бъде получен чрез рафиниране на електролиза на чист или търговски чист алуминий, като се използват сложни органоалуминиеви съединения на алуминия като електролит. Електролизата протича при температура около 1000°C между твърди алуминиеви електроди и по принцип е подобна на рафиниращата електролиза на мед. Естеството на електролита диктува необходимостта от работа без въздух и при ниска плътност на тока.
Този вид рафинираща електролиза, използван първоначално само в лабораторен мащаб, вече се извършва в малък индустриален мащаб - произвеждат се няколко тона метал годишно. Номиналната степен на пречистване на получения метал е 99,999 -99,9999%. Потенциалните области на приложение на метал с такава чистота са криогенната електротехника и електрониката.
Възможно е да се използва разглежданият метод за рафиниране в галванопластиката.
Още по-висока чистота - номинално до A1 99.99999 - може да се получи чрез последващо зоново топене на метала. При преработката на алуминий с висока чистота в полуготов продукт, лист или тел е необходимо, предвид ниската температура на рекристализация на метала, да се вземат специални предпазни мерки. Забележително свойство на рафинирания метал е неговата висока електропроводимост в областта на криогенните температури.


