3 основни Охарактеризирайте елемента, като вмъкнете липсващите думи 1. Алуминият е елемент от III група, основната подгрупа. 2. Зарядът на ядрото на алуминиев атом е 13 протона в ядрото на алуминиев атом. 4. В ядрото на алуминиев атом има 14 неутрона. 5. В алуминиев атом има 13 електрона. 6. Алуминиевият атом има 3 енергийни нива. 7. Електронната обвивка има структура от 2e, 8e, 3e. 8. На външното ниво в атома има 3 електрона. 9. Степента на окисление на атома в съединенията е равна на. Простото вещество алуминият е метал. 11. Алуминиевият оксид и хидроксидът са амфотерни по природа. По-нататък
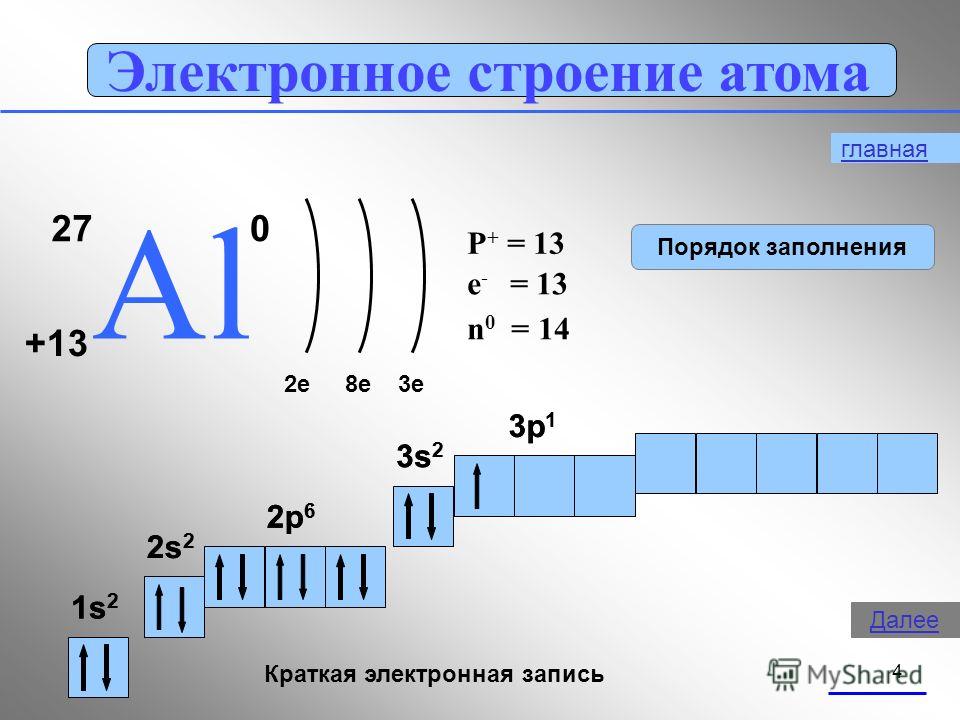
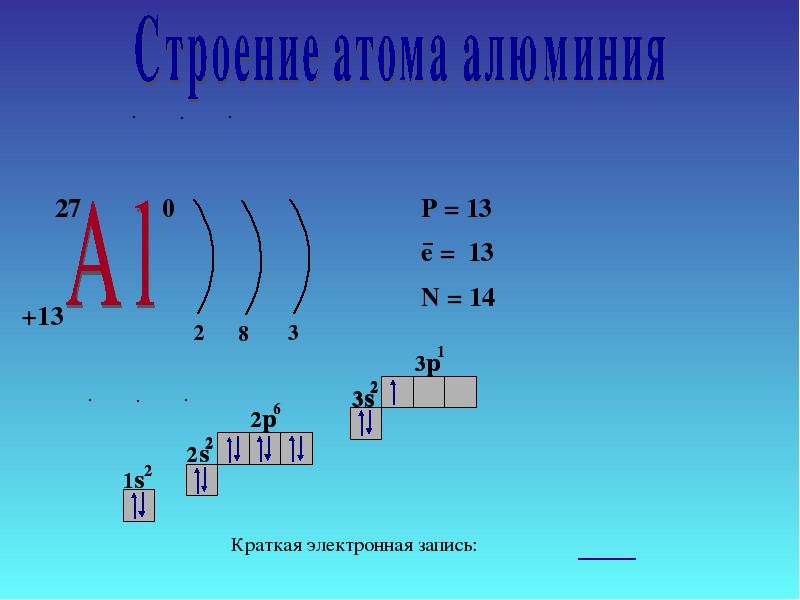
4 Електронна структура на атома 27 AlAl e8e3e P + = 13 n 0 = 14 e - = 13 1s21s2 2s22s2 2p 6 3s 2 3p 1 Кратък електронен запис 1s21s2 2s22s2 2p 6 3s 1 Следващ ред

7 От историята на откритието Главен Следващ По време на откриването на алуминия - металът е бил по-скъп от златото. Британците искаха да почетат великия руски химик Д. И. Менделеев с богат подарък, подариха му химичен баланс, в който едната чаша беше направена от злато, а другата - от алуминий. Чаша от алуминий стана по-скъпа от златото. Полученото "сребро от глина" интересува не само учени, но и индустриалци и дори императора на Франция. По-нататък



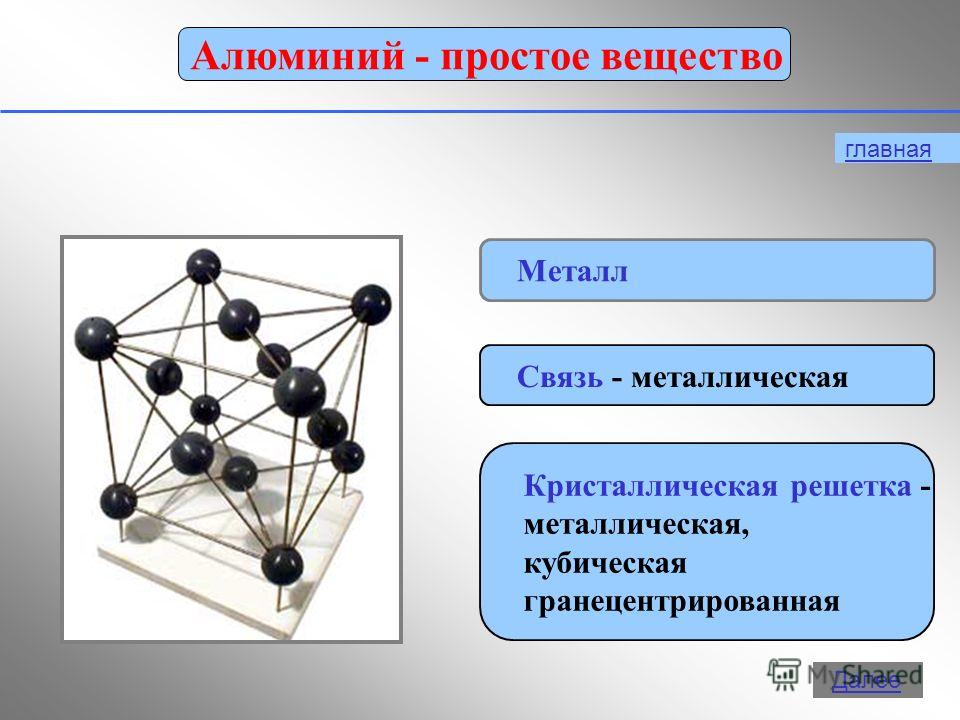
12 1. Сребристо-бял метал 2. Метален блясък 3. Най-твърдият метал 4. Точка на топене +660 ° C 5. Пластмаса 6. Лесен за рязане с нож 7. Провеждащ електричество 8. Лек 9. Провежда топлина 10. Лесен за намагнетизиране и демагнетизиране 11. Мек Изберете и запишете номерата на тези свойства, които се отнасят до физическите свойства на алуминия




Цели на урока:
Образователни -изучаване на физически и Химични свойстваалуминий и неговото приложение. Помислете за характеристиката химичен елементалуминий и изучаване на структурата на атома.
Разработване -развиват умения за провеждане на експеримент, пренасяне на съдържанието на научен и учебен текст под формата на диаграми; развитие на комуникативни умения, умения за слушане, способност за правилно изразяване на мислите.
Образователни -насърчаване на култура на работа с химикали, спазване на правилата за безопасност, възпитават съзнателна дисциплина, яснота и организираност в работата.
Учениците трябва да знаят:
структурата на алуминиевия атом, физичните и химичните свойства на алуминия като просто вещество, области на приложение.
Учениците трябва да могат:
за характеризиране на алуминия, както химичен елемент, така и просто вещество. Напишете реакционни уравнения, които доказват химичните свойства на алуминия в молекулярна и редокс форма.
Тип урок:
изучаване на нов материал.
Форма на организация учебни дейностистуденти:
групова работа, индивидуална, химически експеримент.
Методи и техники на преподаване:
търсене, частично изследване, демонстрационен химически експеримент, групова работа, устни отговори на черната дъска, самостоятелна работас текстове, взаимен контрол.
Оборудване за урок:
научни и учебни текстове по темата на урока, карти със задачи за индивидуални въпросиплан за изучаване на материалите за всяка група, PSCE,
Колекция "Алуминий и неговите съединения", алуминиево фолио, солна киселина и натриев хидроксид, алуминий, лабораторно оборудване.
Учителят поздравява учениците.
2. Актуализация на основни знания, комуникация на темата, задачите и структурата на урока:
Встъпително слово на учителя
Сами, като работите, ще направите всичко
както за любимите хора, така и за себе си,
и ако няма успех в труда,
неуспехът не е проблем, опитайте отново.
Д. И. Менделеев.
Продължаваме да изучаваме голям и важна тема"Метали". Днес на урока трябва да се запознаем с метала, който ви е добре познат от детството. Този урокИскам да започна с легендата.
„Един ден при римския император Тиберий дойде непознат. Като подарък на императора той донесе чаша, която беше направил от метал, който беше брилянтен като сребро, но изключително лек. Майсторът каза, че е получил този метал от Clay Earth. Но императорът, страхувайки се, че златото и среброто му ще се обезценят, заповядва на майстора да отсекат главата му и работилницата му да бъде унищожена. За какъв метал говорим?
(Относно алуминия)
учител:
И така, темата на нашия урок е: "Алуминият е химичен елемент и просто вещество."
Формулирани са целите на урока.
План за изучаване на темата в групи:
- Физически свойстваалуминий.
- Химични свойства на алуминия.
- Използването на алуминий и неговото присъствие в природата.
Групов работен план:
Проучете текста и подчертайте информацията, свързана с вашия въпрос;
- изпълнява предложените задачи;
- подгответе презентация по вашия проблем, базирана на краткост, яснота и яснота на представянето
Групова работа по изучаване на материала.
Подготовка на презентация по вашата тема.
Група 1.
Характеристики на химичния елемент алуминий по позицията му в PSCE.
Задачата:
- Разгледайте текста.
- Дайте описание на алуминия според позицията в PSCE според плана:
А) сериен номер.
Б) атомна маса.
В) период (малък, голям).
Г) група (подгрупа: основна или второстепенна).
Г) химичен знак.
Д) Структурата на атома (заряд на ядрото, брой протони, електрони, неутрони, електронна формула).
I) оксиди.
К) летливи водородни съединения.
2. Обсъдете резултатите в групата и отговорете на въпросите:
- Колко електрона има във външното ниво на алуминиев атом?
- Алуминият ще дарява или приема ли тези електрони?
- Какво окислително състояние ще придобие алуминиевият йон в този случай?
- Заключение: Към какъв клас съединения принадлежи алуминият (метален или неметален)
- Сравнете активността на химичния елемент алуминий с елементи от групи 1 и 2 от същия период.
- Подгответе презентация по този въпрос въз основа на за краткост, яснота и яснота на изложението.
Група 2
Физични свойства на алуминия.
Задачата:
- Разгледайте текста.
- Маркирайте материала, свързан с вашия въпрос.
- Помислете за колекцията "Алуминий и неговите сплави".
- Обсъдете следните въпроси в група:
- а) Агрегатно състояние, цвят, блясък, плътност (лека или тежка), топимост (лека или огнеупорна), електрическа и топлопроводимост, пластмаса.
- б) Начертайте получените данни под формата на диаграма.
5. Подгответе презентация по въпроса, въз основа на на краткост и яснота.
Група 3.
Химични свойства на алуминия.
Задачата:
- Разгледайте текста.
- Маркирайте материала, свързан с вашия въпрос.
- Проучете как се държи алуминият по отношение на сложни вещества?
- Завършете лабораторията, като използвате инструкциите
Задачата:
а) Направете експеримента.
б) Обсъдете наблюдаваните явления в групата.
В) Запишете уравнението на реакцията.
Г) направи изводи.
5. Подгответе презентация по този въпрос, базирани на краткост, яснота и яснота на представянето.
Група 4
Използването на алуминий.
Задачата:
- Разгледайте текста.
- Маркирайте материала, свързан с вашия въпрос.
- Обсъдете следните въпроси във вашата група:
а) Каква е ролята на алуминия в човешкия живот?
б) Използването на алуминий като проста субстанция.
- Направете диаграма, която характеризира обхвата на алуминия.
- Подгответе реч по този въпрос, базирани на краткост, яснота и яснота на представянето
- Доклад на групите по изследваните въпроси.
Всяка група, след като е изпълнила всички задачи, представя схематично представяне на своя въпрос с обсъждане и коментари, учениците си правят бележки, прехвърлят предложените схеми в тетрадки, в резултат на всички групи, референтен рефератпо темата на урока.
Заключения по темата на урока:
Колко електрона има във външното енергийно ниво на алуминиев атом.
Какво е окислителното число на алуминиевия атом? Защо? А йонът?
- С помощта на какви експерименти доказахме, че алуминият е активен метал?
Кои вещества се наричат амфотерни?
- На какви свойства се основават следните приложения?
Къде алуминият се намира най-много в тялото?
- Възможно ли е дълго времесъхранявате храна в алуминиеви съдове?
- Домашна работа: § 13 до стр. 60, ? 1, 4. Подгответе презентация за използването на алуминий.
- Последна думаучители.
Учителят благодари на учениците за съдействието, отбелязва лекторите на дъската.
Справка.
алуминий.
Основната подгрупа на група III включва елементи: бор, алуминий, галий, индий, талий. Върху външния електронен слой атомите на тези елементи съдържат три електрона (…ns2np1). Те са p-елементи. В реакциите атомите на тези елементи са редуциращи агенти, с изключение на неметалния бор, който може да бъде окислител. Всички елементи от тази подгрупа проявяват най-висока степен на окисление +3. Те образуват висши оксиди E2O3 и E(OH)3 хидроксиди, които проявяват амфотерни свойства. В тази подгрупа най-голям интерес представлява алуминият.
Алуминият в свободната си форма е сребристо-бял метал, има блясък, висока топло- и електрическа проводимост (по-ниска от медта в това отношение), светлина (плътност 2,7 g / cm3) и в същото време е издръжлив метал. Това е мек, пластичен метал, може да се навива във фолио, да се изтегля в тел. Топи се при 6600С. При 6000C алуминият става крехък и може да бъде смлян на зърна или прах.
Алуминият е метал, чиято повърхност обикновено е покрита с тънък, издръжлив оксиден филм. Под формата на стърготини и прах гори ярко във въздуха, отделяйки голямо количество топлина.
При стайна температура той активно реагира с халогени; при нагряване взаимодейства със сяра (2000C), азот (8000C) и други неметали.
Съотношението на алуминия към сложните вещества:
Алуминият се разтваря в солна киселина с всякаква концентрация:
Алуминият се разтваря в алкални разтвори:
Алуминият играе важна биологична роля в човешкия живот. Участва в изграждането на епителната и съединителната тъкан. Съдържанието на алуминий в човешкото тяло (на 70 kg телесно тегло) е 61 mg. Намира се във всички органи и тъкани: най-вече в черния дроб, белите дробове, костите на мозъка. Основният прием на алуминий в организма е храната - това са хлебни продукти, чай (от 20 - 200 mg на 100 g продукт), картофи - 4 mg на 100 g. продукт, жълта ряпа - 46 mg на 100 g продукт.
При готвене и съхранение на храна в алуминиеви съдове съдържанието на алуминий в продуктите се удвоява. Увеличаването на съдържанието на алуминий в кръвта предизвиква възбуждане на централната нервна система. При излишък на алуминий в организма се нарушава двигателната активност, гърчовете, влошаването на паметта, чернодробните и бъбречните заболявания. С намаляване на съдържанието на алуминий централната нервна система се инхибира.
Областите на приложение на алуминия са многобройни. Поради своята лекота и здравина, алуминият и неговите сплави се използват в самолето- и ракетостроенето (алуминият се нарича крилат метал), конструкцията на кораби и автомобили; в строителството - за производството на дограма и врати, лекотата и добрата електропроводимост на алуминия се използва при производството на електрически проводници за електропроводи. Топлопроводимостта и нетоксичността са важни при производството на алуминиеви съдове за готвене и фолио за съхранение хранителни продукти. Алуминиевият прах е основата за производството на сребърна боя за защита на железните продукти от корозия. Способността на алуминия да гори във въздуха с ярък пламък се използва при приготвянето на цветни фойерверки и производството на искри.
ОБЩИНСКА БЮДЖЕТНА ОБРАЗОВАТЕЛНА ИНСТИТУЦИЯ
ОБЩО ОБРАЗОВАТЕЛНО УЧИЛИЩЕ № 81
алуминий. Позицията на алуминия в периодична системаи структурата на неговия атом. Намиране в природата. Физични и химични свойства на алуминия.
учител по химия
МБОУ СОУ №81
2013
Тема на урока: Алуминий. Позицията на алуминия в периодичната система и структурата на неговия атом. Намиране в природата. Физични и химични свойства на алуминия.
Цели на урока:
разгледа разпространението на алуминия в природата, неговите физични и химични свойства, както и свойствата на съединенията, които образува.
Работен процес
1. Организационен момент на урока. 2. Усвояване на нов материал. алуминийосновна подгрупа III групи от периодичната система съставляват бор (B), (A l), галий (Ga), индий (In) и талий (T l). Както се вижда от дадените данни, всички тези елементи са отворени в XIX век.Откриване на метали от основната подгрупа
III
групи

IN
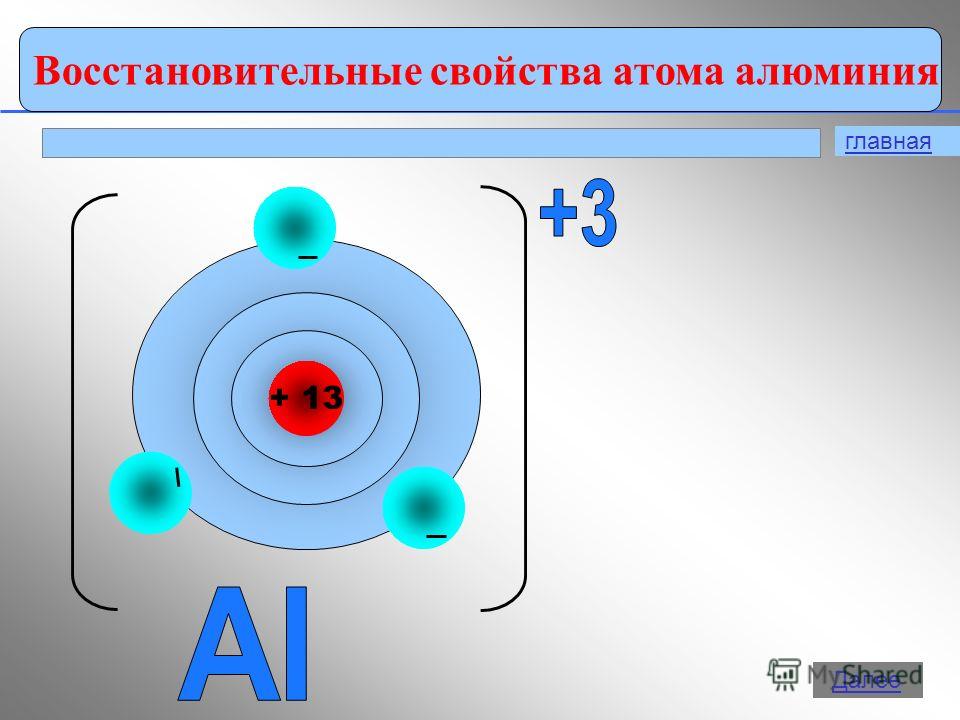
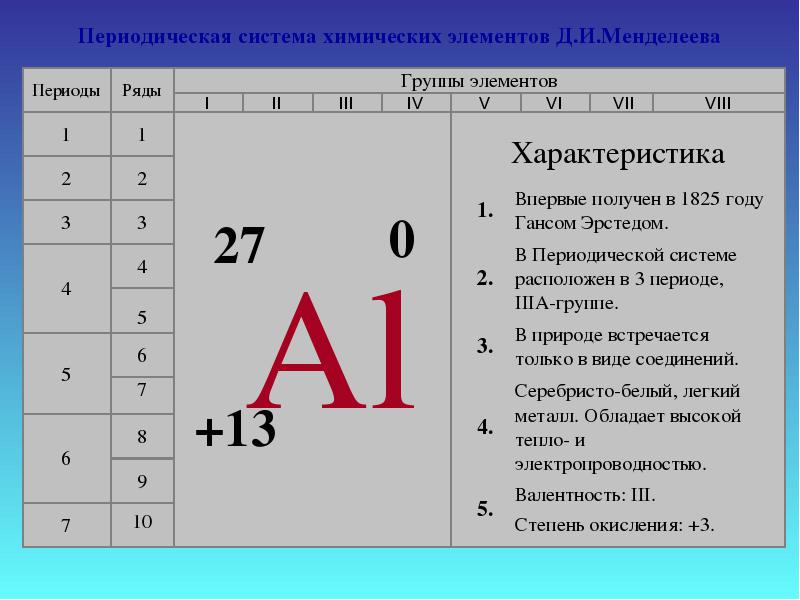
Борът е неметал. Алуминият е преходен метал, докато галий, индий и талий са пълни метали. По този начин, с увеличаване на атомните радиуси на елементите от всяка група от периодичната система, металните свойства прости веществазасилват се.В тази лекция ще разгледаме по-отблизо свойствата на алуминия.1. Позицията на алуминия в таблицата на Д. И. Менделеев. Показани са структурата на атома, степените на окисление. Алуминиевият елемент се намира в III група, основна "А" подгрупа, 3-ти период от периодичната система, сериен номер № 13, относителна атомна масаАр (Ал ) = 27. Неговият съсед отляво в таблицата е магнезий, типичен метал, а отдясно, силиций, който вече не е метал. Следователно алуминият трябва да проявява свойства от някакъв междинен характер и неговите съединения са амфотерни.Al +13) 2 ) 8 ) 3 , p е елемент,
Основно състояние
1 s 2 2 s 2 2 p 6 3 s 2 3 p 1
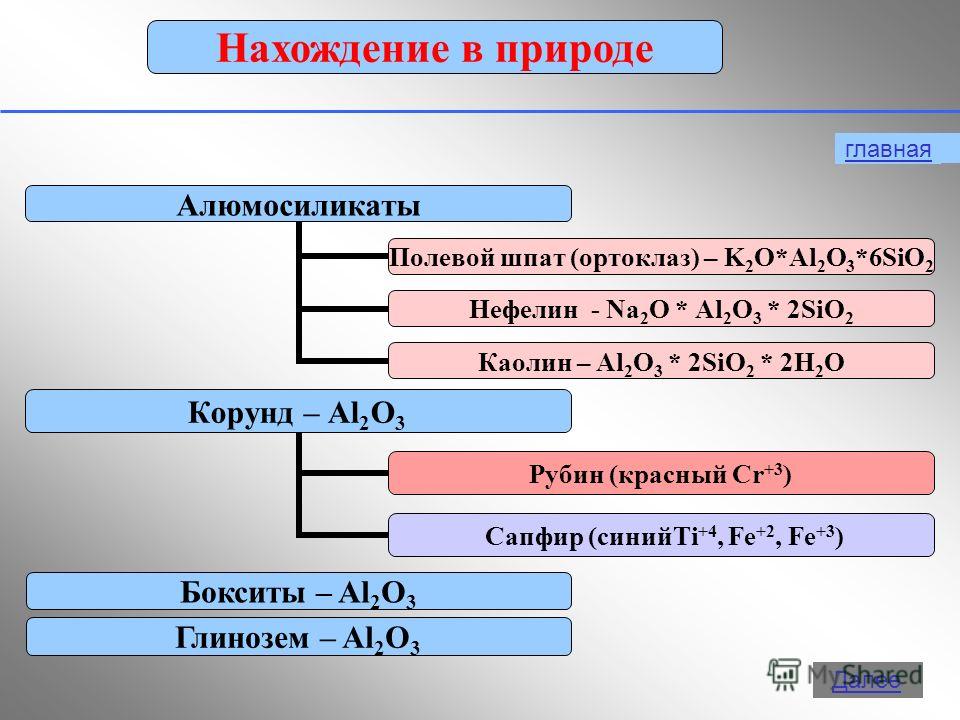
Алуминият проявява степен на окисление +3 в съединения: Al 0 - 3 e - → Al +3 2. Физични свойства Алуминият в свободна форма е сребристо-бял метал с висока топло- и електрическа проводимост. Точка на топене 650относно C. Алуминият има ниска плътност (2,7 g/cm 3 ) - около три пъти по-малко от това на желязото или медта и в същото време е издръжлив метал.3. Да бъдеш сред природата По отношение на разпространението в природата той заема1-во място сред металите и 3-то сред елементите на второ място след кислорода и силиция. Процентът на алуминий в земната кораспоред различни изследователи тя е от 7,45 до 8,14% от масата на земната кора.В природата алуминият се среща само в съединения (минерали). Някои от тях: Боксити - Al 2 O 3 H 2 O (с примеси SiO 2 , Fe 2 O 3 , CaCO 3 ) Нефелини - KNa 3 4 Алунити - KAl(SO 4 ) 2 2Al(OH) 3 Алуминий (смеси от каолини с пясък SiO 2 , варовик CaCO 3 , магнезит MgCO 3 ) Корунд - Al 2 O 3 Фелдшпат (ортоклаз) - К 2 O×Al 2 O 3 ×6SiO 2 Каолинит - Al 2 O 3 ×2SiO 2 × 2H 2 O Алунит - (Na,K) 2 SO 4 ×Al 2 (SO 4 ) 3 ×4Al(OH) 3 Берил - 3BeO Al 2 O 3 6SiO 2Боксит
4. Химични свойства на алуминия и неговите съединения Алуминият лесно взаимодейства с кислород при нормални условия и е покрит с оксиден филм (придава матов вид).Дебелината му е 0,00001 мм, но благодарение на него алуминият не корозира. За да се изследват химичните свойства на алуминия, оксидният филм се отстранява. (С помощта на шкурка или химически: първо чрез потапяне в алкален разтвор за отстраняване на оксидния филм, а след това в разтвор на живачни соли, за да се образува алуминиево-живачна сплав - амалгама).аз . Взаимодействие с прости вещества Алуминият вече при стайна температура реагира активно с всички халогени, образувайки халогениди. При нагряване взаимодейства със сяра (200 °C), азот (800 °C), фосфор (500 °C) и въглерод (2000 °C), с йод в присъствието на катализатор - вода: 2A l + 3 S \u003d A l 2 S 3 (алуминиев сулфид), 2A l + N 2 \u003d 2A lN (алуминиев нитрид), A l + P = A l P (алуминиев фосфид), 4A l + 3C \u003d A l 4 C 3 (алуминиев карбид). 2 Al + 3 I 2 \u003d 2 A lI 3 (алуминиев йодид)Всички тези съединения са напълно хидролизирани с образуването на алуминиев хидроксид и съответно сероводород, амоняк, фосфин и метан: Ал 2 С 3 + 6Н 2 O = 2Al(OH) 3 +3Н 2 САл 4 ° С 3 + 12Н 2 O = 4Al(OH) 3 + 3CH 4 Под формата на стърготини или прах, той гори ярко във въздуха, отделяйки голямо количество топлина: 4A l + 3 O 2 \u003d 2A l 2 O 3 + 1676 kJ.
II. Взаимодействие със сложни вещества Взаимодействие с вода : 2 Al + 6 H 2 O \u003d 2 Al (OH) 3 + 3 H 2 без оксиден филм Взаимодействие с метални оксиди: Алуминият е добър редуктор, тъй като е един от активните метали. Той е в серия на активност непосредствено след алкалоземните метали. Ето защовъзстановява металите от техните оксиди . Такава реакция - алуминотермията - се използва за получаване на чисти редки метали, като волфрам, ванадий и др. 3 Fe 3 O 4 + 8 Al \u003d 4 Al 2 O 3 + 9 Fe + Q Термитна смес Fe 3 О 4 и Al (прах) - също се използва при термитно заваряване. C r 2 O 3 + 2A l \u003d 2C r + A l 2 O 3 Взаимодействие с киселини : С разтвор на сярна киселина: 2 Al + 3 H 2 SO 4 \u003d Al 2 (SO 4) 3 + 3 H 2 Не реагира със студена концентрирана сярна и азотна (пасивира). Следователно азотната киселина се транспортира в алуминиеви резервоари. Когато се нагрява, алуминият е в състояние да намали тези киселини, без да отделя водород: 2A l + 6H 2 SO 4 (конц) \u003d A l 2 (SO 4) 3 + 3 SO 2 + 6H 2 O, A l + 6H NO 3 (конц) \u003d A l (NO 3) 3 + 3 NO 2 + 3H2O. Взаимодействие с алкали . 2 Al + 2 NaOH + 6 H 2 O \u003d 2 Na Al (OH) 4 + 3 H 2 на[НО л(ТОЙ ЛИ Е) 4 ] – натриев тетрахидроксоалуминат По предложение на химика Горбов по време на Руско-японската война тази реакция е използвана за производство на водород за балони. Със солеви разтвори: 2 Al + 3 CuSO 4 \u003d Al 2 (SO 4) 3 + 3 Cu Ако повърхността на алуминия се натрие с живачна сол, тогава се получава следната реакция: 2 Ал + 3 HgCl 2 = 2 AlCl 3 + 3 hgОсвободеният живак разтваря алуминия, образувайки амалгама. 5. Приложение на алуминия и неговите съединения

Физичните и химичните свойства на алуминия са довели до широкото му използване в технологиите.Авиационната индустрия е основен потребител на алуминий. : 2/3 самолета е изработен от алуминий и неговите сплави. Самолет, изработен от стомана, би бил твърде тежък и можел да превозва много по-малко пътници.Следователно алуминият се нарича крилат метал. Кабелите и проводниците са изработени от алуминий : при същата електропроводимост, тяхната маса е 2 пъти по-малка от съответните медни продукти.Като се има предвид устойчивостта на корозия на алуминия, топроизводство на части от апарати и съдове за азотна киселина . Алуминиевият прах е основата за производството на сребърна боя за защита на железните изделия от корозия, както и за отразяване на топлинните лъчи, такава боя се използва за покриване на петролни складове и костюми на пожарникарите.Алуминиевият оксид се използва за производство на алуминий, а също и като огнеупорен материал.Алуминиевият хидроксид е основният компонент на добре познатите лекарства Maalox, Almagel, които понижават киселинността на стомашния сок. Алуминиевите соли са силно хидролизирани. Това свойство се използва в процеса на пречистване на водата. Към водата за пречистване се добавят алуминиев сулфат и малко количество гасена вар, за да се неутрализира получената киселина. В резултат на това се отделя обемна утайка от алуминиев хидроксид, която, утаявайки се, поема със себе си суспендирани частици мътност и бактерии.По този начин алуминиевият сулфат е коагулант.6. Получаване на алуминий 1) Съвременният икономически ефективен метод за производство на алуминий е изобретен от Американския Хол и французина Еру през 1886 г. Състои се в електролиза на разтвор на алуминиев оксид в разтопен криолит. Разтопен криолит Na 3 AlF 6 разтваря Al 2 O 3, как водата разтваря захарта. Електролизата на "разтвор" на алуминиев оксид в разтопен криолит протича така, сякаш криолитът е само разтворител, а алуминиевият оксид е електролит. 2Al 2 O 3 електрически ток → 4Al + 3O 2 В Английската енциклопедия за момчета и момичета статия за алуминия започва със следните думи: „На 23 февруари 1886 г. започва нова метална ера в историята на цивилизацията - ерата на алуминия. На този ден Чарлз Хол, 22-годишен химик, се появи в лабораторията на първия си учител с дузина малки топчета сребристо-бял алуминий в ръка и с новината, че е намерил начин да произведе този метал евтино и в големи количества. Така Хол стана основател на американеца алуминиева индустрияи англосаксонски национален геройкато човек, който направи страхотен бизнес от науката. 2) 2Al 2 O 3 + 3 C \u003d 4 Al + 3 CO 2 ТОВА Е ИНТЕРЕСНО:
- Металният алуминий е изолиран за първи път през 1825 г. от датския физик Ханс Кристиан Ерстед. Чрез преминаване на газообразен хлор през слой от горещ алуминиев оксид, смесен с въглища, Oersted изолира алуминиев хлорид без най-малка следа от влага. За да възстанови металния алуминий, Ерстед трябваше да третира алуминиевия хлорид с калиева амалгама. След 2 години немският химик Фридрих Вьолер. Той подобри метода, като замени калиевата амалгама с чист калий.
През 18-ти и 19-ти век алуминият е основният метал за бижута. През 1889 г. в Лондон Д. И. Менделеев е награден с ценен подарък за заслугите си в развитието на химията - везни от злато и алуминий.
До 1855 г. френският учен Saint-Clair Deville е разработил метод за получаване метален алуминийв технически мащаб. Но методът беше много скъп. Девил се ползвал със специалното покровителство на Наполеон III, император на Франция. В знак на своята преданост и признателност Девил изработва за сина на Наполеон, новородения принц, елегантно гравирана дрънкалка – първият „потребителски продукт“ от алуминий. Наполеон дори възнамеряваше да оборудва гвардейците си с алуминиеви кираси, но цената беше непосилна. По това време 1 кг алуминий струваше 1000 марки, т.е. 5 пъти по-скъпо от среброто. Едва с изобретяването на електролитния процес алуминият става толкова ценен, колкото и конвенционалните метали.
Знаете ли, че алуминият, навлизайки в човешкото тяло, причинява разстройство на нервната система. С излишъка му се нарушава обмяната на веществата. А защитните агенти са витамин С, калций, цинкови съединения.
Когато алуминият гори в кислород и флуор, се отделя много топлина. Поради това се използва като добавка към ракетното гориво. Ракетата Сатурн изгаря 36 тона алуминиев прах по време на полета си. Идеята за използване на метали като компонент на ракетното гориво е предложена за първи път от F.A. Zander.
Мисля! Защо тази реакция не може да се проведе във воден разтвор? №2. Попълнете уравненията на химичните реакции:
Al + H2SO4 (разтвор) ->
Al + CuCl 2 ->
Al + HNO3 (конц) - t ->
Al + NaOH + H2O -> Не. 3. Решете проблема:
Сплав алуминий-мед беше изложена на излишък от концентриран разтвор на натриев хидроксид, докато се нагрява. Изпуснати са 2,24 литра газ (n.o.s.). Изчислете процентния състав на сплавта, ако нейната обща маса е 10 g?4. Домашна работа Забележка: в урока може да се използва презентация„Алуминий. Позицията на алуминия в периодичната система и структурата на неговия атом. Намиране в природата. Физични и химични свойства на алуминия.»
2.1.1 Позицията на алуминия в периодичната система и структурата на неговия атом
Алуминият е в основната подгрупа на група III. Разположението на енергийните нива е както следва:
3 Al 2e - , 8e - ,3e -
Тъй като алуминиевите атоми имат 3 електрона на външното ниво, алуминият в съединенията показва степен на окисление 4-3.
Стигаме до същото заключение, водени от представите за естеството на движението на електроните в атомите и тяхното разположение не само в енергийни нива, но и в поднива. В алуминиев атом 3s 2 електрона лесно се разпадат и един електрон преминава през 3p орбитала:
Резултатът е три несдвоени електрона. Отговорете на въпрос 1 (стр. 138).
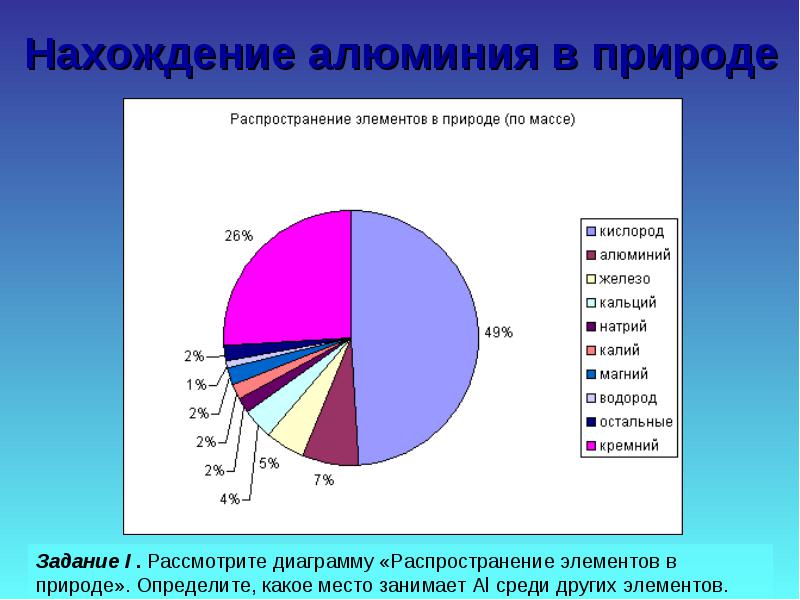
2.1.2 Намиране на алуминий в природата, неговото производство и свойства
Алуминият е третият най-разпространен елемент в земната кора. Среща се само в съединения. Най-важните от тях са показани на фигура 19.
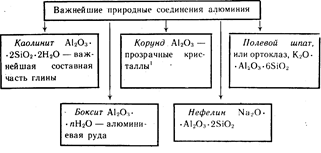
Оцветени червени кристали Al 2 O 3 - рубини, от син цвят- сапфири.
Разписка
През 1827 г. немският химик Ф. Вьолер получава алуминий чрез нагряване на алуминиев хлорид с алкални метали с калий или натрий без достъп на въздух.
AlCl 3 +3K 3KCl + Al
За промишлено производствоалуминий, тези методи са икономически неизгодни, следователно е разработен електрохимичен метод за получаване на алуминий от боксити.
Физически свойства
Алуминият е сребристо-бял метал, лек (r = 2,7 g / cm 3), топи се при 660 ° C. Много е пластичен, лесно се изтегля в тел и се пече на листове и фолио. По електрическа проводимост алуминият е на второ място след среброто и медта (той е 2/3 от електрическата проводимост на медта).
Химични свойства
В серията на електрохимичното напрежение алуминият е поставен зад най-активните метали. От ежедневния опит обаче е известно, че алуминиевите продукти (съдове и др.) не се влияят нито от кислород, нито от вода, дори при температурата на кипене. Алуминият също не се влияе от концентрирана студена азотна киселина. Това се дължи на наличието на тънък оксиден филм върху алуминиевата повърхност, който я предпазва от по-нататъшно окисление. Ако повърхността на алуминия се натрие с живачна сол, тогава се получава следната реакция:
2А1 + 3HgCl 2 ® 2А1С1 3 + 3Hg
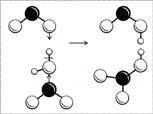
Отделеният живак разтваря алуминия и се образува неговата сплав с живак - алуминиева амалгама. Филмът не се задържа върху амалгатираната повърхност, така че алуминият реагира с вода при нормални условия (фиг. 46):
2А1 + 6НОН ® 2А1(ОН) 3 ¯ + 3Н 2
При повишени температури алуминият реагира с много неметали и сложни вещества без сливане:

Приложение
Алуминият се използва за производството на различни сплави. Най-разпространени са дуралумините, съдържащи мед и магнезий, и силумините - сплави на алуминий със силиций. Основните предимства на тези сплави са лекота и висока якост. Споменатите сплави намират широко приложение в самолетостроенето, автомобилите, корабите и приборостроенето, в ракетната техника и в строителството. Под формата на чист метал алуминият се използва за производството на електрически проводници и различно химическо оборудване.
Алуминият се използва и за алуминиране, т.е. насищане на повърхностите на стоманени и чугунени продукти с алуминий, за да ги предпази от корозия.
На практика често се използва термит (смес от Fe 3 O 4 оксид с алуминиев прах). Ако тази смес се запали (с помощта на магнезиева лента), тогава настъпва бурна реакция с освобождаването на Голям бройтоплина:
8Al + 3Fe 3 O 4 ® 4Al 2 O 3 + 9Fe
Този процес се използва при така нареченото термитно заваряване, както и за получаване на някои метали в свободна форма.
Отговорете на въпроси 2-6 (стр. 138). Решете задачи 1 - 2 (стр. 138).
2.1.3 Най-важните алуминиеви съединения
Алуминиев оксид
Al 2 O 3 може да се получи по следните начини:
1. Чрез директно изгаряне на алуминиев метален прах (чрез издухване на алуминиев прах в пламъка на горелката):
4Al + 3O 2 ® 2А1 2 O 3
2. Чрез трансформация съгласно схемата по-долу:
Алуминиевият оксид е твърдо, огнеупорно (темпер. пл. 2050 ° C) вещество бял цвят.
Според химичните си свойства той е амфотерен оксид (I, § 37). Реагира с киселини, проявява свойствата на основни оксиди:
A1 2 O 3 + 6HC1 2A1C1 3 + 3H2O
Al 2 O 3 + 6H + + 6С1 - 2Al 3+ + 6С1 - + 3Н 2 O
A1 2 O 3 + 6H + 2A1 3+ + 3H 2 O
Алуминиевият оксид реагира с алкали и проявява свойствата на киселинните оксиди. Освен това по време на сливането се образуват соли на метаалуминиевата киселина HA1O 2, т.е. метаалуминати:
Al 2 O 3 + 2NaOH 2NaA10 2 + H 2 0
В присъствието на вода реакцията протича по различен начин:
A1 2 O 3 + 2NaOH + H 2 O ® 2
Това се дължи на факта, че във воден разтвор натриевият алуминат NaA1O 2 свързва една или две водни молекули, които могат да бъдат изобразени по следния начин:
а) NaA1O2-H2O, или NaH2A1O3; б) NaA1O 2 -2H 2O или NaAl (OH) 4.
алуминиев хидроксид
Алуминиевият хидроксид A1 (OH) 3 се получава чрез взаимодействие на алкален разтвор с разтвори на алуминиеви соли (алкален разтвор не може да се приема в излишък):
AlCl 3 + NaOH ® Al(OH) 3 ¯ + 3NaCl
A1 3+ + 3Cl - + 3Na + + 3OH - ® Al(OH) 3 ¯ + 3Na + + 3С1 -
Al 3+ + 3OH - ® A1 (OH) 3 ¯
Ако бялата желеобразна маса от алуминиев хидроксид се изолира от разтвора и се изсуши, тогава се получава бяло кристално вещество, което практически не се разтваря във вода.
Алуминиевият хидроксид (подобно на неговия оксид) има амфотерни свойства. Както всички основи, алуминиевият хидроксид реагира с киселини. Когато алуминиевият хидроксид се стопи с алкали, се образуват метаалуминати и в водни разтвори- хидрати на метаалуминати:
А1(OH) 3 + NaOH NaА1O 2 + 2Н 2 O
A1 (OH) 3 + NaOH ® NaH 2 A1O 3 + H 2 O
Алуминиевите соли се получават главно при взаимодействието на метален алуминий с киселини. По физични свойства това са твърди кристални вещества, лесно разтворими във вода. Химичните свойства на алуминиевите соли са подобни на тези на други соли (, стр. 98-99). Тъй като алуминиевите соли се образуват от слаба основа и силна киселина, те се подлагат на хидролиза във водни разтвори (стр. 18).
Отговорете на въпроси 7-10 (стр. 138). Решете задача 3 (стр. 138).
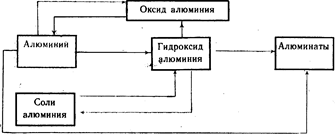
Генетична връзка между алуминия и неговите най-важни съединения (схема 20).
Така от изложеното по-горе може да се заключи, че училищна програмамного малко часове са посветени на изучаването на тази тема, а освен това практически няма информация за екологичните аспекти на тази тема.
Азотът образува редица оксиди, които формално съответстват на всички възможни окислителни състояния от +1 до +5: N 2 O, NO, N 2 O 3, NO 2, N 2 O 5, но само два от тях са азотен оксид ( II) и оксидният азот (IV) са не само стабилни при нормални условия, но също така участват активно в естествените и промишлените азотни цикли.
2.2.1 Някои азотни съединения и техните свойства 1.2.1.1. азотни оксиди
N 2 +1 O - азотен оксид (I), азотен оксид, "смеещ се" газ, несолеобразуващ оксид. Получаване на N 2 O чрез разлагане на амониев нитрат:
N 2 O има лек приятен мирис и сладникав вкус. Не реагира с кислород, вода, разтвори на киселини и основи. Той се разлага на елементи при температури над 500 ° C, с други думи, доста е стабилен.
Структура: кислородът има 2 несдвоени електрона, азотът има 3 - образува се двойна връзка и един несдвоен електрон в остатъка. Може да се предположи, че NO молекули ще се сдвоят и ще образуват димерна ONNO молекула. Структура на молекулата: линейна молекула O=N=N, в която централният N атом е четиривалентен. Той образува две двойни връзки: едната с кислород според типичната схема за създаване на ковалентна връзка (два азотни електрона, два кислородни електрона), другата с азотен атом (който сдвоява два от трите си несдвоени електрона и образува празна орбитала поради към това), едната от връзките е ковалентна, втората е донорно-акцепторна (фиг. 1).
Инсталацията за производство на азотен оксид (I) се състои от стелажи, епруветки, щепсел с тръба за изпускане на газ, кристализатор, цилиндър и спиртна лампа (фиг. 2). NH 4 NO 3 се поставя в епруветка, затваря се със запушалка с тръба за изпускане на газ и се нагрява. Газът се събира в цилиндър, пълен с вода.

Ориз. 1. Молекула азотен оксид (I) - N 2 O
Оксидът N 2 O се разлага при нагряване:
Оксид N 2 O реагира с водород:
N +2 O - азотен оксид (II), несолеобразуващ оксид. NO се получава при взаимодействието на медта с киселина HNO 3 (диф.) (фиг. 3).
Кристална клеткамолекулярно; молекулата е лека, слабо полярна (електроотрицателността на кислорода е малко по-висока от тази на азота). Може да се предположи, че точките на топене и кипене ще бъдат ниски, но по-високи от тези на азота, тъй като полярността на молекулата прави възможно свързването на електростатичните сили на привличане с прости междумолекулни сили. Образуването на димер също допринася за повишаване на точката на кипене. Структурата на молекулата също предполага ниска разтворимост във вода. Азотният оксид (II) е безцветен и без мирис.
За да се получи азотен оксид (II), няколко медни стърготини се поставят в епруветка и се излива разредена азотна киселина. Епруветката се затваря със запушалка с тръба за изпускане на газ и се фиксира в статив. Краят на тръбата за изпускане на газ се спуска във формата с вода и след това в цилиндъра (фиг. 3). При нагряване се отделя NO. NO лесно се окислява от кислорода на въздуха, т.е. действа като редуциращ агент:
![]()
В реакция с кисел газоксид NO - окислител:
![]()
N +2 2 O 3 - азотен оксид (III), азотен анхидрид (отговаря на азотната киселина HNO 2 и нитритните соли); това е кисел оксид, притежава всички свойства на киселинните оксиди. Получаване на оксид N 2 O 3 чрез реакцията:
NO 2 + NO N 2 O 3.
N +4 O 2 - азотен оксид (IV), азотен диоксид, кафяв газ (токсичен).
Помислете за азотните електрони в молекулата NO. Това е несдвоен електрон, свободна двойка електрони и още два електрона, свързани с кислород - общо пет. А кислородният атом, "влизайки в контакт", има шест електрона в четири орбитали. Ако ги подредите две по една, тогава една орбитала ще остане свободна. Именно това пространство е заето от двойка електрони на азотния атом (фиг. 4, 5).
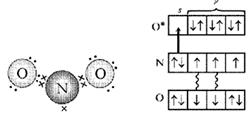
Ориз. 4. Схема електронна структура NO 2 молекули (първи вариант). (Точките показват електроните на O атомите, кръстчетата показват електроните на N атома)
Ориз. 5. Схема на електронната структура на молекулата NO 2 (втори вариант). (Звездичката показва възбудения О атом, стрелката показва връзката донор-акцептор.
Тъй като двойка електрони, разположени в s-орбитала, се „свързаха“, тя просто трябва да претърпи хибридизация. Възниква въпросът: какъв тип хибридизация използва атомът? Отговор: три електронни орбитали на азота са в състояние на sp 2 хибридизация. Молекулата NO 2 е ъглова, ъгълът е 134° (ъгълът е по-голям от 120°, защото 1 електрон отблъсква от себе си свързани електрони по-слаби от двойка електрони) (фиг. 6, 7).
Кристалната решетка е молекулярна, но тъй като самата молекула е по-тежка от NO и склонността й към димеризация е значително по-висока, това вещество трябва да се стопи и да кипи при забележимо по-високи температури. Точката на кипене е 21 ° C, следователно, при нормални условия - 20 ° C и 760 mm Hg. Изкуство. – течност азотен оксид (IV).
Азотният оксид (IV) се разтваря във вода, като едновременно с нея реагира и в този случай се получават две киселини наведнъж.


Ориз. 6. Молекула NO 2 - изглед отгоре
Ориз. 7. Молекула NO 2 - изглед отстрани, от страната на донорно-акцепторната връзка. (Вторият кислороден атом не се вижда отвъд орбиталите на азотния атом. Защрихованите кръгове са хибридизираните атомни орбитали, насочени към четеца.)
Азотният оксид (IV) има както характерна остра миризма, така и червеникаво-кафяв цвят, чиито нюанси се различават един от друг в зависимост от концентрацията. Именно заради този цвят емисиите на азотни оксиди в атмосферата се наричат "лисича опашка".
NO 2 оксидни реакции
1) С вода:
2NO 2 + H 2 O \u003d HNO 3 + HNO 2.
2) С основи:
2NO 2 + 2NaOH \u003d NaNO 3 + NaNO 2 + H 2 O.
3) Димеризация при охлаждане:
![]()
При температура от -11 °C равновесието се измества напълно вдясно, а при +140 °C е напълно наляво.
N +5 2 O 5 - азотен оксид (V), азотен анхидрид, киселинен оксид, силен окислител. Оксид N 2 O 5 лесно се разлага:
2N 2 O 5 \u003d 4NO 2 + O 2.
2.2.1.2 Азотна киселина
От азотните хидроксиди ще разгледаме най-многотонажния - азотна киселина.
Молекулата на азотната киселина е полярна (поради различната електроотрицателност на кислорода и водорода, защото азотът е сякаш скрит вътре в молекулата) и асиметрична. И трите ъгъла, присъстващи в него между връзките на азота и кислорода, са различни. Формалната степен на окисление на азота е най-висока (+5). Но в същото време има само 4 връзки при азотния атом с други атоми - валентността на азота е 4.
Структурата на една молекула е по-лесна за разбиране, ако разгледаме процеса на нейното получаване. Азотната киселина се получава чрез реакцията на азотен оксид (IV) с вода (в присъствието на кислород): две молекули NO 2 едновременно "атакуват" водната молекула със своите несдвоени електрони, в резултат на това връзката между водород и кислород е не се счупи както обикновено (двойка електрони в кислород и "гол протон"), и едната молекула NO 2 получава водород със своя електрон, другата - радикала OH (фиг. 8). Образуват се две киселини: и двете киселини са силни, и двете бързо даряват своя протон на най-близките водни молекули и в крайна сметка остават под формата на NO 2 - и NO 3 - йони. Йонът NO 2 е нестабилен, две молекули HNO 2 се разлагат на вода, NO 2 и NO. NO оксидът реагира с кислорода, превръщайки се в NO 2 и така нататък, докато се получи само азотна киселина.
Ориз. 8. Схема на образуване на молекули на азотна и азотна киселини. (Черната топка е атомът N, големите бели топки са О атомите, малките бели топки са Н атомите.)
Формално се оказва, че азотен атом е свързан с един кислороден атом чрез двойна връзка, а с друг - с обикновена единична връзка (този кислороден атом също е свързан с водороден атом). Азотът в HNO 3 е свързан с третия кислороден атом чрез донорно-акцепторна връзка, като азотният атом действа като донор. Хибридизацията на азотния атом в този случай трябва да бъде sp 2 поради наличието на двойна връзка, която определя структурата - плосък триъгълник. В действителност се оказва, че наистина фрагмент от азотен атом и три кислородни атома е плосък триъгълник, само че в молекула на азотна киселина този триъгълник е неправилен - и трите ONO ъгъла са различни, следователно, различни страни на триъгълника. Когато молекулата се дисоциира, триъгълникът става правилен, равностранен. Това означава, че кислородните атоми в него стават еквивалентни. Всички връзки стават еднакви.
Физични свойства на азотната киселина
Йонизирано съединение, дори и само частично, е трудно да се превърне в газ. По този начин точката на кипене трябва да е достатъчно висока, но с толкова малко молекулно тегло, точката на топене не трябва да е висока. Следователно агрегатното състояние при 20°C е течно. По отношение на разтворимостта, подобно на много други полярни течности, азотната киселина лесно се смесва с вода във всяко съотношение. Чистата азотна киселина е безцветна и без мирис. Въпреки това, поради разлагането на кислород и азотен оксид (IV), който се разтваря в него, можем да кажем, че обикновената концентрирана азотна киселина има жълто-кафяв цвят и остра миризма, характерна за NO 2. Нека видим как структурата на молекулата на азотната киселина влияе върху нейните химични свойства.
HNO 3 е силен окислител
Когато HNO 3 взаимодейства с метали (M), водородът не се отделя:
M + HNO 3 ® сол + вода + газ.
Смес от HNO 3 (конц.) с HCl (конц.) в обемно съотношение 1:3 (1V HNO 3 + 3V HCl) се нарича "царска вода".
Au + HNO 3 + 3HCl = AuCl 3 + NO + 2H 2 O.
Азотната киселина не реагира с други киселини под формата на обменни или комбинирани реакции. Въпреки това, той е доста способен да реагира като силен окислител. В смес от концентрирана азотна и солна киселина, обратими реакции, чиято същност може да бъде обобщена чрез уравнението:
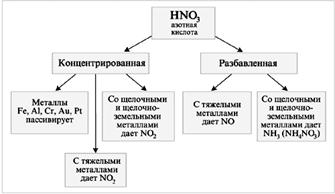
Полученият атомен хлор е много активен и лесно отнема електрони от металните атоми, а хлоридният йон образува стабилни комплексни йони с получените метални йони. Всичко това позволява дори златото да бъде прехвърлено в разтвор. Концентрираната H 2 SO 4 като силен дехидратиращ агент насърчава реакцията на разлагане на азотната киселина в азотен оксид (IV) и кислород. Азотната киселина е една от силните неорганични киселини и естествено реагира с алкали. Той също така реагира с неразтворими хидроксиди и основни оксиди.
При изучаване на тема „Азот. Съединения на азота” използват учебника по химия под редакцията на G.E. Рудзитис, Ф.Г. Фелдман, също учебник за 9 клас, под редакцията на Н.С. Ахметов. Дидактически материалслужи като учебник по химия за 8-9 клас, под редакцията на А. М. Радецки, В. П. Горшков; използвани са задачи за самостоятелна работа по химия за 9 клас, под редакцията на Р.П. Суровцева, С.В. Софронова; колекция от задачи по химия се използва за гимназияи за кандидатстващи в университети, под редакцията на Г.П. Хомченко, И.Г. Хомченко. За изучаване на тази тема са предвидени 7 часа.
ГЛАВА 3. МЕЖДУПРЕДМЕТНИ ВРЪЗКИ ПРИ ИЗУЧАВАНЕ III И V ГРУПИ НА Д.И.
Борът никога не се среща в природата в свободно състояние, винаги се оказва, че е свързан с кислорода. В тази форма той присъства в борната киселина H 3 BO 3, която се намира във водата на горещи извори във вулканични райони. В допълнение, многобройни соли на борната киселина са често срещани в природата. От тези соли най-известната е боракс или тинкал Na 2 B 4 O 7 . 10H 2 O. Борацит 2Mg 3 B 8 O 15 е от техническо значение. MgCl 2, пандермит Ca 2 B 6 O 11. 3H 2 O, колеманит Ca 2 B 6 O 11. 5H 2 O, кернит Na 2 B 4 O 7. 4H2O.
Необходимо е да се посочат следните минерали, които са производни на борната киселина: борокалцит CaB 4 O 7. 4H 2 O, бор-натрокалцит NaCaB 5 O 9. 6H 2 O, хидроборацит MgCaB 6 O 11. 6H 2 O, боромагнезит 2Mg 5 B 4 O 11. 5H 2 O, сингалит MgAlBO 4 и др.
3.1.1.2 Биохимична роля
Борът и неговите съединения имат голямо значениев национална икономика. Изотопът 5 10 B, който абсорбира неутрони, се използва в ядрената технология за забавяне на ядрените верижни реакции. Бораксът и борната киселина отдавна се използват в медицината като антисептици.
Физиологичната и биологична активност на бора е много висока. Борът може да повлияе критични процесибиохимия на животните и растенията. Заедно с Mn, Cu, Zn и Mo, борът е един от петте основни микроелемента. Борът е концентриран в костите и зъбите, в мускулите, в костния мозък, черния дроб и щитовидната жлеза. Вероятно ускорява растежа и развитието на организмите. Това може да се види от ефекта на бора върху растенията. При борно гладуване добивът и особено броят на семената са значително намалени. За живота на животните е важно да се намери в млякото (краве) и в жълтъка пилешки яйца. Някои растения (фуражни треви и захарно цвекло) събират няколко грама бор на хектар земя. Борът се намира в значителни количества в мастните тъкани на някои животни, пасящи на пасища, обогатени с бор. Съставът на борните съединения в тялото не е известен. Установено е, че борът инхибира чревната амилаза и чревните протеинази, засилва действието на инсулина и инхибира окисляването на адреналина, отслабва витамините В2 и В12. При излишък на бор се появява борен ентерит. Излишното съдържание на бор води до болести по растенията. Пшеницата и овесът страдат при наличие на 0,7 - 0,8 mgV/kg почва. Борбата срещу засоляването на почвата с бор се извършва чрез измиване на борни почви.
А дидактическите основи на организацията на обучението позволяват по-лесното обяснение на материала, който се изучава в уроците по физика при изучаване на темата "Основи на електродинамиката". Анализ различни технологиинаправи възможно изготвянето на авторска технология за развиване на фокуса на учениците към диалогичната комуникация в групова форма на обучение. От това колко правилно ще бъде изграден процесът на обучение при използване на ...
С това става необходимо да се разгледа въпросът за връзката между молекулярната физика и химията в курса на средното училище. При изучаването на молекулярната физика връзката й с химията се проявява в две основни посоки. Първата от тях е да се използват знанията на студентите, получени в процеса на изучаване на химия, като материал за доказване на основните положения на молекулярната физика. Второ...
Цели на урока:
Опишете алуминия по позицията му в периодичната таблица на химичните елементи.
Въз основа на структурата на атома, разгледайте неговите физични и химични свойства.
Да се запознаят с индустриалния метод за производство на алуминий и да посочат областите на неговото приложение.

От историята на откриването на алуминия ... "Сребро от глина"
По време на откриването на алуминия този метал е бил по-скъп от златото. Британците искаха да почетат великия руски химик с богат подарък
Д. И. Менделеев, му представи химическа везна, в която едната чаша е направена от злато, а другата - от алуминий. Чаша от алуминий стана по-скъпа от златото. Полученото "сребро от глина" интересува не само учени, но и индустриалци и дори императора на Франция.


Приложение на алуминий






военна индустрия

Строителство

Намиране на алуминий в природата
Естествени алуминиеви съединения
Задача II. Разгледайте проби от естествени съединения, сравнете ги по отношение на твърдост, здравина, цвят, изчислете съдържанието на Al в някои от тях.
Нефелини-KNa34
- Алуминий (смеси от каолини с пясък SiO2, варовик CaCO3, магнезит MgCO3)
- Корунд (сапфир, рубин, шмиргел) - Al2O3
- Фелдшпати - (K,Na)2O Al2O3 6SiO2, Ca
- Каолинит - Al2O3 2SiO2 2H2O
- Берил (изумруд, аквамарин) - 3BeO Al2O3 6SiO2

Физични свойства на алуминия. Лабораторна работа.
карта с инструкции.
2. Определете агрегатното състояние на алуминия.
3. Какъв цвят е чинията?
4. Определете дали тази плоча има гланц?
5. Потопете плочата ¼ от дължината й в чаша гореща вода за 10-15 секунди.
Извадете чинията от водата, избършете я със салфетка и определете дали алуминият има топлопроводимост?
6. Вземете алуминиево фолио. Определете дали алуминият е пластичен? Лек метал ли е?
7. Поставете алуминиева чиния в чаша със студена вода, завъртете няколко пъти. Наблюдава ли се разтваряне на алуминия?
8. Запишете накратко вашите наблюдения според плана:
- агрегатно състояние,
- цвят,
- блясък,
- топлопроводимост,
- пластичност,
- разтворимост във вода.


Лабораторна работа: "Химически свойства на алуминия".
карта с инструкции.
1. Вземете две епруветки. Поставете парче алуминий във всяка. В едната се налива 1-2 ml разтвор на солна киселина, а в другата - същото количество разтвор на сярна киселина. Какво гледате? Загрейте леко епруветките. Запишете уравненията на съответните реакции.
2. Поставете парче алуминий в епруветка. Добавете 1,5 ml концентрирана сярна киселина. Какво гледате? Запишете уравнението на реакцията.
3. Поставете парче алуминий в епруветката и добавете алкалния разтвор. Загрейте съдържанието на епруветката. Какво се случва? Запишете уравнението на реакцията.
4. Поставете резултатите от извършената работа в таблица:


Получаване на алуминий в промишлеността

Тест
1. Каква е електронната конфигурация на алуминиевия атом?
A) 1s22s22p1 B) 1s22s22p3
B) 1s22s22p63s23p1 D) 1s22s22p63s23p63d14s2
2. С кои от следните вещества реагира алуминият?
A) CaO B) HCl
B) Cl2 D) NaOH
3. Кои от посочените метали са по-активни,
отколкото алуминий?
A) Na B) Cu
B) Ca D) Fe
4. Най-характерното състояние на окисление на алуминия:
А) +1 Б) +2
В) +3 Г) +4
5. Алуминият при химични реакции проявява следните свойства:
А) окислител Б) инертно съединение
В) редуциращ агент Г) окислител и редуктор
6. В промишлеността алуминият се получава:
А) използване на метален натрий като редуциращ агент
Б) електролиза на разтопен алуминиев оксид
В) използване на въглероден оксид (Р) като редуциращ агент
Г) електролиза на разтвор на алуминиеви соли



