Структура и свойства на атомите. Алуминий Al - елемент от основната подгрупа на група III (група IIIA) от 3-ти период Периодична системаД. И. Менделеев.
Алуминиевият атом съдържа три електрона на външно енергийно ниво, които лесно се отказва по време на химични взаимодействия. Предшественикът на подгрупата и горният съсед на алуминия, борът, има по-малък атомен радиус (за бор е 0,080 nm, за алуминия е 0,143 nm). В допълнение, алуминиевият атом има един междинен слой от осем електрони (2e; 8e; 3e), който предотвратява привличането на външни електрони към ядрото. Следователно редукционните свойства на алуминиевите атоми са много по-изразени от тези на борните атоми, които проявяват неметални свойства.
В почти всички свои съединения алуминият има степен на окисление +3.
Алуминият е просто вещество. Сребристо бял лек метал. Топи се при 660 °C. Той е много пластичен, лесно се изтегля в тел и се навива във фолио с дебелина до 0,01 мм. Има много висока електрическа и топлопроводимост. Образува леки и здрави сплави с други метали.
Алуминият е много активен метал. В поредицата от напрежения той се намира непосредствено след алкалните и алкалоземните метали. Въпреки това, при стайна температура във въздуха, алуминият не се променя, тъй като повърхността му е покрита с много силен тънък оксиден филм, който предпазва метала от излагане на въздух и водни компоненти.
Ако алуминиев прах или тънко алуминиево фолио се нагреят силно, те се запалват и изгарят с ослепителен пламък:
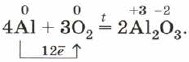
Наблюдавате тази реакция, когато горят искри и фойерверки.
Алуминият, както всички метали, лесно реагира с неметали, особено в прахообразна форма. За да започне реакцията, е необходимо първоначално нагряване (с изключение на реакциите с халогени - хлор и бром), но тогава всички реакции на алуминия с неметали протичат много бързо и са придружени от освобождаване Голям бройтоплина:

Алуминият се разтваря добре в разредена сярна и солна киселини:

Но концентрираните сярна и азотна киселини пасивират алуминия, образувайки плътен, издръжлив оксиден филм върху металната повърхност, който предотвратява по-нататъшната реакция. Следователно тези киселини се транспортират в алуминиеви резервоари.
Както вече знаете, алуминиевият оксид и хидроксидът имат амфотерни свойства. Алуминият се разтваря в водни разтвориалкали, образуващи соли - алуминати, които се наричат комплекс 1:
- 1 Когато хидроксидът и алуминиевият оксид взаимодействат с алкални разтвори, комплексни соли, например Na.
Алуминият намира широко приложение в металургията за получаване на метали - хром, манган, ванадий, титан, цирконий от техните оксиди. Както си спомняте, този метод се нарича алуминотермия. На практика често се използва термит - смес от Fe3O 4 с алуминиев прах. Ако тази смес се запали, например с помощта на магнезиева лента, тогава настъпва енергична реакция с отделяне на голямо количество топлина:
Освободената топлина е напълно достатъчна за пълното топене на полученото желязо, така че този процес се използва за заваряване на стоманени продукти.
Алуминият е много силно свързан в естествени съединения с кислород и други елементи и може да бъде изолиран от тези съединения. химични методимного трудно. Алуминият може да се получи чрез електролиза - разлагане на стопилка на неговия оксид Al 2 O 3 в съставните му части с помощта на електрически ток. Но точката на топене на алуминиевия оксид е около 2050 ° C, така че е необходима много енергия за извършване на електролиза.
Алуминият става технически достъпен метал, след като американските и френски учени C. Hall и P. Héroux установяват през 1886 г., че алуминиевият оксид се разтваря добре в криолит, разтопен при 1000 ° C, чиято формула е Na 3 AlF 6 , с образуването на електропроводима стопилка. Стопяването на алуминиевия оксид в криолита се подлага на електролиза в специални инсталации (фиг. 63) в алуминиеви заводи.

Ориз. 63
Схема на електролизна инсталация за производство на алуминий:
1 - електролит - разтопен криолит с добавки на калциев и алуминиеви флуориди (за намаляване на точката на топене) и алуминиев оксид (добавен периодично); 2 - въглероден катод; 3 - въглероден анод; 4 - кора от втвърден алуминиев оксид, предпазващ стопения алуминий от окисление; 5 - стоманена вана; 6 - разклонителна тръба за вземане на проби от разтопен алуминий
Световното производство на алуминий непрекъснато нараства. Понастоящем той изтласка медта и другите цветни метали на трето и следващо място и се превърна във втория най-важен метал от продължаващата желязна епоха.
Алуминият е почти три пъти по-лек от стоманата и е устойчив на корозия, така че е по-изгоден от стоманата в приложения, където се изискват тези свойства (фиг. 64).

Ориз. 64
Основните области на приложение на алуминия и неговите сплави
Алуминиеви съединения. В природата алуминият се среща само под формата на съединения и по разпространение в земната кора се нарежда на първо място сред металите и на трето място сред всички елементи (след кислорода и силиция). Общото съдържание на алуминий в земната кора е около 9% (по маса).
Посочваме най-важното естествени съединенияалуминий.
Алумосиликати. Тези съединения могат да се разглеждат като соли, образувани от оксиди на алуминий, силиций, алкални и алкалоземни метали. Те съставляват основната маса земната кора. По-специално, алумосиликатите са част от фелдшпатовете, най-разпространените минерали и глини.
Боксит (фиг. 65, а) - скалата, от която се получава алуминий, съдържа алуминиев оксид Al 2 O 3.

Ориз. 65
Естествени алуминиеви съединения:
а - боксит; б - корунд; в - рубин; g - сапфир
Корунд (фиг. 65, б) - минерал от състав Al 2 O 3, има много висока твърдост, неговата финозърнеста разновидност, съдържаща примеси - шмиргел - се използва като абразивен (шлифовъчен) материал.
Същата формула има и друго естествено съединение - алуминиев оксид.
Известни са прозрачни, оцветени в примеси кристали корунд: червено - рубини (фиг. 65, в) и синьо - сапфири (фиг. 65, г), които се използват като скъпоценни камъни. В момента те се получават изкуствено и се използват не само в бижута, но и за технически цели, например за производството на части за часовници и други прецизни инструменти. Рубинените кристали се използват в лазерите.
Алуминиевият оксид Al 2 O 3 е бяло вещество с много висока точка на топене. Може да се получи чрез разлагане чрез нагряване на съответния алуминиев хидроксид:
Алуминиевият хидроксид Al (OH) 3 се утаява под формата на бяла желатинова утайка, когато алкали действат върху разтвори на алуминиеви соли (фиг. 66), например:
AlCl 3 (напр.) + 3NaOH \u003d Al (OH) 3 ↓ + 3NaCl.
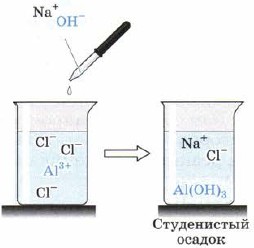
Ориз. 66
Получаване на алуминиев хидроксид чрез обменна реакция от разтворима алуминиева сол
Като амфотерен хидроксид, той лесно се разтваря в основи и киселини (фиг. 67):
Al (OH) 3 + NaOH (напр.) \u003d Na,
Al (OH) 3 + 3HN03 \u003d Al (NO 3) 3 + 3H2O.

Ориз. 67
Химични свойства на алуминиевия хидроксид:
а - взаимодействие с алкали; b - взаимодействие с киселина
Лабораторен експеримент No16
Получаване на алуминиев хидроксид и изследване на неговите свойства
Солите на нестабилните алуминиеви киселини - орто-алуминиев H 3 AlO 3 и мета-алуминий HAlO 2 (може да се разглежда като орто-алуминиева киселина, от молекулата на която е отнета водна молекула) - се наричат алуминати. Естествените алуминати включват благороден шпинел (той украсява историческата реликва - короната руски императори) и скъпоценен хризоберил.
Алуминиевите соли, с изключение на фосфатите, са силно разтворими във вода. Някои соли (сулфиди, сулфити) се разлагат от вода.
Алуминиевият хлорид AlCl 3 се използва като катализатор при производството на много органични вещества.
Откриване на алуминия. Алуминият е получен за първи път от датския физик Х. Ерстед през 1825 г. Името на този елемент идва от латинското алумен, както се е наричало стипца в древни времена, което е било използвано за боядисване на тъкани.
Нови думи и понятия
- Структурата на алуминиевия атом.
- Физически и Химични свойстваалуминий: образуване на бромид, сулфид, карбид, оксид и алуминати.
- Алуминотермия.
- Получаване на алуминий чрез електролиза.
- Области на приложение на алуминия.
- Естествени алуминиеви съединения: алумосиликати (глина и фелдшпати), корунд (рубин, сапфир, шмиргел).
- Амфотерност на алуминиев оксид и хидроксид.
Изпращаме го във въздуха и го изстрелваме в космоса, слагаме го на печка, строим от него сгради, правим гуми, намазваме го по кожата и лекуваме с него язви... Още ли не разбираш? Става дума за алуминий.
Опитайте се да изброите всички приложения на алуминия и не забравяйте да се объркате. Вероятно дори не знаете, че много от тях съществуват. Всеки знае, че алуминият е материалът на производителите на самолети. Но какво да кажем за автомобилната индустрия или, да речем. лекарство? Знаете ли, че алуминият е хранителна добавка E-137, който обикновено се използва като багрило, което придава на продуктите сребрист оттенък?
Алуминият е елемент, който лесно образува стабилни съединения с всякакви метали, кислород, водород, хлор и много други вещества. В резултат на такива химични и физични влияния се получават сплави и съединения, диаметрално различни по своите свойства.
Използването на алуминиеви оксиди и хидроксиди
Областите на приложение на алуминия са толкова обширни, че за да се предпазят производителите, конструкторите и инженерите от неволни грешки, у нас използването на маркировка на алуминиеви сплави стана задължително. На всяка сплав или съединение е присвоено собствено буквено-цифрово обозначение, което след това ви позволява бързо да ги сортирате и да ги изпратите за по-нататъшна обработка.
Най-често срещаните естествени алуминиеви съединения са неговият оксид и хидроксид. в природата те съществуват изключително под формата на минерали - корунд, боксит, нефелин и др. - и като алуминиев оксид. Използването на алуминия и неговите съединения е свързано с бижутерията, козметологията, медицинските области, химическата промишленост и строителството.
Цветните, „чисти” (не мътни) корунди са познатите на всички ни бижута – рубини и сапфири. Въпреки това, в основата си те не са нищо повече от най-разпространения алуминиев оксид. В допълнение към сектора на бижутата, използването на алуминиев оксид се простира и в химическата промишленост, където обикновено действа като адсорбент, както и в производството на керамични съдове. Керамичните тенджери, тенджери, чаши имат забележителни топлоустойчиви свойства именно поради съдържащия се в тях алуминий. Алуминиевият оксид също е намерил своето приложение като материал за производството на катализатори. Често към бетона се добавят алуминиеви оксиди за по-доброто му втвърдяване, а стъклото, към което се добавя алуминий, става топлоустойчиво.
Списъкът с приложения за алуминиев хидроксид е още по-впечатляващ. Поради способността си да абсорбира киселина и да има каталитичен ефект върху човешкия имунитет, алуминиевият хидроксид се използва при производството на лекарства и ваксини срещу хепатит тип "А" и "В" и инфекция с тетанус. Те се лекуват и при бъбречна недостатъчност поради наличието на Голям бройфосфат в тялото. Веднъж попаднал в тялото, алуминиевият хидроксид реагира с фосфатите и образува неразривни връзки с тях, а след това естественоекскретиран от тялото.
Хидроксидът, поради отличната си разтворимост и нетоксичност, често се добавя към пасти за зъби, шампоани, сапуни, слънцезащитни кремове, подхранващи и овлажняващи кремове за лице и тяло, антиперспиранти, тоници, почистващи лосиони, пяни и др. При необходимост за равномерно и стабилно боядисване тъканта, след това към боята се добавя малко алуминиев хидроксид и цветът буквално се "изяжда" в повърхността на материята.
Приложение на алуминиеви хлориди и сулфати
Хлоридите и сулфатите също са изключително важни алуминиеви съединения. Алуминиевият хлорид не се среща естествено, но е доста лесно да се получи индустриално от боксит и каолин. Използването на алуминиев хлорид като катализатор е доста едностранчиво, но практически безценно за нефтопреработващата индустрия.

Алуминиевите сулфати съществуват естествено като минерали във вулканичните скали и са известни със способността си да абсорбират вода от въздуха. Използването на алуминиев сулфат обхваща козметичната и текстилната промишленост. В първия той действа като добавка в антиперсперандите, във втория - под формата на багрило. Интересно използване на алуминиев сулфат в състава на репелентите за насекоми. Сулфатите не само отблъскват комари, мухи и мухи, но и анестезират мястото на ухапване. Въпреки това, въпреки осезаеми ползи, алуминиевите сулфати имат двусмислен ефект върху човешкото здраве. Ако вдишвате или поглъщате алуминиев сулфат, можете да получите сериозно отравяне.

Алуминиеви сплави - основни приложения
Изкуствено получените съединения на алуминия с метали (сплави), за разлика от естествените образувания, могат да имат такива свойства, каквито самият производител желае - достатъчно е да промените състава и количеството на легиращите елементи. Днес има почти неограничени възможности за получаване на алуминиеви сплави и тяхното приложение.
Най-известната индустрия на употреба алуминиеви сплави- самолетна индустрия. Самолетите са почти изцяло изработени от алуминиеви сплави. Сплавите от цинк, магнезий и алуминий дават безпрецедентна здравина, използвани в обшивките на самолетите и конструктивните части.
Алуминиеви сплави се използват по подобен начин в конструкцията на кораби, подводници и малък речен транспорт. Тук е най-изгодно да се правят надстройки от алуминий, те намаляват теглото на кораба с повече от половината, без да се компрометира тяхната надеждност.
Подобно на самолетите и корабите, автомобилите стават все по-„алуминиеви“ всяка година. Алуминият се използва не само в части на каросерията, но сега е и рамки, греди, стълбове и панели на кабината. Поради химическата инертност на алуминиевите сплави, ниската податливост на корозия и топлоизолационните свойства, алуминиевите сплави се използват за направата на резервоари за транспорт на течни продукти.

Използването на алуминия в промишлеността е широко известно. Производството на нефт и газ не би било там, където е днес, ако не бяха изключително устойчивите на корозия, химически инертни тръбопроводи от алуминиева сплав. Алуминиеви бормашини тежат няколко пъти по-малко, което означава, че са лесни за транспортиране и монтаж. И това да не говорим за всички видове резервоари, бойлери и други контейнери ...
Тенджери, тигани, тави за печене, черпаци и други домакински съдове са изработени от алуминий и неговите сплави. Алуминиевите съдове за готвене провеждат топлината много добре, загряват се много бързо и лесно се почистват, не вреди на здравето и храната. На алуминиево фолионие печем месо във фурната и печем пайове, олио и маргарини, сирена, шоколади и сладки са опаковани в алуминий.

Изключително важна и обещаваща област е използването на алуминия в медицината. В допълнение към споменатите по-рано употреби (ваксини, лекарства за бъбреци, адсорбенти), трябва да се спомене и употребата на алуминий в лекарства за язви и киселини.
От всичко казано по-горе може да се направи едно заключение - алуминиевите класове и тяхното приложение са твърде разнообразни, за да им посветим една малка статия. По-добре е да пишете книги за алуминия, защото не напразно го наричат "металът на бъдещето".


