Предмет: Химични свойстваелементи.
План:
1. Свойства на металите и техните съединения ( I и II гл. подгр.)
1.1 IA елементи
1.2 Елементи на IIA групи - обща характеристика.
2. Химични свойства на р-елементите.
2.1 IIIA елементи групи - обща характеристика.
2.2 Елементи на IVA групи - обща характеристика.
2.3 VA елементи групи - обща характеристика.
2.4 VIA елементи групи - обща характеристика.
2.5 Елементи на VIIA групи - обща характеристика.
2.6 Елементи на VIIA групи - обща характеристика.
3. Водород
Алкални метали - елементи от основната подгрупа на група I на Периодичната система химични елементиД. И. Менделеев: литий Li, натрий Na, калий К, рубидий Rb, цезий Cs и франций Fr. Тези метали се наричат алкални, тъй като повечето от техните съединения са разтворими във вода. На славянски език „излугване“ означава „разтварям“ и това определи името на тази група метали. Когато алкалните метали се разтварят във вода, се образуват разтворими хидроксиди, наречени алкали. Г. Дейви през 1807 г. за първи път получава свободен калий и натрий.
Във външния електронен слой атомите на алкалния метал имат по един електрон. Във втория електронен слой отвън литиевият атом съдържа два електрона, а атомите на другите алкални метали имат по осем електрона. Имайки във външния електронен слой само един електрон, разположен на относително голямо разстояние от ядрото, атомите на тези елементи доста лесно даряват този електрон, т.е. те се характеризират с ниска йонизационна енергия. Образуваните в този случай еднократно заредени положителни йони имат стабилна електронна структура на съответния благороден газ (литиевият йон е структурата на хелиевия атом, натриевият йон е структурата на неоновия атом и т.н.). Лекотата на отката на външните електрони характеризира разглежданите елементи като най-много типични представителиметали: металните свойства се изразяват особено рязко в алкалните метали.
Същата структура не само на външния, но и на предпоследния електронен слой на атомите на всички алкални метали, с изключение на лития, определя голямото сходство на свойствата на тези елементи. В същото време се увеличава ядреният заряд и общ бройелектроните в атома, когато се движат отгоре надолу в подгрупа, създава някои различия в техните свойства. Както в други групи, тези различия се проявяват главно в увеличаване на лекотата на даряване на валентни електрони и увеличаване на металните свойства с увеличаване на атомния номер.
|
Свойства на алкалните метали |
||||||||
|
атомна |
име, |
метални |
йонна |
Потенциал |
EO |
п, |
t pl , |
т бала, |
|
литий Li |
0,152 |
0,078 |
5,32 |
0,98 |
0,53 |
1347 |
||
|
Натрий Na |
0,190 |
0,098 |
5,14 |
0,93 |
0,97 |
|||
|
Калий К |
0,227 |
0,133 |
4,34 |
0,82 |
0,86 |
|||
|
Рубидий Rb |
0,248 |
0,149 |
4,18 |
0,82 |
1,53 |
|||
|
Цезий Cs |
0,265 |
0,165 |
3,89 |
0,79 |
1,87 |
|||
Химични свойства на алкалните метали. Поради високата химическа активност на алкалните метали по отношение на водата, кислорода, азота, те се съхраняват под слой керосин. За да се извърши реакцията с алкален метал, парче с необходимия размер внимателно се отрязва със скалпел под слой керосин, металната повърхност се почиства старателно от продуктите на взаимодействието му с въздух в атмосфера на аргон и само след това пробата се поставя в реакционния съд.
1. Взаимодействие с вода. Важно свойство на алкалните метали- високата им активност по отношение на водата. Литият реагира най-спокойно (без експлозия) с вода:
При извършване на подобна реакция натрият изгаря с жълт пламък и се получава малка експлозия. Калият е още по-активен: в този случай експлозията е много по-силна и пламъкът е оцветен в лилаво. 2. Взаимодействие с кислорода. Продуктите от горенето на алкалните метали във въздуха имат различен съставв зависимост от активността на метала.
Само литият гори във въздуха с образуването на оксид със стехиометричен състав:
По време на изгарянето на натрий пероксидът Na2O2 се образува главно с малка примес на супероксид NaO2:
Продуктите от горенето на калий, рубидий и цезий съдържат главно супероксиди: ![]()
За да се получат оксиди на натрий и калий, смеси от хидроксид, пероксид или супероксид се нагряват с излишък от метал при липса на кислород: 
За кислородните съединения на алкалните метали е характерна следната закономерност: с увеличаване на радиуса на катиона на алкалния метал се увеличава стабилността на кислородните съединения, съдържащи пероксиден йон O22- и супероксиден йон O2-.
Тежките алкални метали се характеризират с образуването на доста стабилни озониди от състава на EO3. Всички кислородни съединения имат различни цветове, чийто интензитет се задълбочава в серията от Li до Cs:
|
Формула |
Цвят |
|
Li2O |
Бяла |
|
Na2O |
Бяла |
|
K2O |
Жълтеникаво |
|
Rb2O |
жълт |
|
Cs2O |
оранжево |
|
Na2O2 |
Светлина |
|
КО 2 |
оранжево |
|
RbO2 |
тъмно- |
|
CsO2 |
жълт |
Оксидите на алкалните метали имат всички свойства на основните оксиди: реагират с вода, киселинни оксиди и киселини:
Пероксидите и супероксидите проявяват свойствата на силни окислители:
Пероксидите и супероксидите интензивно взаимодействат с вода, образувайки хидроксиди:
3. Взаимодействие с други вещества. Алкалните метали реагират с много неметали. При нагряване те се свързват с водород, за да се образуват хидриди, с халогени, сяра, азот, фосфор, въглерод и силиций, за да образуват съответно халиди, сулфиди, нитриди, фосфиди, карбиди и силициди:
хидриди, с халогени, сяра, азот, фосфор, въглерод и силиций, за да образуват съответно халиди, сулфиди, нитриди, фосфиди, карбиди и силициди:
При нагряване алкалните метали могат да реагират с други метали, образувайки интерметални съединения. Алкалните метали реагират активно (с експлозия) с киселини.
Алкалните метали се разтварят в течен амоняк и неговите производни - амини и амиди:
Когато се разтваря в течен амоняк, алкален метал губи електрон, който се солватира от амонячни молекули и придава на разтвора син цвят. Получените амиди лесно се разлагат от вода с образуването на алкали и амоняк:
Алкалните метали взаимодействат с органична материяалкохоли (с образуване на алкохолати) и карбоксилни киселини (с образуване на соли):
4. Качествено определяне на алкални метали. Тъй като йонизационните потенциали на алкалните метали са малки, когато метал или неговите съединения се нагряват в пламък, атомът се йонизира, оцветявайки пламъка в определен цвят:
|
Оцветяване на пламъка с алкални метали |
|
|
карминово червено |
|
|
жълт |
|
|
Виолетова |
|
|
белезникаво розово |
|
|
лилаво червено |
|
Получаване на алкални метали
1. За получаване на алкални метали те използват главно електролизата на стопилки на техните халиди, най-често хлориди, които образуват естествени минерали:
катод: Li+ + e → Лианод: 2Cl- - 2e → Cl22. Понякога, за да се получат алкални метали,
електролиза на стопилки на техните хидроксиди:
катод: Na + + e → Na анод: 4OH- - 4e → 2H2O + O2 Тъй като алкалните метали са вляво от водорода в електрохимичната серия от напрежения, тогава електролитен препаратги от солеви разтвори е невъзможно; в този случай се образуват съответните алкали и водород.
В природата алкални металисе намират изключително под формата на съединения. Натрият и калият са постоянни съставки на много много често срещани силикати. От отделните натриеви минерали най-важният — обикновената сол (NaCl) — е част от морската вода и в определени области на земната повърхност образува огромни находища на така наречената каменна сол под слой от алувиални скали (в СССР , Соликамск, Артемовен, Илецк и др.). Горните слоеве на такива отлагания понякога съдържат натрупвания на калиеви соли [под формата на минерали силвинит (KCl–NaCl), карналит (KCl MgCl2 6H2O) и др.], които служат като основен източник за получаване на съединения на този елемент. Известни са само няколко естествени натрупвания на калиеви соли от промишлено значение. Най-важното от тях е находището Соликамск в СССР.
За лития са известни редица минерали [например сподумен - LiAl (SiO3) 2], но натрупванията им са редки. Рубидият и цезият се срещат почти изключително като примеси с други алкални метали. Следи от франций винаги се намират в урановите руди.
Съединенията на натрия и калия са от голямо значение за живота. Достатъчно е да си припомним поне, че човек консумира годишно 5-10 кг NaCl. По същия начин калиевите соли са необходими за растенията. В тази връзка около 90% от всички добивани поташни съединения се използват за торене на почвата. Останалите 10%, както и огромни суми различни съединениянатрий се използва в промишлеността. Литиевите производни досега са намерили само сравнително малка употреба, а Rb и Cs съединенията са намерили много ограничена употреба.
В свободно състояние алкални металимогат да бъдат изолирани чрез електролиза на техните стопени хлоридни соли. Основната практическа стойност е натрият, чието годишно световно производство е повече от 50 хиляди тона.
Основната подгрупа на група II включва елементи b epu liy, магнезий, калций, стронций, барийи радий. Всички тези елементи, с изключение на берилия, имат изразени метални свойства. В свободно състояниеи са сребърни кристално бели вещества, по-твърди от алкалните метали, с доста високи точки на топене. По плътност всички те, с изключение на радия, принадлежат към леките метали.
Първите двама членове на разглежданата подгрупа заемат малко по-специална позиция в нея, различаваща се в много отношения от останалите четири елемента. Берилиум според някои свои stvam се доближава до алуминия.
Всички изотопи на последния елемент от подгрупата - радий - са радиоактивни. Дългоживещ изотоп 226 Ра използван преди в лъчетерапията; сега е заменен от по-евтини изотопи на други елементи, произведени в ядрени реактори.
Във външния електронен слой атомите на елементите от тази подгрупа имат два електрона, във втория външен слой берилият има два електрона, а останалите елементи имат осем.
Простите вещества, образувани от атомите на тези елементи, са метали. Литий, натрий, калий, рубидий, цезий и франций се наричат алкални метали, тъй като техните хидроксиди са алкални. Калцият, стронций и барий се наричат алкалоземни метали. Химическата активност на тези вещества се увеличава с увеличаване на атомния радиус. От химичните свойства на тези метали, техните редуциращи свойства са най-важни. Алкалните метали са най-силните редуциращи агенти. Металите от група IIA също са доста силни редуциращи агенти. Всички те (с изключение на берилий) реагират с вода (магнезий при варене):
2M + 2H 2 O \u003d 2M aq + 2OH aq + H 2, M + 2H 2 O \u003d M 2 + 2OH + H 2.
В случай на магнезий, калций и стронций, поради ниската разтворимост на получените хидроксиди, реакцията е придружена от образуване на утайка:
M 2 + 2OH \u003d Mg (OH) 2
Алкалните метали реагират с повечето неметали: 2M + H 2 = 2MH (при нагряване), 4M + O 2 \u003d 2M 2 O (M - Li), 2M + Cl 2 = 2MCl (при нормални условия), 2M + S = M 2 S (при нагряване).
От алкалните метали, изгарящи в кислород, обичайният оксид образува само литий. Останалите алкални метали образуват пероксиди (M 2O2 ) или супероксиди (MO 2
- съединения, съдържащи супероксиден йон с формален заряд -1 e). Подобно на алкалните метали, металите от група IIA елементи реагират с много неметали, но при по-строги условия: M + H 2 = MH 2 (при нагряване; с изключение на берилий),
2M+O 2
\u003d 2MO (при нормални условия; Be и Mg - при нагряване), M + Cl 2 = MCl 2 (при нормални условия), M + S = MS (при нагряване). За разлика от алкалните метали, те образуват обикновени оксиди с кислород. Само магнезият и берилият реагират спокойно с киселини, останалите прости веществамного бурно, често с експлозия Берилият реагира с концентрирани алкални разтвори: Be + 2OH+ 2H 2 O \u003d 2 + H 2
В съответствие с позицията в поредицата от напрежения, само берилият и магнезият реагират със солеви разтвори, останалите метали в този случай реагират с вода. Като силни редуциращи агенти, алкалните и алкалоземните метали редуцират много по-малко активни метали от своите съединения, например при нагряване се появяват реакции: 4Na + MnO 2 \u003d 2Na 2 O + Mn; 2Ca + SnO 2 \u003d 2CaO + Sn. Индустриалният производствен метод, общ за всички алкални метали и метали от група IIA, е електролизата на разтопени соли.
В допълнение към берилия, оксидите на всички разглеждани елементи са основни оксиди, а хидроксидите са силни основи (в берилия тези съединения са амфотерни, магнезиевият хидроксид е слаба основа). Засилването на основните свойства на хидроксидите с увеличаване на атомния номер на елемента в групата лесно се проследява в поредицата от хидроксиди на елементите от група IIA. Бъди (OH) 2
– амфотерен хидроксид, Mg(OH) 2
– слаба основа, Ca(OH) 2, Sr(OH) 2 и Ba(OH) 2 силни основи, но с увеличаване на серийния номер тяхната разтворимост се увеличава и Ba (OH) 2
вече може да се припише на алкали.
Всички алкалоземни метали се намират (в различни количества) в природата. Поради високата си химическа активност, всички те не се намират в свободно състояние. Най-разпространеният алкалоземен метал е калцият, чието количество е 3,38% (от масата на земната кора). Магнезият е малко по-нисък от него, чието количество е 2,35% (от масата на земната кора). Барий и стронций също са често срещани в природата, които съответно са 0,05 и 0,034% от масата на земната кора. Берилият е рядък елемент, чието количество е 6×10−4% от масата на земната кора. Що се отнася до радия, който е радиоактивен, той е най-редкият от всички алкалоземни метали, но винаги се намира в малки количества в урановите руди. По-специално, той може да бъде отделен от там с химически средства. Съдържанието му е 1 × 10−10% (от масата на земната кора) /
Р-елементите от група III на периодичната система на Д. И. Менделеев включват: бор В, алуминий Al, галий Ga, индий In и талий Tl. Електронна конфигурацияатоми ns2 np1 .
Някои константи, характеризиращи свойствата на атомите на p-елементите от разглежданата група и съответните метални вещества, се сравняват по-долу:
Свойствата на p-елементите от III група се влияят от d-компресията (Al се намира в периодичната система в малък III период, а Ga, In и Tl в големи периодинепосредствено след d-елементите). И така, от Al до Ga, атомният радиус малко намалява и първият йонизационен потенциал се увеличава. Свойствата на атомите на талия също се влияят от f-компресията. Ето защо радиусът на атома Tl е близък до радиуса на атома In, а йонизационната енергия е малко по-висока.
Бор. В съответствие с електронната структура на атома (1s2 2s2 2p1), борът може да бъде едновалентен (един несдвоен електрон в 2p енергийно подниво). Въпреки това, борът е най-характерен за съединения, в които е тривалентен (когато един атом е възбуден, има три несдвоени електрона в енергийните 2s и 2p поднива).
Свободната 2p орбитала във възбудения борен атом определя акцепторните свойства на много от неговите съединения, в които чрез обменния ковалентен механизъм се образуват три ковалентни връзки (например BBr3). Тези съединения са склонни към добавяне на частици с електрон-донорни свойства, т.е. към образуване на друга ковалентна връзка по механизма донор-акцептор. Например:
BBr3 + Br- = [ВВr4]-
Известни са два изотопа на бора: 105 B (19,6%) и 11 5 B (80,4%). Ядрата на атомите на изотопа (105 V) лесно абсорбират неутрони:
105 V + 1 0 n = 4 2 He + 7 5 Li
Способността на бора да абсорбира неутрони определя използването му в ядрената енергетика: управляващите пръти на ядрените реактори са направени от бор-съдържащи материали.
Черен бор кристали; те са огнеупорни (т.т. 2300 ° C), диамагнитни, имат полупроводникови свойства (гранина ΔE = 1,55 eV). Електрическата проводимост на бора, подобно на тази на други метали, е ниска и малко се увеличава с повишаване на температурата.
При стайна температура борът е химически инертен и взаимодейства директно само с флуор; при нагряване борът се окислява от хлор, кислород и някои други неметали. Например:
4V + 3O2 = 2V2 O3
2B + ZCl2 = 2BCl3
В съединения с неметали степента на окисление на бора е +3; всички тези съединения са ковалентни.
Борният триоксид B2O3 е кристално вещество (т.т. 450 °C, bp 2250 °C), характеризиращо се с високи стойностиенталпия и енергията на Гибс на образуване. При взаимодействие с вода, B2O3 преминава в борна киселина:
B2 O3 + ZH2 O = 2H3 BO3
H3 BO3 е много слаба (Kd ≈ 10-9) едноосновна киселина. Електролитната дисоциация на H3 BO3 с елиминирането само на един H+ йон се обяснява с описаните по-горе акцепторни свойства на бора: свободната 2p орбитала на борния атом се предоставя на донора на електрони OH-, който се образува по време на дисоциацията на H2 О молекули Процесът протича по схемата
H3 BO3 + H2 O \u003d H [B (OH) 4] = H + + [B (OH) 4] -
Комплексният анион [B(OH)4]- има тетраедрична структура (sp3 хибридизация на електронни орбитали). Акцепторните свойства на бора в съединения със степен на окисление + 3 се проявяват и в химията на неговите халогениди. Например реакциите
BF3+F-=-
BF3 + NH3 =
при който химичната връзка между BF и F- или NH3 се образува чрез донорно-акцепторен механизъм. Свойството на борните халогениди да бъдат акцептори на електрони определя широкото им приложение като катализатори в реакциите на синтеза на органични съединения.
Борът не взаимодейства директно с водорода, но образува бориди с метали - обикновено нестехиометрични съединения Me4 B, Me2 B, MeB, Me3 B4, MeB2 и MeB6.
Борните хидриди (борани) са много отровни и имат много неприятна миризма. Получават се косвено, най-често
при взаимодействие на реактивни бориди с киселини или борни халогениди с хидриди на алкални метали:
6MgB2 + 12HCl = H2 + 8B + B4 H10 + 6MgCl2
8BF3 + 6LiH = B2 H6 + 6LiBF4
Най-простата комбинация от бор с водород BH3 не съществува при нормални условия, sp2 -Хибридизация на електронни орбитали в борния атом води до ненасищане на координацията на частицата BH3, в резултат на което две такива частици се комбинират в молекула диборан: 2BH3 = B2 H6 (ΔG0 298 = -127 kJ / mol).
В диборан B2H6 борът е в състояние на 5p3 хибридизация, като всеки борен атом има една от четирите хибридни орбитали празни, докато другите три са припокрити от s-орбитали на водородни атоми. Връзките между BH3 групите в молекулата B2H6 се образуват като водородна връзка поради изместването на електронната плътност от един водороден атом на групата BH3 към празната орбитала на друга BH3 група. Известни са и други борани, които могат да бъдат представени с две серии Bn Hn+4 и Bn Hn+6.
S-металните бориди са реактивни и често се използват за получаване на смес от борани чрез третиране с киселини. Повечето d- и f-метални бориди са топлоустойчиви, много твърди и химически стабилни. Те се използват широко директно под формата на сплави за производството на части за реактивни двигатели, остриета газови турбини. Някои бориди се използват за направата на катоди за електронни устройства.
алуминий. Електронната конфигурация на алуминиев атом се изразява с формулата 1s2 2s2 2p6 3s2 3p1 . Най-външният електронен слой на атома има един несдвоен електрон:
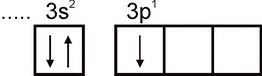
Следователно алуминият може да показва валентност, равна на единица. Тази валентност обаче не е типична за алуминия. Във всички стабилни съединения степента на окисление на алуминия е +3. Валентност, равна на три, съответства на възбуденото състояние на Al атома:
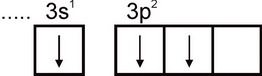
По отношение на разпространението си алуминият се нарежда на четвърто място сред всички елементи (след O, H и Si) и е най-разпространеният метал в природата. Основната част от алуминия е концентрирана в алумосиликати: фелдшпати, слюди и др.
Алуминият е сребристо-бял лек и изключително пластичен метал с висока топло- и електрическа проводимост.
Алуминият е реактивен; той реагира с хлор и бром при стайна температура, а с йод - при нагряване или в присъствието на вода като катализатор. При 800°C алуминият взаимодейства с азот, а при 2000°C - с въглерод. Алуминият проявява висок химичен афинитет към кислорода (ΔG0 298 = -1582 kJ/mol):
2Al + 0,502 \u003d Al2 O3, ΔH0 298 = -1650 kJ / mol
Във въздуха алуминият е покрит с много силен тънък (10-8 m) оксиден филм, който донякъде отслабва металния блясък на алуминия. Поради оксидния филм повърхността на алуминия придобива висок устойчивост на корозия. Това се проявява преди всичко в безразличието на алуминия към водата и парата. Поради образуването на защитен филм, алуминият е устойчив на концентрирани азотни и сярни киселини. Тези киселини пасивират алуминия на студено. Тенденцията към пасивиране ви позволява да увеличите устойчивостта на корозия на алуминия чрез третиране на повърхността му със силни окислители (например K2 Cr2 O7) или използване на анодно окисляване. В този случай дебелината на оксидния филм се увеличава до 3·10-5 м. При високи температури силата на защитния филм рязко намалява. Ако механично действиеотстранете оксидния филм, алуминият става изключително реактивен. Той реагира енергично с вода и водни разтвори на киселини и основи, измествайки водорода и образувайки катиони или аниони. Взаимодействието на алуминия с киселинни разтвори протича съгласно уравнението на реакцията
Al + 6H2 O + 3H+ \u003d [Al (H2O) 6] 3+ + 0,5H2
и с алкални разтвори
Al + ZH2O + OH- \u003d [Al (OH) 4] - + 0,5H2
Алуминиеви катиони и аниони лесно преминават един в друг, когато рН на разтвора се промени:
[Аl(Н2 O)6]3+ + 4OH- = [Аl(ОН)4]- + 6Н2 O
[Al(OH)4]- + 4H+ + 2H2O = [Al(H2O)6]3+
Смесени съединения могат да се образуват и в разтвор, например [Al(H2O)5 (OH)]2+, [Al(H2O)4 (OH)2]+, [Al(H2O)3 (OH)3] . Последният лесно (особено при нагряване) се дехидратира и се превръща в Al(OH)3 хидроксид:
[Al (H2O) 3 (OH) 3] \u003d Al (OH) 3 + ZH2O
Най-широкото използване на алуминия в технологиите се основава на неговите ценни физични и химични свойства и голямото му разпространение в земната кора. Поради високата си електрическа проводимост (4 10-5 Ohm-1 cm-1) и ниската плътност се използва за производството на електрически проводници. Високата пластичност на алуминия прави възможно производството на най-тънкото фолио от него, което се използва в кондензатори и замества оловото в кабелните обвивки с алуминий. Поради немагнетизирането, алуминиевите сплави се използват в радиотехниката.
Основната част от алуминия се използва за производството на леки сплави - дуралуминий (94% Al, останалото Cu, Mg, Mn, Fe и Si), силумин (85-90% Al, 10-14% Si, останалото Na) и др. В допълнение, алуминият се използва като легираща добавка към сплавите, за да им придаде топлоустойчивост. Алуминият и неговите сплави заемат едно от основните места като конструктивни материали в самолетостроенето, ракетната техника, машиностроенето и др. Устойчивостта на алуминия (особено анодизирания) на корозия значително надвишава корозионната устойчивост на стоманата. Поради това неговите сплави се използват като конструкционни материали и в корабостроенето. С d-елементите алуминият образува химични съединения - интерметални съединения (алуминиди): NiAl, Ni3 Al, CoAl и др., които се използват като топлоустойчиви материали. Алуминият се използва в алуминотермията за получаване на редица метали и за термитно заваряване. Алуминотермията се основава на високия афинитет на алуминия към кислорода. Например при реакция, протичаща според уравнението
8Al + 3Fe3 O4 = 4Al2 O3 + 9Fe
отделя се около 3500 kJ топлина и се развиват температури до 3000 °C.
Алуминиевият оксид е известен под формата на няколко модификации. Най-стабилен е α-Al2O3. Тази модификация се намира в земната кора под формата на минерала корунд, от който се приготвят шлифовъчни дискове и шмиргел. Използването на корунд като абразивен материал се основава на неговата висока твърдост, на второ място след твърдостта на диаманта, карборунд SiC и боразон BN. Сливането на Al2O3 с Cr2O3 произвежда изкуствени рубини. Използват се за направата на поддържащи камъни в прецизни механизми. AT последните временаизкуствените рубини се използват в квантови генератори (лазери). Продуктите от Al2O3 се използват като огнеупорни материали и диелектрици.
Алуминиевият хидроксид Al(OH)3 е полимерно съединение. Има слоеста кристална решетка. Всеки слой се състои от Al(OH)6 октаедри (фиг. 1); между слоевете има водородна връзка. Алуминиевият хидроксид, получен чрез обменната реакция, е желатинова бяла утайка, лесно разтворима в киселини и основи. При престоя утайката „старее“ и губи химическата си активност. При калциниране хидроксидът губи вода и се превръща в оксид Al2O3. Една форма на дехидратиран хидроксид, алуминиев гел, се използва в инженерството като адсорбент.
Изключително голям интерес представляват алуминиевите съединения – зеолити, сродни на алумосиликатите. Съставът им може да се изрази с общата формула Mex Eu O2y nH2 O, където Me е Ca или Na (по-рядко Ba, Sr, K); E - Si и Al в променливо съотношение. Зеолитните кристали имат канали, в които могат да проникнат молекули H2O.Съдържанието на вода в зеолитите варира в широк диапазон в зависимост от налягането на водните пари. Зеолитите са способни да обменят водата, която съдържат, с други течности (алкохол и др.). При леко нагряване водата постепенно се отстранява от зеолитите. Но дори пълното обезводняване не води до разрушаване на зеолитните кристали. Ca2+ или Na+ катиони в зеолити образуват дифузионен слой; те не са фиксирани в кристалната решетка, а заедно с водата се намират в празнините на кристала. Това обяснява наличието на катионообменни свойства в зеолити, които са важни за технически цели. Възможността за заместване на едни катиони с други прави възможно използването на зеолити като йонообменници.
Редица изкуствени зеолити се използват като така наречените молекулярни сита. Кристалите на последните се характеризират с наличието на тесни канали с диаметър от 3·10-10 до 13·10-10 м. Молекулните сита абсорбират вещества, чиито молекули могат да влязат в тези дупки.
Например, молекулярно сито с диаметър на отвора 3,5 x 10-10 m може да абсорбира молекули H2, O2, N2, но не абсорбира по-големи CH4 или Ar молекули. Молекулните сита могат да се използват за разделяне на въглеводороди, сухи газове и др.
Галий, индий и талий под формата на прости вещества са топими сребристо-бели метали. Физическите и химичните свойства на Ga, In и Tl се различават значително от тези на Al, въпреки сходството на електронната структура на външното енергийно ниво на атомите на разглежданите елементи.
Тук, очевидно, разликата в електронната структура на предвъншното енергийно ниво на атомите Al: (n-1)s2 (n-1)p6 от една страна и Ga, In и Tl атоми от друга страна: (n- 1)s2 (n- 1)р6 (n-1)d10 .
Степента на окисление на галия и индия в стабилни съединения е +3. За талия е по-характерно степента на окисление + 1. Талиевите съединения, при които степента на окисление на метала е +3, са силни окислители.
Галият има широк температурен диапазон за съществуване на течно състояние. Ниска точка на топене (около 30 °C), висока точка на кипене (2205 °C) позволяват използването на течен галий за производството на манометри.
Индият равномерно отразява светлинните вълни от всички дължини на вълната и следователно се използва в прецизни инструменти за производството на огледала. В допълнение, In е съставна част на някои топими сплави.
Талият се въвежда и в някои сплави, главно сплави с калай и олово (киселинноустойчиви, носещи).
Оксидите Ga2 O3 , In2 O3 и Тl2 O3 са практически неразтворими във вода. Забележимо засилване на основните свойства в серията Ga2 O3 - In2 O3 - Tl2 O3 се проявява в нарастващата разтворимост на оксидите в киселини.
Хидроксидите Ga (OH) 3 , In (OH) 3 , Tl (OH) 3 във вода са също толкова неразтворими, колкото и оксидите. Бялата утайка на Ga(OH)3 е еднакво разтворима както в киселини, така и в основи, докато червено-кафявият Tl(OH)3 е разтворим само в киселини.
Галият и индият образуват бинарни съединения от тип AIII BV с p-елементите от V групата на периодичната система (например GaP, GaAs, InSb и др.). В по-голямата част от съединенията от тип AIII BV, електронните орбитали са sp3-хибридизирани; кристалните решетки на тези съединения имат структура, характеризираща се с тетраедрично разположение на химичните връзки. Много от тези диамантени съединения са полупроводници. Използват се като материал за AC токоизправители, сензори, термоелектрически генератори и др.
Въглерод, силиций, германий, калай и олово съставляват основната подгрупа на група IV. Външните енергийни нива на p-елементите от група IV съдържат по четири електрона (конфигурация ns2np2), от които два са сдвоени s-електрони и два несдвоени p-електрона.
В невъзбудено състояние елементите от тази подгрупа проявяват валентност, равна на две. При преминаване към възбудено състояние, придружено от прехода на един от s-електроните на външното ниво към свободна клетка на p-поднивото на същото ниво, всички електрони на външния слой стават несдвоени и валентността се увеличава до 4.
Сярата, селенът, телурът и полоният също имат 6 електрона във външното ниво (s 2 стр. 4 ), но всички те имат незапълнено d-ниво, така че могат да имат до 6 несдвоени електрона и да показват степени на окисление - 2, +4 и +6 в съединенията.
Моделът на промените в активността на тези елементи е същият като в халогенната подгрупа: най-лесно се окисляват телуридите, след това селенидите и сулфидите. От кислородните съединения на сярата най-стабилни са серните (VI) съединения, а за телура съединенията на телура (IV). Селеновите съединения заемат междинна позиция.
В елементите от подгрупата на хром се запълва d-нивото, следователно на s-нивото на техните атоми има 1 (за хром и молибден) или 2 (за волфрам) електрона. Всички те показват максимално ниво на окисление от +6, но за молибдена и особено за хрома са характерни съединения, при които имат по-ниска степен на окисление (+4 за молибден и +3 или +2 за хром). Съединенията на хром (III) са много стабилни и подобни на съединенията на алуминия.
Всички метали от подгрупата на хрома са широко използвани.
Молибденът е получен за първи път от K. V. Scheele през 1778 г. Използва се при производството на стомани с висока якост и издръжливост, използвани за производството на оръжейни цеви, брони, валове и др.
Поради способността си да се изпарява при висока температура, той не е много подходящ за производство на нишки, но има добра способност да се стопява със стъкло, поради което се използва за направата на държачи за волфрамова нишка в лампи с нажежаема жичка.
Волфрамът е открит и от K. V. Scheele през 1781 г. Използва се за производството на специални стомани. Добавянето на волфрам към стоманата повишава нейната твърдост, еластичност и здравина. Заедно с хрома, волфрамът дава на стоманата способността да запазва твърдостта при много високи температури, така че тези стомани се използват за направата на фрези за високоскоростни стругове.
Чистият волфрам има най-високата точка на топене сред металите (3370 градуса С), поради което се използва за направата на нишки в лампи с нажежаема жичка. Волфрамовият карбид се характеризира с много висока твърдост и устойчивост на топлина и е основният компонент на огнеупорните сплави.
Азотната подгрупа се състои от пет елемента: азот, фосфор, арсен, антимон и бисмут. Това са p-елементите от група V на периодичната система на Д. И. Менделеев.На външно енергийно ниво атомите на тези елементи съдържат пет електрона, които имат конфигурация ns2np3 и са разпределени по следния начин:
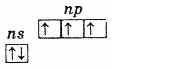
Следователно най-високата степен на окисление на тези елементи е +5, най-ниската -3 също е характерна за +3. Наличието на три несдвоени електрона на външното ниво показва, че в невъзбудено състояние атомите на елементите имат валентност 3 Външното ниво на азотния атом се състои само от две поднива - 2s и 2r. Атомите на останалите елементи от тази подгрупа имат свободни клетки от d-подниво на външните енергийни нива. Следователно, един от s-електроните на външното ниво може при възбуждане да премине на d-подниво на същото ниво, което води до образуването на 5 несдвоени електрона.
външна електронна обвивка на фосфор (невъзбуден атом)
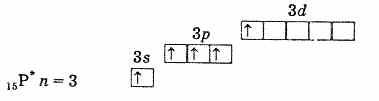
външната електронна обвивка на възбудения фосфорен атом По този начин фосфорът, арсенът, антимонът и бисмутът във възбудено състояние имат 5 несдвоени електрона и тяхната валентност в това състояние е 5. Възбудете електрон в азотния атом По подобен начинневъзможно поради липсата на d-подниво на второ ниво. Следователно азотът не може да бъде петвалентен, но може да образува четвърта ковалентна връзка чрез механизма донор-акцептор поради самотната електронна двойка 2s2. Друг процес е възможен за азотния атом. Когато един от двата 2s електрона се отдели, азотът преминава в еднозареден четиривалентен N+ йон.

От азот към бисмут атомните радиуси се увеличават и йонизационните потенциали намаляват. Редукционните свойства на неутралните атоми се увеличават от N до Bi, докато окислителните свойства отслабват (виж Таблица 21).
С водород, азот, фосфор и арсен образуват полярни RH3 съединения, показващи отрицателна степен на окисление от -3. RH3 молекулите имат пирамидална форма. В тези съединения връзките на елементите с водорода са по-силни, отколкото в съответните съединения на елементите от кислородната подгрупа и особено от халогенната подгрупа. Следователно водородните съединения на елементите от азотната подгрупа в водни разтворине образуват водородни йони.
С кислород елементите от азотната подгрупа образуват оксиди с обща формула R2O3 и R2O5. Оксидите съответстват на киселините HRO2 и HRO3 (и ортокиселините H3RO4, с изключение на азота). В рамките на подгрупата природата на оксидите се променя, както следва: N2O3 е кисел оксид; P4O6 е слабо кисел оксид; As2O3 е амфотерен оксид с преобладаващи киселинни свойства; Sb2O3 е амфотерен оксид с преобладаващи основни свойства; Bi2O3 е основният оксид. Така киселинните свойства на оксидите от състава R2O3 и R2O5 намаляват с увеличаване на атомния номер на елемента.Както се вижда от табл. 21, в рамките на подгрупата от азот към бисмут, неметалните свойства намаляват и металните свойства се увеличават. При антимона тези свойства се изразяват по същия начин; при бисмута преобладават металните свойства, при азота - неметалните свойства. Фосфорът, арсенът и антимонът образуват няколко алотропни съединения.
Шестата група на периодичната система от елементи се състои от две подгрупи: основната група - кислород, сяра, селен, телур и полоний - и страничната група - хром, молибден и волфрам. В основната подгрупа се разграничава подгрупа на селен (селен, телур и полоний), вторичната подгрупа се нарича подгрупа на хром. Всички елементи от основната подгрупа, с изключение на кислорода, могат да прикрепят по два електрона всеки, образувайки електроотрицателни йони.
Елементите от основната подгрупа имат шест електрона (s2p4) на външното електронно ниво. Кислородните атоми имат два несдвоени електрона и нямат d-ниво. Следователно кислородът проявява основно степен на окисление от (2 и само в съединения с флуор +2. Сярата, селенът, телурът и полоният също имат шест електрона (s2p4) във външното ниво, но всички те имат празно d-ниво, така че те могат да имат до шест несдвоени електрона и да показват окислителни състояния в съединения - 2, +4 и +6.
Моделът на промените в активността на тези елементи е същият като в халогенната подгрупа: най-лесно се окисляват телуридите, след това селенидите и сулфидите. От кислородните съединения на сярата най-стабилни са съединенията на сярата (VI), а за телура - съединенията на телура (IV). Селеновите съединения заемат междинна позиция.
Селенът и телурът, както и техните съединения с някои метали (индий, талий и др.), притежават полупроводникови свойства и намират широко приложение в радиоелектрониката. Съединенията на селен и телур са силно токсични. Използват се в стъкларската индустрия за производство на цветни (червени и кафяви) стъкла.
В елементите от подгрупата на хром, d-нивото е запълнено, следователно, на s-нивото на техните атоми - по един (за хром и молибден) или два (за волфрам) електрона. Всички те проявяват максимално ниво на окисление от +6, но молибденът и особено хромът се характеризират със съединения, в които имат по-ниска степен на окисление (+4 за молибден и +3 или +2 за хром). Съединенията на хром (III) са много стабилни и подобни на съединенията на алуминия. Всички метали от подгрупата на хрома са широко използвани.
Молибденът е получен за първи път от K. V. Scheele през 1778 г. Използва се при производството на стомани с висока якост и якост, които се използват за производството на оръжейни цеви, брони, валове и др. Поради способността си да се изпарява при високи температури, той е малко полезен за производството на нишки, но има добра способност за стопяване със стъкло, така че се използва за направата на държачи за волфрамова нишка в лампи с нажежаема жичка.
Волфрамът е открит и от K. V. Scheele през 178 г.! г. Използва се за производство на специални стомани. Добавянето на волфрам към стоманата повишава нейната твърдост, еластичност и здравина. Заедно с хрома, волфрамът дава на стоманата способността да запазва твърдостта при много високи температури, така че тези стомани се използват за направата на фрези за високоскоростни стругове. Чистият волфрам има най-високата точка на топене сред металите (3370 (C), поради което се използва за производството на нишки в лампи с нажежаема жичка. Волфрамовият карбид има много висока твърдост и устойчивост на топлина и е основният компонент на огнеупорните сплави.
Елементите, включени в група VII на периодичната система, са разделени на 2 подгрупи: основната - халогенната подгрупа - и страничната - манганова подгрупа. Водородът е поставен в същата група, въпреки че неговият атом има един електрон на външно валентно ниво и той трябва да бъде поставен в група I.
Водородът обаче има много малко общо както с елементите от основната подгрупа - алкални метали, така и с елементите от вторичната подгрупа - мед, сребро и злато. В същото време, подобно на халогените, чрез добавяне на електрон в реакции с активни метали, той образува хидриди, които имат известна прилика с халогенидите.
Халогенната подгрупа включва флуор, хлор, бром, йод и астатин. Първите 4 елемента се срещат в природата, последният е получен изкуствено и затова е изследван много по-малко от останалите халогени. Думата "халоген" означава солеобразуващ. Елементите от подгрупата получиха това име поради лекотата, с която реагират с много метали, образувайки соли.
Всички халогени имат структура на външната електронна обвивка s 2p5 . Следователно те лесно приемат електрон, образувайки стабилна електронна обвивка на благороден газ (s 2 r 6 ). Най-малкият радиус на атом в подгрупата е за флуор, за останалата част той се увеличава в серия F< Cl < Br < I < Аt и составляет соответственно 133; 181; 196; 220 и 270 нм. В таком же порядке уменьшается сродство атомов элементов к электрону.
халогени - много активни елементи. Те могат да вземат електрони не само от атоми, които ги даряват лесно, но и от йони и дори изместват други по-малко активни халогени от техните съединения. Например, флуорът измества хлора от хлориди, бром от бромиди и йод от йодиди.
От всички халогени само флуорът, който е в период II, няма незапълнено d-ниво. Поради тази причина той не може да има повече от 1 несдвоен електрон и показва само валентност от -1. В атомите на други халогени, d-нивото не е запълнено, което прави възможно те да имат различен брой несдвоени електрони и да показват валентността -1, +1, +3, +5 и +7, наблюдавана в кислородни съединения на хлор, бром и йод.
Подгрупата на манган включва манган, технеций и рений. За разлика от халогените, елементите от манганова подгрупа имат само 2 електрона на външно електронно ниво и следователно не показват способността да прикачват електрони, образувайки отрицателно заредени йони.
Манганът е често срещан в природата и широко използван в индустрията.
Технеций е радиоактивен, не срещаме в природата, но е получен по изкуствен път (за първи път - Е. Сегре и К. Перие, 1937 г.) Този елемент се образува поради радиоактивния разпад на урана. Реният е един от микроелементите. Той не образува самостоятелни минерали, но се среща като спътник на някои минерали, особено на молибден.
Открит е от В. и И. Нодак през 1925 г. Сплавите с малки добавки на рений имат повишена устойчивост на корозия. Добавянето на рений към сплавите повишава тяхната механична якост.
Това свойство на рения позволява да се използва вместо благородния метал иридий. Термодвойки платина-платина-рений работят по-добре от термодвойки платина-платина-иридий, но не могат да се използват при много високи температури, тъй като се образува летливо съединение Re. 2 O 7 .
Основната подгрупа на осмата група на периодичната система са благородните газове -хелий, неон, аргон, криптон, ксенони радон. Тези елементи се характеризират с много ниска химическа активност, което дава основание да ги наричаме благородни или инертни газове. Те само трудно образуват съединения с други елементи или вещества; не са получени химически съединения на хелий, неон и аргон. Атомите на благородните газове не се комбинират в молекули, с други думи, техните молекули са едноатомни.
Благородните газове завършват всеки период от системата от елементи. В допълнение към хелия, всички те имат осем електрона във външния електронен слой на атома, образувайки много стабилна система. Електронната обвивка на хелия, която се състои от два електрона, също е стабилна. Следователно атомите на благородния газ се характеризират с високи енергии на йонизация и като правило отрицателни енергии на електронен афинитет.
Дълго време се смяташе, че атомите на благородните газове като цяло не са в състояние да образуват химически връзки с атомите на други елементи. Известни са само относително нестабилни молекулярни съединения на благородните газове, като хидрати
Ag-6N 2 0, Kg-6N 2 0, Xe-6N 2 0, образуван от действието на сгъстени благородни газове върху кристализираща преохладена вода. Тези хидрати принадлежат към клатратния тип; валентни връзки не възникват по време на образуването на такива съединения. Образуването на клатрати с вода се благоприятства от наличието на множество кухини в кристалната структура на леда.
Въпреки това, по време на последните десетилетиябеше установено, че криптон, ксенон и радон могат да се комбинират с други елементи и преди всичко с флуор. Така, ; флуоридите се получават чрез директно взаимодействие на благородни газове с флуор (при нагряване или при електрически разряд) KrF 2 , XeF 2 , KrF 4 , XeF 4 и RnF 4 . Всички те са кристали, които са стабилни при нормални условия. Бяха получени и производни на ксенон в степен на окисление +6 - хексафлуорид XEF 6 , XeO3 триоксид, Xe(OH)b хидроксид. Последните две съединения проявяват киселинни свойства; така че, реагирайки с алкали, те образуват соликсенонова киселина,например: Xe0 3 + Ba (OH) 2 - BaXe0 4 + H 2 0.
деривати; ксенонът (VI) са силни окислители. Под действието на още по-силни окислители обаче могат да се получат съединения, в които ксенонът има степен на окисление -4-8. От тези съединения е известен октафлуорид. XeF 8, Xe0 4 тетроксид и оксохексафлуорид XeOF 6.
По-високата химическа активност на криптона, ксенона и радона в сравнение с първите членове на групата на благородните газове се обяснява с относително ниските йонизационни потенциали на техните атоми. За криптон, ксенон и радон тези стойности са близки до йонизационните потенциали на някои други елементи (например, йонизационният потенциал на азотния атом е 14,53 AT, хлорен атом - 12,97 V).
Най велик практическа употребанамерете аргон, неон и хелий.
водород (лат. Hydrogenium),H, химичен елемент, първи по ред в периодичната система на Менделеев; атомна маса 1,0079. При обикновени условия водородът е газ; няма цвят, мирис и вкус.
Справка по история.В трудовете на химиците от 16-ти и 17-ти век многократно се споменава отделянето на горим газ по време на действието на киселини върху металите. През 1766 г. Г. Кавендиш събира и изследва освободения газ, наричайки го "запалим въздух". Като привърженик на теорията за флогистона, Кавендиш вярва, че този газ е чист флогистон. През 1783 г. А. Лавоазие, анализирайки и синтезирайки водата, доказва сложността на нейния състав, а през 1787 г. определя "горим въздух" като нов химичен елемент (Водород) и му дава съвременно имехидроген (от гръцки hydor - вода и gennao - раждам), което означава "раждам вода"; този корен се използва в имената на водородни съединения и процеси, които го включват (например хидриди, хидрогениране). Съвременното руско име "Водород" е предложено от М. Ф. Соловьов през 1824 г.
Разпространение на водорода в природата.Водородът е широко разпространен в природата, съдържанието му в земната кора (литосфера и хидросфера) е 1% от масата и 16% от броя на атомите. Водородът е част от най-разпространеното вещество на Земята - водата (11,19% водород по маса), в съединенията, които съставляват въглищата, нефта, природните газове, глината, както и животинските и растителните организми (тоест в състава на протеини, нуклеинови киселини, мазнини, въглехидрати и др.). Водородът е изключително рядък в свободно състояние, намира се в малки количества във вулканични и други природни газове. В атмосферата присъстват незначителни количества свободен водород (0,0001% от броя на атомите). В околоземното пространство водородът под формата на поток от протони образува вътрешния („протонен“) радиационен пояс на Земята. Водородът е най-разпространеният елемент в космоса. Под формата на плазма той съставлява около половината от масата на Слънцето и повечето звезди, по-голямата част от газовете на междузвездната среда и газовите мъглявини. Водородът присъства в атмосферата на редица планети и в кометите под формата на свободен H 2, метан CH 4, амоняк NH 3, вода H 2 O, радикали като CH, NH, OH, SiH, PH и др. Под формата на поток от протони, водородът е част от корпускулното излъчване на Слънцето и космическите лъчи.
Изотопи, атом и молекула на водорода.Обикновеният водород се състои от смес от 2 стабилни изотопа: лек водород или протий ( 1 H) и тежък водород или деутерий ( 2 H или D). AT естествени съединенияВодород на атом 2 H представлява средно 6800 атома 1 N. Радиоактивен изотоп с масово число 3 се нарича свръхтежък водород или тритий ( 3 H, или T), с меко β-лъчение и полуживот T½ = 12,262 години. В природата тритият се образува например от атмосферния азот под действието на неутрони от космическите лъчи; той е незначителен в атмосферата (4 10-15 % от общия брой водородни атоми). Получава се изключително нестабилен изотоп 4 H. Масови числа на изотопи 1 N, 2 N, 3 N и 4 H, съответно 1, 2, 3 и 4, показват, че ядрото на протиевия атом съдържа само един протон, деутерий - един протон и един неутрон, тритий - един протон и 2 неутрона, 4 H е един протон и 3 неутрона. Голямата разлика в масите на изотопите на водорода причинява по-забележима разлика в техните физични и химични свойства, отколкото в случая на изотопи на други елементи.
Водородният атом има най-простата структура сред атомите на всички други елементи: той се състои от ядро и един електрон. Енергията на свързване на електрон с ядро (йонизационен потенциал) е 13,595 eV. Неутралният атом Водород може също да прикачи втори електрон, образувайки отрицателен йон H- в този случай енергията на свързване на втория електрон с неутралния атом (електронен афинитет) е 0,78 eV. Квантовата механика дава възможност да се изчислят всички възможни енергийни нива на водородния атом и следователно да се даде пълна интерпретация на неговия атомен спектър. Водородният атом се използва като моделен атом в квантовомеханичните изчисления на енергийните нива на други, по-сложни атоми.
Молекула водород H 2 се състои от два атома, свързани с ковалент химическа връзка. Енергията на дисоциация (тоест разпадане на атоми) е 4,776 eV. Междуатомното разстояние при равновесното положение на ядрата е 0,7414Å. При високи температури молекулният водород се дисоциира на атоми (степента на дисоциация при 2000°C е 0,0013; при 5000°C е 0,95). Атомен водород също се образува в различни химична реакция(например, действието на Zn върху солна киселина). Въпреки това съществуването на водорода в атомно състояние продължава само кратко време, атомите се рекомбинират в H молекули 2 .
Физични свойства на водорода.Водородът е най-лекият от всички известни вещества (14,4 пъти по-лек от въздуха), плътност 0,0899 g/l при 0°C и 1 атм. Водородът кипи (втечнява) и се топи (втвърдява) съответно при -252,8°C и -259,1°C (само хелият има по-ниски точки на топене и кипене). Критичната температура на водорода е много ниска (-240°C), така че втечняването му е свързано с големи трудности; критично налягане 12,8 kgf/cm 2 (12,8 атм), критична плътност 0,0312 g/cm 3 . Водородът има най-високата топлопроводимост от всички газове, равна на 0,174 W/(m K) при 0°C и 1 атм, т.е. 4,16 10-4 кал/(s cm °C). Специфичен топлинен капацитет на водорода при 0°С и 1 атм Сстр 14,208 kJ / (kg K), тоест 3,394 cal / (g ° C). Водородът е слабо разтворим във вода (0,0182 ml / g при 20 ° C и 1 atm), но добре - в много метали (Ni, Pt, Pa и други), особено в паладий (850 обема на 1 обем Pd). Разтворимостта на водорода в металите е свързана със способността му да дифундира през тях; дифузията през въглеродна сплав (например стомана) понякога е придружена от разрушаване на сплавта поради взаимодействието на водорода с въглерода (т.нар. декарбонизация). Течният водород е много лек (плътност при -253°С 0,0708 g/cm 3 ) и течност (вискозитет при -253°C 13,8 градуса по Целзий).
Химични свойства на водорода.В повечето съединения водородът проявява валентност (по-точно степен на окисление) от +1, подобно на натрия и други алкални метали; обикновено се счита за аналог на тези метали, заглавна група I на системата на Менделеев. Въпреки това, в металните хидриди, водородният йон е отрицателно зареден (степен на окисление -1), тоест Na хидрид+H- изграден като натриев хлорид+Cl- . Това и някои други факти (близост физични свойстваВодород и халогени, способността на халогените да заместват водорода в органичните съединения) дават основание да се класифицира водородът като VII групапериодична система. При нормални условия молекулярният водород е относително неактивен, като се комбинира директно само с най-активните неметали (с флуор, а на светлина също и с хлор). Въпреки това, когато се нагрява, той реагира с много елементи. Атомният водород има повишена химическа активност в сравнение с молекулярния водород. Водородът се комбинира с кислород, за да образува вода:
H 2 + 1/2 O 2 \u003d H 2 O
с отделяне на 285,937 kJ / mol, тоест 68,3174 kcal / mol топлина (при 25 ° C и 1 atm). При обикновени температури реакцията протича изключително бавно, над 550 ° C - с експлозия. Границите на експлозивност на водородно-кислородната смес са (по обем) от 4 до 94% H 2 , а водородно-въздушната смес - от 4 до 74% Н 2 (смес 2 тома H 2 и 1 том O 2 наречен експлозивен газ). Водородът се използва за редуциране на много метали, тъй като отнема кислорода от техните оксиди:
CuO + H 2 \u003d Cu + H 2 O,
Fe 3 O 4 + 4H 2 \u003d 3Fe + 4H 2 O и др.
С халогени водородът образува водородни халогениди, например:
H 2 + Cl 2 \u003d 2HCl.
Водородът експлодира с флуор (дори на тъмно и при -252°C), реагира с хлор и бром само при осветяване или нагряване, а с йод - само при нагряване. Водородът реагира с азот, за да образува амоняк:
ZN 2 + N 2 \u003d 2NH 3
само на катализатор и при повишени температури и налягания. При нагряване водородът реагира енергично със сярата:
H 2 + S \u003d H 2 S (сероводород),
много по-трудно със селен и телур. Водородът може да реагира с чист въглерод без катализатор само при високи температури:
2H 2 + C (аморфен) = CH 4 (метан).
Водородът директно реагира с някои метали (алкални, алкалоземни и други), образувайки хидриди:
H2 + 2Li = 2LiH.
От голямо практическо значение са реакциите на водорода с въглероден оксид (II), при които в зависимост от температурата, налягането и катализатора, различни органични съединения, например HCHO, CH 3 OH и други. Ненаситените въглеводороди реагират с водорода, за да станат наситени, например:
C n H 2n + H 2 \u003d C n H 2n + 2.
Ролята на водорода и неговите съединения в химията е изключително голяма. Водородът определя киселинните свойства на така наречените протонови киселини. Водородът има тенденция да образува така наречената водородна връзка с някои елементи, която има решаващо влияние върху свойствата на много органични и неорганични съединения.
Получаване на водород.Основните видове суровини за промишлено производствоВодород - природни горими газове, газ от коксови пещи и газове от рафиниране на нефт. Водородът се получава и от водата чрез електролиза (на места с евтина електроенергия). Най-важните методи за производство на водород от природен газса каталитичното взаимодействие на въглеводороди, главно метан, с водна пара (преобразуване):
CH 4 + H 2 O \u003d CO + ZH 2,
и непълно окисление на въглеводороди с кислород:
CH 4 + 1/2 O 2 \u003d CO + 2H 2
Полученият въглероден оксид (II) също се подлага на преобразуване:
CO + H 2 O \u003d CO 2 + H 2.
Водородът, произведен от природен газ, е най-евтиният.
Водородът се изолира от коксовия газ и газовете от рафинериите чрез отстраняване на останалите компоненти на газовата смес, които се втечняват по-лесно от водорода, при дълбоко охлаждане. Електролизата на водата се извършва с постоянен ток, преминавайки през разтвор на KOH или NaOH (киселини не се използват, за да се избегне корозия на стоманено оборудване). Водородът се произвежда в лаборатории чрез електролиза на вода, както и чрез реакция между цинк и солна киселина. Въпреки това, по-често те използват готов водород в бутилки.
Приложение на водород.Водородът започва да се произвежда в промишлен мащаб в края на 18 век за пълнене балони. В момента водородът се използва широко в химическата промишленост, главно за производството на амоняк. Голям потребител на водород е и производството на метилови и други алкохоли, синтетичен бензин и други продукти, получени чрез синтез от водород и въглероден оксид (II). Водородът се използва за хидрогениране на твърди и тежки течни горива, мазнини и други, за синтез на HCl, за хидрообработка на нефтопродукти, при заваряване и рязане на метали с кислородно-водороден пламък (температура до 2800°C) и при атомно водородно заваряване (до 4000 ° C). Водородните изотопи, деутерий и тритий, са намерили много важни приложения в ядрената енергетика.
Химични свойства на елементите стр. 13
"Химия. 9 клас". ОПЕРАЦИОННА СИСТЕМА. Габриелян (gdz)
Характеристики на химичните елементи. Периодичен закон на Менделеев
Въпрос 1.
Периодичният закон на Менделеев е един от основните закони на химията. Може да се твърди, че цялата съвременна химия е изградена върху него. Той обяснява зависимостта на свойствата на атомите от тяхната структура, обобщава тази зависимост за всички елементи, като ги разделя на различни групи, а също така предвижда техните свойства в зависимост от структурата и структурата в зависимост от свойствата.
Има и други закони, които имат обяснителни, обобщаващи и предсказващи функции. Например законът за запазване на енергията, законът за пречупване на светлината, генетичният закон на Мендел, законът за всемирното притегляне и т.н.
Въпрос 2.
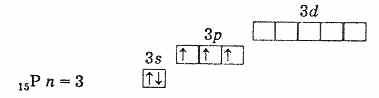
Водени от периодичната система, намираме елемент с желаното разположение на електроните на енергийни нива (2 и 5). Този елемент е азот: N: 1s 2 2s 2 2p 3.
Този елементобразува просто вещество - N 2, азот. Водородното съединение на азота е NH3, амоняк. Върховен оксидазот - N 2 O 5. Този оксид принадлежи към киселинните оксиди, тъй като при разтваряне във вода се трансформира в силната азотна киселина HNO3.
N 2 O 5 + H 2 O \u003d 2HNO 3;
N 2 O 5 + BaO = Ba (OH) 2;
N2O5 + Ba(OH)2 = Ba(NO3)2 + H2O;
Азотът в степен на окисление +5 (N +5) има силни окислителни свойства:
2N 2 O 5 + 5C \u003d 2N 2 + 5CO 2.
Въпрос 3.
Преди това елементът берилий погрешно беше причислен към група III. Причината за това беше неправилното определяне на атомната маса на берилия (вместо 9, тя се смяташе за равна на 13,5). DI. Менделеев предполага, че берилият е в група II, въз основа на химичните свойства на елемента. Свойствата на берилия бяха много сходни с тези на магнезия (Mg) и калция (Ca) и доста различни от тези на алуминия (Al). Знаейки, че атомните маси на Li и B, съседни на Be елементи, са съответно 7 и 11, Д. И. Менделеев предполага, че атомната маса на берилия е 9.
Въпрос 4.
Ca е атом, чиито електрони са разпределени според сериите
числа 2, 8, 8, 2.
Артикул № 7-N,
елемент номер 8 - O.
Реакционни уравнения:
3Ca + N 2 \u003d Ca 3 N 2,
2Ca + O 2 \u003d 2CaO.
Продуктите на реакцията имат тип йонна връзка.
Азотът и кислородът имат молекулярна структура на кристални решетки, докато калцият има метална кристална решетка.
Продуктите на взаимодействието - Ca 3 N 2 и CaO имат йонна структура на кристалната решетка.
Въпрос 5.
N, P, As, Sb, Bi - укрепване на металните свойства.
Металните свойства в групите са подобрени.
Въпрос 6.
Сред елементите: N, Mg, Al, Si, P, S, Cl - укрепване на неметалните свойства.
Неметалните свойства на елементите в периоди се подобряват.
Въпрос 7.
Cl 2 O 7 , P 2 O 5 , SiO 2 , Al 2 O 3 , MgO, Na 2 O - намаляване на киселинните свойства.
Киселинните свойства в периодите се увеличават.
HClO 4 , H3PO 4 , H 2 SO 4 , Al(OH) 3 , NaOH - намаляване на киселинните свойства.
Въпрос 8.
B 2 O 3 , BeO, Li 2 O - повишаване на основните свойства.
B(OH) 3 , Be(OH) 2 , LiOH - повишаване на основните свойства.
B(OH)3 е слаба киселина;
Be(OH) 2 - слаба основа;
LiOH е силна основа.
Въпрос 9.
Периодичната система от елементи отразява връзката на химичните елементи. Атомният номер на елемент е равен на заряда на ядрото, числено е равен на броя на протоните. Броят на неутроните, съдържащи се в ядрата на един елемент, за разлика от броя на протоните, може да бъде различен. Атомите на един и същи елемент, чиито ядра съдържат различен брой неутрони, се наричат изотопи.
Всеки химичен елемент има няколко изотопа (естествени или изкуствени). Атомната маса на химичен елемент е равна на средната стойност на масите на всичките му естествени изотопи, като се вземе предвид тяхното изобилие.
С откриването на изотопи зарядите на ядрата, а не техните атомни маси, започват да се използват за разпределение на елементите в периодичната система.
Въпрос 10.
Това се дължи на факта, че свойствата на елементите и техните съединения не зависят от общия брой електрони, а само от броя на валентностите, които са на последния слой. Броят на валентните електрони се променя периодично, следователно свойствата на елементите също се променят периодично.
Въпрос 11.
1. Свойствата на химичните елементи и образуваните от тях вещества са периодично зависими от отн атомни масиелементи.
2. Свойствата на химичните елементи и образуваните от тях вещества са в периодична зависимост от заряда на атомните ядра на елементите.
Химията е наука, която изучава химичните елементи, простите и сложни вещества, които образуват (състав, структура, свойства), техните трансформации и законите, на които се подчиняват тези трансформации. Подразделя се на неорганична, органична, физическа, аналитична, колоидна и др. Съвременната химия се свързва с други науки, в резултат на което възникват гранични области на науката: биохимия, агрохимия, космохимия, радиохимия и др. Постиженията на съвременната химия са стимул за интензивния растеж на химическата промишленост, играят важна роля в научно-техническия прогрес на всички индустрии Национална икономика. Химията играе важна роля в решаването на най-неотложните и обещаващи проблеми модерно общество(повишаване на ефективността и безопасността на изкуствените торове за повишаване на добива на селскостопански продукти и проблемът за синтезиране на хранителни продукти от нехранителни суровини; развитие на океански източници на суровини; разработване и създаване на нови енергийни източници; синтез на нови вещества и състави, необходими за решаване на проблеми в бъдеще; защита заобикаляща среда). Вижте #2, стр.334.
Обект на изследване в химията са химичните елементи и техните съединения. Химическият елемент е съвкупност от атоми със същия ядрен заряд. От своя страна атомът е най-малката частица от химичен елемент, която запазва всичките си химични свойства. По този начин всеки химичен елемент съответства на определен тип атоми. Вижте #3, стр.11.
Молекулата е най-малката частица от отделно вещество, способна на самостоятелно съществуване, притежаваща основните си химични свойства и състояща се от едни и същи или различни атоми. Молекулите могат да бъдат едно-, дву- и многоатомни. Те са съставните частици на материята. Ако молекулите се състоят от еднакви атоми, тогава веществото се нарича просто или елементарно, например He, Ar, H2, O2, O3, S4, P4. Простото вещество е форма на съществуване на химичен елемент в свободно състояние. Вижте #3, стр. 11 стр. 12.
Ако една молекула на вещество се състои от различни атоми, тогава веществото се нарича сложно (или химично съединение), например CO, H2O, NH3, H3PO4. Всяко вещество се характеризира с определен състав (естество и брой на атомите в неговата молекула), структура (пространствено разположение на атомите в молекула) и определени физични и химични свойства. Вижте #3, стр.12.
Химичните свойства на веществото характеризират способността му да участва в химични реакции, тоест в процесите на трансформация на едно вещество в друго. За да разберете тези свойства, е необходимо да знаете състава и структурата на веществата. Вижте #3, стр.12.
Цялата периодична таблица може да бъде разделена на метали, неметали и амфотерни вещества. метали- прости вещества, характеризиращи се със способността да даряват електрони, разположени на външно енергийно ниво (валентни електрони) и преминават в положително заредени йони. Почти всички метали имат висока електрическа и топлопроводимост, способност да отразяват добре светлинните вълни (което определя техния блясък и непрозрачност), пластичност. В твърдо състояние те обикновено имат кристална структура. Връзката между атомите в метала се осъществява от валентни електрони, които се движат свободно в кристалната решетка, образувана от положително заредени метални йони. От 107 елемента в периодичната таблица 83 елемента са метали. Много експлоатационни свойства на металите зависят не само от техните химични свойства, но и от структурата, която придобиват в резултат на методите на производство и последваща обработка. Това създава възможност за широка промяна в свойствата на металите и ги прави най-важните структурни, електрически, механични и други материали. Днес металите се използват широко в различни областитехнология. неметали- простите вещества, които нямат ковкост, метален блясък, са лоши проводници на топлина и електричество. За неметалните атоми способността за прикачване на електрони е предимно характерна, т.е. стават отрицателно заредени йони. Неметалите включват 22 елемента: H, B, C, Si, N, P, As, O, S, Se, Te, халогени и благородни газове. Неметалните оксиди са кисели по природа, отговарят на кислород-съдържащи киселини. Амфотерни веществаВещества, които проявяват както киселинни, така и основни свойства. Амфотерно вещество, реагиращо например със силна основа, може да прояви киселинни свойства, докато в същото време същото вещество, реагиращо със силна киселина, може да прояви основни свойства. Вижте № 2, стр. 273, стр. 279, стр. 225.
Обмисли периодична системахимични елементи. Създаден е на базата периодичен закон. Таблицата се състои от 7 периода и 8 групи.
Периодите са хоризонтални редове на таблицата, те са разделени на големи и малки. В сапунените периоди има 2 елемента (1-ви период) или 8 елемента (2-ри и 3-ти период), в големи периоди 18 елемента (4-ти и 5-ти) или 32 елемента (6-ти период). 7-ми период все още не е приключил. Всеки период започва с типичен метал и завършва с типичен неметал и благороден газ. Вижте № 1, стр. 271.
Вертикалните колони се наричат групи от елементи. Всяка група е разделена на две подгрупи - основна и второстепенна. Подгрупа е набор от елементи, които са химически аналози. Често елементите на подгрупа имат най-високо ниво на окисление, съответстващо на номера на групата. Вижте № 1, стр. 271.
В основните подгрупи химичните свойства на елементите могат да варират в широки граници.


