Алуминият е в основната подгрупа на група III. Разположението на енергийните нива е както следва:
3 Al 2e - , 8e - , 3e -
Тъй като алуминиевите атоми имат 3 електрона на външното ниво, алуминият в съединенията показва степен на окисление 4-3.
Стигаме до същото заключение, водени от представите за естеството на движението на електроните в атомите и тяхното разположение не само в енергийни нива, но и в поднива. В алуминиев атом 3s 2 електрона лесно се разпадат и един електрон преминава през 3p орбитала:
Резултатът е три несдвоени електрона. Отговорете на въпрос 1 (стр. 138).
> Намиране на алуминий в природата, неговото производство и свойства
Алуминият е третият най-разпространен елемент в земната кора. Среща се само в съединения. Най-важните от тях са показани на фигура 19.
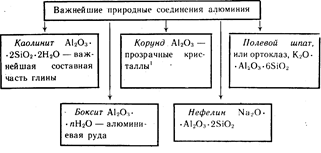
Цветни кристали от Al 2 O 3 червени - рубини, от син цвят- сапфири.
Разписка
През 1827 г. немският химик Ф. Вьолер получава алуминий чрез нагряване на алуминиев хлорид с алкални метали с калий или натрий без въздух.
AlCl 3 +3K 3KCl + Al
За промишлено производствоалуминий, тези методи са икономически неизгодни, следователно е разработен електрохимичен метод за получаване на алуминий от боксити.
Физически свойства
Алуминият е сребристо-бял метал, лек (= 2,7 g / cm 3), топи се при 660 ° C. Много е пластичен, лесно се изтегля в тел и се пече на листове и фолио. По електрическа проводимост алуминият е на второ място след среброто и медта (той е 2/3 от електрическата проводимост на медта).
Химични свойства
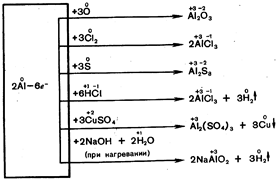
В серията на електрохимичното напрежение алуминият е поставен зад най-активните метали. От ежедневния опит обаче е известно, че алуминиевите продукти (съдове и др.) не се влияят нито от кислород, нито от вода, дори при температурата на кипене. Алуминият също не се влияе от концентрирана студена азотна киселина. Това се дължи на наличието на тънък оксиден филм върху алуминиевата повърхност, който я предпазва от по-нататъшно окисление. Ако повърхността на алуминия се натрие с живачна сол, тогава се получава следната реакция:
2А1 + 3HgCl 2 2А1С1 3 + 3Hg
Отделеният живак разтваря алуминия и се образува неговата сплав с живак - алуминиева амалгама. Филмът не се задържа върху амалгатираната повърхност, така че алуминият реагира с вода при нормални условия (фиг. 46):
2А1 + 6НОН 2А1(ОН)3 + 3Н2
При повишени температури алуминият реагира с много неметали и сложни вещества без сливане:
Приложение
Алуминият се използва за производството на различни сплави. Най-разпространени са дуралумините, съдържащи мед и магнезий, и силумините - сплави на алуминий със силиций. Основните предимства на тези сплави са лекота и висока якост. Споменатите сплави намират широко приложение в самолетостроенето, автомобилите, корабите и приборостроенето, в ракетната техника и в строителството. Под формата на чист метал алуминият се използва за производството на електрически проводници и различно химическо оборудване.
Алуминият се използва и за алуминиране, т.е. насищане на повърхностите на стоманени и чугунени продукти с алуминий, за да ги предпази от корозия.
На практика често се използва термит (смес от Fe 3 O 4 оксид с алуминиев прах). Ако тази смес се запали (с помощта на магнезиева лента), тогава настъпва бурна реакция с освобождаването на Голям бройтоплина:
8Al + 3Fe 3 O 4 4Al 2 O 3 + 9Fe
Този процес се използва при така нареченото термитно заваряване, както и за получаване на някои метали в свободна форма.
Отговорете на въпроси 2-6 (стр. 138). Решете задачи 1 - 2 (стр. 138).
алуминий. Позиция в периодичната система, физическа и Химични свойства
Въведение 3
1. Физични и химични свойства на алуминия 5
2. Получаване на алуминий 9
3. Алуминий в природата 10
4. Приложение на алуминия и неговите сплави 12
Заключение 16
Литература 18
Въведение
За първи път публиката е представена на алуминия на Световното изложение в Париж през 1855 г., където са представени малки слитъци от новия метал. Публиката беше разочарована. Вестниците пишат: „Парижката изложба беше предназначена да сложи край на приказката за среброто от глина. Алуминият беше показан там публично и при това стана ясно, че повечетоказаното за него трябва да се припише на фантазията и доверчивостта на широката публика. Вместо очакваните планини от алуминий, имаше само 12 малки блока с общо тегло може би около килограм, което, разбира се, не е много за откритие, което изглежда способно да обърне света. Въпреки това, постепенно от рядко любопитство, веднъж оценено наравно с скъпоценни метали, алуминият се превърна в незаменим материал за архитекти, конструктори и дизайнери. И така, през 1967 г. американският дизайнер Оскар де ла Рента направи фурор в света на модата, като представи на публиката бански костюм от най-тънката алуминиева нишка.
Този метал с удивително разнообразни свойства само за два века от създаването си успя да завладее света, превръщайки се в синоним на технологичния прогрес. А 21-ви век, според всички сметки, обещава да бъде векът на алуминия.
Днес алуминият е по-скъп от обикновената въглеродна стомана, но по-евтин от неръждаемата стомана. Ако изчислим цената на алуминиеви и стоманени продукти, като вземем предвид тяхното тегло и относителна устойчивост на корозия, се оказва, че днес в много случаи е много по-изгодно да се използва алуминий, отколкото стомана.
Алуминият е металът на третото хилядолетие. Издръжлив, здрав и лек, устойчив на корозия, деформация и влияния на околната среда, естетичен и лесен за поддръжка, алуминият е един от най-търсените метали в съвременната индустрия.
1. Физични и химични свойства на алуминия
В периодичната система на Д. И. Менделеев от 110 елемента 87 са метали. Те са в групи I, II, III, във вторични подгрупи на всички групи. Освен това металите са най-тежките елементи IV, V, VI и Група VII. Въпреки това, много метали са амфотерни и понякога могат да се държат като неметали.
Алуминият е елемент от III период от основната подгрупа на III група.
Означава се със символа Al (лат. Aluminium).
Принадлежи към семейството на р-елементите. Валентните електрони на алуминия са разположени на s- и p-поднивата на външния електронен слой. Има три от тези електрони, така че алуминият може да образува три валентни връзки, което е най-характерно за него. Следователно за алуминия обичайната степен на окисление е +3. В някои съединения има степени на окисление +2 и +1.
по цвят чист алуминийнапомня на среброто, той е много лек метал: неговата плътност е само 2,7 g/cm3. По-леки от алуминия са само алкални и алкалоземни метали (с изключение на барий), берилий и магнезий. Алуминият също се топи лесно - при 600 ° C (тънка алуминиева тел може да се стопи на обикновена кухненска горелка), но кипи само при 2452 ° C. По електропроводимост алуминият е на 4-то място, на второ място след среброто (той е на първо място), мед и злато, което, предвид евтиността на алуминия, е от голямо практическо значение. Топлопроводимостта на металите се променя в същия ред. Лесно е да се провери високата топлопроводимост на алуминия чрез потапяне на алуминиева лъжица в горещ чай. И още едно забележително свойство на този метал: неговата гладка, лъскава повърхност перфектно отразява светлината: от 80 до 93% във видимата област на спектъра, в зависимост от дължината на вълната. В ултравиолетовата област алуминият няма равен в това отношение и само в червения регион е малко по-нисък от среброто (в ултравиолетовия среброто има много ниска отражателна способност) ..............
Списък на използваната литература
1. Бердоносов С.С. Наръчник за ученици по химия. - М.: Аквариум, 2006. - 572 с.
2. Бушков Н.Н. Химия. Надбавка за абитуриентите. - М.: Кнорус, 2007. 455 с.
3. Давидянц А.П. Тринадесетият елемент // Икономика и живот. - 2002.- февр. (N 7). - С. 2-3.
4. Карапетянц М.Х. Генерал и неорганична химия: учебник за химик технолог. специалист. университети. - М.: Химия, 2006. - 592 с.
5. Стрелцов А. Крилат метал // Икономика и живот. - 2002.- февр. (N 7). - С. 1.
Страница 1
Алуминият е в основната подгрупа на група III. Разположението на енергийните нива е както следва:
3Al 2e-, 8e-, 3e-
Тъй като алуминиевите атоми имат 3 електрона на външното ниво, алуминият в съединенията показва степен на окисление 4-3.
Стигаме до същото заключение, водени от представите за естеството на движението на електроните в атомите и тяхното разположение не само в енергийни нива, но и в поднива. В алуминиевия атом 3s2 електроните лесно се разпадат и един електрон преминава през 3p орбитала:
Резултатът е три несдвоени електрона. Отговорете на въпрос 1.
Намиране на алуминий в природата, неговото производство и свойства
Алуминият е третият най-разпространен елемент в земната кора. Среща се само в съединения. Най-важните от тях са показани на фигура 19.
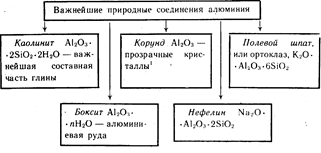
Цветни кристали Al2O3 с червен цвят - рубини, сини - сапфири.
Разписка
През 1827 г. немският химик Ф. Вьолер получава алуминий чрез нагряване на алуминиев хлорид с алкални метали с калий или натрий без въздух.
AlCl3 +3K 3KCl + Al
За промишленото производство на алуминий тези методи не са икономически изгодни, поради което е разработен електрохимичен метод за производство на алуминий от боксити.
Физически свойства
Алуминият е сребристо-бял метал, лек (r = 2,7 g/cm3), топи се при 660°C. Много е пластичен, лесно се изтегля в тел и се пече на листове и фолио. По електрическа проводимост алуминият е на второ място след среброто и медта (той е 2/3 от електрическата проводимост на медта).
Химични свойства
В серията на електрохимичното напрежение алуминият е поставен зад най-активните метали. От ежедневния опит обаче е известно, че алуминиевите продукти (съдове и др.) не се влияят нито от кислород, нито от вода, дори при температурата на кипене. Алуминият също не се влияе от концентрирана студена азотна киселина. Това се дължи на наличието на тънък оксиден филм върху алуминиевата повърхност, който я предпазва от по-нататъшно окисление. Ако повърхността на алуминия се натрие с живачна сол, тогава се получава следната реакция:
2А1 + 3HgCl2 ® 2А1С13 + 3Hg
Отделеният живак разтваря алуминия и се образува неговата сплав с живак - алуминиева амалгама. Филмът не се задържа върху амалгатираната повърхност, така че алуминият реагира с вода при нормални условия (фиг. 46):
2А1 + 6НОН ® 2А1(ОН)3¯ + 3Н2
При повишени температури алуминият реагира с много неметали и сложни вещества без сливане:

Приложение
Алуминият се използва за производството на различни сплави. Най-разпространени са дуралумините, съдържащи мед и магнезий, и силумините - сплави на алуминий със силиций. Основните предимства на тези сплави са лекота и висока якост. Споменатите сплави намират широко приложение в самолетостроенето, автомобилите, корабите и приборостроенето, в ракетната техника и в строителството. Под формата на чист метал алуминият се използва за производството на електрически проводници и различно химическо оборудване.
Алуминият се използва и за алуминиране, т.е. насищане на повърхностите на стоманени и чугунени продукти с алуминий, за да ги предпази от корозия.
На практика често се използва термит (смес от Fe3O4 оксид с алуминиев прах). Ако тази смес се запали (с помощта на магнезиева лента), тогава настъпва бурна реакция с отделяне на голямо количество топлина:
8Al + 3Fe3O4 ® 4Al2O3 + 9Fe
Този процес се използва при така нареченото термитно заваряване, както и за получаване на някои метали в свободна форма.
Отговорете на въпроси 2-6 (стр. 138). Решете задачи 1 - 2 (стр. 138).
Най-важните алуминиеви съединения
Алуминиев оксид
Al2O3 може да се получи по следните начини:
1. Прах за директно изгаряне метален алуминий(чрез издухване на алуминиев прах в пламъка на горелката):
4Al + 3O2 ® 2А12O3
2. Чрез трансформация съгласно схемата по-долу:
Алуминиевият оксид е твърдо, огнеупорно (температура пл. 2050 ° C) бяло вещество.
Според химичните си свойства той е амфотерен оксид (I, § 37). Реагира с киселини, проявява свойствата на основни оксиди:
A12O3 + 6HC1 2A1C13 + 3H2O
Al2O3 + 6H+ +6С1- 2Al3+ + 6С1- + 3Н2O
Актуализация за образованието:
Елементи III-A от групата на периодичната система
Алуминий Al (лат. Aluminium, от лат. alumen - стипца). Al - елемент от III група от 3-ти период периодична системаД. И. Менделеев, п. с. тринадесет, атомна маса 26.9815 има един стабилен изотоп 27Al (100%). Метален Al е получен през 1827 г. Wohler. Според съдържанието в земната кора (8,8%) Al заема ...
Диференциране на ниво на обучение въз основа на задължителни резултати
Тази технология предлага въвеждането на два стандарта: за образование (нивото, което училището трябва да предостави на заинтересован, способен и трудолюбив завършил) и стандарт за задължително общо образование (нивото, което всеки трябва да постигне). Пространството между нивата...
Системата на инженерното образование в САЩ
Като цяло Съединените щати са приели многоетапна система висше образование, според който обучението е разделено на няколко цикъла. Първата – бакалавърска – продължава четири години и завършва с бакалавърска степен. От първите две години студентите изучават общообразователни дисциплини, около ...
Цел на урока: да се създадат условия за учениците да изучават физичните и химичните свойства на алуминия въз основа на структурата на неговия атом.
Цели на урока:
1. Разгледайте алуминия като химичен елемент и просто вещество; затвърдете знанията за структурата на металите, техните общи физични и химични свойства, способността да се пишат уравнения химична реакция, прочетете ги, определете вида, разгледайте в светлината на представите за процесите на окисление и редукция.
2. Развивайте умствени операции на анализ, синтез, сравнение, както и логика, внимание и наблюдение.
3. Формиране на научен мироглед, способност за подход към решаването на ежедневни проблеми с научна точкавизия, прилагат своите знания.
Метод на обучение: проблемен.
Организационни форми: беседа, самостоятелна работа, практическа работа.
Учебни помагала: маршрутна карта, инструкции, химическо оборудване, таблици.
Демонстрационно оборудване: маси, демонстрационна стойка, алуминиева тел, железен пирон, епруветки с вода, спиртна лампа, кибрит, пластилин, източник на захранване, ключ, крушка.
Оборудване на ученическите маси: алуминий, разтвор на натриев хидроксид, солна киселина, поставка за епруветки, две епруветки с вода, съдържаща алуминиева тел и железен пирон, спиртна лампа, кибрит, държач за епруветки.
По време на занятията
I. Приблизително-мотивационен етап (мотивиране, актуализиране на знанията).
1. Въведениеучители. Поздравления.
- Момчета, сега ще ви прочета едно стихотворение, а вие го слушайте внимателно и назовете въпросния химичен елемент.
Артикулът е скрит в кутията
Не мога да обядвам без него.
Нещото е незаменимо.
Нещото е необходимо.
Ако седнем да ядем
Наистина се нуждаем от този артикул.
От какво е този артикул?
Сребристо бял цвят
Ще ви бъде позволено да отговорите.
- Каква е темата? (Правилно, за алуминиевата лъжица.)
- И така, момчета, темата на урока е „Алуминият: химичен елемент и просто вещество“.
Какво мислите, какво можете да научите за алуминия в урок?
2. Проверка на домашните.
Но преди да започнем да учим нов материал, нека си спомним какво научихте в предишния урок. И за това, моля, отговорете ми на следните въпроси (звездички за верния отговор).
1. Разкажете за позицията на желязото в D.I. Менделеев.
2. Запишете структурата на атома на желязото и неговата електронна конфигурация.
3. Нека да чуем кратки съобщения за съединенията на желязото.
4. Какви реагенти могат да се използват за определяне на йони на желязо Fe 2 + Fe 3 в разтвор? ( двувалентни и тривалентни.)
- Браво момчета! Усвоихте добре материала от последния урок. В края на урока ми покажи своите звезди. Да преминем към изучаването на нов материал. Всеки от нас има свой собствен адрес: това е улица, къща, апартамент. Химическите елементи също имат свой собствен „дом“. Как се нарича? какви "адреси" химични елементи? Днес ще се запознаем с един от "наемателите" на тази къща. И за това ще отидем на пътешествие, за да се запознаем с удивителен химичен елемент - алуминия и простото вещество, образувано от него. За да направите това, ще ви е необходима карта на маршрута.
II.
Оперативен и изпълнителен етап(научаване на нов материал)Запишете датата на нашето пътуване и темата на урока в маршрутната карта.
1) Вие сте на извиканата станция „Визитна карта на химичен елемент“. Задачата е индивидуална за всеки: намерете алуминий в PSCE и попълнете първата част от картата на маршрута. Времето за изпълнение е 3 минути, който пръв изпълни задачата правилно - звездичка. Нека проверим вашите бележки (моля, до черната дъска...).
Имахте ли затруднения при съставянето на диаграма на подреждането на електроните на алуминиев атом в атомни орбитали?
В първата схема няма трудности. И какво означава 2-ра схема: Al *. Когато един атом премине във възбудено състояние, електрон от подниво 3s преминава към свободна орбитала на подниво 3p. Тогава електронна формулапромени в атома на алуминия.
Какво е степента на окисление на алуминия? (+3)
- Какви свойства има този елемент - метални или неметални? ( метални.)
Какво просто вещество образува елемент, който има метални свойства? ( метални.)
Така че алуминият е метал. Вижте химичните елементи около алуминия в PSCE. Вляво от него са активни метали, вдясно - неметали.
- Направете заключение за активността на алуминия. (Ал - неактивен метал.)
Нека се обърнем към електрохимичния ред на напреженията на металите. Тук алуминият се намира непосредствено след активните метали, а зад него също са доста активни метали.
Каква е активността на алуминия? (Ал – активен метал.)
На масата ми има две чаши вода. Преди седмица във водата бяха поставени железен пирон и алуминиева тел.
– Какво виждаме? ( Желязото взаимодейства с вода, променя цвета си, но нищо не се случва с алуминиевата тел.)
- Погледнете отново електрохимичните серии от метални напрежения.
- Кой от металите - Al или Fe - е по-активен? ( Оказва се, чеАл.)
- Защо алуминиевата тел не реагира, а железният пирон взаимодейства с нея?
И така, алуминият активен метал ли е? - това е проблемът, който трябва да решим днес.
Тъй като информацията, получена на станция "Химичен елемент Виситка" не е достатъчна, за да се направи окончателно заключение за активността на алуминия, ще преминем към следващата станция - „Физични свойства на простото вещество“.
2) Сега трябва да работите по двойки. Вземете алуминиев проводник, разгледайте го, опитайте се да промените формата му.
И така неусетно се приближихме до втората станция от нашия маршрут, която се нарича „Физични свойства на простото вещество“.
Сега, момчета, трябва да работите по двойки с текста на учебника. Отворете учебника си на стр. 57 и прочетете само един параграф, който започва с думите „Алуминият е просто вещество“.
Въз основа на текста и житейския си опит опишете физическите свойства на алуминия и ги запишете. В случай на затруднение поставете въпросителен знак пред съответния имот с молив. (Който го направи първи - вдига ръка - за правилния отговор - звездичка.)
Алуминият се нарича „крилатият“ метал, тъй като поради своята лекота, здравина в сплавите и устойчивост на корозия се използва в производството на самолети и ракети.
Както вече казахте, алуминият все още има висока топлопроводимост. За да докажа топлопроводимостта на алуминия, ще демонстрирам експеримент. (Ще фиксирам хоризонтално алуминиева тел в крака на демонстрационния статив, към който ще закрепя два кибрита с пластилин. Ще нагрея края на жицата в пламъка на спиртна лампа. След време кибритите падат в завъртете.)
- Познанията, получени на тази станция, позволяват ли да направим извод за активността на алуминия? ( Не.)
3) Следващата станция от нашето пътуване е не по-малко интересна от предишната и се нарича „Химически свойства на простото вещество“.
По време на доста дълго спиране на тази гара ще преминете два етапа. На първия етап ще изучавате взаимодействието на алуминия с прости вещества, на втория - със сложни.
И така, първият етап. Съставете три уравнения за реакциите на алуминия с прости вещества с кислород, сяра и хлор и покажете промяната в степента на окисление на елементите. Попълнете таблицата в маршрутната карта.
(Тази реакция може да се наблюдава при изгаряне на искри и фойерверки - алуминиевият прах се запалва и изгаря с ослепителен пламък при силно нагряване.)
- Какво е алуминият в тези реакции - окислител или редуктор? ( Активен редуциращ агент.)
Всички тези реакции протичат при нагряване.
На втория етап изучаваме взаимодействието на алуминия със сложни вещества: солна киселина и разтвор на натриев хидроксид.
Момчета, взаимодейства ли алуминият с вода? Виждам, че се загубваш да отговориш на този въпрос.
– Възниква ли химическа реакция, когато наливате вода в алуминиева купа? Случва ли се нещо с алуминиевите електрически проводници, когато вали?
- Изброените продукти не се променят под въздействието на вода, тъй като алуминият е покрит със силен оксиден филм. Ако този филм се отстрани, алуминият ще реагира с вода (и някои прости вещества) дори при нормални условия.
Този филм може да бъде премахнат, тоест унищожен с шкурка или химически (например с алкален разтвор) или алуминиевата повърхност може да се разтрие с живачна сол, след което настъпва реакцията:
2Al + 3HqCl 2 –> AlCl 3 + 3Hq
Освободеният живак разтваря алуминия и образува неговата сплав с живак - алуминиева амалгама. Филмът не се задържа върху амалгатираната повърхност, така че алуминият реагира с вода при нормални условия:
2Al + 6HOH –> 2Al(OH) 3 + 3H 2
Алуминият се разтваря добре в разредени HCl и H2SO4 киселини. Но концентрираните H 2 SO 4 и HN0 3 киселините пасивират киселините, образувайки оксиден филм върху металната повърхност, тоест предотвратяват по-нататъшното протичане на реакцията. Следователно тези киселини се транспортират в алуминиеви резервоари.
Опит I. Взаимодействие на алуминия с разтвор на НС1 киселина.
Поставете две парчета алуминий и един ml в епруветка. киселинен разтвор. Ако не настъпи реакция, леко загрейте съдържанието на епруветката.
2Al + 6HCl \u003d 2AlO 3 + 3H 2
(2Al + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2)
Опит II. Взаимодействието на алуминия с алкален разтвор.
Поставете две парчета алуминий и един ml в епруветка. алкален разтвор. Ако не настъпи реакция, загрейте.
И в двата експеримента I и II реакциите не протичат веднага, въпреки че алуминият е активен метал, тъй като оксидният филм се намесва, тогава настъпва бурна реакция, тъй като филмът се разрушава.
(2Al + 2NaOH + 2H 2 O \u003d 2NaAlO 2 + 3H 2) - натриев алуминат
Направете схеми на уравнения на реакциите.
- Какъв извод може да се направи за активността на метала? ( активен метал.)
Алуминият е химически активен, може да реагира с неметали, вода, киселини.
Момчета, учените са доказали, че:
Алуминият ни причинява крампи
И паметта при хората намалява.
Той инхибира редица ензими
Особено хемопоетични центрове,
А деменцията е негова работа!
Защо тогава съдовете са направени от алуминий?
Излиза, че алуминиеви прибори не могат да се използват? Възможно е, тъй като какво се образува на повърхността му? Оксиден филм! Което предпазва алуминия от въздействието на факторите на околната среда. Само че в него е невъзможно да се приготвят киселинни и алкални храни, което означава, че картофите (които съдържат нишесте) могат.
За да започне алуминият да реагира, от повърхността му трябва да се отстрани оксиден филм. Понякога в алуминиеви тигани на дъното виждаме черни петна, оксидният филм е унищожен. Това е вид ястие, което не можете да използвате.
III. Първичен тест за овладяване на знанията.
Следваща спирка - "Избери задача". В рамките на 4 мин. трябва да изпълните една от трите задачи по ваш избор (по избор). Изберете само задачата, с която можете да се справите. (Вижте картата на маршрута.)
Попълнете уравнението на реакцията. Напишете го в пълна и съкратена йонна форма:
Al + HCl –> ... (вариант I);
Al + H 2 SO 4 –> ... (вариант II).
Напишете уравненията на реакцията в съответствие със схемата:
Al –> Al 2 O 3 –> Al (NO 3) 3 (вариант I);
Al –> AlCl 3 –> Al(NO 3) 3 (вариант II).
Определете неизвестното вещество и напишете уравненията на реакцията в съответствие със схемата:
Al –> ... –> Al(OH) 3 (вариант I);
Al –> ... –> AlCl 3 (вариант II).
IV.
Първична консолидация на знаниятаСтигнахте до последната станция. В тетрадките си се оказа референтен рефературок.
– Ако продължим пътуването си, кои станции ще трябва да посетите? ( „Намиране в природата“, „Получаване“, „Използване“.)
Алуминият е най-разпространеният метал в земната кора. Той представлява 8,8% от масата му. Въпреки това, индустриалният метод на неговото производство е открит сравнително наскоро. През 1886 г. младият американски инженер Чарлз Мартин Хол изтича до професор Ивет, държейки на протегнатата си длан 12 малки алуминиеви топки, получени за първи път чрез електролиза ...
Но вие ще изучавате този материал в следващия урок.
v.
Обобщаване на урока. ОтражениеДа се върнем към темата на днешния урок.
Какъв проблем поставихме в началото?
Успяхме ли да го решим?
- До какъв извод стигнахме?
Приложение
Елементи и атоми
В кръга на Менделеев,
Направи химията най-богата.
И най-креативната наука.
(Г. Санников)
Карта на маршрута
Цел: изучаване на положението на алуминия в периодичната система, структурата на атома на елемента, физичните и химичните свойства на простото вещество.
Станция 1. „Визитна картичка на химически елементи”
Време за паркиране 3 минути. Работейки поотделно, определете местоположението на елемента в периодичната система, съставете електронната формула на атома. Правете бележки:
алуминий
химичен елемент
химичен знак: атомна маса Ar(Al) =
сериен номер:
месечен цикъл:
група:
подгрупа-ред:
структура на атома:
електронна конфигурация:
проста материя
химична формула:
молекулно тегло Mr(Al) –
Станция 2. „Физични свойства на простото вещество”
Време за паркиране 5 минути. Работете по двойки. Запишете физичните свойства на веществото в маршрутната карта
Цвят:
агрегатно състояние:
пластмасов:
метален блясък:
топлопроводимост:
електропроводимост:
плътност:
температура на топене:
сплави:
Станция 3. “Химически свойства на простото вещество”
Време за паркиране 10 минути. Работейки в групи по 4, напишете уравнение за химичната реакция между алуминия и веществата. Направете свои собствени изводи. Напишете едно уравнение на химическа реакция в редокс форма. Покажете прехода на електроните.
Алуминиеви взаимодействия |
|
с прости вещества |
със сложни вещества Al –> A1 2 O 3 –> Al(HO 3) 3 (вариант I); Al –> AlCl 3 –> Al(HO 3) 3 (вариант II). Определете неизвестното вещество и напишете уравненията на реакцията в съответствие със схемата: Al –> ... –> Al(OH) 3 (вариант I); Al –> ... –> AlCl 3 (вариант II). Благодаря ви за вашата работа! Вашият домашна работа. Въз основа на материала от учебника и справочните бележки напишете история на тази тема „Трябва ли да използвам алуминиеви съдове за готвене?“. Дайте аргументи за и против. |


