Po raz pierwszy metaliczne aluminium został otrzymany chemicznie przez niemieckiego chemika F. Wöhlera w 1821 r. (redukcja z chlorku glinu metalicznym potasem po podgrzaniu). W 1854 roku francuski naukowiec Saint-Clair Deville zaproponował elektrochemiczną metodę wytwarzania aluminium poprzez redukcję podwójnego chlorku glinowo-sodowego sodem.
Produkcja i produkcja aluminium
Aluminium metaliczne pozyskiwane jest w trzech etapach:
- Otrzymywanie tlenku glinu (Al 2 O 3) z rud aluminium;
- Otrzymywanie aluminium z tlenku glinu;
- rafinacja aluminium.
Zdobywanie tlenku glinu
Około 95% całego tlenku glinu uzyskuje się z rud boksytu.
Boksyt(Francuski boksyt) (od nazwy obszaru Baux na południu Francji) - ruda glinu, składająca się z wodorotlenków glinu, tlenków żelaza i krzemu, surowców do produkcji tlenku glinu i materiałów ogniotrwałych zawierających tlenek glinu. Zawartość tlenku glinu w komercyjnych boksytach waha się od 40% do 60% i więcej. Jest również stosowany jako topnik w metalurgii żelaza.
Zdjęcie 1 - Ruda boksytu
Zazwyczaj boksyt jest ziemistą, gliniastą masą, która może mieć teksturę w postaci pasm, pizolitu (podobną do groszku) lub jednolitą. W normalnych warunkach atmosferycznych skalenie (minerały, które tworzą) bardzo skorupa Ziemska i będące glinokrzemianami) rozkładają się z utworzeniem iłów, ale w gorącym klimacie i dużej wilgotności końcowym produktem ich rozkładu może okazać się boksyt, gdyż takie środowisko sprzyja usuwaniu zasad i krzemionki, zwłaszcza z syenitów czy gabro. Boksyty są przetwarzane na aluminium etapami: najpierw otrzymuje się tlenek glinu (tlenek glinu), a następnie aluminium metaliczne (elektrolitycznie w obecności kriolitu).
Głównymi zanieczyszczeniami boksytów są Fe 2 O 3 , SiO 2 , TiO 2 . Drobne zanieczyszczenia boksytów to: Na 2 O, K 2 O, CaO, MgO, pierwiastki ziem rzadkich, Cr, P, V, F, związki organiczne.
Zazwyczaj boksyty są klasyfikowane:
- według koloru;
- przez główny minerał (częściej są mieszane);
- przez wiek.
Główne kryteria cechy rudy aluminium są:
- Moduł krzemowy (Msi = Al 2 O 3 /SiO 2 (% wag.)). Im większy moduł krzemowy, tym lepsza jakość(Msi = 7);
- Zawartość żelaza w przeliczeniu na Fe 2 O 3 . Jeśli zawartość Fe2O3 wynosi około 18% wag., wówczas boksyt jest uważany za bogaty w żelazo. Im większa zawartość żelaza, tym trudniej wydobywać boksyty;
- Zawartość siarki. Obecność dużej ilości siarki komplikuje przetwarzanie boksytu;
- Zawartość węglanów w przeliczeniu na CO 3 (2-) . Obecność dużej ilości węglanów komplikuje przetwarzanie boksytu.
Stosowane są boksyty:
- w produkcji tlenku glinu;
- w produkcji materiałów ściernych;
- w produkcji materiałów ogniotrwałych;
- jako topnik do wytapiania stali martenowskich;
- do suszenia gazów i oczyszczania oleju z siarki;
- jako barwnik.
Do chwili obecnej głównymi dostawcami boksytu są:
- Australia - są też ogromne złoża Fe, Au, U, Ni, Co, Cu itp. Bardziej opłaca się kupować surowce z Australii niż przerabiać własne.
- Gwinea - Rosja ma kilka zakupionych miejsc.
- Ameryka Środkowa: Gujana, Jamajka, Suriman.
- Brazylia.
W Europie wszystkie złoża są wyczerpane. Boksyty sprowadzane są z Grecji, ale surowiec ten jest kiepskiej jakości.

Rysunek 2 - Rezerwy boksytu na świecie
Poniżej znajdują się główne złoża rud aluminium w Rosji.
- Pierwsze złoże odkryto w 1914 roku pod Petersburgiem, w pobliżu miasta Tichwin. Na tym polu wybudowano 6 zakładów. Największa to fabryka aluminium Volkhov. Do tej pory złoże Tichwinskoje jest wyczerpane i działa głównie na importowanych surowcach.
- W 1931 r. odkryto unikalne złoże boksytu o wysokiej jakości (SUBR) Severo-Uralskoye. Służył jako podstawa do budowy w 1939 r. Uralskiej fabryki aluminium (UAZ). A na bazie kopalni boksytu Południowego Uralu (YUBR) zbudowano hutę aluminium Bogosłowski (BAZ).
- Pole Severoonezhskoye znajduje się na drodze na Półwysep Kolski. Jest w planie, ale data budowy nie jest znana.
- Złoże Vislovskoe jest złożem czystej gliny typu kaolitu. Nie używany do tlenku glinu.
- Pole Timanskoye (Republika Komi, Varkuta). Kanadyjczycy są zainteresowani tą dziedziną, więc planują budowę fabryk (Komi Sual jest spółką holdingową).
Otrzymywanie tlenku glinu z rud boksytu
Ponieważ aluminium jest amfoteryczne, tlenek glinu jest wytwarzany na trzy sposoby:
- alkaliczny,
- kwas;
- elektrolityczny.
Najbardziej rozpowszechniona jest metoda alkaliczna (metoda K. I. Bayera, opracowana w Rosji pod koniec ubiegłego wieku i stosowana do przetwarzania wysokogatunkowych boksytów z niewielką ilością (do 5–6%) krzemionki). Od tego czasu wdrożenie techniczne został znacznie ulepszony. Schemat produkcji tlenku glinu metodą Bayera przedstawiono na rysunku 3.
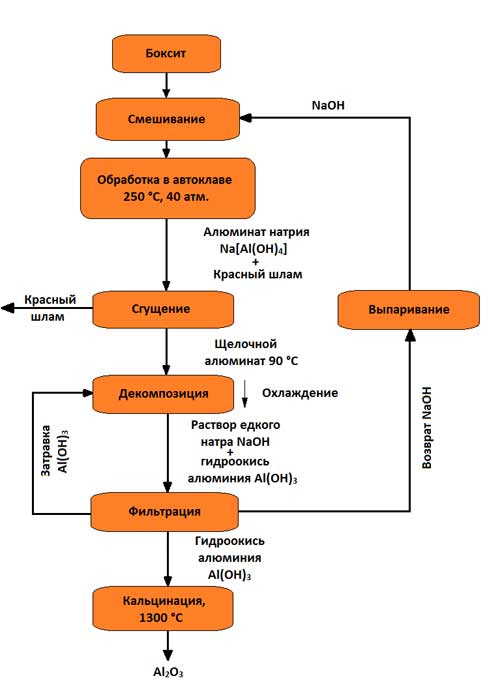
Rysunek 3 - Schemat otrzymywania tlenku glinu metodą Bayera
Istota metody polega na tym, że roztwory glinu ulegają szybkiemu rozkładowi po wprowadzeniu do nich wodorotlenku glinu, a roztwór pozostały z rozkładu po jego odparowaniu w warunkach intensywnego mieszania w temperaturze 169–170 °C może ponownie rozpuszczać tlenek glinu zawarty w boksytach. Ta metoda składa się z następujących głównych operacji:
1. Przygotowanie boksytu polegające na jego kruszeniu i mieleniu w młynach; młyny są dostarczane z boksytem, ługiem kaustycznym i nie duża liczba wapno, które poprawia przydział Al 2 O 3 ; otrzymana miazga jest podawana do ługowania;
2. Ługowanie boksytu (w ostatnie czasy dotychczas stosowane okrągłe bloki autoklawowe zostały częściowo zastąpione autoklawami rurowymi, w których ługowanie następuje w temperaturach 230–250 °C (500–520 K), co polega na jego chemicznym rozkładzie w wyniku oddziaływania z roztwór wodny zasady; hydraty tlenku glinu podczas interakcji z alkaliami przechodzą do roztworu w postaci glinianu sodu:
AlOOH+NaOH→NaAlO2 +H2O
Al(OH)3 +NaOH→NaAlO2+2H2O;
SiO2 +2NaOH→Na2SiO3 +H2O;
w roztworze glinian sodu i krzemian sodu tworzą nierozpuszczalny glinokrzemian sodu; tlenki tytanu i żelaza przechodzą do nierozpuszczalnej pozostałości, nadając pozostałości czerwony kolor; ta pozostałość nazywana jest czerwonym błotem. Po zakończeniu rozpuszczania powstały glinian sodu rozcieńcza się wodnym roztworem zasady, jednocześnie obniżając temperaturę o 100 ° C;
3. Oddzielanie roztworu glinianu od czerwonego szlamu, zwykle przeprowadzane przez płukanie w specjalnych zagęszczaczach; w wyniku tego czerwone błoto osiada, a roztwór glinianu jest spuszczany, a następnie filtrowany (klarowany). W ograniczonych ilościach osad stosowany jest np. jako dodatek do cementu. W zależności od gatunku boksytu na 1 tonę wytworzonego tlenku glinu przypada 0,6 - 1,0 tony czerwonego błota (suchej pozostałości);
4. Rozkład roztworu glinianu. Jest filtrowany i pompowany do dużych pojemników z mieszadłami (rozkładnikami). Wodorotlenek glinu Al(OH) 3 ekstrahuje się z przesyconego roztworu po ochłodzeniu do 60°C (330 K) i ciągłym mieszaniu. Ponieważ proces ten przebiega powoli i nierównomiernie, a tworzenie i wzrost kryształów wodorotlenku glinu mają bardzo ważne w trakcie jego dalszej obróbki do rozkładników dodaje się dużą ilość wodorotlenku stałego - nasiona:
Na2O Al2O3 + 4H2O→Al(OH)3 + 2NaOH;
5. Przydział wodorotlenku glinu i jego klasyfikacja; dzieje się tak w hydrocyklonach i filtrach próżniowych, gdzie od roztworu glinianu oddziela się osad zawierający 50 - 60% cząstek Al(OH) 3 . Znaczna część wodorotlenku wraca do procesu rozkładu jako materiał siewny, który pozostaje w obiegu w niezmienionych ilościach. Pozostałość po przemyciu wodą przechodzi do kalcynacji; filtrat jest również zawracany do obiegu (po zatężeniu w wyparkach - w celu wypłukania nowych boksytów);
6. Odwodnienie wodorotlenku glinu (kalcynacja); jest to ostatnia operacja produkcji tlenku glinu; odbywa się w rurowych piecach obrotowych, a ostatnio także w piecach z turbulentnym ruchem materiału w temperaturze 1150 - 1300 °C; surowy wodorotlenek glinu przechodzący przez piec obrotowy, suszony i odwadniany; po podgrzaniu następują kolejno następujące przekształcenia strukturalne:
Al(OH) 3 → AlOOH → γ-Al 2 O 3 → α-Al 2 O 3
200 °C - 950 °C - 1200 °C.
Końcowy kalcynowany tlenek glinu zawiera 30-50% α-Al2O3 (korund), reszta to γ-Al2O2.
Ta metoda ekstrahuje 85 - 87% całego wytworzonego tlenku glinu. Powstały tlenek glinu jest mocny związek chemiczny o temperaturze topnienia 2050 ° C.
Otrzymywanie aluminium przez elektrolizę
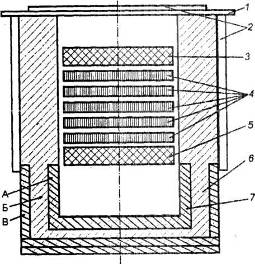
Elektrolityczna redukcja tlenku glinu rozpuszczonego w stopie na bazie kriolitu jest przeprowadzana w temperaturze 950-970 °C w ogniwie elektrolitycznym. Elektrolizer składa się z wanny wyłożonej blokami węglowymi, na dnie której a Elektryczność. Płynne aluminium uwalniane na dnie pełniące funkcję katody jest cięższe niż stopiona sól elektrolityczna, dlatego jest gromadzone na podłożu węglowym, skąd jest okresowo wypompowywane (rys. 4). Od góry w elektrolicie zanurzone są anody węglowe, które spalają się w atmosferze tlenu uwalnianego z tlenku glinu, uwalniając tlenek węgla (CO) lub dwutlenek węgla (CO 2). W praktyce stosuje się dwa rodzaje anod:
- samopieczelne anody Zederberg, składające się z brykietów, tzw. „chlebów” masy Zederberg (węgiel niskopopiołowy o zawartości 25-35% paku smołowego), upchanych w aluminiowej osłonie; pod działaniem wysokiej temperatury masa anodowa jest wypalana (spiekana);
- wypalane lub „ciągłe” anody wykonane z dużych bloków węglowych (na przykład 1900 × 600 × 500 mm, ważące około 1,1 tony).

Rysunek 4 - Schemat elektrolizera
Natężenie prądu na elektrolizerach wynosi 150 000 A. Są one połączone szeregowo z siecią, tj. Uzyskuje się układ (szereg) - długi rząd elektrolizerów.
Napięcie robocze na kąpieli, które wynosi 4-5 V, jest znacznie wyższe niż napięcie, przy którym rozkłada się tlenek glinu, ponieważ straty napięcia w procesie są nieuniknione. różne części systemy. Bilans surowców i energii po otrzymaniu 1 tony aluminium przedstawiono na rysunku 5.
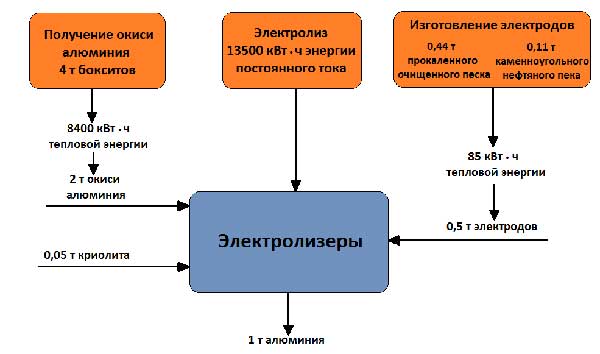
Rysunek 5 - Bilans surowców i energii przy produkcji 1 tony aluminium
W naczyniu reakcyjnym tlenek glinu jest najpierw przekształcany w chlorek glinu. Następnie w szczelnie izolowanej kąpieli zachodzi elektroliza AlCl 3 rozpuszczonego w stopionych solach KCl, NaCl. Uwolniony w tym procesie chlor jest odsysany i kierowany do recyklingu; aluminium osadza się na katodzie.
Zaletami tej metody w stosunku do istniejącej elektrolizy ciekłego stopionego kriolit-tlenek glinu (Al 2 O 3 , Na 3 AlF 6 rozpuszczony w kriolicie) są: oszczędność do 30% energii; możliwość zastosowania tlenku glinu, który nie nadaje się do tradycyjnej elektrolizy (np. Al 2 O 3 o wysokiej zawartości krzemu); zastąpienie drogiego kriolitu tańszymi solami; eliminacja niebezpieczeństwa emisji fluorków.
Uzyskanie rafinowanego aluminium
W przypadku aluminium rafinacja elektrolizy z rozkładem wodnych roztworów soli nie jest możliwa. Ponieważ dla niektórych celów stopień oczyszczenia aluminium przemysłowego (Al 99,5 - Al 99,8), otrzymanego przez elektrolizę stopionego kriolit-tlenku glinu, jest niewystarczający, nawet czystsze aluminium (Al 99,99 R) otrzymuje się z aluminium przemysłowego lub odpadów metalowych przez rafinację . Najbardziej znaną metodą rafinacji jest elektroliza trójwarstwowa.
Rafinacja przez trójwarstwową elektrolizę
Wyłożona blachą stalową, działająca na prąd stały (rys. 6), kąpiel rafinacyjna składa się z paleniska węglowego z przewodami prądowymi i termoizolacyjnej wykładziny magnezytowej. W przeciwieństwie do elektrolizy stopionego kriolit-tlenek glinu, anoda jest tutaj z reguły roztopionym metalem rafinowanym (dolna warstwa anody). Elektrolit składa się z czystych fluorków lub mieszaniny chlorku baru oraz fluorków glinu i sodu (warstwa środkowa). Aluminium rozpuszczające się z warstwy anodowej w elektrolicie uwalnia się nad elektrolitem (górna warstwa katodowa). Czysty metal służy jako katoda. Prąd dostarczany jest do warstwy katodowej przez elektrodę grafitową.

Rysunek 6 - Schemat ogniwa elektrolitycznego z przednim paleniskiem do rafinacji aluminium (według Fuldy - Ginzberga)
1 - stop aluminium; 2 – elektrolit; 3 - aluminium rafinowane wysokiej częstotliwości; 4 – katoda grafitowa; 5 - ściana magnezytowa; 6 - przedni klakson; 7 - warstwa izolacyjna; 8 - izolacja boczna; 9 - palenisko węglowe; 10 – przewód anodowy; 11 - izolacja paleniska; 12 - żelazne pudełko; 13 - okładka
Kąpiel pracuje w temperaturze 750 - 800°C, pobór mocy to 20 kWh na 1 kg czyste aluminium, tj. nieco wyższy niż w konwencjonalnej elektrolizie aluminium.
Metal anodowy zawiera 25-35% Cu; 7 – 12% Zn; 6 – 9% Si; do 5% Fe i niewielka ilość manganu, niklu, ołowiu i cyny, reszta (40 - 55%) to aluminium. Wszystkie metale ciężkie i krzem pozostają w warstwie anodowej podczas rafinacji. Obecność magnezu w elektrolicie prowadzi do niepożądanych zmian w składzie elektrolitu lub do jego silnego żużlowania. Aby usunąć magnez, żużle zawierające magnez poddaje się działaniu topników lub gazowego chloru.
W wyniku rafinacji otrzymuje się czyste aluminium (99,99%) oraz produkty segregacji (produkt Zigera), które zawierają metale ciężkie i krzem i są izolowane w postaci roztworu alkalicznego oraz krystalicznej pozostałości. Roztwór alkaliczny jest odpadem, a stałą pozostałość wykorzystuje się do odkwaszania.
Rafinowane aluminium ma zwykle następujący skład, %: Fe 0,0005 - 0,002; Si 0,002 - 0,005; Cu 0,0005 - 0,002; Zn 0,0005 - 0,002; ślady magnezu; Odpocznij.
Rafinowane aluminium jest przetwarzane na półprodukt o określonym składzie lub stapiany z magnezem (tabela 1).
Tabela 1 - Skład chemiczny aluminium o wysokiej czystości i aluminium pierwotne wg DIN 1712 arkusz 1
|
Dopuszczalne zanieczyszczenia*, % |
||||||||
|
łącznie z |
||||||||
* O ile to możliwe do ustalenia konwencjonalne metody Badania.
** Czyste aluminium dla elektrotechniki (przewody aluminiowe) dostarczane jest w postaci aluminium pierwotnego 99,5 zawierającego nie więcej niż 0,03% (Ti + Cr + V + Mn); oznaczony w tym przypadku jako E-A1, numer materiału 3.0256. Poza tym jest zgodny z VDE-0202.
Rafinacja za pomocą kompleksowych związków glinoorganicznych i topienie stref
Aluminium o wyższej klasie czystości A1 99,99 R można otrzymać przez rafinację elektrolizy czystego lub komercyjnie czystego aluminium przy użyciu złożonych związków glinoorganicznych aluminium jako elektrolitu. Elektroliza zachodzi w temperaturze około 1000°C pomiędzy stałymi elektrodami aluminiowymi i jest zasadniczo podobna do elektrolizy rafinacji miedzi. Charakter elektrolitu dyktuje potrzebę pracy bez powietrza i przy niskiej gęstości prądu.
Ten rodzaj elektrolizy rafinacyjnej, stosowany początkowo tylko w skali laboratoryjnej, jest już przeprowadzany na małą skalę przemysłową – rocznie produkuje się kilka ton metalu. Nominalny stopień oczyszczenia powstałego metalu wynosi 99,999 -99,9999%. Potencjalne obszary zastosowań metalu o tej czystości to kriogeniczna elektrotechnika i elektronika.
Możliwe jest zastosowanie rozważanej metody rafinacji w galwanotechnice.
Nawet więcej wysoka czystość- nominalnie do A1 99,99999 - można uzyskać przez kolejne strefowe topienie metalu. Przetwarzając aluminium o wysokiej czystości w półprodukt, blachę lub drut, należy, biorąc pod uwagę niską temperaturę rekrystalizacji metalu, podjąć szczególne środki ostrożności. Niezwykłą właściwością rafinowanego metalu jest jego wysoka przewodność elektryczna w zakresie temperatur kriogenicznych.
Wstęp
Aluminium jest najważniejszym metalem, wielkość jego produkcji znacznie przewyższa produkcję wszystkich innych metali nieżelaznych i ustępuje jedynie produkcji stali. Wysokie tempo wzrostu produkcji aluminium wynika z jego unikatowości fizyczne i chemiczne właściwości dzięki czemu znalazł szerokie zastosowanie w elektrotechnice, budowie samolotów i samochodów, transporcie, AGD, budownictwie, opakowaniach produkty żywieniowe itp.
Przemysł aluminiowy Rosji, stworzony w czas sowiecki, zajmuje dominującą pozycję w produkcji metali nieżelaznych w kraju i zajmuje drugie miejsce na świecie pod względem produkcji metali. W ostatnie lata, z racji znane przyczyny, sprzęt do produkcji aluminium praktycznie nie jest modernizowany, technologia elektrolizy nie jest ulepszana, ilość badań naukowych jest niedopuszczalnie zmniejszona i wyraźnie pozostaje w tyle za krajami rozwiniętymi. Jednocześnie za granicą sprzęt jest intensywnie modernizowany, doskonalona jest technologia, co pozwoliło na gwałtowny wzrost wydajność ekonomiczna i bezpieczeństwa ekologicznego produkcji aluminium.
Ostatnio inżynieria mechaniczna coraz częściej wymaga metali lekkich, zwłaszcza w przemyśle lotniczym i transporcie kolejowym. Dlatego duże znaczenie ma rozwój nowych i bardziej ekonomicznych metod pozyskiwania aluminium oraz doskonalenie istniejących metod.
1. Historia rozwoju przemysłu aluminiowego
Obecnie aluminium zajmuje pierwsze miejsce wśród metali nieżelaznych pod względem wielkości produkcji, a jego produkcja stale się rozwija.
Historycznie pierwsze wzmianki o metalicznym aluminium miały miejsce w pismach rzymskich z pierwszego wieku. W słynna encyklopedia„Historia naturalis” można znaleźć w następującej historii. Pewnego dnia rzymski jubiler mógł pokazać cesarzowi Tyberiuszowi talerz obiadowy wykonany z nowego metalu. Talerz był bardzo lekki i lśnił jak srebro. Jubiler powiedział cesarzowi, że wydobył metal ze zwykłej gliny. Zapewnił też cesarza, że tylko on i bogowie wiedzą, jak wydobyć metal z gliny. Cesarz był bardzo zainteresowany. Jednak natychmiast zdał sobie sprawę, że cały jego skarbiec, składający się ze złota i srebra, popadnie w ruinę, jeśli ludzie zaczną wytwarzać ten lekki metal z gliny. Dlatego zamiast nagrody oczekiwanej przez jubilera został ścięty.
Nie wiadomo na ile prawdziwa jest ta historia, ale opisywane wydarzenia miały miejsce 2000 lat przed odkryciem przez ludzkość metody produkcji aluminium. Stało się to w 1825 roku, kiedy duński fizyk H. Oersted uzyskał kilka miligramów metalicznego glinu w wyniku termicznej redukcji chlorku glinu amalgamatem potasu.
Znaczne trudności w pozyskaniu aluminium powstały ze względu na następujące czynniki:
Wysokie powinowactwo aluminium do tlenu. Aluminium można redukować tlenkiem węgla w temperaturze około 2000°C. Jednak już w 1200°C węgiel oddziałuje z aluminium, dając węglik;
Wysoki potencjał elektrochemiczny aluminium (-1,67V). Niemożliwe jest uzyskanie glinu z roztworów wodnych, ponieważ proces wydzielania wodoru (rozkład wody) praktycznie zachodzi na katodzie;
Wysoka temperatura topnienia tlenku glinu (2050°C), co wyklucza możliwość elektrolizy stopionego tlenku glinu.
Przemysłowa produkcja aluminium kojarzy się z nazwiskiem Francuza Henri Saint-Clair Deville. Doskonale zdawał sobie sprawę z eksperymentów G. Oersteda i innego naukowca, F. Wehlera, któremu w 1827 roku udało się wyizolować ziarna aluminium. Powodem niepowodzenia F. Wöhlera było to, że ziarna te w powietrzu zostały natychmiast pokryte najcieńszą warstwą tlenku glinu.
Przede wszystkim A.S.-K. Deville w procesie pozyskiwania metalu zastępuje potas tańszym sodem i przeprowadza na dużą skalę eksperymenty laboratoryjne. Powstały chlorek glinu został załadowany do dużej stalowej rury, w której naczynia wypełnione metaliczny sód. Podczas ogrzewania chlorek glinu oddziaływał z sodem w fazie gazowej i cząstki glinu osadzały się na dnie probówki. Ziarna powstałe w wyniku reakcji starannie zebrano, przetopiono i otrzymano wlewki metalowe.
Nowy sposób produkcji aluminium okazał się bardzo pracochłonny. Ponadto oddziaływanie par chlorku glinu z sodem często przebiega z wybuchem. W warunkach laboratoryjnych nie stanowiło to poważnego zagrożenia, ale w warunkach fabrycznych mogło spowodować katastrofę. ZAPYTAĆ. Deville zastąpił chlorek glinu mieszaniną AlCl3 z NaCl. Teraz uczestnicy reakcji byli w stanie stopionym. Eksplozje ustały, ale co najważniejsze, zamiast małych metalowych kulek, które trzeba było zbierać ręcznie, dostały znaczną ilość płynnego aluminium.
Eksperymenty w zakładzie Javel zakończyły się sukcesem. W 1855 r. uzyskano pierwszy wlewek metalu o wadze 6–8 kg.
Pałeczkę produkcji aluminium metodami chemicznymi kontynuował rosyjski naukowiec N. N. Beketov. Przeprowadził reakcję interakcji między kriolitem (Na 3 AlF 6) a magnezem. Metoda N. N. Beketova niewiele różniła się od metody A.S.-K. Deville, ale było łatwiej. W niemieckim mieście Gmelingem w 1885 r. wybudowano fabrykę metodą N. N. Beketowa, w której w ciągu pięciu lat uzyskano 58 ton aluminium - ponad jedną czwartą całej światowej produkcji metali środkami chemicznymi w okresie od 1854 r. do 1890 roku.
Pozyskiwanie aluminium środkami chemicznymi nie mogło zapewnić przemysłowi taniego metalu. Był nieproduktywny i nie dawał czystego aluminium bez zanieczyszczeń. To sprawiło, że badacze różnych krajówświat w poszukiwaniu nowych sposobów produkcji aluminium.
Z pomocą naukowcom przyszedł prąd elektryczny. W 1808 roku G. Davy próbował rozłożyć tlenek glinu za pomocą potężnej baterii elektrycznej, ale bezskutecznie. Prawie 50 lat później R. Bunsen i A.S.-K. Deville niezależnie przeprowadził elektrolizę mieszaniny chlorków glinu i sodu. Mieli więcej szczęścia niż ich poprzednicy i udało im się uzyskać małe kropelki aluminium. Jednak w tamtych czasach wciąż nie było tanich i wystarczająco mocnych źródeł energii elektrycznej. Dlatego elektroliza aluminium miała jedynie znaczenie teoretyczne.
W 1867 wynaleziono dynamo i wkrótce nauczyli się przesyłać prąd na duże odległości. Elektryczność zaczęła atakować przemysł.
W 1886 roku P. Héroult we Francji i C. Hall w USA niemal równocześnie położyły podwaliny pod nowoczesną metodę produkcji aluminium, proponując otrzymanie go przez elektrolizę tlenku glinu rozpuszczonego w stopionym kriolicie (metoda Halla-Héraulta). Od teraz nowy sposób produkcja aluminium zaczyna się szybko rozwijać, czemu sprzyjała poprawa elektrotechniki, a także opracowanie metod pozyskiwania tlenku glinu z rud aluminium. Znaczący wkład w rozwój produkcji tlenku glinu wnieśli rosyjscy naukowcy K. I. Bayer, D. A. Penyakov, A. N. Kuznetsov, E. I. Zhukovsky, A. A. Yakovkin i inni Carska Rosja nie miała własnego przemysłu aluminiowego. Jednak pierwsze badania teoretyczne w dziedzinie elektrolizy aluminium należały do wybitnego rosyjskiego naukowca, twórcy elektrometalurgii metali nieżelaznych w naszym kraju, prof. P.P. Fedotiew. W 1912 wraz z V.P. Ilyinsky opublikował pracę „Experimental; Research on the Electrometalurgia of Aluminium”, która została natychmiast przetłumaczona na wiele języków. języki obce i stał się podręcznikiem dla metalurgów na całym świecie. P.P. Fedotiew i Ilyinsky w St. Petersburg Polytechnic Institute (St. Petersburg State Technical University) przeprowadzili dokładne badania nad wyborem optymalnego składu elektrolitu, a także dowiedzieli się, jak rozpuszczalność tlenku glinu w kriolicie i temperatura krystalizacji dodatku fluorków sodu, glinu i wapnia.
28 marca 1929 r. W gazecie Leningradskaja Prawda opublikowano artykuł, w którym podano, że z jednej kąpieli po raz pierwszy uzyskano 8 kg metalicznego aluminium w zakładzie pilotażowym zakładu Krasny Wyborżec. To był początek naszej branży aluminiowej.
W 1931 Instytut Badawczy Przemysłu Aluminium-Magnez (VAMI) został zorganizowany w 1932 roku. Wołchowski został uruchomiony, aw 1933 roku. - Zakłady aluminiowe Dnipro. Od tego czasu przemysł aluminiowy zaczął kwitnąć w różnych częściach kraju.
2. Podstawy elektrolizy stopów kriolit-tlenek glinu
Elektroliza stopów kriolit-tlenek glinu jest główną metodą otrzymywania aluminium, chociaż niektóre stopy aluminium wytwarzany w procesie elektrotermicznym.
Pierwsze elektrolizery przemysłowe były przystosowane do prądów do 0,6 kA, aw ciągu następnych 100 lat wzrosła do 300 kA. Nie przyniosło to jednak istotnych zmian w podstawach procesu produkcyjnego.
Ogólny schemat produkcji aluminium pokazano na ryc. 2.1. Główną jednostką jest elektrolizer. Elektrolit to stopiony kriolit z niewielkim nadmiarem fluorku glinu, w którym rozpuszcza się tlenek glinu. Proces prowadzi się przy różnych stężeniach tlenku glinu od około 1 do 8% (wag.). Od góry anoda węglowa jest opuszczana do kąpieli, częściowo zanurzona w elektrolicie. Istnieją dwa główne rodzaje anod protektorowych: samopieczone i wstępnie wypiekane. Te pierwsze wykorzystują ciepło elektrolizy do prażenia masy anodowej, która składa się z mieszaniny koksu wypełniacza i spoiwa, paku. Wypiekane anody są wstępnie upieczoną mieszanką koksu i spoiwa smołowego. Technologia produkcji masy anodowej i anod wypalanych jest szczegółowo opisana w literaturze (patrz np.).
Ryż. 2.1. Schemat produkcji aluminium z tlenku glinu.
Stopione aluminium w temperaturze elektrolizy (950-960°C) jest cięższe od elektrolitu i znajduje się na dnie elektrolizera. Stopiony kriolit-tlenek glinu jest bardzo agresywny, czemu mogą przeciwdziałać materiały węglowe i niektóre nowe materiały. Z nich wykonana jest wewnętrzna wyściółka elektrolizera.
Aby przekonwertować AC na DC włączone nowoczesne fabryki stosowane są prostowniki półprzewodnikowe o napięciu 850V i współczynniku konwersji 98,5%, instalowane w krzemowej podstacji przekształtnikowej (KPP). Jedna jednostka prostownikowa daje prąd do 63 kA. Liczba takich jednostek zależy od wymaganej siły prądu, ponieważ wszystkie są połączone równolegle.
Proces zachodzący w elektrolizerze polega na elektrolitycznym rozkładzie tlenku glinu rozpuszczonego w elektrolicie. Aluminium jest uwalniane na płynnej katodzie aluminiowej, która jest okresowo wylewana za pomocą kadzi próżniowej i przesyłana do odlewni w celu zalania lub mieszalnika, gdzie w zależności od dalszego przeznaczenia metalu, stopy z krzemem, magnezem, manganem, miedzią są przygotowywane lub przeprowadzana jest rafinacja. Na anodzie węgiel jest utleniany przez uwolniony tlen. Gaz anodowy jest mieszaniną CO 2 i CO.
Elektrolizery są zwykle wyposażone w schrony usuwające spaliny oraz system czyszczenia. Zmniejsza to uwalnianie szkodliwych substancji do atmosfery. Proces technologiczny wymaga hermetycznego uszczelnienia schronu, aby zapewnić zasysanie gazu do kolektora za pomocą wentylatorów. W gazach usuwanych z elektrolizerów dominuje dwutlenek węgla (większość tlenku węgla jest spalana albo nad elektrolitem lub w specjalnych palnikach za dzwonem zbiorczym gazu), azot, tlen, fluorki gazowe i stałe oraz cząstki pyłu glinowego. Do ich usuwania i przywracania do procesu wykorzystywane są różne schematy technologiczne.
Nowoczesne elektrolizery wyposażone są w automatyczny system podawania tlenku glinu (AAF) z czasem ładowania 10–30 min.
Całą reakcję zachodzącą w elektrolizerze można przedstawić równaniem
Tak więc teoretycznie do procesu elektrolizy zużywany jest tlenek glinu i węgiel anodowy, a także energia elektryczna niezbędna nie tylko do realizacji procesu elektrolitycznego - rozkładu tlenku glinu, ale także do utrzymania wysokiej temperatury pracy. W praktyce zużywana jest również pewna ilość soli fluorkowych, które odparowują i są wchłaniane przez wyściółkę. Aby uzyskać 1 tonę aluminium potrzebujesz:
Produkcja aluminium jest jednym z najbardziej energochłonnych procesów, dlatego huty aluminium budowane są blisko źródeł energii.
Wszystkie materiały wchodzące do elektrolizy muszą mieć: minimalna ilość zanieczyszczenia bardziej elektrododatnie niż aluminium (żelazo, krzem, miedź itp.), ponieważ zanieczyszczenia te prawie całkowicie przechodzą do metalu podczas elektrolizy.
3. Alternatywne sposoby pozyskiwania aluminium
Przemysłowa metoda wytwarzania aluminium przez elektrolizę stopów kriolit-tlenek glinu, pomimo jej długotrwałego stosowania, ma szereg znaczące niedociągnięcia: wysokie jednostkowe zużycie energii, niskie jednostkowe usuwanie metalu i żywotność elektrolizerów, wysokie koszty pracy i kapitału, uwalnianie szkodliwych substancji do atmosfery i wiele innych. W związku z tym proponuje się inne metody wytwarzania aluminium. Rozważmy niektóre z nich.
3.1. Produkcja elektrotermiczna stopów aluminium z krzemem.
Nie da się uzyskać czystego aluminium przez bezpośrednią redukcję jego tlenku. Procesy karbotermiczne wymagają wysokich temperatur (około 2000°C), aby zredukować tlenek glinu, a przy braku składników tworzących stop metal wiąże się z węglem, dając węglik glinu (A1 4 C 3). Wiadomo, że węglik glinu i aluminium są wzajemnie rozpuszczalne i tworzą bardzo ogniotrwałe mieszaniny. Ponadto A1 4 C 3 rozpuszcza się w A1 2 O 3, dlatego w wyniku redukcji tlenku glinu węglem otrzymuje się mieszaniny glinu, węglika i tlenku o wysokich temperaturach topnienia. Zwykle nie jest możliwe uwolnienie takiej masy z pieca. Nawet jeśli można to zrobić, koszt separacji będzie wysoki.
W naszym kraju po raz pierwszy na świecie opracowano i wdrożono na skalę przemysłową metodę wytwarzania krzemoglinu (stopów glinowo-krzemowych) o odpowiednio wysokich wskaźnikach technicznych i ekonomicznych.
Ogólny schemat technologiczny produkcji stopów aluminiowo-krzemowych przedstawiono na ryc. 3.1. Oprócz kaolinów (Al 2 O 3 × 2 SiO 2 × 2H 2 O), jako wsad można stosować cyjanity (Al 2 O 3 × SiO 2), distensilimanity (Al 2 O 3 × SiO 2) oraz boksyty o niskiej zawartości żelaza.
Stop po wytopie elektrycznym dostarczany jest do oczyszczania z zanieczyszczeń niemetalicznych. W tym celu dostarczany jest topnik składający się z mieszaniny kriolitu i chlorku sodu, który zwilża te zanieczyszczenia i „zbiera” je. Rafinowany glinokrzemian ma średni skład (%): A1 - 61; Si - 36; Fe - 1,7; Ti - 0,6; Zr - 0,5; Ca - 0,7. Stop ten nie nadaje się do produkcji siluminu i wymaga oczyszczenia z żelaza. Najpopularniejszą metodą oczyszczania jest mangan, który tworzy z żelazem ogniotrwałe związki międzymetaliczne.

Ryż. 3.1. Ogólny schemat produkcji stopów aluminiowo-krzemowych.
Powstały stop jest rozcieńczany technicznym aluminium elektrolitycznym lub aluminium wtórnym do składu odpowiadającego różnym gatunkom siluminu i odlewany we wlewki.
Zalety tej metody otrzymywania siluminu nad fuzją aluminium elektrolityczne z krzemem krystalicznym są następujące: duża moc pojedynczej jednostki – nowoczesne piece mają moc 22,5 MB×A, czyli około 30 razy większą od mocy elektrolizera o 160 kA, a co za tym idzie zmniejszenie ruchu towarowego , spadek kosztów kapitałowych i kosztów pracy; zastosowanie surowców o niskim module krzemowym, których zapasy są dość duże.
Teoretycznie czyste aluminium można wyizolować ze stopu aluminium i krzemu różnymi metodami. Jednak ze względu na złożoność projektowania sprzętowego i technologicznego w przemyśle metody te nie są obecnie wdrażane.
3.2. Proces subhalogenowy
Wiadomo, że jeśli ogrzewa się mieszaninę halogenku i zanieczyszczonego aluminium, to czyste aluminium jest uwalniane po obniżeniu temperatury. Odkrycie to wywołało zainteresowanie systemami aluminium-halogenek glinu. Stwierdzono, że metaliczne aluminium reaguje z AlX 3 (gdzie X oznacza halogen) w wysokiej temperaturze, tworząc podhalogenek glinu:
![]()
Ponieważ podhalogenek glinu jest produktem gazowym, równowaga przesuwa się w lewo wraz ze spadkiem temperatury. Na przykład, A1C1(G) można wytworzyć z Al i AlCl3 w strefie reakcyjnej w stosunkowo wysokich temperaturach, a następnie przenieść jako parę do zimniejszej strefy, gdzie dysproporcjonuje do czystego glinu i chlorku glinu. Stała równowagi dla systemu A1 - A1C1 3 jest wyższa niż dla systemu A1 - A1F 3, dlatego też system chlorkowy może być stosowany w procesach przemysłowych. Temperatura tworzenia podchlorku wynosi około 1300°C pod ciśnieniem atmosferycznym. Proces ten jest szczególnie atrakcyjny w przypadku oddzielania aluminium od stopów, ponieważ halogenek glinu reaguje z aluminium i praktycznie nie wchodzi w interakcje z większością innych metali. Trudności pojawiają się tylko w przypadku niektórych lotnych halogenków amonu, takich jak FeCl 3 , MnCl 2 i niektórych innych. Mogą tworzyć mieszaniny z AlCl3 i zanieczyszczać powstały glin.
Alcan opracował technologię, która obejmuje pięć etapów:
1. Wytwarzanie surowego stopu, takiego jak żelazo-krzem-aluminium, w karbotermicznym piecu redukcyjnym.
2. Oddziaływanie między A1 i AJC1 w konwerterze w temperaturze 1300 °C.
3. Rozdzielanie lotnych halogenków i subhalogenków w kolumnach destylacyjnych.
4. Powrót AICI, do reakcji między chlorkiem a ciekłym stopem bogatym w aluminium.
5. Rozkład A1C1, produkcja aluminium i zwrot A1C1 3 do rektyfikacji.
Metoda podchlorkowa cieszy się największym zainteresowaniem w przemysłowej rafinacji stopów aluminium.
3.3. Ten proces
Schemat otrzymywania aluminium metodą Thota pokazano na ryc. 3.2. Surowce zawierające glin po odpowiednim przygotowaniu są chlorowane w złożu fluidalnym w obecności koksu i SiCl 4 . Ten ostatni służy do tłumienia reakcji chlorowania SiO 2 . W wyniku chlorowania w piecach fluidyzacyjnych (BF) powstaje mieszanina gazowo-parowa (VGM), w skład której wchodzą AlCl 3 , FeCl 3 , TiCl 4 i SiCl 4 . W pierwszym skraplaczu około 75% FeCl 3 w stanie stałym jest uwalniane z PGM i przesyłane do reaktora utleniacza, gdzie oddziałuje z tlenem atmosferycznym, w wyniku czego powstają Fe 2 O 3 i C1 2 . Chlor jest zwracany do chlorowania. W drugim skraplaczu uwalniany jest pozostały FeCl 3 i skrapla się A1C1 3 . W trzecim kondensatorze kondensują chlorki tytanu i krzemu. Oddzielanie tych chlorków odbywa się w kolumnie destylacyjnej.
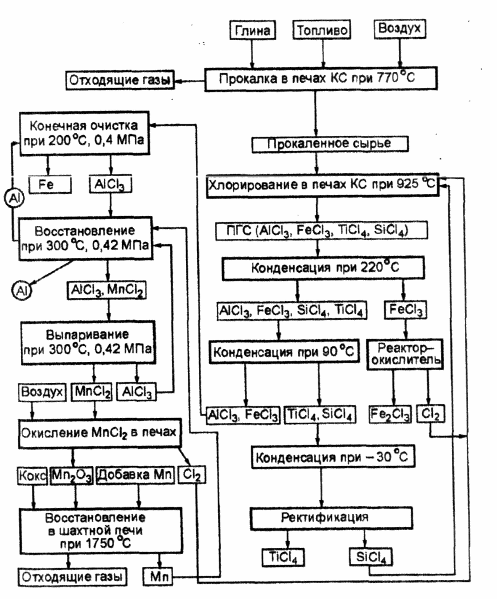
Ryż. 3.2. Schemat otrzymywania aluminium metodą Thotha.
Chlorki glinu i żelaza wyładowane z drugiego skraplacza są podgrzewane, pompowane do urządzenia do czyszczenia styków, gdzie stykają się w przeciwprądzie z ruchomą warstwą stałych cząstek aluminium. Tu zachodzi reakcja:
Oczyszczony chlorek glinu jest podawany do redukcji metalotermicznej. Dostępne technicznie środki redukujące, które mają większe powinowactwo do chloru niż aluminium, to sód, magnez i mangan. Jednak dwa pierwsze elementy drogi i ich produkcja są bardzo energochłonne. Dlatego, zdaniem twórców procesu, zastosowanie manganu ma pewne zalety, które można regenerować z chlorków metodą karbotermiczną przy znacznie mniejszym zużyciu energii. Podczas redukcji chlorku glinu manganem zachodzą następujące reakcje:
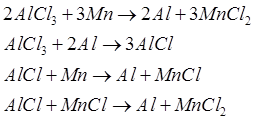
Glin z mieszaniny MnCl2 z nieprzereagowanym AlCl3 jest rozdzielany w separatorach cyklonowych, natomiast chlorki manganu i glinu są rozdzielane w wyparce. Chlorek glinu jest zawracany do reaktora w celu wytworzenia glinu, a chlorek manganu reaguje z tlenem, tworząc stałe tlenki manganu i chloru. Tlenek manganu jest redukowany do metalu metodą karbotermiczną w piecach szybowych, w których ładowany jest koks i wapień. Do pieca dodawany jest mangan, aby zrekompensować jego straty w trakcie procesu.
Do wad ten proces, jak również inne metody metalotermiczne, obejmują zanieczyszczenie powstałego produktu metalem redukującym, konieczność zorganizowania produkcji w celu regeneracji środka redukującego oraz wzrost kosztów kapitałowych.
Prace badawcze nad wytwarzaniem aluminium metodą redukcji manganem w skali laboratoryjnej i powiększonej prowadzono w latach 1966-1973. Następnie w literaturze nie było doniesień o rozwoju przemysłowym ten kierunek, co najwyraźniej wynika ze znacznych trudności w technicznej realizacji tego złożonego, wieloetapowego procesu.
3.4. Elektroliza stopionych chlorków
W styczniu 1973 roku firma Alcoa ogłosiła opracowanie nowej metody produkcji aluminium. Firma pracowała nad tym procesem przez 15 lat i wydała 23 miliony dolarów.
Metoda ta polega na produkcji chlorku glinu i jego późniejszej elektrolizie. W 1976 roku pojawiły się doniesienia o przejściu firmy "Alcoa" do przemysłowego wdrożenia technologii chlorkowej do produkcji aluminium. W mieście Palestyna (Teksas, USA) działał zakład o zdolności projektowej 30 tys. ton produkcji aluminium rocznie tą metodą.
Podstawowy schemat technologiczny pokazano na ryc. 2.4.

Ryż. 3.3. System technologii otrzymywanie aluminium z chlorku.
Chlorek glinu ma duże powinowactwo do wody oraz tendencję do tworzenia tlenków i chlorowodorków. W związku z tym otrzymanie go w czysta forma to trudne zadanie. Obecność wilgoci powoduje korozję, a obecność związków zawierających tlen prowadzi do wytrącania i utleniania anod. Firma „Alcoa” zaproponowała chlorowanie oczyszczonego tlenku glinu, co częściowo rozwiązuje te problemy. Jednak konieczne jest spełnienie zwiększonych wymagań dotyczących czystości węgla podczas chlorowania w stosunku do wodoru lub wilgoci.
Ostatnio pojawiły się doniesienia, że firmie Toth Aluminium Corporation udało się wyprodukować chlorek glinu zawierający co najmniej 99,97% głównego składnika na dużą skalę przemysłową.
Powstały chlorek glinu w postaci granulek lub pary jest poddawany elektrolizie. Elektrolizer zastosowany w tej technologii składa się ze stalowej obudowy wyłożonej cegłami szamotowymi oraz dodatkowo cegłami okrzemkowymi w dolnej części tj. termoizolacyjny nieprzewodzący materiał ogniotrwały, który słabo oddziałuje z roztopionymi chlorkami. Na dnie wanny znajduje się grafitowa komora do zbierania płynnego aluminium. W pokrywie ogniwa znajdują się otwory do ładowania chlorku glinu, okresowego odsysania glinu oraz ciągłego wyprowadzania gazowego chloru stosowanego do produkcji chlorku glinu. Ściany boczne i pokrywa elektrolizera są chłodzone wodą.
Elektroliza wykorzystuje grafitowe nie zużywające się elektrody. Ta zaleta (w porównaniu do elektrolizy stopów kriolit-tlenek glinu) wraz ze stosunkowo niską temperaturą procesu (około 700ºС) umożliwia całkowite uszczelnienie elektrolizerów.
Ryż. 2.5. Schemat ogniwa elektrolitycznego z elektrodami bipolarnymi do elektrolizy chlorku glinu.
1 - osłona: 2 - chłodzenie wodne: 3 - anoda; 4 - elektrody bipolarne; 5 - katoda; 6 - podszewka; 7 - komora do zbierania aluminium. Materiał: A - grafit; B - szamot; B - okrzemka.
Elektrolityczny rozkład chlorku glinu teoretycznie wymaga wyższego napięcia niż elektroliza stopionego kriolit-tlenek glinu, ponieważ napięcie rozkładu chlorku glinu jest znacznie wyższe. Do wad procesu można więc zaliczyć konieczność dostarczenia dużej ilości ciepła do elektrolizera oraz znaczne straty napięcia. Jednak wysokie straty omowe i termiczne są znacznie zmniejszone, gdy stosuje się system elektrod bipolarnych. W ogniwie górna elektroda to anoda, dolna katoda, a pomiędzy nimi elektrody grafitowe, których górna część to katoda, a dolna to anoda. Jednocześnie wyniki obliczeń pokazują, że wraz ze wzrostem liczby elektrod bipolarnych i zmniejszeniem ich pola przekroju, prądy upływu rosną, tj. część prądu przepływa przez impregnowaną elektrolitem część okładziny oraz kanały między okładziną a dwubiegunami, bez wykonywania prac elektrochemicznych. Te prądy upływowe powodują zmniejszenie prądu wyjściowego.
Ze względu na bliskość temperatur topnienia i wrzenia pod ciśnieniem atmosferycznym chlorek glinu sublimuje praktycznie bez topienia. Temperatura sublimacji 180,2°C. Punkt potrójny odpowiada temperaturze 192,6°C i ciśnieniu bezwzględnemu 0,23 MPa. W związku z tym jako elektrolit stosuje się stopioną mieszaninę chlorku glinu (5 ± 2% (masa)), chlorku litu (~28% (masa)) i chlorku sodu (67% (masa)). W tych wytopach aktywność A1C1 3 spada. Wynika to w dużej mierze z faktu, że w stopionych mieszaninach chlorków A1C1 3 wiąże się na przykład z anionami złożonymi.
Odległość międzypolowa wynosi 1,0 - 1,5 cm, temperatura 700 ± 30ºС, gęstość prądu -0,8 - 2,5 A / cm2.
Wyniki.
Głównymi zaletami przewidzianymi i potwierdzonymi podczas przemysłowego wdrożenia w Stanach Zjednoczonych metody Alcoa wytwarzania aluminium metodą elektrolizy jego chlorków w porównaniu z elektrolizą stopów kriolit-tlenek glinu jest możliwość stosowania niskiej jakości surowców zawierających aluminium, zmniejszająca jednostkowy pobór mocy podczas elektrolizy o około 30% oraz eliminacja zużycia wysokiej jakości materiałów elektrodowych zawierających węgiel, stosowanie mniej rzadkich i agresywnych chlorków zamiast fluorków, zwiększenie wydajności pracy, zmniejszenie nakładów inwestycyjnych, zmniejszenie kosztów, kosztów produkty końcowe i szkodliwe emisje do środowiska.
Ostatnio zalety metody chlorkowej do produkcji aluminium stały się bardziej namacalne ze względu na wzrost kosztów energii elektrycznej, surowców do istniejącej przemysłowej metody produkcji aluminium oraz zwiększone wymagania dotyczące ochrony. środowisko oraz dotychczasowy brak pozytywnych wyników w otrzymywaniu czystego tlenku glinu z niskiej jakości surowców nieboksytowych.
Tak więc najbardziej obiecujący z alternatywne sposoby produkcja aluminium polega na elektrolizie chlorku glinu w elektrolizerach z elektrodami bipolarnymi.
Bibliografia
1. Rozen B. M., Rozen Ya B. Metal o szczególnej wartości. - M.: Metalurgia, 1975. - 128 s.
2. Kolodin E. A., Sverdlin V. A., Svoboda R. V. Produkcja wypalonych anod elektrolizerów aluminiowych. - M.: Metalurgia, 1980, - 84 s.
3. Yankho E. A., Vorobyov D. N. Produkcja masy anodowej. - M.: Metalurgia, 1975. - 128 s.
4. M. M. Vetkzhov, A. M. Ts’shlakov i S. N. Shkolnikov, Elektrometalurgia aluminium i magnezu. - M.: Metalurgia, 1987. - 320 s.
5. Shchenkov V.V., Litwak S.N. Rozwój nowych procesy technologiczne produkcja aluminium // Tsv. metalurgia: Bull. NTI / Informacje o kolorze. - 1974. - nr 9. - S. 38 - 41.
6. Sandler R. A., Rapier A. Kh. Elektrometalurgia aluminium i magnezu. - L: LGI, 1983. - 94 s.
 Najczęściej spotykane jest aluminium pierwiastek chemiczny na ziemi. Zajmuje trzecie miejsce po tlenie i krzemie. Jego zawartość to 8,8 procent wszystkich zasobów naturalnych.
Najczęściej spotykane jest aluminium pierwiastek chemiczny na ziemi. Zajmuje trzecie miejsce po tlenie i krzemie. Jego zawartość to 8,8 procent wszystkich zasobów naturalnych.
Jak pozyskuje się czyste aluminium?
Ale czy wiesz, że wolne aluminium nie występuje w naturze. Nie ma kopalni aluminium. Jest wydobywany z kopalń zawierających boksyt, ałunit i nefilinę. Aby uzyskać aluminium w czystej postaci, trzeba przejść długą drogę w oddzieleniu metalu od innych pierwiastków chemicznych.
Proces technologiczny otrzymywania aluminiumskłada się z dwóch etapów:
1 Ruda boksytu jest kruszona, uzyskuje się tlenek glinu.
2 .Ekstrakcja aluminium z tlenku glinu.
Tlenek glinu nazywany jest krystalicznym tlenkiem glinu.
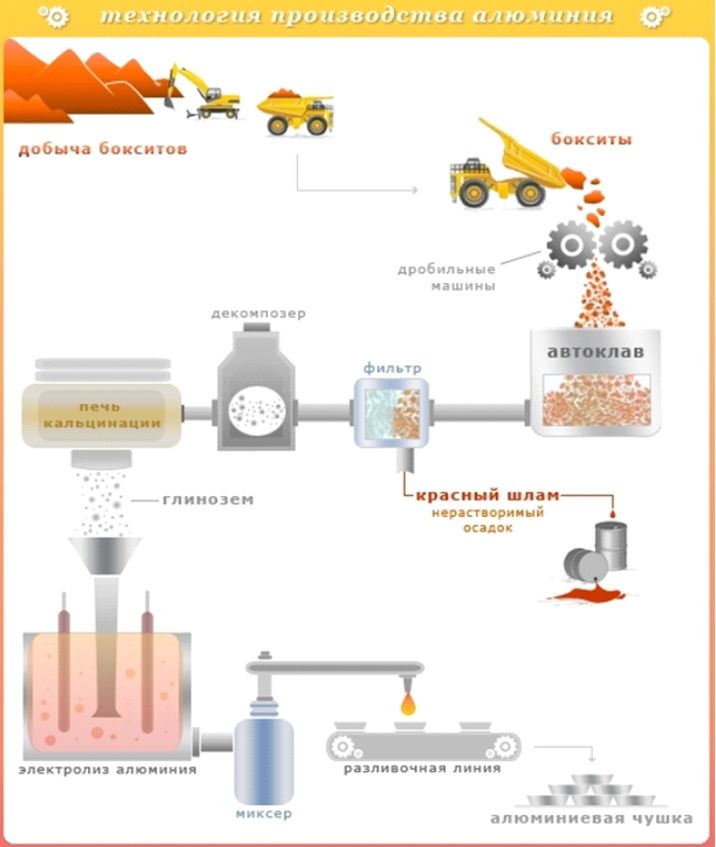
Tlenek glinu poddawany jest procedurze elektrolizy w kriolicie. W temperaturze 960-970 0 C w specjalnych kąpielach aktywuje się niskie napięcie 4,5 V, ale przy bardzo wysoka wytrzymałość obecne 250 tysięcy amperów. W rezultacie ciekłe aluminium jest skoncentrowane na dnie kąpieli wokół katody, podczas gdy tlen gromadzi się wokół anody. Aluminium jest następnie rafinowane i wlewane do form. Następnie powstają różne produkty.
Produkcja aluminium to pracochłonny proces, w którym zużywa się lwią część energii elektrycznej. Dlatego też zakłady produkujące aluminium najczęściej można znaleźć w pobliżu dużych elektrowni wodnych, by pozyskać tanią energię elektryczną.

Jaka jest przyszłość aluminium?
W przeszłości: Na zamówienie Napoleona III sztućce zostały wykonane z aluminium. Podawano je na uroczystościach dla cesarza i najbardziej honorowych gości, reszta zadowalała się złotymi i srebrnymi naczyniami.
W połowie XIX wieku paryscy fashionistki musiały mieć w swoich strojach przynajmniej jeden kawałek aluminium.
Dziś: Co nie jest wykonane z aluminium; samoloty, paliwo rakietowe, profile szklarniowe, produkty elektroniczne. Produkcja aluminium w hutnictwie stanowi 2% produkcji metali, w przyszłości według prognoz wzrośnie do 4-5%.
W przyszłości: producenci już tworzą tkaniny pokryte cienką warstwą tego metalu. Nazywa się to „tkaniną aluminiowaną”. Na przykład, jeśli tkanina zostanie użyta jako zasłona w upalny dzień, tkanina sprawdzi się na dwa sposoby: ciepło zostanie odbite, a światło z łatwością dostanie się do pomieszczenia. Dzięki temu mieszkanie będzie lekkie i jednocześnie chłodne.
Przez dwa stulecia lekki metal był w stanie podbić świat. A dwudziesty pierwszy wiek, pod każdym względem, zapowiada się na wiek aluminium.
1. Odzyskiwanie tlenku glinu wodorem
2. Elektrolityczne
3. Metalowo-termiczny
4. Pirometalurgia
5. Hydrometalurgia
181. Materiałem wyjściowym do produkcji surówki są:
1. Rudy żelaza
2. Złom, topniki
3. Rudy żelaza, topniki, paliwo
4. Rudy żelaza, koks
5. Boksyty
182. Żeliwo wytapiane jest w:
1. Wielki piec
3. Piece szybowe
4. Piec tunelowy
5. Piec komorowy
183. Stop metali żelaznych to:
1. Nikiel
2. Elektron
5. Żeliwo szare
184. Stopy żelaza o zawartości węgla od 0,2 do 2% nazywane są:
5. Cementyty
185. Stopy żelaza o zawartości węgla powyżej 2% nazywane są:
5. Nikiel
186. Aluminium otrzymuje się przez elektrolizę:
1. Boxtov
2. Stopiona mieszanina tlenku glinu z kriolitem
3. Alunici
4. Wodorotlenek glinu
5. Nefelina
187. Stopy aluminium z krzemem to:
1. Duraluminium
3. Silumin
188. Stopy aluminium z miedzią, magnezem, manganem nazywane są:
1. Duraluminium
3. Silumin
189. Stop żelaza z węglem (do 2%) składa się z:
1. Austenit
2. Austenit i ledeburyt
3. Cementyt
4. Cementyt i ledeburyt
5. Ledeburita
190. Żeliwo o zawartości węgla (2-4%) składa się z:
1. Austenit
2. Austenit i ledeburyt
3. Cementyt
4. Cementyt i ledeburyt
5. Ledeburita
191. Żeliwo o zawartości węgla powyżej 4% składa się z:
1. Austenit
2. Austenit i ledeburyt
3. Cementyt
4. Cementyt i ledeburyt
5. Ledeburita
192. Nikiel łączy się ze stalą:
193. Mangan daje stal:
1. Czerwona twardość, wytrzymałość, odporność na korozję w wysokiej temperaturze
2. Wytrzymałość, ciągliwość, odporność na korozję
3. Siła w normalnych warunkach
4. Twardość i odporność na korozję
5. Twardość, odporność na zużycie, odporność na uderzenia
194. Niob daje stal:
1. Zwiększona ciągliwość i lepkość
2. Trwałość
3. Twardość i odporność na korozję
4. Kwasoodporność
5. Wytrzymałość w wysokich temperaturach
195. Molibden daje stal:
1. Czerwona twardość, wytrzymałość, odporność na korozję w wysokiej temperaturze
2. Wytrzymałość, ciągliwość, odporność na korozję
3. Siła w normalnych warunkach
4. kwasoodporność
5. Twardość, odporność na zużycie, odporność na uderzenia
Surowcem do produkcji koksu naftowego jest
2. Ciężkie produkty naftowe
Po raz pierwszy metaliczny glin został otrzymany chemicznie przez niemieckiego chemika F. Wöhlera w 1821 r. (przez redukcję z chlorku glinu metalicznym potasem po podgrzaniu). W 1854 roku francuski naukowiec Saint-Clair Deville zaproponował elektrochemiczną metodę wytwarzania aluminium poprzez redukcję podwójnego chlorku glinowo-sodowego sodem.
Produkcja i produkcja aluminium
Aluminium metaliczne pozyskiwane jest w trzech etapach:
- Otrzymywanie tlenku glinu (Al 2 O 3) z rud aluminium;
- Otrzymywanie aluminium z tlenku glinu;
- rafinacja aluminium.
Zdobywanie tlenku glinu
Około 95% całego tlenku glinu uzyskuje się z rud boksytu.
Boksyt(Francuski boksyt) (od nazwy obszaru Baux na południu Francji) - ruda glinu, składająca się z wodorotlenków glinu, tlenków żelaza i krzemu, surowców do produkcji tlenku glinu i materiałów ogniotrwałych zawierających tlenek glinu. Zawartość tlenku glinu w komercyjnych boksytach waha się od 40% do 60% i więcej. Jest również stosowany jako topnik w metalurgii żelaza.
Zdjęcie 1 - Ruda boksytu
Zazwyczaj boksyt jest ziemistą, gliniastą masą, która może mieć teksturę w postaci pasm, pizolitu (podobną do groszku) lub jednolitą. W normalnych warunkach atmosferycznych skalenie (minerały, które stanowią większość skorupy ziemskiej i są glinokrzemianami) rozkładają się na gliny, ale w gorącym klimacie i dużej wilgotności końcowym produktem ich rozkładu może być boksyt, ponieważ takie środowisko sprzyja ich usuwaniu zasad i krzemionki, zwłaszcza z syenitów lub gabro. Boksyty są przetwarzane na aluminium etapami: najpierw otrzymuje się tlenek glinu (tlenek glinu), a następnie aluminium metaliczne (elektrolitycznie w obecności kriolitu).
Głównymi zanieczyszczeniami boksytów są Fe 2 O 3 , SiO 2 , TiO 2 . Drobne zanieczyszczenia boksytów to: Na 2 O, K 2 O, CaO, MgO, pierwiastki ziem rzadkich, Cr, P, V, F, związki organiczne.
Zazwyczaj boksyty są klasyfikowane:
- według koloru;
- przez główny minerał (częściej są mieszane);
- przez wiek.
Główne kryteria cechy rudy aluminium są:
- Moduł krzemowy (Msi = Al 2 O 3 /SiO 2 (% wag.)). Im większy moduł krzemowy, tym lepsza jakość (Msi = 7);
- Zawartość żelaza w przeliczeniu na Fe 2 O 3 . Jeśli zawartość Fe2O3 wynosi około 18% wag., wówczas boksyt jest uważany za bogaty w żelazo. Im większa zawartość żelaza, tym trudniej wydobywać boksyty;
- Zawartość siarki. Obecność dużej ilości siarki komplikuje przetwarzanie boksytu;
- Zawartość węglanów w przeliczeniu na CO 3 (2-) . Obecność dużej ilości węglanów komplikuje przetwarzanie boksytu.
Stosowane są boksyty:
- w produkcji tlenku glinu;
- w produkcji materiałów ściernych;
- w produkcji materiałów ogniotrwałych;
- jako topnik do wytapiania stali martenowskich;
- do suszenia gazów i oczyszczania oleju z siarki;
- jako barwnik.
Do chwili obecnej głównymi dostawcami boksytu są:
- Australia - są też ogromne złoża Fe, Au, U, Ni, Co, Cu itp. Bardziej opłaca się kupować surowce z Australii niż przerabiać własne.
- Gwinea - Rosja ma kilka zakupionych miejsc.
- Ameryka Środkowa: Gujana, Jamajka, Suriman.
- Brazylia.
W Europie wszystkie złoża są wyczerpane. Boksyty sprowadzane są z Grecji, ale surowiec ten jest kiepskiej jakości.

Rysunek 2 - Rezerwy boksytu na świecie
Poniżej znajdują się główne złoża rud aluminium w Rosji.
- Pierwsze złoże odkryto w 1914 roku pod Petersburgiem, w pobliżu miasta Tichwin. Na tym polu wybudowano 6 zakładów. Największa to fabryka aluminium Volkhov. Do tej pory złoże Tichwinskoje jest wyczerpane i działa głównie na importowanych surowcach.
- W 1931 r. odkryto unikalne złoże boksytu o wysokiej jakości (SUBR) Severo-Uralskoye. Służył jako podstawa do budowy w 1939 r. Uralskiej fabryki aluminium (UAZ). A na bazie kopalni boksytu Południowego Uralu (YUBR) zbudowano hutę aluminium Bogosłowski (BAZ).
- Pole Severoonezhskoye znajduje się na drodze na Półwysep Kolski. Jest w planie, ale data budowy nie jest znana.
- Złoże Vislovskoe jest złożem czystej gliny typu kaolitu. Nie używany do tlenku glinu.
- Pole Timanskoye (Republika Komi, Varkuta). Kanadyjczycy są zainteresowani tą dziedziną, więc planują budowę fabryk (Komi Sual jest spółką holdingową).
Otrzymywanie tlenku glinu z rud boksytu
Ponieważ aluminium jest amfoteryczne, tlenek glinu jest wytwarzany na trzy sposoby:
- alkaliczny,
- kwas;
- elektrolityczny.
Najbardziej rozpowszechniona jest metoda alkaliczna (metoda K. I. Bayera, opracowana w Rosji pod koniec ubiegłego wieku i stosowana do przetwarzania wysokogatunkowych boksytów z niewielką ilością (do 5–6%) krzemionki). Od tego czasu jego parametry techniczne uległy znacznej poprawie. Schemat produkcji tlenku glinu metodą Bayera przedstawiono na rysunku 3.

Rysunek 3 - Schemat otrzymywania tlenku glinu metodą Bayera
Istota metody polega na tym, że roztwory glinu ulegają szybkiemu rozkładowi po wprowadzeniu do nich wodorotlenku glinu, a roztwór pozostały z rozkładu po jego odparowaniu w warunkach intensywnego mieszania w temperaturze 169–170 °C może ponownie rozpuszczać tlenek glinu zawarty w boksytach. Ta metoda składa się z następujących głównych operacji:
1. Przygotowanie boksytu polegające na jego kruszeniu i mieleniu w młynach; młyny są zasilane boksytem, ługiem kaustycznym i niewielką ilością wapna, co poprawia uwalnianie Al 2 O 3 ; otrzymana miazga jest podawana do ługowania;
2. Ługowanie boksytu (ostatnio dotychczas stosowane okrągłe bloki autoklawowe zostały częściowo zastąpione przez autoklawy rurowe, w których ługowanie następuje w temperaturze 230–250 °C (500–520 K), co polega na jego chemicznym rozkładzie z interakcja z wodnym roztworem zasad; hydraty tlenku glinu podczas interakcji z alkaliami przechodzą do roztworu w postaci glinianu sodu:
AlOOH+NaOH→NaAlO2 +H2O
Al(OH)3 +NaOH→NaAlO2+2H2O;
SiO2 +2NaOH→Na2SiO3 +H2O;
w roztworze glinian sodu i krzemian sodu tworzą nierozpuszczalny glinokrzemian sodu; tlenki tytanu i żelaza przechodzą do nierozpuszczalnej pozostałości, nadając pozostałości czerwony kolor; ta pozostałość nazywana jest czerwonym błotem. Po zakończeniu rozpuszczania powstały glinian sodu rozcieńcza się wodnym roztworem zasady, jednocześnie obniżając temperaturę o 100 ° C;
3. Oddzielanie roztworu glinianu od czerwonego szlamu, zwykle przeprowadzane przez płukanie w specjalnych zagęszczaczach; w wyniku tego czerwone błoto osiada, a roztwór glinianu jest spuszczany, a następnie filtrowany (klarowany). W ograniczonych ilościach osad stosowany jest np. jako dodatek do cementu. W zależności od gatunku boksytu na 1 tonę wytworzonego tlenku glinu przypada 0,6 - 1,0 tony czerwonego błota (suchej pozostałości);
4. Rozkład roztworu glinianu. Jest filtrowany i pompowany do dużych pojemników z mieszadłami (rozkładnikami). Wodorotlenek glinu Al(OH) 3 ekstrahuje się z przesyconego roztworu po ochłodzeniu do 60°C (330 K) i ciągłym mieszaniu. Ponieważ proces ten przebiega powoli i nierównomiernie, a powstawanie i wzrost kryształów wodorotlenku glinu ma ogromne znaczenie w jego dalszym przetwarzaniu, do rozkładników dodaje się dużą ilość wodorotlenku stałego - nasiona:
Na2O Al2O3 + 4H2O→Al(OH)3 + 2NaOH;
5. Przydział wodorotlenku glinu i jego klasyfikacja; dzieje się tak w hydrocyklonach i filtrach próżniowych, gdzie od roztworu glinianu oddziela się osad zawierający 50 - 60% cząstek Al(OH) 3 . Znaczna część wodorotlenku wraca do procesu rozkładu jako materiał siewny, który pozostaje w obiegu w niezmienionych ilościach. Pozostałość po przemyciu wodą przechodzi do kalcynacji; filtrat jest również zawracany do obiegu (po zatężeniu w wyparkach - w celu wypłukania nowych boksytów);
6. Odwodnienie wodorotlenku glinu (kalcynacja); jest to ostatnia operacja produkcji tlenku glinu; odbywa się w rurowych piecach obrotowych, a ostatnio także w piecach z turbulentnym ruchem materiału w temperaturze 1150 - 1300 °C; surowy wodorotlenek glinu przechodzący przez piec obrotowy, suszony i odwadniany; po podgrzaniu następują kolejno następujące przekształcenia strukturalne:
Al(OH) 3 → AlOOH → γ-Al 2 O 3 → α-Al 2 O 3
200 °C - 950 °C - 1200 °C.
Końcowy kalcynowany tlenek glinu zawiera 30-50% α-Al2O3 (korund), reszta to γ-Al2O2.
Ta metoda ekstrahuje 85 - 87% całego wytworzonego tlenku glinu. Powstały tlenek glinu jest silnym związkiem chemicznym o temperaturze topnienia 2050 ° C.
Otrzymywanie aluminium przez elektrolizę
Elektrolityczna redukcja tlenku glinu rozpuszczonego w stopie na bazie kriolitu jest przeprowadzana w temperaturze 950-970 °C w ogniwie elektrolitycznym. Ogniwo składa się z wanny wyłożonej blokami węglowymi, do której dna doprowadzany jest prąd elektryczny. Płynne aluminium uwalniane na dnie pełniące funkcję katody jest cięższe niż stopiona sól elektrolityczna, dlatego jest gromadzone na podłożu węglowym, skąd jest okresowo wypompowywane (rys. 4). Od góry w elektrolicie zanurzone są anody węglowe, które spalają się w atmosferze tlenu uwalnianego z tlenku glinu, uwalniając tlenek węgla (CO) lub dwutlenek węgla (CO 2). W praktyce stosuje się dwa rodzaje anod:
- samopieczelne anody Zederberg, składające się z brykietów, tzw. „chlebów” masy Zederberg (węgiel niskopopiołowy o zawartości 25-35% paku smołowego), upchanych w aluminiowej osłonie; pod działaniem wysokiej temperatury masa anodowa jest wypalana (spiekana);
- wypalane lub „ciągłe” anody wykonane z dużych bloków węglowych (na przykład 1900 × 600 × 500 mm, ważące około 1,1 tony).

Rysunek 4 - Schemat elektrolizera
Natężenie prądu na elektrolizerach wynosi 150 000 A. Są one połączone szeregowo z siecią, tj. Uzyskuje się układ (szereg) - długi rząd elektrolizerów.
Napięcie robocze na kąpieli, które wynosi 4-5 V, jest znacznie wyższe niż napięcie, przy którym rozkłada się tlenek glinu, ponieważ straty napięcia w różnych częściach układu są nieuniknione podczas pracy. Bilans surowców i energii po otrzymaniu 1 tony aluminium przedstawiono na rysunku 5.

Rysunek 5 - Bilans surowców i energii przy produkcji 1 tony aluminium
W naczyniu reakcyjnym tlenek glinu jest najpierw przekształcany w chlorek glinu. Następnie w szczelnie izolowanej kąpieli zachodzi elektroliza AlCl 3 rozpuszczonego w stopionych solach KCl, NaCl. Uwolniony w tym procesie chlor jest odsysany i kierowany do recyklingu; aluminium osadza się na katodzie.
Zaletami tej metody w stosunku do istniejącej elektrolizy ciekłego stopionego kriolit-tlenek glinu (Al 2 O 3 , Na 3 AlF 6 rozpuszczony w kriolicie) są: oszczędność do 30% energii; możliwość zastosowania tlenku glinu, który nie nadaje się do tradycyjnej elektrolizy (np. Al 2 O 3 o wysokiej zawartości krzemu); zastąpienie drogiego kriolitu tańszymi solami; eliminacja niebezpieczeństwa emisji fluorków.
Uzyskanie rafinowanego aluminium
W przypadku aluminium rafinacja elektrolizy z rozkładem wodnych roztworów soli nie jest możliwa. Ponieważ dla niektórych celów stopień oczyszczenia aluminium przemysłowego (Al 99,5 - Al 99,8), otrzymanego przez elektrolizę stopionego kriolit-tlenku glinu, jest niewystarczający, nawet czystsze aluminium (Al 99,99 R) otrzymuje się z aluminium przemysłowego lub odpadów metalowych przez rafinację . Najbardziej znaną metodą rafinacji jest elektroliza trójwarstwowa.
Rafinacja przez trójwarstwową elektrolizę
Wyłożona blachą stalową, działająca na prąd stały (rys. 6), kąpiel rafinacyjna składa się z paleniska węglowego z przewodami prądowymi i termoizolacyjnej wykładziny magnezytowej. W przeciwieństwie do elektrolizy stopionego kriolit-tlenek glinu, anoda jest tutaj z reguły roztopionym metalem rafinowanym (dolna warstwa anody). Elektrolit składa się z czystych fluorków lub mieszaniny chlorku baru oraz fluorków glinu i sodu (warstwa środkowa). Aluminium rozpuszczające się z warstwy anodowej w elektrolicie uwalnia się nad elektrolitem (górna warstwa katodowa). Czysty metal służy jako katoda. Prąd dostarczany jest do warstwy katodowej przez elektrodę grafitową.

Rysunek 6 - Schemat ogniwa elektrolitycznego z przednim paleniskiem do rafinacji aluminium (według Fuldy - Ginzberga)
1 - stop aluminium; 2 – elektrolit; 3 - aluminium rafinowane wysokiej częstotliwości; 4 – katoda grafitowa; 5 - ściana magnezytowa; 6 - przedni klakson; 7 - warstwa izolacyjna; 8 - izolacja boczna; 9 - palenisko węglowe; 10 – przewód anodowy; 11 - izolacja paleniska; 12 - żelazne pudełko; 13 - okładka
Kąpiel pracuje w temperaturze 750 - 800 ° C, zużycie energii wynosi 20 kWh na 1 kg czystego aluminium, czyli nieco więcej niż przy konwencjonalnej elektrolizie aluminium.
Metal anodowy zawiera 25-35% Cu; 7 – 12% Zn; 6 – 9% Si; do 5% Fe i niewielka ilość manganu, niklu, ołowiu i cyny, reszta (40 - 55%) to aluminium. Wszystkie metale ciężkie i krzem pozostają w warstwie anodowej podczas rafinacji. Obecność magnezu w elektrolicie prowadzi do niepożądanych zmian w składzie elektrolitu lub do jego silnego żużlowania. Aby usunąć magnez, żużle zawierające magnez poddaje się działaniu topników lub gazowego chloru.
W wyniku rafinacji otrzymuje się czyste aluminium (99,99%) oraz produkty segregacji (produkt Zigera), które zawierają metale ciężkie i krzem i są izolowane w postaci roztworu alkalicznego oraz krystalicznej pozostałości. Roztwór alkaliczny jest odpadem, a stałą pozostałość wykorzystuje się do odkwaszania.
Rafinowane aluminium ma zwykle następujący skład, %: Fe 0,0005 - 0,002; Si 0,002 - 0,005; Cu 0,0005 - 0,002; Zn 0,0005 - 0,002; ślady magnezu; Odpocznij.
Rafinowane aluminium jest przetwarzane na półprodukt o określonym składzie lub stapiany z magnezem (tabela 1).
Tabela 1 - Skład chemiczny aluminium o wysokiej czystości i aluminium pierwotnego zgodnie z DIN 1712, arkusz 1
|
Dopuszczalne zanieczyszczenia*, % |
||||||||
|
łącznie z |
||||||||
* O ile to możliwe do określenia konwencjonalnymi metodami badawczymi.
** Czyste aluminium dla elektrotechniki (przewody aluminiowe) dostarczane jest w postaci aluminium pierwotnego 99,5 zawierającego nie więcej niż 0,03% (Ti + Cr + V + Mn); oznaczony w tym przypadku jako E-A1, numer materiału 3.0256. Poza tym jest zgodny z VDE-0202.
Rafinacja za pomocą kompleksowych związków glinoorganicznych i topienie stref
Aluminium o wyższej klasie czystości A1 99,99 R można otrzymać przez rafinację elektrolizy czystego lub komercyjnie czystego aluminium przy użyciu złożonych związków glinoorganicznych aluminium jako elektrolitu. Elektroliza zachodzi w temperaturze około 1000°C pomiędzy stałymi elektrodami aluminiowymi i jest zasadniczo podobna do elektrolizy rafinacji miedzi. Charakter elektrolitu dyktuje potrzebę pracy bez powietrza i przy niskiej gęstości prądu.
Ten rodzaj elektrolizy rafinacyjnej, stosowany początkowo tylko w skali laboratoryjnej, jest już przeprowadzany na małą skalę przemysłową – rocznie produkuje się kilka ton metalu. Nominalny stopień oczyszczenia powstałego metalu wynosi 99,999 -99,9999%. Potencjalne obszary zastosowań metalu o tej czystości to kriogeniczna elektrotechnika i elektronika.
Możliwe jest zastosowanie rozważanej metody rafinacji w galwanotechnice.
Jeszcze wyższą czystość - nominalnie do A1 99,99999 - można uzyskać przez kolejne strefowe topienie metalu. Przetwarzając aluminium o wysokiej czystości w półprodukt, blachę lub drut, należy, biorąc pod uwagę niską temperaturę rekrystalizacji metalu, podjąć szczególne środki ostrożności. Niezwykłą właściwością rafinowanego metalu jest jego wysoka przewodność elektryczna w zakresie temperatur kriogenicznych.


