3 main Scharakteryzuj element, wstawiając brakujące słowa 1. Aluminium jest elementem grupy III, głównej podgrupy. 2. Ładunek jądra atomu glinu to 13 protonów w jądrze atomu glinu. 4. W jądrze atomu glinu znajduje się 14 neutronów. 5. W atomie aluminium znajduje się 13 elektronów. 6. Atom aluminium ma 3 poziomy energii. 7. Powłoka elektronowa ma strukturę 2e, 8e, 3e. 8. Na zewnętrznym poziomie w atomie znajdują się 3 elektrony. 9. Stopień utlenienia atomu w związkach jest równy Prosta substancja aluminium jest metalem. 11. Tlenek i wodorotlenek glinu mają charakter amfoteryczny. Dalej
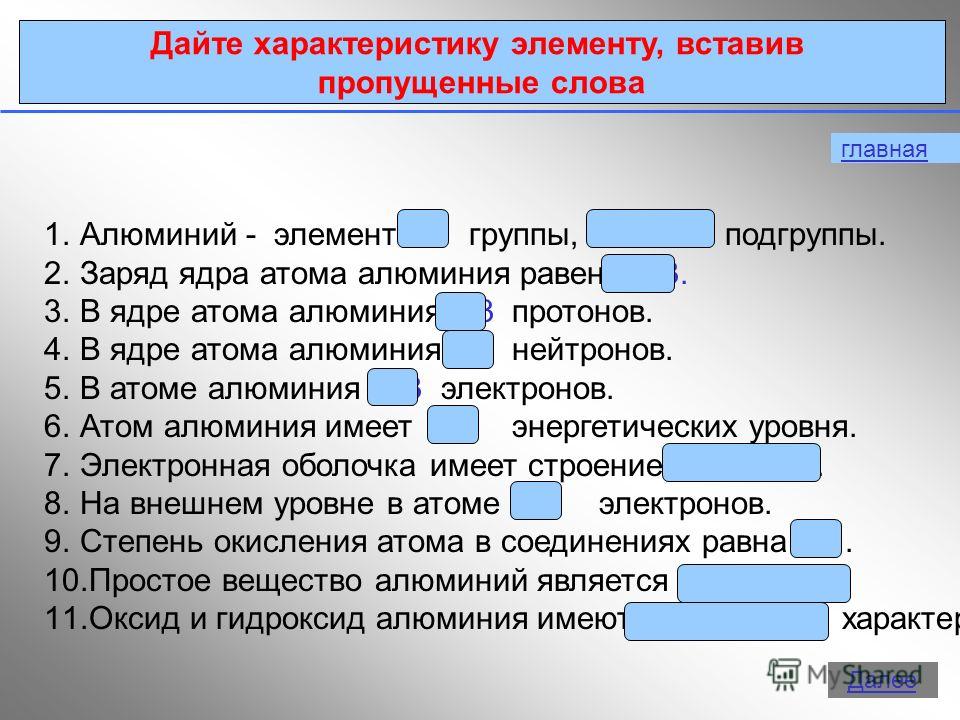
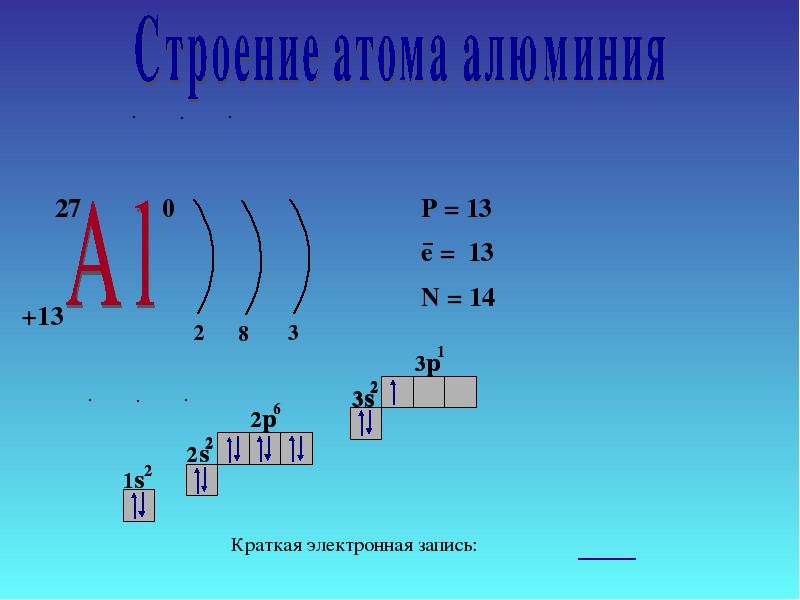
4 Struktura elektronowa atomu 27 AlAl e8e3e P + = 13 n 0 = 14 e - = 13 1s21s2 2s22s2 2p 6 3s 2 3p 1 Krótki zapis elektroniczny 1s21s2 2s22s2 2p 6 3s 2 3p 1 Kolejność wypełnienia główna Dalej

7 Z historii odkrycia Main Next Podczas odkrycia aluminium – metal był droższy od złota. Brytyjczycy chcieli uhonorować wielkiego rosyjskiego chemika D.I. Mendelejewa bogatym prezentem, dali mu równowagę chemiczną, w której jedna filiżanka była wykonana ze złota, druga - z aluminium. Kubek wykonany z aluminium stał się droższy od złota. Powstałe „srebro z gliny” zainteresowało nie tylko naukowców, ale także przemysłowców, a nawet cesarza Francji. Dalej



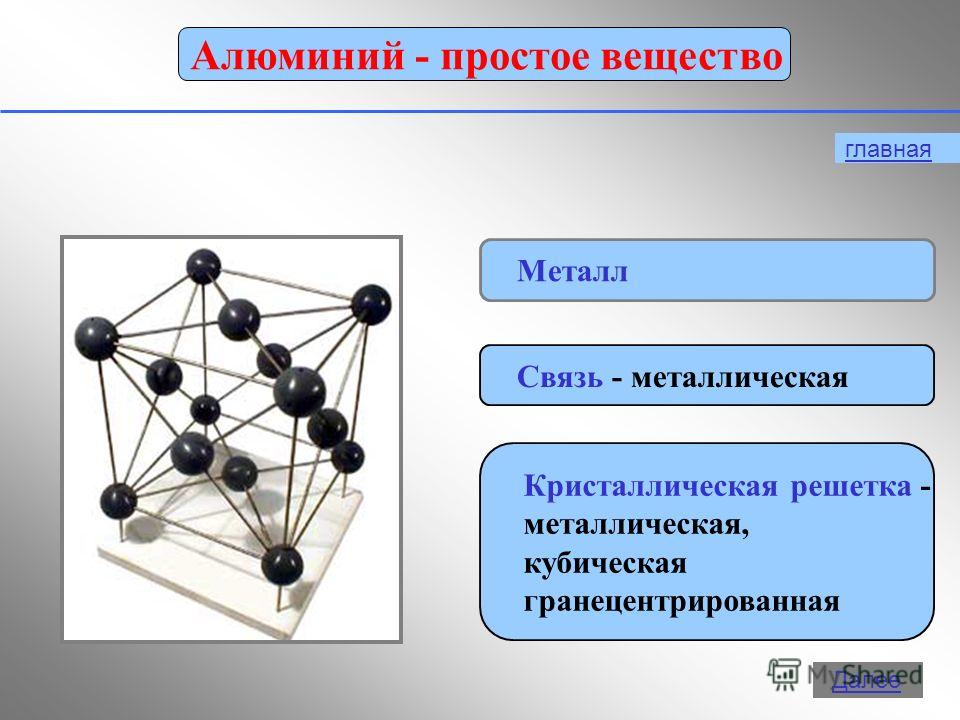
12 1. Metal srebrno-biały 2. Metaliczny połysk 3. Najtwardszy metal 4. Temperatura topnienia +660 ° C 5. Plastik 6. Łatwy do cięcia nożem 7. Przewodzi Elektryczność 8. Lekki 9. Przewodzi ciepło 10. Łatwy do namagnesowania i rozmagnesowania 11. Miękki Wybierz i zapisz numery tych właściwości, które odnoszą się do fizycznych właściwości aluminium




Cele Lekcji:
Edukacyjny - studiować fizyczne i Właściwości chemiczne aluminium i jego zastosowania. Rozważ charakterystykę pierwiastek chemiczny aluminium i zbadaj strukturę atomu.
Rozwijanie - rozwijać umiejętności przeprowadzania eksperymentu, przenoszącego treść tekstu naukowego i edukacyjnego w postaci diagramów; rozwój umiejętności komunikacyjnych, umiejętności słuchania, umiejętności poprawnego wyrażania myśli.
Edukacyjny - pielęgnować kulturę pracy z chemikalia, przestrzegania przepisów bezpieczeństwa, pielęgnować świadomą dyscyplinę, przejrzystość i organizację pracy.
Studenci powinni wiedzieć:
budowa atomu glinu, właściwości fizyczne i chemiczne aluminium jako prostej substancji, obszary zastosowań.
Studenci powinni być w stanie:
scharakteryzować aluminium, zarówno pierwiastek chemiczny, jak i prostą substancję. Napisz równania reakcji, które potwierdzają właściwości chemiczne glinu w postaci molekularnej i redoks.
Rodzaj lekcji:
nauka nowego materiału.
Forma organizacji działania edukacyjne studenci:
praca grupowa, indywidualna, eksperyment chemiczny.
Metody i techniki nauczania:
rewizja, badania cząstkowe, demonstracyjny eksperyment chemiczny, praca w grupach, odpowiedzi ustne przy tablicy, niezależna praca z tekstami, wzajemna kontrola.
Wyposażenie lekcji:
teksty naukowe i edukacyjne na temat lekcji, karty zadań dla indywidualne pytania plan studiów materiałowych dla każdej grupy, PSCE,
Kolekcja „Aluminium i jego związki”, folia aluminiowa, kwas solny i wodorotlenek sodu, aluminium, sprzęt laboratoryjny.
Nauczyciel wita uczniów.
2. Aktualizacja podstawowej wiedzy, komunikacja tematu, zadań i struktury lekcji:
Przemówienie wprowadzające nauczyciela
Sami, pracując, zrobicie wszystko
zarówno dla bliskich, jak i dla siebie,
a jeśli nie ma powodzenia w pracy,
awaria nie jest problemem, spróbuj ponownie.
D. I. Mendelejew.
Nadal studiujemy duże i ważny temat„Metale”. Dziś na lekcji musimy zapoznać się z metalem dobrze Wam znanym od dzieciństwa. Ta lekcja Chcę zacząć od legendy.
„Pewnego dnia do rzymskiego cesarza Tyberiusza przybył nieznajomy. W prezencie dla cesarza przywiózł puchar, który zrobił z metalu, który był równie lśniący jak srebro, ale niezwykle lekki. Mistrz powiedział, że otrzymał ten metal z Clay Earth. Ale cesarz, obawiając się, że jego złoto i srebro ulegną deprecjacji, nakazał mistrzowi odciąć mu głowę, a jego warsztat zniszczyć. O jakim metalu mówimy?
(O aluminium)
Nauczyciel:
Dlatego tematem naszej lekcji jest: „Aluminium jest pierwiastkiem chemicznym i prostą substancją”.
Sformułowane są cele lekcji.
Zaplanuj studiowanie tematu w grupach:
- Właściwości fizyczne aluminium.
- Właściwości chemiczne aluminium.
- Zastosowanie aluminium i jego obecność w przyrodzie.
Plan pracy grupowej:
Przestudiuj tekst i zaznacz informacje istotne dla twojego pytania;
- wykonać proponowane zadania;
- przygotuj prezentację na swój temat, opartą na zwięzłości, jasności i jasności prezentacji
Praca grupowa nad studiowaniem materiału.
Przygotowanie prezentacji na Twój temat.
Grupa 1.
Charakterystyka pierwiastka chemicznego aluminium według jego pozycji w PSCE.
Ćwiczenie:
- Sprawdź tekst.
- Podaj opis aluminium według pozycji w PSCE według planu:
A) numer seryjny.
B) masa atomowa.
C) okres (mały, duży).
D) grupa (podgrupa: główna lub drugorzędna).
D) znak chemiczny.
E) Budowa atomu (ładunek jądra, liczba protonów, elektronów, neutronów, wzór elektronowy).
I) tlenki.
K) lotne związki wodoru.
2. Omów wyniki w grupie i odpowiedz na pytania:
- Ile elektronów znajduje się na zewnętrznym poziomie atomu aluminium?
- Czy aluminium odda czy przyjmie te elektrony?
- Jaki stan utlenienia uzyska w tym przypadku jon glinu?
- Wniosek: do jakiej klasy związków należy aluminium (metal lub niemetal)
- Porównaj aktywność pierwiastka chemicznego aluminium z pierwiastkami z grup 1 i 2 tego samego okresu.
- Przygotuj prezentację na ten temat na podstawie na zwięzłość, jasność i jasność prezentacji.
Grupa 2
Właściwości fizyczne aluminium.
Ćwiczenie:
- Sprawdź tekst.
- Zaznacz materiał związany z Twoim pytaniem.
- Rozważ kolekcję „Aluminium i jego stopy”.
- Omów w grupie następujące pytania:
- a) Stan skupienia, kolor, połysk, gęstość (lekka lub ciężka), topliwość (łatwa lub ogniotrwała), przewodność elektryczna i cieplna, tworzywo sztuczne.
- b) Narysuj uzyskane dane w formie diagramu.
5. Przygotuj prezentację na ten temat w oparciu o: na zwięzłość i jasność.
Grupa 3.
Właściwości chemiczne aluminium.
Ćwiczenie:
- Sprawdź tekst.
- Zaznacz materiał związany z Twoim pytaniem.
- Zbadaj, jak zachowuje się aluminium w stosunku do złożonych substancji?
- Wypełnij laboratorium, korzystając z instrukcji
Ćwiczenie:
a) Przeprowadź eksperyment.
b) Omów zaobserwowane zjawiska w grupie.
C) Zapisz równanie reakcji.
D) wyciągać wnioski.
5. Przygotuj prezentację na ten temat, na podstawie zwięzłości, jasności i jasności prezentacji.
Grupa 4
Zastosowanie aluminium.
Ćwiczenie:
- Sprawdź tekst.
- Zaznacz materiał związany z Twoim pytaniem.
- Omów w grupie następujące pytania:
a) Jaka jest rola aluminium w życiu człowieka?
b) Wykorzystanie aluminium jako prostej substancji.
- Zrób schemat charakteryzujący zakres aluminium.
- Przygotuj przemówienie na ten temat, na podstawie zwięzłości, jasności i jasności prezentacji
- Sprawozdanie grup na temat badanych zagadnień.
Każda grupa, po wykonaniu wszystkich zadań, przedstawia schematyczne przedstawienie swojego pytania wraz z dyskusją i komentarzami, uczniowie robią notatki, przenoszą zaproponowane schematy do zeszytów, w wyniku wszystkich grup, streszczenie odniesienia na temat lekcji.
Wnioski na temat lekcji:
Ile elektronów znajduje się na zewnętrznym poziomie energetycznym atomu aluminium.
Jaki jest stopień utlenienia atomu glinu? Czemu? A jon?
- Za pomocą jakich eksperymentów udowodniliśmy, że aluminium jest metalem aktywnym?
Jakie substancje nazywamy amfoterycznymi?
- Na jakich właściwościach opierają się poniższe aplikacje?
Gdzie aluminium znajduje się najczęściej w ciele?
- Czy to możliwe długi czas przechowywać żywność w naczyniach aluminiowych?
- Praca domowa: § 13 do s. 60, ? 1, 4. Przygotuj prezentację dotyczącą zastosowania aluminium.
- Ostatnie słowo nauczyciele.
Nauczyciel dziękuje uczniom za współpracę, zaznacza mówców na tablicy.
Odniesienie.
Aluminium.
Główna podgrupa grupy III obejmuje pierwiastki: bor, glin, gal, ind, tal. Na zewnętrznej warstwie elektronowej atomy tych pierwiastków zawierają trzy elektrony (…ns2np1). Są to pierwiastki p. W reakcjach atomy tych pierwiastków są czynnikami redukującymi, z wyjątkiem niemetalicznego boru, który może być czynnikiem utleniającym. Wszystkie pierwiastki tej podgrupy wykazują najwyższy stopień utlenienia +3. Tworzą się wyższe tlenki Wodorotlenki E2O3 i E(OH)3, które wykazują właściwości amfoteryczne. W tej podgrupie największym zainteresowaniem cieszy się aluminium.
Aluminium w swojej wolnej postaci jest metalem srebrzystobiałym, ma połysk, wysoką przewodność cieplną i elektryczną (pod tym względem gorszą od miedzi), światło (gęstość 2,7 g/cm3) a jednocześnie jest metalem trwałym. Jest to miękki, ciągliwy metal, można go zwijać w folię, przeciągać w drut. Topi się w 6600C. W temperaturze 6000C aluminium staje się kruche i można je zmielić na ziarna lub proszek.
Aluminium to metal, którego powierzchnia jest zwykle pokryta cienką, trwałą warstwą tlenku. W postaci wiórków i proszku pali się jasno w powietrzu, wydzielając dużą ilość ciepła.
W temperaturze pokojowej aktywnie reaguje z halogenami, po podgrzaniu wchodzi w interakcje z siarką (2000C), azotem (8000C) i innymi niemetalami.
Stosunek glinu do substancji złożonych:
Glin rozpuszcza się w kwasie solnym o dowolnym stężeniu:
Aluminium rozpuszcza się w roztworach alkalicznych:
Aluminium odgrywa ważną rolę biologiczną w życiu człowieka. Bierze udział w budowie tkanek nabłonkowych i łącznych. Zawartość glinu w organizmie człowieka (na 70 kg masy ciała) wynosi 61 mg. Znajduje się we wszystkich narządach i tkankach: przede wszystkim w wątrobie, płucach, kościach mózgu. Głównym spożyciem glinu w organizmie jest żywność - są to produkty chlebowe, herbata (od 20 - 200 mg na 100 g produktu), ziemniaki - 4 mg na 100 g. produkt, żółta rzepa - 46 mg na 100 g produktu.
Podczas gotowania i przechowywania żywności w naczyniach aluminiowych zawartość aluminium w produktach podwaja się. Wzrost zawartości glinu we krwi powoduje pobudzenie ośrodkowego system nerwowy. Przy nadmiarze aluminium w organizmie zaburzona jest aktywność ruchowa, drgawki, zaburzenia pamięci, choroby wątroby i nerek. Wraz ze spadkiem zawartości glinu hamowany jest ośrodkowy układ nerwowy.
Obszary zastosowania aluminium są bardzo liczne. Ze względu na swoją lekkość i wytrzymałość aluminium i jego stopy są wykorzystywane w budowie samolotów i rakiet (aluminium nazywa się uskrzydlonym metalem), konstrukcji statków i samochodów; w budownictwie - do produkcji ram okiennych i drzwi, do produkcji przewodów elektrycznych do linii energetycznych wykorzystuje się lekkość i dobrą przewodność elektryczną aluminium. Przewodność cieplna i nietoksyczność są ważne w produkcji naczyń aluminiowych i folii do przechowywania produkty żywieniowe. Proszek aluminiowy jest podstawą do produkcji srebrnej farby do ochrony produktów żelaznych przed korozją. Zdolność aluminium do palenia się w powietrzu jasnym płomieniem jest wykorzystywana do przygotowania kolorowych fajerwerków i produkcji ognie.
BUDŻET GMINY INSTYTUCJA EDUKACYJNA
OGÓLNA SZKOŁA EDUKACYJNA № 81
Aluminium. Pozycja aluminium w układ okresowy i strukturę jego atomu. Odnajdywanie w naturze. Właściwości fizyczne i chemiczne aluminium.
nauczyciel chemii
Szkoła średnia MBOU №81
2013
Temat lekcji: Aluminium. Pozycja glinu w układzie okresowym i budowa jego atomu. Odnajdywanie w naturze. Właściwości fizyczne i chemiczne aluminium.
Cele Lekcji:
rozważ rozmieszczenie aluminium w przyrodzie, jego właściwości fizyczne i chemiczne, a także właściwości związków, które tworzy.
Postęp
1. Moment organizacyjny lekcji. 2. Nauka nowego materiału. Aluminiumgłówna podgrupa III grupy układu okresowego tworzą bor (B), (A l), gal (Ga), ind (In) i tal (T l). Jak widać z podanych danych, wszystkie te elementy zostały otwarte w XIX wiek.Odkrycie metali głównej podgrupy
III
grupy

W
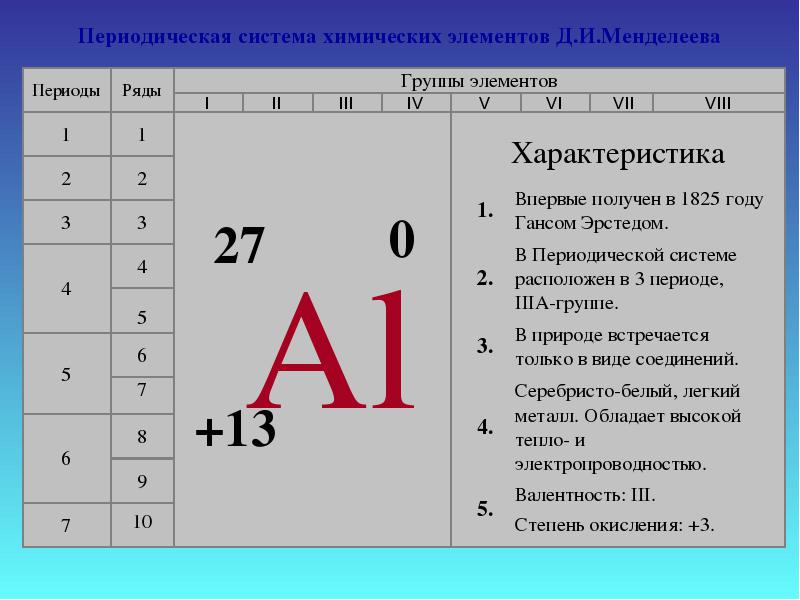
Bor jest niemetalem. Aluminium jest metalem przejściowym, podczas gdy gal, ind i tal są metalami pełnymi. Tak więc, wraz ze wzrostem promieni atomowych pierwiastków każdej grupy układu okresowego, właściwości metaliczne proste substancje zintensyfikować.W tym wykładzie przyjrzymy się bliżej właściwościom aluminium.1. Pozycja aluminium w tabeli D. I. Mendelejewa. Struktura atomu, pokazane stany utlenienia. Aluminiowy element znajduje się w III grupa, główna podgrupa „A”, III okres układu okresowego, numer seryjny nr 13, względna masa atomowa Ar(Al ) = 27. Jego sąsiad po lewej w tabeli to magnez, typowy metal, a po prawej krzem, który nie jest już metalem. Dlatego aluminium musi wykazywać właściwości pośrednie, a jego związki są amfoteryczne.Al+13) 2 ) 8 ) 3 , p jest elementem,
Stan podstawowy
1 s 2 2 s 2 2 s 6 3 s 2 3 s 1
Aluminium wykazuje stopień utlenienia +3 w związkach: Al 0 - 3 e - → Al +3 2. Właściwości fizyczne Aluminium w dowolnej formie to srebrzystobiały metal o wysokiej przewodności cieplnej i elektrycznej. Temperatura topnienia 650 o C. Aluminium ma niską gęstość (2,7 g/cm 3 ) - około trzykrotnie mniej niż żelaza czy miedzi, a przy tym jest to metal trwały.3. Bycie w naturze Pod względem rozpowszechnienia w przyrodzie zajmuje1 miejsce wśród metali i 3 miejsce wśród pierwiastków ustępuje tylko tlenowi i krzemowi. Procent aluminium w skorupa Ziemska według różnych badaczy jest to od 7,45 do 8,14% masy skorupy ziemskiej.W naturze aluminium występuje tylko w związkach (minerały). Niektórzy z nich: Boksyty - Al 2 O 3 H 2 O (z zanieczyszczeniami SiO 2 , Fe 2 O 3 , CaCO 3 ) Nefeliny - KNa 3 4 Alunity - KAl(SO 4 ) 2 2Al(OH) 3 Tlenek glinu (mieszaniny kaolinów z piaskiem SiO 2 , wapień CaCO 3 , magnezyt MgCO 3 ) Korund - Al 2 O 3 Skaleń (ortoklaz) - K 2 O×Al 2 O 3 ×6SiO 2 Kaolinit - Al 2 O 3 ×2SiO 2 × 2H 2 O Alunit - (Na,K) 2 SO 4 ×Al 2 (SO 4 ) 3 ×4Al(OH) 3 Beryl - 3BeO Al 2 O 3 6SiO 2Boksyt
4. Właściwości chemiczne aluminium i jego związków Aluminium łatwo wchodzi w interakcje z tlenem w normalnych warunkach i jest pokryte warstwą tlenku (daje matowy wygląd).Jego grubość wynosi 0,00001 mm, ale dzięki temu aluminium nie koroduje. Aby zbadać właściwości chemiczne aluminium, usuwa się warstwę tlenku. (Za pomocą papieru ściernego lub chemicznie: najpierw zanurzenie w roztworze alkalicznym, aby usunąć warstwę tlenku, a następnie w roztworze soli rtęci, aby utworzyć stop aluminium z rtęcią - amalgamat).I . Interakcja z prostymi substancjami Aluminium już w temperaturze pokojowej aktywnie reaguje ze wszystkimi halogenami, tworząc halogenki. Po podgrzaniu oddziałuje z siarką (200°C), azotem (800°C), fosforem (500°C) i węglem (200°C), z jodem w obecności katalizatora - wody: 2A l + 3 S \u003d A l 2 S 3 (siarczek glinu), 2A l + N 2 \u003d 2A lN (azotek glinu), A l + P = A l P (fosforek glinu), 4A l + 3C \u003d A l 4 C 3 (węglik glinu). 2 Al + 3 Ja 2 \u003d 2 A lI 3 (jodek glinu)Wszystkie te związki są całkowicie hydrolizowane z utworzeniem wodorotlenku glinu i odpowiednio siarkowodoru, amoniaku, fosfiny i metanu: Glin 2 S 3 + 6H 2 O = 2Al(OH) 3 + 3 godz 2 SGlin 4 C 3 + 12 godzin 2 O = 4Al(OH) 3 + 3CH 4 W postaci wiórów lub proszku pali się jasno w powietrzu, wydzielając dużą ilość ciepła: 4A l + 3 O 2 \u003d 2 A l 2 O 3 + 1676 kJ.
II. Interakcja ze złożonymi substancjami Interakcja z wodą : 2 Al + 6 H 2 O \u003d 2 Al (OH) 3 + 3 H 2 bez filmu tlenkowego Oddziaływanie z tlenkami metali: Aluminium jest dobrym środkiem redukującym, ponieważ jest jednym z aktywnych metali. Jest w serii aktywności zaraz po metalach ziem alkalicznych. Dlategoodnawia metale z ich tlenków . Taka reakcja - aluminotermia - służy do uzyskania czystych metali rzadkich, takich jak wolfram, wanad itp. 3 Fe 3 O 4 + 8 Al \u003d 4 Al 2 O 3 + 9 Fe + Q Mieszanka termitów Fe 3 O 4 oraz Al (proszek) - stosowany również w spawaniu termitowym. C r 2 O 3 + 2A l \u003d 2C r + A l 2 O 3 Interakcja z kwasami : Z roztworem kwasu siarkowego: 2 Al + 3 H 2 SO 4 \u003d Al 2 (SO 4) 3 + 3 H 2 Nie reaguje z zimnymi stężonymi siarkowymi i azotowymi (pasywaty). Dlatego kwas azotowy transportowany jest w zbiornikach aluminiowych. Po podgrzaniu aluminium jest w stanie zredukować te kwasy bez uwalniania wodoru: 2A l + 6H 2 SO 4 (stęż.) \u003d A l 2 (SO 4) 3 + 3 SO 2 + 6H 2 O, A l + 6H NO 3 (stęż.) \u003d A l (NO 3) 3 + 3 NO 2 + 3H2O. Interakcja z alkaliami . 2 Al + 2 NaOH + 6 H 2 O \u003d 2 Na Al (OH) 4 + 3 H 2 Na[ALE ja(ON) 4 ] – tetrahydroksoglinian sodu Zgodnie z sugestią chemika Gorbowa, podczas wojny rosyjsko-japońskiej, reakcja ta została wykorzystana do produkcji wodoru do balonów. Z roztworami soli: 2 Al + 3 CuSO 4 \u003d Al 2 (SO 4) 3 + 3 Cu Jeśli powierzchnię aluminium pociera się solą rtęci, następuje następująca reakcja: 2 Glin + 3 HgCl 2 = 2 AlCl 3 + 3 hgUwolniona rtęć rozpuszcza aluminium, tworząc amalgamat. 5. Zastosowanie aluminium i jego związków

Właściwości fizyczne i chemiczne aluminium doprowadziły do jego szerokiego zastosowania w technologii.Przemysł lotniczy jest głównym konsumentem aluminium. : Samolot 2/3 jest wykonany z aluminium i jego stopów. Samolot wykonany ze stali byłby zbyt ciężki i mógłby przewozić znacznie mniej pasażerów.Dlatego aluminium nazywa się uskrzydlonym metalem. Kable i przewody wykonane są z aluminium : przy tej samej przewodności elektrycznej ich masa jest 2 razy mniejsza niż odpowiednich produktów miedzianych.Biorąc pod uwagę odporność aluminium na korozję, toprodukcja części aparatury i pojemników na kwas azotowy, . Proszek aluminiowy jest podstawą w produkcji srebrnej farby do ochrony produktów żelaznych przed korozją, a także odbijania promieni cieplnych, taka farba jest stosowana do pokrywania magazynów ropy naftowej i kombinezonów strażackich.Tlenek glinu jest używany do produkcji aluminium, a także jako materiał ogniotrwały.Wodorotlenek glinu jest głównym składnikiem znanych leków Maalox, Almagel, obniżających kwasowość soku żołądkowego. Sole glinu są silnie zhydrolizowane. Ta właściwość jest wykorzystywana w procesie oczyszczania wody. Do oczyszczonej wody dodaje się siarczan glinu i niewielką ilość wapna gaszonego, aby zneutralizować powstały kwas. W rezultacie uwalniany jest wolumetryczny osad wodorotlenku glinu, który osadzając się zabiera ze sobą zawieszone cząstki zmętnienia i bakterii.Tak więc siarczan glinu jest koagulantem.6. Uzyskanie aluminium 1) Nowoczesna, opłacalna metoda produkcji aluminium została wynaleziona przez American Hall i Francuza Héroux w 1886 roku. Polega na elektrolizie roztworu tlenku glinu w stopionym kriolicie. Stopiony kriolit Na 3 AlF 6 rozpuszcza Al 2 O 3, jak woda rozpuszcza cukier. Elektroliza „roztworu” tlenku glinu w stopionym kriolicie przebiega tak, jakby kriolit był tylko rozpuszczalnikiem, a tlenek glinu był elektrolitem. 2Al 2 O 3 prąd elektryczny → 4Al + 3O 2 W angielskiej encyklopedii dla chłopców i dziewcząt artykuł o aluminium zaczyna się następującymi słowami: „23 lutego 1886 r. W historii cywilizacji rozpoczęła się nowa era metalu - era aluminium. Tego dnia Charles Hall, 22-letni chemik, pojawił się w swoim pierwszym laboratorium nauczycielskim z tuzinem małych kulek srebrzystobiałego aluminium w dłoni i z wiadomością, że znalazł sposób na wyprodukowanie tego metalu. tanio iw dużych ilościach. Więc Hall został założycielem American przemysł aluminiowy i anglosaski bohater narodowy jako człowieka, który zrobił wielki biznes na nauce. 2) 2Al 2 O 3 + 3 C \u003d 4 Al + 3 CO 2 TO INTERESUJĄCE:
- Metaliczne aluminium zostało po raz pierwszy wyizolowane w 1825 roku przez duńskiego fizyka Hansa Christiana Oersteda. Przepuszczając gazowy chlor przez warstwę gorącego tlenku glinu zmieszanego z węglem, Oersted wyizolował chlorek glinu bez najmniejszego śladu wilgoci. Aby przywrócić metaliczne aluminium, Oersted musiał potraktować chlorek glinu amalgamatem potasu. Po 2 latach niemiecki chemik Friedrich Wöller. Udoskonalił metodę, zastępując amalgamat potasu czystym potasem.
W XVIII i XIX wieku aluminium było głównym metalem jubilerskim. W 1889 roku w Londynie D.I. Mendelejew otrzymał cenny prezent za zasługi dla rozwoju chemii - wagi wykonane ze złota i aluminium.
Do 1855 roku francuski naukowiec Saint-Clair Deville opracował metodę uzyskiwania metalowe aluminium w skali technicznej. Ale metoda była bardzo kosztowna. Deville cieszył się szczególnym patronatem Napoleona III, cesarza Francji. Na znak swojego oddania i wdzięczności Deville wykonał dla syna Napoleona, nowonarodzonego księcia, elegancko grawerowaną grzechotkę - pierwszy "wyrób konsumencki" wykonany z aluminium. Napoleon zamierzał nawet wyposażyć swoich gwardzistów w aluminiowe kirysy, ale cena była wygórowana. W tym czasie 1 kg aluminium kosztował 1000 marek, czyli 5 razy droższe niż srebro. Dopiero wynalezienie procesu elektrolitycznego sprawiło, że aluminium stało się tak cenne jak konwencjonalne metale.
Czy wiesz, że aluminium dostające się do ludzkiego ciała powoduje zaburzenia układu nerwowego. Z jego nadmiarem zaburzony jest metabolizm. A środkami ochronnymi są witamina C, wapń, związki cynku.
Kiedy aluminium spala się w tlenie i fluorze, uwalniane jest dużo ciepła. Dlatego jest stosowany jako dodatek do paliwa rakietowego. Rakieta Saturn podczas lotu spala 36 ton proszku aluminiowego. Pomysł wykorzystania metali jako składnika paliwa rakietowego jako pierwszy zaproponował F.A. Zander.
Myśleć! Dlaczego tej reakcji nie można przeprowadzić w roztworze wodnym? №2. Uzupełnij równania reakcji chemicznych:
Al + H 2 SO 4 (roztwór) ->
Al + CuCl2 ->
Al + HNO 3 (stęż.) - t ->
Al + NaOH + H2O -> Nie. 3. Rozwiąż problem:
Stop aluminium-miedź został poddany działaniu nadmiaru stężonego roztworu wodorotlenku sodu podczas ogrzewania. Wypuszczono 2,24 litra gazu (i.n.o.). Oblicz procentowy skład stopu, jeśli jego masa całkowita wynosiła 10 g?4. Praca domowa Uwaga: podczas lekcji można wykorzystać prezentację"Aluminium. Pozycja glinu w układzie okresowym i budowa jego atomu. Odnajdywanie w naturze. Właściwości fizyczne i chemiczne aluminium.»
2.1.1 Pozycja glinu w układzie okresowym i budowa jego atomu
Aluminium należy do głównej podgrupy grupy III. Układ poziomów energii jest następujący:
3 Al 2e - , 8e - ,3e -
Ponieważ atomy glinu mają 3 elektrony na poziomie zewnętrznym, glin w związkach wykazuje stopień utlenienia 4-3.
Dochodzimy do tego samego wniosku, kierując się wyobrażeniami o naturze ruchu elektronów w atomach i ich lokalizacji nie tylko na poziomach energetycznych, ale także na podpoziomach. W atomie aluminium elektrony 3s 2 łatwo ulegają zniszczeniu i jeden elektron przechodzi przez orbital 3p:
Rezultatem są trzy niesparowane elektrony. Odpowiedz na pytanie 1 (s. 138).
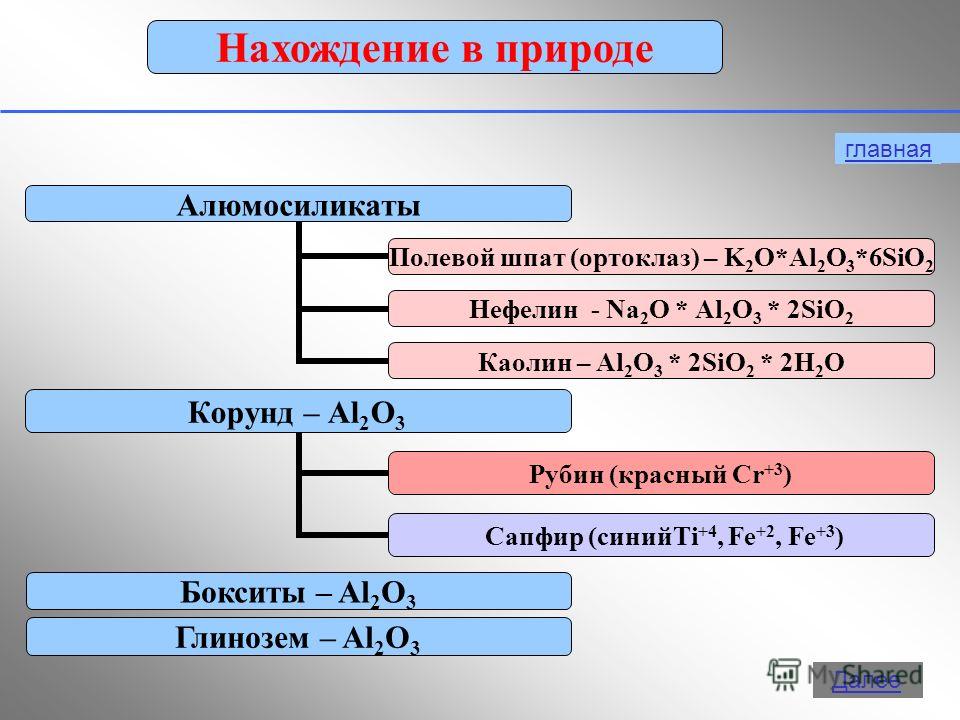
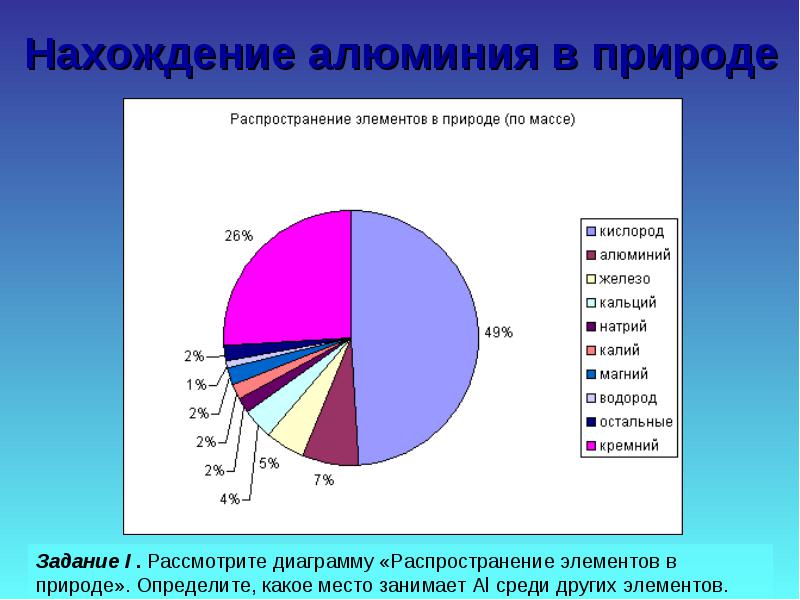
2.1.2 Znalezienie aluminium w przyrodzie, jego produkcji i właściwości
Aluminium jest trzecim najobficiej występującym pierwiastkiem w skorupie ziemskiej. Występuje tylko w związkach. Najważniejsze z nich pokazano na rysunku 19.
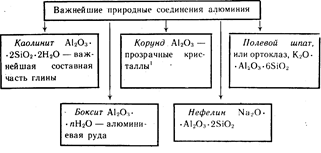
Barwne czerwone kryształy Al 2 O 3 - rubiny, koloru niebieskiego- szafiry.
Paragon fiskalny
W 1827 r. niemiecki chemik F. Wöhler uzyskał aluminium przez ogrzewanie chlorku glinu z metalami alkalicznymi z potasem lub sodem bez dostępu do powietrza.
AlCl3 +3K 3KCl + Al
Do produkcja przemysłowa aluminium, metody te są ekonomicznie nieopłacalne, dlatego opracowano metodę elektrochemiczną do otrzymywania aluminium z boksytów.
Właściwości fizyczne
Aluminium to srebrzystobiały metal, lekki (r=2,7 g/cm3), topi się w temperaturze 660 °C. Jest bardzo plastyczny, łatwo wciągany w drut i pieczony w arkuszach i folii. Pod względem przewodności elektrycznej aluminium ustępuje tylko srebru i miedzi (stanowi 2/3 przewodności elektrycznej miedzi).
Właściwości chemiczne
W serii napięć elektrochemicznych aluminium znajduje się za najbardziej aktywnymi metalami. Jednak z codziennego doświadczenia wiadomo, że na produkty aluminiowe (naczynia itp.) nie ma wpływu ani tlen, ani woda, nawet w temperaturze wrzenia. Na aluminium nie ma również wpływu stężony zimny kwas azotowy. Wynika to z obecności cienkiej warstwy tlenku na powierzchni aluminium, która chroni ją przed dalszym utlenianiem. Jeśli powierzchnię aluminium pociera się solą rtęci, następuje następująca reakcja:
2А1 + 3HgCl2 ® 2А1С1 3 + 3Hg
Uwolniona rtęć rozpuszcza aluminium i powstaje jego stop z rtęcią - amalgamat aluminiowy. Folia nie zatrzymuje się na połączonej powierzchni, dlatego aluminium w normalnych warunkach reaguje z wodą (rys. 46):
2А1 + 6НОН ® 2А1(ОН) 3 ¯ + 3Н 2
W podwyższonych temperaturach aluminium reaguje z wieloma niemetalami i złożonymi substancjami bez amalgamacji:

Aplikacja
Aluminium wykorzystywane jest do produkcji różnych stopów. Najbardziej rozpowszechnione są duraluminium zawierające miedź i magnez oraz silumin – stopy aluminium z krzemem. Głównymi zaletami tych stopów są lekkość i wysoka wytrzymałość. Wspomniane stopy są szeroko stosowane w budowie samolotów, samochodów, statków i przyrządów, w technologii rakietowej oraz w budownictwie. Aluminium w postaci czystego metalu jest wykorzystywane do produkcji przewodów elektrycznych i różnych urządzeń chemicznych.
Aluminium stosuje się również do aluminizacji, czyli nasycania aluminium powierzchni wyrobów stalowych i żeliwnych w celu zabezpieczenia ich przed korozją.
W praktyce często stosowany jest termit (mieszanina tlenku Fe 3 O 4 z proszkiem aluminiowym). Jeśli ta mieszanina zostanie podpalona (za pomocą taśmy magnezowej), następuje gwałtowna reakcja z uwolnieniem duża liczba ciepło:
8Al + 3Fe 3 O 4 ® 4Al 2 O 3 + 9Fe
Proces ten wykorzystywany jest w tzw. spawaniu termitowym, a także do otrzymywania niektórych metali w postaci swobodnej.
Odpowiedz na pytania 2-6 (s. 138). Rozwiąż zadania 1 - 2 (s. 138).
2.1.3 Najważniejsze związki glinu
Tlenek glinu
Al 2 O 3 można uzyskać w następujący sposób:
1. Przez bezpośrednie spalanie proszku aluminiowego (przez wdmuchiwanie proszku aluminiowego do płomienia palnika):
4Al + 3O 2 ® 2А1 2 O 3
2. Przez przekształcenie według poniższego schematu:
Tlenek glinu jest substancją stałą, ogniotrwałą (temp. pl. 2050 °C) biały kolor.
Zgodnie ze swoimi właściwościami chemicznymi jest tlenkiem amfoterycznym (I, § 37). Reaguje z kwasami, wykazuje właściwości tlenków zasadowych:
A1 2 O 3 + 6HC1 2A1C1 3 + 3H 2 O
Al 2 O 3 + 6H + + 6С1 - 2Al 3+ + 6С1 - + 3Н 2 O
A1 2 O 3 + 6H + 2A1 3+ + 3H 2O
Tlenek glinu reaguje z alkaliami i wykazuje właściwości tlenków kwasowych. Ponadto podczas fuzji powstają sole kwasu metaglinu HA1O 2, czyli metagliniany:
Al 2 O 3 + 2NaOH 2NaA10 2 + H 2 0
W obecności wody reakcja przebiega inaczej:
A1 2 O 3 + 2NaOH + H 2 O ® 2
Wynika to z faktu, że w roztworze wodnym glinian sodu NaA1O 2 przyłącza jedną lub dwie cząsteczki wody, co można przedstawić w następujący sposób:
a) NaAlO2-H2O lub NaH2AlO3; b) NaA1O2-2H2O lub NaAl (OH) 4.
wodorotlenek glinu
Wodorotlenek glinu A1 (OH) 3 otrzymuje się w reakcji roztworu alkalicznego z roztworami soli glinu (roztwór alkaliczny nie może być przyjmowany w nadmiarze):
AlCl3 + NaOH® Al(OH)3 ¯ + 3NaCl
A1 3+ + 3Cl - + 3Na + + 3OH - ® Al(OH) 3 ¯ + 3Na + + 3С1 -
Al 3+ + 3OH - ® A1 (OH) 3 ¯
Jeśli białą galaretowatą masę wodorotlenku glinu zostanie wyizolowana z roztworu i wysuszona, otrzymuje się białą substancję krystaliczną, która praktycznie nie rozpuszcza się w wodzie.
Wodorotlenek glinu (podobnie jak jego tlenek) ma właściwości amfoteryczne. Jak wszystkie zasady, wodorotlenek glinu reaguje z kwasami. Gdy wodorotlenek glinu jest skondensowany z alkaliami, powstają metagliniany i nie roztwory wodne- hydraty metaglinianów:
А1(OH)3 + NaOH NaА1O2 + 2Н2O
A1 (OH) 3 + NaOH ® NaH 2 A 1 O 3 + H 2 O
Sole glinu otrzymuje się głównie w wyniku oddziaływania glinu metalicznego z kwasami. Zgodnie z właściwościami fizycznymi są to stałe substancje krystaliczne, łatwo rozpuszczalne w wodzie. Właściwości chemiczne soli glinu są podobne do właściwości innych soli (s. 98-99). Ponieważ sole glinu tworzą słaba zasada i mocny kwas, ulegają hydrolizie w roztworach wodnych (s. 18).
Odpowiedz na pytania 7-10 (s. 138). Rozwiąż problem 3 (s. 138).
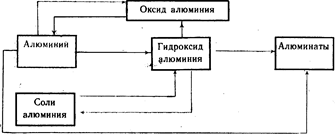
Genetyczny związek glinu z jego najważniejszymi związkami (Schemat 20).
Zatem z powyższego można wywnioskować, że program nauczania bardzo niewiele godzin poświęca się na studiowanie tego tematu, a poza tym praktycznie nie ma informacji o środowiskowych aspektach tego tematu.
Azot tworzy szereg tlenków, które formalnie odpowiadają wszystkim możliwym stopniom utlenienia od +1 do +5: N 2 O, NO, N 2 O 3, NO 2, N 2 O 5, jednak tylko dwa z nich to tlenek azotu ( II) i tlenkowy azot(IV) są nie tylko stabilne w normalnych warunkach, ale także aktywnie uczestniczą w naturalnym i przemysłowym obiegu azotu.
2.2.1 Niektóre związki azotu i ich właściwości 1.2.1.1. Tlenki azotu
N 2 +1 O - podtlenek azotu (I), podtlenek azotu, gaz „rozweselający”, tlenek niesolący. Uzyskaj N 2 O przez rozkład azotanu amonu:
N 2 O ma delikatny przyjemny zapach i słodkawy smak. Nie reaguje z tlenem, wodą, roztworami kwasów i zasad. Rozkłada się na pierwiastki w temperaturach powyżej 500 ° C, innymi słowy jest dość stabilny.
Struktura: tlen ma 2 niesparowane elektrony, azot ma 3 - tworzy się podwójne wiązanie, a jeden niesparowany elektron w pozostałej części. Można założyć, że cząsteczki NO połączą się w pary i utworzą dimeryczną cząsteczkę ONNO. Struktura cząsteczki: cząsteczka liniowa O=N=N, w której centralny atom N jest czterowartościowy. Tworzy dwa podwójne wiązania: jedno z tlenem zgodnie z typowym schematem tworzenia wiązania kowalencyjnego (dwa elektrony azotu, dwa elektrony tlenu), drugie z atomem azotu (który łączy dwa z trzech niesparowanych elektronów i tworzy pustą orbitę z powodu do tego), jedno z wiązań jest kowalencyjne, drugie jest akceptorem dawcy (ryc. 1).
Instalacja do produkcji tlenku azotu (I) składa się ze statywów, probówek, korka z rurką wylotową gazu, krystalizatora, cylindra i lampy alkoholowej (ryc. 2). NH 4 NO 3 umieszcza się w probówce, zamyka korkiem z rurką wylotową gazu i ogrzewa. Gaz gromadzony jest w butli wypełnionej wodą.

Ryż. 1. Cząsteczka tlenku azotu (I) - N 2 O
Tlenek N 2 O rozkłada się po podgrzaniu:
Tlenek N 2 O reaguje z wodorem:
N +2 O - tlenek azotu (II), tlenek nie tworzący soli. NO otrzymuje się w reakcji miedzi z kwasem HNO 3 (różnic.) (rys. 3).
Kryształowa komórka molekularny; cząsteczka jest lekka, słabo polarna (elektroujemność tlenu jest nieco wyższa niż azotu). Można założyć, że temperatury topnienia i wrzenia będą niskie, ale wyższe niż azotu, ponieważ polarność cząsteczki umożliwia połączenie elektrostatycznych sił przyciągania z prostymi siłami międzycząsteczkowymi. Tworzenie się dimeru również przyczynia się do wzrostu temperatury wrzenia. Struktura cząsteczki również sugeruje niską rozpuszczalność w wodzie. Tlenek azotu (II) jest bezbarwny i bezwonny.
Aby otrzymać tlenek azotu (II), kilka wiórów miedzi umieszcza się w probówce i wlewa rozcieńczony kwas azotowy. Probówka zamykana jest korkiem z rurką wylotową gazu i mocowana na statywie. Koniec rurki wylotowej gazu jest opuszczany do formy z wodą, a następnie do cylindra (rys. 3). Po podgrzaniu uwalnia się NO. NO łatwo utlenia się tlenem z powietrza, czyli działa jako czynnik redukujący:
![]()
W reakcji z kwaśny gaz tlenek NO - środek utleniający:
![]()
N +2 2 O 3 - tlenek azotu (III), bezwodnik azotawy (odpowiada kwasowi azotowemu HNO 2 i solom azotynowym); jest tlenkiem kwasowym, posiada wszystkie właściwości tlenków kwasowych. Uzyskaj tlenek N 2 O 3 w reakcji:
NO 2 + NO N 2 O 3.
N +4 O 2 - tlenek azotu (IV), dwutlenek azotu, brązowy gaz (toksyczny).
Rozważmy elektrony azotu w cząsteczce NO. Jest to niesparowany elektron, wolna para elektronów i jeszcze dwa elektrony związane z tlenem – w sumie pięć. A atom tlenu „wchodzący w kontakt” ma sześć elektronów na czterech orbitalach. Jeśli ułożysz je dwa po drugim, jeden orbital pozostanie wolny. To właśnie ta przestrzeń zajmuje para elektronów atomu azotu (ryc. 4, 5).
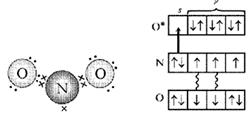
Ryż. 4. Schemat struktura elektroniczna Cząsteczki NO 2 (pierwsza opcja). (Kropki oznaczają elektrony atomów O, krzyżyki oznaczają elektrony atomu N)
Ryż. 5. Schemat struktury elektronowej cząsteczki NO 2 (wersja druga). (Gwiazdka wskazuje wzbudzony atom O, strzałka wskazuje wiązanie donor-akceptor.
Ponieważ para elektronów znajdujących się na orbicie s „połączyła się”, po prostu musi przejść hybrydyzację. Powstaje pytanie: jakiego typu hybrydyzacji używa atom? Odpowiedź: trzy orbitale elektronowe azotu są w stanie hybrydyzacji sp2. Cząsteczka NO 2 jest kanciasta, kąt wynosi 134° (kąt jest większy niż 120°, ponieważ 1 elektron odpycha od siebie elektrony słabsze niż para elektronów) (rys. 6, 7).
Sieć krystaliczna jest jednak molekularna, ponieważ sama cząsteczka jest cięższa od NO, a jej tendencja do dimeryzacji jest zauważalnie większa, substancja ta powinna topić się i wrzeć w zauważalnie wyższych temperaturach. Temperatura wrzenia wynosi 21 ° C, dlatego w normalnych warunkach - 20 ° C i 760 mm Hg. Sztuka. – płynny tlenek azotu (IV).
Tlenek azotu (IV) rozpuszcza się w wodzie, jednocześnie z nią reagując iw tym przypadku otrzymuje się jednocześnie dwa kwasy.


Ryż. 6. Cząsteczka NO 2 - widok z góry
Ryż. 7. Cząsteczka NO 2 - widok z boku, od strony wiązania donor-akceptor. (Drugi atom tlenu nie jest widoczny poza orbitalami atomu azotu. Zacienione kółka to zhybrydyzowane orbitale atomowe skierowane w stronę czytelnika.)
Tlenek azotu (IV) ma zarówno charakterystyczny ostry zapach, jak i czerwono-brązowy kolor, których odcienie różnią się od siebie w zależności od stężenia. To dla tego koloru emisje tlenków azotu do atmosfery nazywane są „lisim ogonem”.
Reakcje tlenków NO 2
1) Z wodą:
2NO 2 + H 2 O \u003d HNO 3 + HNO 2.
2) Z alkaliami:
2NO 2 + 2NaOH \u003d NaNO 3 + NaNO 2 + H 2 O.
3) Dimeryzacja przy chłodzeniu:
![]()
W temperaturze -11°C równowaga jest całkowicie przesunięta w prawo, aw temperaturze +140°C całkowicie w lewo.
N +5 2 O 5 - tlenek azotu (V), bezwodnik azotowy, tlenek kwasowy, silny utleniacz. Tlenek N 2 O 5 łatwo rozkłada się:
2N 2 O 5 \u003d 4NO 2 + O 2.
2.2.1.2 Kwas azotowy
Spośród wodorotlenków azotu rozważymy najbardziej wielotonażowy - kwas azotowy.
Cząsteczka kwasu azotowego jest polarna (ze względu na różną elektroujemność tlenu i wodoru, ponieważ azot jest jakby ukryty wewnątrz cząsteczki) i asymetryczna. Wszystkie trzy kąty występujące w nim między wiązaniami azotu i tlenu są różne. Formalny stopień utlenienia azotu jest najwyższy (+5). Ale jednocześnie na atomie azotu są tylko 4 wiązania z innymi atomami - wartościowość azotu wynosi 4.
Strukturę cząsteczki łatwiej zrozumieć, jeśli weźmiemy pod uwagę proces jej otrzymywania. Kwas azotowy otrzymuje się w reakcji tlenku azotu (IV) z wodą (w obecności tlenu): dwie cząsteczki NO 2 jednocześnie „atakują” cząsteczkę wody swoimi niesparowanymi elektronami, w wyniku czego powstaje wiązanie między wodorem i tlenem nie rozbite jak zwykle (para elektronów w tlenie i „nagim protonie”), a jedna cząsteczka NO 2 dostaje wodór ze swoim elektronem, druga - rodnik OH (rys. 8). Powstają dwa kwasy: oba kwasy są silne, oba szybko oddają swój proton najbliższym cząsteczkom wody i ostatecznie pozostają w postaci jonów NO 2 - i NO 3 -. Jon NO 2 jest niestabilny, dwie cząsteczki HNO 2 rozkładają się na wodę, NO 2 i NO. Tlenek NO reaguje z tlenem, zamieniając się w NO 2 i tak dalej, aż do uzyskania samego kwasu azotowego.
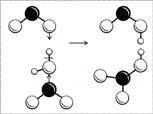
Ryż. 8. Schemat powstawania cząsteczek kwasu azotowego i azotawego. (Czarna kula to atom N, duże białe kulki to atomy O, małe białe kulki to atomy H.)
Formalnie okazuje się, że atom azotu jest połączony z jednym atomem tlenu wiązaniem podwójnym, a z drugim zwykłym wiązaniem pojedynczym (ten atom tlenu jest również połączony z atomem wodoru). Azot w HNO 3 jest połączony z trzecim atomem tlenu wiązaniem donor-akceptor, przy czym atom azotu działa jako donor. Hybrydyzacja atomu azotu w tym przypadku powinna być sp 2 ze względu na obecność podwójnego wiązania, które determinuje strukturę - płaski trójkąt. W rzeczywistości okazuje się, że rzeczywiście fragment atomu azotu i trzech atomów tlenu to płaski trójkąt, tylko w cząsteczce kwasu azotowego ten trójkąt jest niepoprawny – wszystkie trzy kąty ONO są różne, a więc różne boki trójkąta. Kiedy cząsteczka dysocjuje, trójkąt staje się regularny, równoboczny. Oznacza to, że zawarte w nim atomy tlenu stają się równoważne. Wszystkie połączenia stają się takie same.
Właściwości fizyczne kwasu azotowego
Zjonizowany związek, nawet jeśli tylko częściowo, jest trudny do przekształcenia w gaz. Zatem temperatura wrzenia powinna być wystarczająco wysoka, ale przy tak małej masie cząsteczkowej temperatura topnienia nie powinna być wysoka. Dlatego stan skupienia w 20°C jest płynny. Jeśli chodzi o rozpuszczalność, podobnie jak wiele innych cieczy polarnych, kwas azotowy łatwo miesza się z wodą w dowolnym stosunku. Czysty kwas azotowy jest bezbarwny i bezwonny. Jednak ze względu na rozkład na tlen i tlenek azotu (IV), który się w nim rozpuszcza, możemy powiedzieć, że zwykły stężony kwas azotowy ma żółto-brązowy kolor i ostry zapach charakterystyczny dla NO 2. Zobaczmy, jak budowa cząsteczki kwasu azotowego wpływa na jego właściwości chemiczne.
HNO 3 jest silnym środkiem utleniającym
Gdy HNO 3 wchodzi w interakcję z metalami (M), wodór nie jest uwalniany:
M + HNO 3 ® sól + woda + gaz.
Mieszanina HNO 3 (stęż.) z HCl (stęż.) w stosunku objętościowym 1:3 (1 V HNO 3 + 3 V HCl) nazywana jest „aqua regia”.
Au + HNO 3 + 3HCl = AuCl 3 + NO + 2H 2 O.
Kwas azotowy nie reaguje z innymi kwasami w formie wymiany lub reakcji złożonych. Jest jednak całkiem zdolny do reagowania jako silny środek utleniający. W mieszaninie stężonych kwasów azotowego i chlorowodorowego, reakcje odwracalne, którego istotę można uogólnić równaniem:
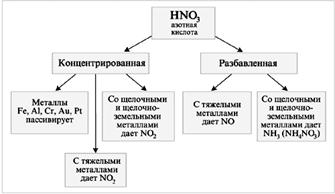
Powstały chlor atomowy jest bardzo aktywny i łatwo pobiera elektrony z atomów metali, a jon chlorkowy tworzy stabilne jony złożone z powstałymi jonami metali. Wszystko to pozwala na przekształcenie nawet złota w roztwór. Stężony H 2 SO 4 jako silny środek odwadniający sprzyja reakcji rozkładu kwasu azotowego na tlenek azotu (IV) i tlen. Kwas azotowy jest jednym z mocnych kwasów nieorganicznych i naturalnie reaguje z zasadami. Reaguje również z nierozpuszczalnymi wodorotlenkami i zasadowymi tlenkami.
Podczas studiowania tematu „Azot. Związki azotu” wykorzystuje podręcznik chemii pod redakcją G.E. Rudzitis, F.G. Feldman, także podręcznik do klasy 9, pod redakcją N.S. Achmetow. Materiały dydaktyczne służy jako książka o chemii dla klas 8-9, pod redakcją A. M. Radetsky'ego, V. P. Gorshkova; wykorzystywane są zadania do samodzielnej pracy w chemii dla klasy 9, pod redakcją R.P. Surowcewa, Św. Sofronowa; służy zbiór problemów z chemii Liceum oraz dla kandydatów na uniwersytety, pod redakcją G.P. Chomczenko, I.G. Chomczenko. Na przestudiowanie tego tematu przeznaczono 7 godzin.
ROZDZIAŁ 3. STOSUNKI MIĘDZYTEMATOWE PODCZAS STUDIOWANIA III I V GRUP D.I.
Bor nigdy nie występuje w naturze w stanie wolnym, zawsze okazuje się być związany z tlenem. W tej postaci występuje w kwasie borowym H 3 BO 3, który znajduje się w wodach gorących źródeł na terenach wulkanicznych. Ponadto w przyrodzie występują liczne sole kwasu borowego. Spośród tych soli najbardziej znanym jest boraks lub cynk Na 2 B 4 O 7 . 10H 2 O. Boracyt 2Mg 3 B 8 O 15 ma znaczenie techniczne. MgCl 2, pandermit Ca 2 B 6 O 11. 3H 2 O, kolemanit Ca 2 B 6 O 11. 5H 2 O, kernit Na 2 B 4 O 7. 4H2O.
Należy wskazać następujące minerały, które są pochodnymi kwasu borowego: borokalcyt CaB 4 O 7. 4H 2 O, bor-natrokalcyt NaCaB 5 O 9. 6H 2 O, hydroboracyt MgCaB 6 O 11. 6H 2 O, boromagnezyt 2Mg 5 B 4 O 11. 5H 2 O, singalit MgAlBO 4 i inne.
3.1.1.2 Rola biochemiczna
Bor i jego związki mają bardzo ważne w gospodarka narodowa. Izotop 5 10 B, który absorbuje neutrony, jest stosowany w technologii jądrowej do spowalniania reakcji łańcuchów jądrowych. Boraks i kwas borowy są od dawna stosowane w medycynie jako środki antyseptyczne.
Aktywność fizjologiczna i biologiczna boru jest bardzo wysoka. Bor może mieć wpływ procesy krytyczne biochemia zwierząt i roślin. Wraz z Mn, Cu, Zn i Mo bor jest jednym z pięciu podstawowych pierwiastków śladowych. Bor jest skoncentrowany w kościach i zębach, w mięśniach, w szpiku kostnym, wątrobie i tarczycy. Prawdopodobnie przyspiesza wzrost i rozwój organizmów. Widać to po wpływie boru na rośliny. Przy głodzie boru znacznie zmniejsza się plon, a zwłaszcza liczba nasion. Dla życia zwierząt ważne jest, aby znaleźć go w mleku (krowie) i żółtku jajka kurze. Niektóre rośliny (trawy pastewne i buraki cukrowe) gromadzą kilka gramów boru na hektar ziemi. Bor znajduje się w znacznych ilościach w tkankach tłuszczowych niektórych zwierząt wypasanych na pastwiskach wzbogaconych borem. Skład związków boru w organizmie jest nieznany. Ustalono, że bor hamuje amylazę jelitową i proteinazy jelitowe, wzmacnia działanie insuliny i hamuje utlenianie adrenaliny, osłabia witaminy B2 i B12. Przy nadmiarze boru pojawia się borowe zapalenie jelit. Nadmiar boru prowadzi do chorób roślin. Pszenica i owies cierpią w obecności 0,7 – 0,8 mgV/kg gleby. Walkę z zasoleniem gleby borem prowadzi się poprzez płukanie gleb borowych.
A dydaktyczne podstawy organizacji edukacji umożliwiają łatwiejsze wyjaśnienie materiału badanego na lekcjach fizyki podczas studiowania tematu „Podstawy elektrodynamiki”. Analiza różne technologie umożliwiła opracowanie autorskiej technologii rozwijania u uczniów koncentracji na komunikacji dialogowej w grupowej formie edukacji. Od tego, jak poprawnie zostanie zbudowany proces uczenia się podczas korzystania z ...
W związku z tym konieczne staje się rozważenie kwestii związku między fizyką molekularną a chemią w szkole średniej. W badaniach fizyki molekularnej jej związek z chemią przejawia się w dwóch głównych kierunkach. Pierwszym z nich jest wykorzystanie wiedzy studentów zdobytej w procesie studiowania chemii jako materiału do udowodnienia głównych przepisów fizyki molekularnej. Drugi...
Cele Lekcji:
Opisz aluminium według jego pozycji w układzie okresowym pierwiastków chemicznych.
W oparciu o strukturę atomu rozważ jego właściwości fizyczne i chemiczne.
Zapoznanie się z przemysłową metodą wytwarzania aluminium i wskazanie obszarów jego zastosowania.

Z historii odkrycia aluminium… „Srebro z gliny”
Podczas odkrycia aluminium metal ten był droższy od złota. Brytyjczycy chcieli uhonorować wielkiego rosyjskiego chemika bogatym prezentem
D.I. Mendelejew przedstawił mu wagę chemiczną, w której jedna filiżanka była wykonana ze złota, a druga z aluminium. Kubek wykonany z aluminium stał się droższy od złota. Powstałe „srebro z gliny” zainteresowało nie tylko naukowców, ale także przemysłowców, a nawet cesarza Francji.


Zastosowanie aluminium






przemysł wojskowy

Budowa

Odnajdywanie aluminium w przyrodzie
Naturalne związki glinu
Zadanie II. Rozważ próbki związków naturalnych, porównaj je pod względem twardości, wytrzymałości, koloru, oblicz zawartość Al w niektórych z nich.
Nephelines-KNa34
- Tlenek glinu (mieszaniny kaolinów z piaskiem SiO2, wapień CaCO3, magnezyt MgCO3)
- Korund (szafir, rubin, szmergiel) - Al2O3
- Skaleń - (K,Na)2O Al2O3 6SiO2, Ca
- Kaolinit - Al2O3 2SiO2 2H2O
- Beryl (szmaragd, akwamaryn) - 3BeO Al2O3 6SiO2

Właściwości fizyczne aluminium. Praca laboratoryjna.
karta instrukcji.
2. Określ stan skupienia aluminium.
3. Jakiego koloru jest płyta?
4. Ustal, czy ta płyta ma połysk?
5. Zanurz rekord ¼ jego długości w szklance gorącej wody na 10-15 sekund.
Wyjmij płytkę z wody, wytrzyj ją serwetką i sprawdź, czy aluminium ma przewodność cieplną?
6. Chwyć folię aluminiową. Sprawdź, czy aluminium jest plastyczne? Czy to lekki metal?
7. Umieść aluminiową płytkę w szklance zimnej wody, przekręć kilka razy. Czy obserwuje się rozpuszczanie aluminium?
8. Krótko zapisz swoje obserwacje zgodnie z planem:
- stan skupienia,
- kolor,
- połysk,
- przewodność cieplna,
- plastyczność,
- rozpuszczalność w wodzie.


Praca laboratoryjna: „Właściwości chemiczne aluminium”.
karta instrukcji.
1. Weź dwie probówki. Włóż do każdego kawałek aluminium. Do jednej z nich wlej 1-2 ml roztworu kwasu solnego, a do drugiej taką samą ilość roztworu kwasu siarkowego. Co oglądasz? Lekko podgrzej probówki. Zapisz równania odpowiednich reakcji.
2. Włóż kawałek aluminium do probówki. Dodaj 1,5 ml stężonego kwasu siarkowego. Co oglądasz? Zapisz równanie reakcji.
3. Umieść kawałek aluminium w probówce i dodaj roztwór alkaliczny. Podgrzać zawartość probówki. Co się dzieje? Zapisz równanie reakcji.
4. Umieść wyniki wykonanej pracy w tabeli:


Pozyskiwanie aluminium w przemyśle

Test
1. Jaka jest elektroniczna konfiguracja atomu aluminium?
A) 1s22s22p1 B) 1s22s22p3
B) 1s22s22p63s23p1 D) 1s22s22p63s23p63d14s2
2. Z którą z poniższych substancji reaguje aluminium?
A) CaO B) HCl
B) Cl2 D) NaOH
3. Które ze wskazanych metali są bardziej aktywne,
niż aluminium?
A) Na B) Cu
B) Ca D) Fe
4. Najbardziej charakterystyczny stan utlenienia aluminium:
A) +1 B) +2
C) +3 D) +4
5. Aluminium w reakcjach chemicznych wykazuje następujące właściwości:
A) środek utleniający B) związek obojętny
C) środek redukujący D) środek utleniający i środek redukujący
6. W przemyśle aluminium uzyskuje się:
A) użycie metalicznego sodu jako środka redukującego
B) elektroliza stopionego tlenku glinu
C) przy użyciu tlenku węgla (P) jako środka redukującego
D) elektroliza roztworu soli glinu



