Budowa i właściwości atomów. Aluminium Al - element głównej podgrupy grupy III (grupa IIIA) III okresu Układ okresowy D. I. Mendelejew.
Atom aluminium zawiera trzy elektrony na zewnętrznym poziomie energii, z których łatwo oddaje się podczas oddziaływań chemicznych. Przodek podgrupy i wyższy sąsiad aluminium, bor, ma mniejszy promień atomowy (dla boru 0,080 nm, dla aluminium 0,143 nm). Dodatkowo atom glinu posiada jedną pośrednią warstwę ośmioelektronową (2e; 8e; 3e), która zapobiega przyciąganiu zewnętrznych elektronów do jądra. Dlatego właściwości redukujące atomów glinu są znacznie wyraźniejsze niż atomów boru, które wykazują właściwości niemetaliczne.
W prawie wszystkich swoich związkach aluminium ma stopień utlenienia +3.
Aluminium to prosta substancja. Srebrzystobiały lekki metal. Topi się w 660 °C. Jest bardzo plastyczny, łatwo wciągany w drut i zwijany w folię o grubości do 0,01 mm. Posiada bardzo wysoką przewodność elektryczną i cieplną. Tworzy lekkie i mocne stopy z innymi metalami.
Aluminium jest bardzo aktywnym metalem. W szeregu napięć znajduje się bezpośrednio za metalami alkalicznymi i ziem alkalicznych. Jednak w temperaturze pokojowej w powietrzu aluminium się nie zmienia, ponieważ jego powierzchnia pokryta jest bardzo mocną cienką warstwą tlenku, która chroni metal przed działaniem składników powietrza i wody.
Jeśli proszek aluminiowy lub cienka folia aluminiowa zostaną mocno podgrzane, zapalą się i spłoną olśniewającym płomieniem:
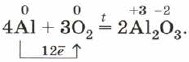
Obserwujesz tę reakcję, gdy płoną ognie i fajerwerki.
Aluminium, jak wszystkie metale, łatwo reaguje z niemetalami, zwłaszcza w postaci sproszkowanej. Aby reakcja mogła się rozpocząć, konieczne jest wstępne ogrzewanie (z wyjątkiem reakcji z halogenami - chlorem i bromem), ale wtedy wszystkie reakcje aluminium z niemetalami przebiegają bardzo szybko i towarzyszy im uwalnianie duża liczba ciepło:

Aluminium dobrze rozpuszcza się w rozcieńczonych kwasach siarkowym i chlorowodorowym:

Jednak stężony kwas siarkowy i azotowy pasywują aluminium, tworząc na powierzchni metalu gęstą, trwałą warstwę tlenku, która zapobiega dalszej reakcji. Dlatego kwasy te transportowane są w cysternach aluminiowych.
Jak już wiesz, tlenek i wodorotlenek glinu mają właściwości amfoteryczne. Aluminium rozpuszcza się w roztwory wodne zasady, tworzące sole - gliniany, które nazywane są kompleksem 1:
- 1 Gdy wodorotlenek i tlenek glinu wchodzą w interakcję z roztworami alkalicznymi, sole złożone, na przykład Na.
Aluminium jest szeroko stosowane w metalurgii do pozyskiwania metali - chromu, manganu, wanadu, tytanu, cyrkonu z ich tlenków. Jak pamiętasz, ta metoda nazywa się aluminotermią. W praktyce często stosuje się termit - mieszaninę Fe3O 4 z proszkiem aluminiowym. Jeśli ta mieszanina zostanie podpalona, na przykład za pomocą taśmy magnezowej, następuje reakcja energetyczna z uwolnieniem dużej ilości ciepła:
Uwolnione ciepło wystarcza do całkowitego stopienia powstałego żelaza, więc proces ten jest wykorzystywany do spawania wyrobów stalowych.
Aluminium jest bardzo silnie związane w związkach naturalnych z tlenem i innymi pierwiastkami i może być z tych związków wyizolowane. metody chemiczne bardzo trudny. Aluminium można otrzymać przez elektrolizę - rozkład stopionego jego tlenku Al 2 O 3 na jego części składowe za pomocą prąd elektryczny. Ale temperatura topnienia tlenku glinu wynosi około 2050 ° C, więc do przeprowadzenia elektrolizy potrzeba dużo energii.
Aluminium stało się metalem dostępnym technicznie po tym, jak amerykańscy i francuscy naukowcy C. Hall i P. Héroux ustalili w 1886 r., że tlenek glinu dobrze rozpuszcza się w kriolicie topionym w temperaturze 1000°C, którego formuła to Na 3 AlF 6 , z utworzeniem stopiony elektrycznie . Stopiony tlenek glinu w kriolicie poddawany jest elektrolizie w specjalnych instalacjach (ryc. 63) w zakładach aluminiowych.

Ryż. 63.
Schemat instalacji elektrolizy do produkcji aluminium:
1 - elektrolit - stopiony kriolit z dodatkami fluorków wapnia i glinu (w celu obniżenia temperatury topnienia) oraz tlenku glinu (dodawany okresowo); 2 - katoda węglowa; 3 - anoda węglowa; 4 - skorupa zestalonego tlenku glinu, chroniąca roztopione aluminium przed utlenianiem; 5 - kąpiel stalowa; 6 - rura odgałęziona do pobierania próbek stopionego aluminium
Światowa produkcja aluminium stale rośnie. Obecnie zepchnął miedź i inne metale nieżelazne na trzecie i kolejne miejsca i stał się drugim najważniejszym metalem trwającej epoki żelaza.
Aluminium jest prawie trzy razy lżejsze od stali i jest odporne na korozję, dlatego jest korzystniejsze od stali w zastosowaniach, w których te właściwości są wymagane (rys. 64).

Ryż. 64.
Główne obszary zastosowań aluminium i jego stopów
Związki glinu. W naturze aluminium występuje tylko w postaci związków i pod względem występowania w skorupie ziemskiej zajmuje pierwsze miejsce wśród metali i trzecie wśród wszystkich pierwiastków (po tlenie i krzemie). Całkowita zawartość glinu w skorupie ziemskiej wynosi około 9% (masy).
Wskazujemy najważniejsze związki naturalne aluminium.
Glinokrzemiany. Związki te można uznać za sole utworzone przez tlenki glinu, krzemu, metali alkalicznych i metali ziem alkalicznych. Stanowią większość skorupa Ziemska. W szczególności glinokrzemiany wchodzą w skład skaleni, najpowszechniejszych minerałów i iłów.
Boksyt (ryc. 65, a) - skała, z której uzyskuje się aluminium, zawiera tlenek glinu Al 2 O 3.

Ryż. 65.
Naturalne związki glinu:
a - boksyt; b - korund; c - rubin; g - szafir
Korund (ryc. 65, b) - minerał o składzie Al 2 O 3, ma bardzo wysoką twardość, jego drobnoziarnista odmiana zawierająca zanieczyszczenia - szmergiel - jest stosowana jako materiał ścierny (szlifierski).
Ta sama formuła ma inny naturalny związek - tlenek glinu.
Dobrze znane są przezroczyste kryształy korundu w kolorze zanieczyszczeń: czerwony - rubiny (ryc. 65, c) i niebieski - szafiry (ryc. 65, d), które są używane jako klejnoty. Obecnie są pozyskiwane sztucznie i wykorzystywane nie tylko w jubilerstwie, ale także do celów technicznych, np. do produkcji części zegarków i innych instrumentów precyzyjnych. Kryształy rubinowe są używane w laserach.
Tlenek glinu Al 2 O 3 jest białą substancją o bardzo wysokiej temperaturze topnienia. Można go otrzymać przez rozkład przez ogrzewanie odpowiadającego mu wodorotlenku glinu:
Wodorotlenek glinu Al (OH) 3 wytrąca się w postaci białego galaretowatego osadu, gdy zasady działają na roztwory soli glinu (ryc. 66), na przykład:
AlCl 3 (ex) + 3NaOH \u003d Al (OH) 3 ↓ + 3NaCl.
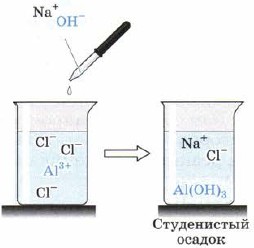
Ryż. 66.
Otrzymywanie wodorotlenku glinu w reakcji wymiany z rozpuszczalnej soli glinu
Jako amfoteryczny wodorotlenek łatwo rozpuszcza się w alkaliach i kwasach (rys. 67):
Al (OH) 3 + NaOH (ex) \u003d Na,
Al (OH) 3 + 3HN03 \u003d Al (NO 3) 3 + 3H 2 O.

Ryż. 67.
Właściwości chemiczne wodorotlenku glinu:
a - interakcja z alkaliami; b - interakcja z kwasem
Doświadczenie laboratoryjne nr 16
Otrzymywanie wodorotlenku glinu i badanie jego właściwości
Sole niestabilnych kwasów glinowych - orto-glin H 3 AlO 3 i meta-glin HAlO 2 (można go uznać za kwas orto-glinowy, z którego cząsteczki odebrano cząsteczkę wody) - nazywane są glinianami. Naturalne gliny to szlachetny spinel (ozdabia zabytkowy relikt – koronę) cesarze rosyjscy) i cenny chryzoberyl.
Sole glinu, z wyjątkiem fosforanów, są dobrze rozpuszczalne w wodzie. Niektóre sole (siarczki, siarczyny) są rozkładane przez wodę.
Chlorek glinu AlCl 3 jest stosowany jako katalizator w produkcji wielu substancji organicznych.
Odkrycie aluminium. Aluminium po raz pierwszy otrzymał duński fizyk H. Oersted w 1825 roku. Nazwa tego pierwiastka pochodzi od łacińskiego ałunu, jak nazywano w starożytności ałunu, który był używany do barwienia tkanin.
Nowe słowa i pojęcia
- Struktura atomu aluminium.
- Fizyczne i Właściwości chemiczne aluminium: tworzenie bromku, siarczku, węglika, tlenku i glinianów.
- Aluminotermia.
- Otrzymywanie aluminium metodą elektrolizy.
- Obszary zastosowania aluminium.
- Naturalne związki glinu: glinokrzemiany (glina i skalenie), korund (rubin, szafir, szmergiel).
- Amfoteryczność tlenku i wodorotlenku glinu.
Wysyłamy go w powietrze i wyrzucamy w kosmos, kładziemy na piecu, budujemy z niego budynki, robimy opony, smarujemy nim skórę i leczymy nim wrzody… Jeszcze nie rozumiesz? Chodzi o aluminium.
Spróbuj wymienić wszystkie zastosowania aluminium i upewnij się, że się pomyliłeś. Prawdopodobnie nawet nie wiesz, że wiele z nich istnieje. Wszyscy wiedzą, że aluminium to materiał producentów samolotów. Ale co z motoryzacją lub powiedzmy. medycyna? Czy wiesz, że aluminium jest? dodatek do żywności E-137, który jest powszechnie stosowany jako barwnik nadający produktom srebrzysty odcień?
Aluminium to pierwiastek, który z łatwością tworzy stabilne związki z dowolnymi metalami, tlenem, wodorem, chlorem i wieloma innymi substancjami. W wyniku takich oddziaływań chemicznych i fizycznych powstają stopy i związki o diametralnie różnych właściwościach.
Zastosowanie tlenków i wodorotlenków glinu
Obszary zastosowań aluminium są tak rozległe, że w celu ochrony producentów, projektantów i inżynierów przed niezamierzonymi błędami, w naszym kraju stosowanie znakowania stopów aluminium stało się obowiązkowe. Każdy stop lub związek ma przypisane własne oznaczenie alfanumeryczne, co później pozwala na ich szybkie sortowanie i wysyłanie do dalszej obróbki.
Najpopularniejszymi naturalnymi związkami glinu są jego tlenek i wodorotlenek. w naturze występują wyłącznie w postaci minerałów - korundu, boksytu, nefelinu itp. - oraz jako tlenek glinu. Zastosowanie aluminium i jego związków wiąże się z biżuterią, kosmetologią, medycyną, przemysłem chemicznym i budownictwem.
Kolorowe, „czyste” (nie mętne) korundy to klejnoty znane nam wszystkim – rubiny i szafiry. Jednak w swej istocie nie są niczym innym jak najpowszechniejszym tlenkiem glinu. Oprócz sektora jubilerskiego zastosowanie tlenku glinu rozciąga się na przemysł chemiczny, gdzie zwykle pełni on funkcję adsorbentu, a także na produkcję naczyń ceramicznych. Ceramiczne garnki, garnki, filiżanki mają niezwykłe właściwości żaroodporne właśnie ze względu na zawarte w nich aluminium. Tlenek glinu znalazł również zastosowanie jako materiał do produkcji katalizatorów. Często do betonu dodaje się tlenki glinu w celu jego lepszego utwardzenia, a szkło, do którego dodaje się aluminium, staje się żaroodporne.
Jeszcze bardziej imponująca jest lista zastosowań wodorotlenku glinu. Ze względu na swoją zdolność do wchłaniania kwasów i katalitycznego działania na ludzką odporność, wodorotlenek glinu jest wykorzystywany do produkcji leków i szczepionek na wirusowe zapalenie wątroby typu „A” i „B” oraz tężcowy. Są również leczeni z powodu niewydolności nerek z powodu obecności duża liczba fosforan w organizmie. W organizmie wodorotlenek glinu reaguje z fosforanami i tworzy z nimi nierozerwalne wiązania, a następnie naturalnie wydalany z organizmu.
Wodorotlenek ze względu na doskonałą rozpuszczalność i nietoksyczność jest często dodawany do past do zębów, szamponów, mydeł, filtrów przeciwsłonecznych, odżywczych i nawilżających kremów do twarzy i ciała, antyperspirantów, toników, płynów oczyszczających, pianek itp. W razie potrzeby równomiernie i stabilnie farbować tkaniny, następnie do barwnika dodaje się trochę wodorotlenku glinu i kolor zostaje dosłownie „wytrawiony” na powierzchni materii.
Zastosowanie chlorków i siarczanów glinu
Niezwykle ważnymi związkami glinu są również chlorki i siarczany. Chlorek glinu nie występuje naturalnie, ale dość łatwo jest go pozyskać przemysłowo z boksytu i kaolinu. Zastosowanie chlorku glinu jako katalizatora jest raczej jednostronne, ale praktycznie nieocenione dla przemysłu rafineryjnego.

Siarczany glinu występują naturalnie jako minerały w skałach wulkanicznych i są znane ze swojej zdolności do pochłaniania wody z powietrza. Zastosowanie siarczanu glinu rozciąga się na przemysł kosmetyczny i tekstylny. W pierwszym działa jako dodatek do antypersperandów, w drugim - w postaci barwnika. Ciekawe zastosowanie siarczanu glinu w składzie środków odstraszających owady. Siarczany nie tylko odstraszają komary, muchy i muszki, ale także znieczulają miejsce ukąszenia. Jednak pomimo Rzeczowe korzyści, siarczany glinu mają niejednoznaczny wpływ na zdrowie człowieka. Jeśli wdychasz lub połykasz siarczan glinu, możesz dostać poważnego zatrucia.

Stopy aluminium - główne zastosowania
Sztucznie otrzymane związki aluminium z metalami (stopami), w przeciwieństwie do naturalnych formacji, mogą mieć takie właściwości, jakich sobie życzy sam producent - wystarczy zmienić skład i ilość pierwiastków stopowych. Obecnie istnieją niemal nieograniczone możliwości otrzymywania stopów aluminium i ich zastosowań.
Najsłynniejsza branża użytkowania stopy aluminium- przemysł lotniczy. Samoloty są prawie w całości wykonane ze stopów aluminium. Stopy cynku, magnezu i aluminium dają niespotykaną wytrzymałość, stosowane w poszyciach samolotów i częściach konstrukcyjnych.
Podobnie stopy aluminium wykorzystywane są do budowy statków, łodzi podwodnych i transportu rzecznego. Tutaj najbardziej opłaca się wykonać nadbudówki z aluminium, zmniejszają one masę statku o ponad połowę, bez uszczerbku dla ich niezawodności.
Podobnie jak samoloty i statki, samochody z roku na rok stają się coraz bardziej „aluminiowe”. Aluminium wykorzystywane jest nie tylko w częściach nadwozia, ale teraz także w ramach, belkach, słupkach i panelach kabiny. Ze względu na obojętność chemiczną stopów aluminium, niską podatność na korozję oraz właściwości termoizolacyjne, stopy aluminium wykorzystywane są do wykonywania zbiorników do transportu produktów płynnych.

Zastosowanie aluminium w przemyśle jest powszechnie znane. Produkcja ropy i gazu nie byłaby tam, gdzie jest dzisiaj, gdyby nie wyjątkowo odporne na korozję, chemicznie obojętne rurociągi ze stopu aluminium. Wiertła wykonane z aluminium ważą kilkakrotnie mniej, dzięki czemu są łatwe w transporcie i montażu. I nie wspominając o wszelkiego rodzaju zbiornikach, kotłach i innych pojemnikach...
Garnki, patelnie, blachy do pieczenia, chochle i inne sprzęty gospodarstwa domowego wykonane są z aluminium i jego stopów. Naczynia aluminiowe bardzo dobrze przewodzi ciepło, nagrzewa się bardzo szybko i jest łatwe w czyszczeniu, nie szkodzi zdrowiu i żywności. Na folia aluminiowa pieczemy mięso w piekarniku i pieczemy ciasta, oleje i margaryny, sery, czekoladki i słodycze pakujemy w aluminium.

Niezwykle ważnym i obiecującym obszarem jest zastosowanie aluminium w medycynie. Oprócz wspomnianych wcześniej zastosowań (szczepionki, leki na nerki, adsorbenty) należy wspomnieć o zastosowaniu glinu w lekach na wrzody i zgagę.
Z powyższego można wyciągnąć jeden wniosek - gatunki aluminium i ich zastosowanie są zbyt różnorodne, aby poświęcić im jeden mały artykuł. O aluminium lepiej pisać książki, bo nie bez powodu nazywa się je „metalem przyszłości”.


