Kimyasal olarak alüminyum oldukça aktif bir metaldir. Havada, yüzeyi anında yoğun bir Al 2 O 3 oksit filmi ile kaplanır, bu da oksijenin metale daha fazla erişimini önler ve reaksiyonun sona ermesine yol açar, bu da alüminyumun yüksek korozyon önleyici özelliklerine yol açar. Konsantre nitrik asit içine konulursa alüminyum üzerinde koruyucu bir yüzey filmi de oluşur.
Şekil 1, bir katı klorür alaşımlı klorürü göstermektedir. Özellikleri. A., yüz merkezli kübik bir kafes içinde kristalleşen gümüşi beyaz, nispeten yumuşak, dövülebilir bir metaldir. İnce tabakaları açmak ve tele çekmek kolaydır. A. çok iyi bir ısı iletkenidir, elektriksel iletkenliği bakır kütlesinin yaklaşık %65'idir.
Yüksek pozitif yüklerinden dolayı suda oldukça hidratlıdırlar. Bu nedenle, katı alüminyum tuzları genellikle 3 katyon içerir. A. havada güçlü bir yapışkan oksit tabakası oluşturur, bu nedenle belirgin indirgeme etkisi keskin bir şekilde azalır. Oksitleyici veya elektrolitik ajanlarla işlendiğinde bu oksit tabakası güçlendirilebilir ve bu nedenle korozyon direnci geliştirilebilir. Böylece işlenmiş A. havaya, suya, asitlere ve zayıf bazlara karşı dayanıklıdır. Bir oksit tabakası olmadan alüminyum, alüminyum oksit ve hidrojen oluşturmak için hava veya su ile hızla reaksiyona girer.
Alüminyumun karakteristik oksidasyon durumu +3'tür, ancak doldurulmamış 3p ve 3d orbitallerin varlığından dolayı alüminyum atomları ek verici-alıcı bağları oluşturabilir. Bu nedenle, küçük bir yarıçapa sahip Al3+ iyonu, çeşitli katyonik ve anyonik kompleksler oluşturarak kompleks oluşumuna çok yatkındır: AlCl 4 - , AlF 6 3- , 3+ , Al(OH) 4 - , Al(OH) 6 3- , AlH 4 - ve diğerleri. Organik bileşiklerle kompleksler de bilinmektedir.
Teknikte alümina oluşturmaya yönelik yüksek bir eğilim kullanılmaktadır. A. ayrıca oksitlerinden çok sayıda metali temsil etmek için kullanılır. Algler, çoğunlukla yapısal olan alüminyum halojenürlerle ekzotermik bir reaksiyonda halojenlerle birleşir. Bakış açısı değil, aynı zamanda Lewis asit aktiviteleri nedeniyle de ilgi görüyor. Analitik.
Mevduat. A. %8,1 ile yer kabuğunun yapımına katılır, bu da onu oksijen ve silikondan sonra en bol bulunan üçüncü element ve demirden önce en yaygın metal yapar. Her zaman çeşitli feldispatlar, mika, kil ve boksit şeklinde ilişkilendirilir. Feldspaltaltit kayaçları, aşındığında kil oluşturur. farklı kompozisyon. Silika ve demir oksitle kirlenmiş killere kil, kil marnları şeklinde kalsiyum veya magnezyum karbonat içeren killere denir. Çünkü saf alümina, daha önce krom oksit veya titanyum oksit safsızlıkları veya zımpara ile boyanabilen korundum formunda gelir.
Alüminyumun kimyasal aktivitesi çok yüksektir; üst üste elektrot potansiyelleri magnezyumun hemen yanındadır. İlk bakışta, böyle bir ifade garip görünebilir: sonuçta, bir alüminyum tava veya kaşık havada oldukça kararlıdır ve kaynar suda çökmez. Alüminyum, demirin aksine paslanmaz. Havada metalin, metali oksidasyondan koruyan renksiz, ince fakat güçlü bir oksitle kaplandığı ortaya çıktı. Bu nedenle, brülör alevine kalın bir alüminyum tel veya 0,5-1 mm kalınlığında bir levha sokulursa, metal erir, ancak alüminyum oksit torbasında kaldığı için akmaz. Alüminyumu koruyucu filmden yoksun bırakırsanız veya gevşetirseniz (örneğin, bir cıva tuzları çözeltisine daldırarak), alüminyum hemen gerçek özünü gösterecektir: zaten oda sıcaklığında, su ile şiddetli reaksiyona girmeye başlayacaktır. hidrojen: 2Al + 6H20 -> 2Al (OH ) 3 + 3H2 . Havada, koruyucu film içermeyen alüminyum, gözlerimizin hemen önünde gevşek bir oksit tozuna dönüşür: 2Al + 3O 2 -> 2Al 2 O 3. Alüminyum özellikle ince bölünmüş halde aktiftir; alüminyum tozu, aleve üflendiğinde anında yanar. Alüminyum tozunu sodyum peroksit ile seramik bir tabakta karıştırır ve karışımın üzerine su damlatırsanız alüminyum da alevlenir ve beyaz bir alevle yanar.
A. ayrıca bitki ve hayvan dokusunda bulunur, ancak fizyolojik olarak büyük ölçüde kayıtsız davranır. Oksijenin alüminyuma yüksek afinitesi nedeniyle, indirgeme, alüminyumun en soy metal bileşen olduğu bir kriyolit-alümina eriyiğinin elektrolizi ile gerçekleştirilir. Alümina üretimi. Çoğu şirkette saf alümina, Bayer prosesine göre ham maddelerin ıslak sindirimi ile üretilir.
Parçalama solüsyonu 100°C'ye soğutulur ve seyreltilir. 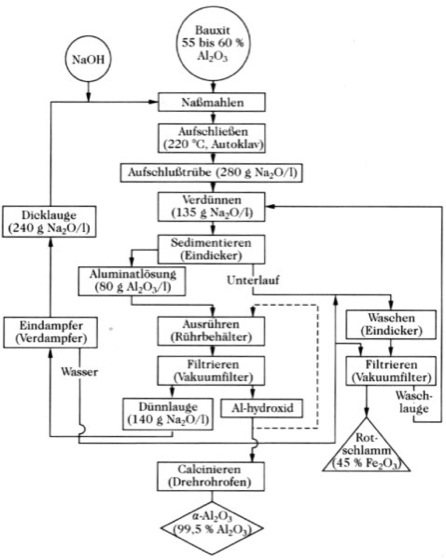
Alüminyum. Şekil 1: Bayer prosesine göre alümina üretiminin şeması. Cihazın çürütme asitliğini ve aşındırıcı yüklemesini eski haline getirmek sorunlu olsa da, hammadde durumu nedeniyle asitle çürütme önemli hale gelecektir. Magmatik.
Alüminyumun oksijen için çok yüksek afinitesi, bir dizi başka metalin oksitlerinden oksijen almasına izin vererek onları azaltır (alüminotermi yöntemi). Çoğu ünlü örnek- yanma sırasında ortaya çıkan demirin eritildiği çok fazla ısı açığa çıkan termit karışımı: 8Al + 3Fe 3 O 4 -> 4Al 2 O 3 + 9Fe. Bu reaksiyon 1856'da N.N. Beketov tarafından keşfedildi. Bu şekilde, Fe 2 O 3 , CoO, NiO, MoO 3 , V 2 O 5 , SnO 2 , CuO ve bir dizi başka oksit metallerini geri yüklemek mümkündür. Cr 2 O 3 , Nb 2 O 5 , Ta 2 O 5 , SiO 2 , TiO 2 , ZrO 2 , B 2 O 3'ü alüminyum ile indirgediğinde, reaksiyonun ısısı, reaksiyon ürünlerini erime noktalarının üzerinde ısıtmak için yeterli değildir.
Yukarıdan eriyiğe daldırılan anotlar, önceden ısıtılmış karbon bloklardan veya kendiliğinden tutuşan Söderberg elektrotlarından oluşur. 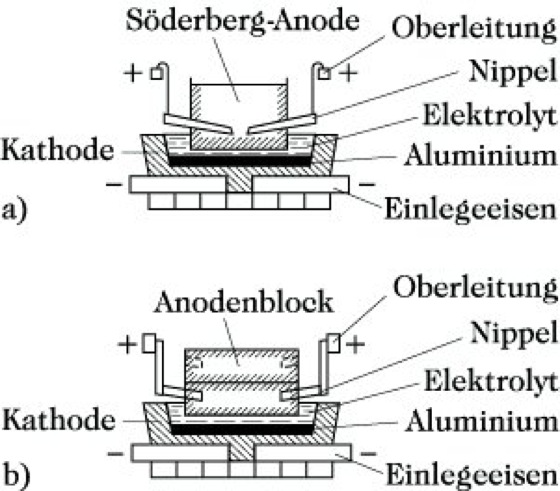
Şekil 2: Eriyik elektrolizi ile alüminyum üretimi için elektroliz hücreleri: anormal ön anotlara sahip Söderberg anotları ile. Kullanmak. Hem de arabalar ve uçaklar için. Cam A. üzerine bırakılan vakum, ışığı ve ısıyı yaymak için mükemmel yansıtıcı katmanlar oluşturur. Korozyon önleyici boyaların ve piroteknik ürünlerin hazırlanmasında alüminyum tozu, metalurjide alüminotermik bir işlem sonucunda çeşitli metallerin üretimi için alüminosilikat kullanılır.
Alüminyum, seyreltik mineral asitlerde kolayca çözünür ve tuzlar oluşturur. Konsantre nitrik asit, alüminyum yüzeyi oksitleyerek oksit filmin kalınlaşmasına ve sertleşmesine (metal pasivasyonu olarak adlandırılır) katkıda bulunur. Bu şekilde işlenen alüminyum, hidroklorik asit ile bile reaksiyona girmez. Elektrokimyasal anodik oksidasyon (anotlama) yardımı ile alüminyum yüzeyinde boyanması kolay kalın bir film oluşturulabilir. farklı renkler.
Diğer sözlüklerde "alüminyum" un ne olduğunu görün
Walter Dannecker, Hamburg Prof. Hans-Günter Dessler, Freital Klaus-Stephan Dreyer, Hamburg Lutz-Karsten Finse, Grossenhain-Wisnitz Sandra Grande, Heidelberg Prof. Günther Hoffmann, Eberswalde Prof. , Leipzig Prof. Reinhard Kramolovsky, Hamburg Wolfgang Eberhard Kraus, Dresden Wolfgang Liebscher, Berlin Anna Schleitzer, Swabian Market Prof. Helmut Schmiers, Freiberg Prof. Martina Vanshott, Hannover Prof. Rainer Vulpius, Freiberg Prof. Manfred Weissenfels, Dresden Klaus-Peter Wendlandt, Merseburg Prof.
Alüminyum tarafından tuz çözeltilerinden daha az aktif metallerin yer değiştirmesi genellikle alüminyum yüzeyinde koruyucu bir film tarafından engellenir. Bu film bakır klorür tarafından hızla yok edilir, bu nedenle 3CuCl 2 + 2Al -> 2AlCl 3 + 3Cu reaksiyonu kolayca ilerler ve buna güçlü ısıtma eşlik eder. Güçlü alkali çözeltilerde, alüminyum hidrojen salınımı ile kolayca çözünür: 2Al + 6NaOH + 6H20 -> 2Na 3 + 3H2 (diğer anyonik hidrokso kompleksleri de oluşur). Alüminyum bileşiklerinin amfoterik doğası, taze çökeltilmiş oksit ve hidroksitin alkalilerde kolay çözünmesinde de kendini gösterir. Kristal oksit (korindon) asitlere ve alkalilere karşı çok dirençlidir. Alkalilerle kaynaştığında susuz alüminatlar oluşur: Al 2 O 3 + 2NaOH -> 2NaAlO 2 + H 2 O. Magnezyum alüminat Mg (AlO2) 2 - yarı değerli taş genellikle çok çeşitli renklerde safsızlıklarla boyanmış spinel.
Uzman koordinasyonu: Hans-Dieter Jakubke, Ruth Karcher. Editör: Sabina Bartels, Ruth Karcher, Sonya Nagel. İsim Atom numarası Valencia Oksidasyon durumu. Elektronegatiflik Kovalent radyo. Alüminyum alaşımları çok çeşitli yüzeylere izin verir. Alüminyum, fiziksel, kimyasal ve metalurjik özelliklerinden dolayı
Alüminyum, Dünya'da ve Ay'da en bol bulunan metalik elementtir, ancak asla alüminyum içeren formda alümina silikat mineralleri olarak bulunmaz. Bu koşullar altında, alüminyum üretiminde ana malzeme görevi gören boksitler oluşur. Alüminyum, yüksek iletkenliği ile bilinir.
Alüminyum halojenlerle şiddetli reaksiyona girer. 1 ml bromlu bir test tüpüne ince bir alüminyum tel sokulursa, Kısa bir zaman alüminyum alev alır ve parlak bir alevle yanar. Alüminyum ve iyot tozlarının bir karışımının reaksiyonu, bir damla su ile başlatılır (iyotlu su, oksit filmini yok eden bir asit oluşturur), ardından mor iyot buharı kulüpleri ile parlak bir alev belirir. alüminyum halojenürler sulu çözeltiler hidroliz nedeniyle asidik reaksiyona sahiptir: AlCl 3 + H 2 O -> Al (OH) Cl 2 + HCl.
Alüminyum sadece 3 değerlik gösterir. Alüminyum havaya dayanıklıdır ve deniz suyu, birçok sulu çözelti ve diğer %95 korozyona karşı dirençlidir, çoğu asidin saldırısına direnir, ancak sulu modada çözünür. Alüminyum amfoteriktir ve mineral asitlerle reaksiyona girerek çözünebilir tuzlar oluşturabilir.
Erimiş alüminyum su ile patlayıcı reaksiyonlara sahip olabilir. Yüksek sıcaklıklarda oksijen içeren bileşiklerin, özellikle metal oksitlerin miktarını azaltır. İnşaattaki uygulaması en büyük pazarı temsil ediyor alüminyum endüstrisi. Binlerce konut, endüstriyel inşaatın en önemli ürünlerinden biridir.
Alüminyumun azot ile reaksiyonu, AlN nitrür oluşumu ile sadece 800 ° C'nin üzerinde, 200 ° C'de kükürt ile (Al 2 S 3 sülfür oluşur), 500 ° C'de fosfor ile (AlP fosfit oluşur) gerçekleşir. Erimiş alüminyuma bor eklendiğinde, AlB2 ve AlB 12 bileşiminin borürleri oluşur - asitlere dayanıklı refrakter bileşikler. Hidrür (AlH)x (x = 1.2), atomik hidrojenin alüminyum buharı ile reaksiyonunda sadece düşük sıcaklıklarda vakumda oluşur. Oda sıcaklığında nem yokluğunda kararlı olan AlH3 hidrit, susuz bir eter çözeltisinde elde edilir: AlCl 3 + LiH -> AlH 3 + 3LiCl. Fazla LiH ile, organik sentezde kullanılan çok güçlü bir indirgeyici ajan olan tuz benzeri lityum alüminyum hidrit LiAlH 4 oluşur. Su ile anında ayrışır: LiAlH 4 + 4H 2 O -> LiOH + Al (OH) 3 + 4H 2.
Elektrik uygulamalarında ana ürünler alüminyum teller ve kablolardır. Dondurucular. esas olarak asitleşme problemlerinden kaynaklanmaktadır. Yüzlerce var kimyasal uygulamalar alüminyum ve bileşikleri. soluyun ve cilt ile temas yoluyla. Alüminyumun Sağlığa Etkileri Alüminyum en yaygın kullanılan metallerden biridir ve aynı zamanda en yaygın bulunan masum bileşiklerden biridir. Bir kişi yüksek konsantrasyonlara maruz kaldığında. Kilo kaybı ve azalmış aktivite.
Boyalarda alüminyum tozu kullanılmaktadır. Bu göllerde çok sayıda balık ve kurbağa embriyosu bulunur. Alüminyum böbrek sorunlarına neden olabilir. alüminyumun etkisi çevre. Alüminyumun etkisi dikkatimizi çekiyor. Yüksek konsantrasyonlarda alüminyum sadece balıklar üzerinde etkilere neden olmaz. alüminyum tozu soluduklarında akciğer problemlerini bulabileceğiniz yer. Asitlenmiş göllerde alüminyum konsantrasyonları çok yüksek görünmektedir. buzdolapları. Ama hala. alüminyum klorür gibi. Alüminyum alımı gıda yoluyla yapılabilir.
Alüminyum - üçüncü grubun kimyasal elementi periyodik sistem DI. Mendeleyev.
markalar ve kimyasal bileşim(%) birincil alüminyum (GOST 11069–74)
| marka tanımı | Kirlilik, artık yok | ||||||
| Fe | Si | Cu | çinko | Ti | toplam | ||
| Yüksek saflıkta alüminyum | |||||||
| A999 | 99,999 | – | – | – | – | – | 0,001 |
| Alüminyum yüksek saflık | |||||||
| A995 | 99,995 | 0,0015 | 0,0015 | 0,001 | 0,001 | 0,001 | 0,005 |
| A99 | 99,99 | 0,003 | 0,003 | 0,003 | 0,003 | 0,002 | 0,010 |
| A97 | 99,97 | 0,015 | 0,015 | 0,005 | 0,003 | 0,002 | 0,03 |
| A95 | 99,95 | 0,025 | 0,020 | 0,010 | 0,005 | 0,002 | 0,05 |
| Teknik sınıf alüminyum | |||||||
| A85 | 99,85 | 0,08 | 0,06 | 0,01 | 0,02 | 0,008 | 0,15 |
| A8 | 99,8 | 0,12 | 0,10 | 0,01 | 0,04 | 0,01 | 0,20 |
| A7 | 99,7 | 0,16 | 0,15 | 0,01 | 0,04 | 0,01 | 0,30 |
| A7E*** | 99,7 | 0,20 | 0,08 | 0,01 | 0,04 | 0,01* | 0,30 |
| A6 | 99,6 | 0,25 | 0,18 | 0,01 | 0,05 | 0,02 | 0,40 |
| A5E | 99,5 | 0,35** | 0,10 | 0,02 | 0,04 | 0,015* | 0,50 |
| A5 | 99,5 | 0,30 | 0,25 | 0,02 | 0,06 | 0,02 | 0,50 |
| A0 | 99,0 | 0,50 | 0,5 | 0,02 | 0,08 | 0,02 | 1,0 |
*Titanyum, vanadyum, krom ve manganez toplamı için.
Yüksek konsantrasyonlarda alüminyum sadece asidik göllerde ve aryalarda bulunmaz. Hasardan Merkeze Alma gergin sistem Demans Hafıza kaybı Kayıtsızlık Ağır sarsıntı Alüminyum belirli çalışma ortamlarında bir risktir. Özellikle, dönüşüm katmanının hem tepki süresi hem de koruyucu etkisinin süresi incelenmiştir, bu nedenle frekans yanıtında üç farklı zaman sabitinin gözlenmesi beklenmektedir, bu nedenle dönüşüm katmanlarının koruyucu etkisini değerlendirmek için, sahip olacaksınız. bu sabitin zaman içindeki eğilimini incelemek.
** En az %0,18'lik bir demir kütle fraksiyonuna izin verilir.
*** "E" - garantili elektriksel özelliklere sahip sınıflarda.
Yarı mamul ve deformasyon yoluyla ürünlerin imalatında kullanılan teknik saflıkta alüminyum GOST 4784-74'e dahildir.
Teknik alüminyumun kimyasal bileşimi (%)
| Marka | Al, daha az değil | Kirlilik, artık yok | |||||||||
| Rusça | Uluslararası | Cu | mg | Mn | Fe | Si | çinko | Ti | cr | ||
| Mektup | Dijital | ||||||||||
| AD000 | – | 1080A | 99,80 | 0,03 | 0,02 | 0,02 | 0,15 | 0,15 | 0,06 | 0,02 | – |
| AD00 | 1010 | 1070A | 99,70 | 0,03 | 0,03 | 0,03 | 0,25 | 0,20 | 0,07 | 0,03 | – |
| AD00E | 1010E | 1370 | 99,70 | 0,02 | 0,02 | 0,01 | 0,25 | 0,10 | 0,04 | * | 0,01 |
| AD0 | 1011 | 1050 | 99,50 | 0,05 | 0,05 | 0,05 | 0,40 | 0,25 | 0,07 | 0,05 | – |
| AD0E | 1011E | 1350 | 99,50 | 0,05 | – | 0,01 | 0,40 | 0,10 | 0,05 | ** | 0,01 |
| AD1 | 1013 | 1230 | 99,30 | 0,05 | 0,05 | 0,025 | 0,30 | 0,30 | 0,10 | 0,15 | – |
| CEHENNEM | 1015 | 1200 | 98,80 | 0,05 | – | 0,05 | Fe+Si: 1.0 | 0,10 | 0,05 | – | |
| AD1pl | – | – | 99,30 | 0,02 | 0,05 | 0,025 | 0,30 | 0,30 | 0,10 | 0,15 | – |
* B: %0.02; Ti+V: %0.02
Daldırma işleminden 6 saat sonra, 100 ila 10-2 Hz frekans aralığında frekans eğrisi boyunca açının açısı "önemli bir azalma" gösterir, bu davranış organik filmde gözeneklerin varlığı ile açıklanabilir. Şekil 7'den görülebileceği gibi, çalışılan zamanın zaman sabiti dalıştan 7 gün sonra ilk kez görünür. Bir dalıştan sonra ve yukarıdaki periyotlarda, zaman sabiti inişler ve çıkışlar meydana gelir ve kaybolur.
Zaman sabitinin geçici olarak kaybolması, organik filmdeki gözenek bölgelerini dolduran korozyon ürünlerinin oluşumu ile ilişkilendirilebilir, bu da savunma eylemleri. Tek fark, analiz süresi boyunca düşük empedans değeridir. Şekil 7'de görülebileceği gibi, fosfokromatik numunelerin modülünün değeri, iki büyüklük mertebesinden daha az bir aralıkta değişir. Empedans modülünün değiştiği değer aralığı ne kadar geniş olursa, işlemin o kadar önemli olduğu bilinmektedir.Bu nedenle, sonuçlar, çok miktarda zirkonyum tuzu ile kaplanmış bir sistemin korozyon önleyici özelliklerinin en önemli olduğunu göstermektedir. fosfor-krom kaplamaya maruz bırakılan numuneler ile aynı iken, daha az zirkonyum ile kaplanmış numuneler diğer iki tip numuneye göre daha kötü özelliklere sahiptir.
**B: %0,05; Ti+V: %0.02
AD0, AD1'den sacların garantili mekanik özellikleri (en azından)
ALÜMİNYUM, periyodik sistemin III. grubunun kimyasal elementi, atom numarası 13, bağıl atom kütlesi 26.98. Doğada, yalnızca bir kararlı nüklid 27 Al ile temsil edilir. Yapay olarak bir dizi radyoaktif alüminyum izotopu elde edilmiştir, en uzun ömürlüdür - 26 Al, 720 bin yıllık bir yarı ömre sahiptir.
Sahte test tüpü östrojen
onların sayesinde benzersiz özellikler ve bu malzemelerin düşük maliyetli üretimi neredeyse her yerde bulunur hale geldi. Bununla birlikte, birkaç on yıl boyunca, bu bileşiğin insan sağlığı üzerinde zararlı bir etkiye sahip olabileceğine karar verilebilecek sonuçlar elde edilmiştir.
Başlıca şüphelilerin çoğunlukla plastik kaplarda ve kalay kaplı koruyucu füzyonlarda saklanan yiyecek ve içecekler olduğu düşünülüyordu. Huzursuz bir halkın baskısı altında, daha güvenli bir alternatif bulmak için termokupl üreticilerini aramak zorunda kaldılar. Ancak ticari açıdan bakıldığında, bu hareket görünüşte başarılı oldu.
doğada alüminyum. Yerkabuğunda çok fazla alüminyum var: ağırlıkça %8,6. Tüm metaller arasında birinci, diğer elementler arasında (oksijen ve silikondan sonra) üçüncü sırada yer alır. Demirin iki katı kadar alüminyum ve bakır, çinko, krom, kalay ve kurşunun 350 katı kadar alüminyum var! 100 yılı aşkın bir süre önce klasik ders kitabında yazdığı gibi Kimyanın Temelleri DI. Mendeleev, tüm metaller arasında “alüminyum doğada en yaygın olanıdır; Alüminyumun yerkabuğundaki genel dağılımının net olması için kilin bir parçası olduğunu belirtmek yeterlidir. Alüminyum veya şap metali (alümen), bu nedenle kilde bulunan kil olarak adlandırılır.
En önemli alüminyum minerali, bazik oksit AlO(OH) ve hidroksit Al(OH) 3'ün bir karışımı olan boksittir. En büyük boksit yatakları Avustralya, Brezilya, Gine ve Jamaika'dadır; sanayi üretimi başka ülkelerde de yapılmaktadır. Alunite (şap taşı) (Na, K) 2 SO 4 Al 2 (SO 4) 3 4Al (OH) 3, nefelin (Na, K) 2 O Al 2 O 3 2SiO 2 alüminyum açısından da zengindir. Toplamda, alüminyum içeren 250'den fazla mineral bilinmektedir; çoğu, esas olarak oluşturulduğu alüminosilikatlardır. yerkabuğu. Yıprandıklarında, temeli mineral kaolinit Al 2 O 3 2SiO 2 2H 2 O olan kil oluşur. Demir safsızlıkları genellikle kili kahverengi renklendirir, ancak porselen yapmak için kullanılan beyaz kil - kaolin de vardır. ve fayans ürünleri.
Nadiren, son derece sert (sadece elmastan ikinci) mineral korindon bulunur - genellikle farklı renklerde safsızlıklarla renklendirilmiş, Al203 kristalli bir oksit. Mavi çeşidine (titan ve demir karışımı) safir, kırmızı çeşidine (krom karışımı) yakut denir. Çeşitli safsızlıklar, sözde asil korundumu yeşil, sarı, turuncu, mor ve diğer renk ve tonlarda renklendirebilir.
Yakın zamana kadar, çok aktif bir metal olan alüminyumun doğada serbest halde bulunmadığına, ancak 1978'de kayalarda bulunduğuna inanılıyordu. Sibirya platformu Doğal alüminyum keşfedildi - sadece 0,5 mm uzunluğunda bıyık şeklinde (birkaç mikrometre kalınlığında dişlerle). Dünya'ya Kriz ve Bolluk Denizleri bölgelerinden teslim edilen ay toprağında, doğal alüminyumu tespit etmek de mümkün oldu. varsayılır ki metalik alüminyum gazdan yoğunlaşma ile oluşturulabilir. Alüminyum halojenürler - klorür, bromür, florür - ısıtıldığında, az çok kolayca buharlaşabilecekleri bilinmektedir (örneğin, AlCl3 zaten 180 ° C'de süblimleşir). Sıcaklıktaki güçlü bir artışla, alüminyum halojenürler ayrışır ve örneğin AlCl gibi metalin daha düşük değerliliğine sahip bir duruma geçer. Böyle bir bileşik, sıcaklıkta bir düşüş ve oksijen yokluğunda yoğunlaştığında, katı fazda bir orantısızlık reaksiyonu meydana gelir: alüminyum atomlarının bazıları oksitlenir ve olağan üç değerlikli duruma geçer ve bazıları indirgenir. Tek değerli alüminyum sadece metale indirgenebilir: 3AlCl 2Al + AlCl 3 . Bu varsayım, doğal alüminyum kristallerinin filamentli şekli tarafından da desteklenir. Tipik olarak, bu yapının kristalleri, gaz fazından hızlı büyüme nedeniyle oluşur. Muhtemelen, ay toprağındaki mikroskobik alüminyum külçeler de benzer şekilde oluşmuştur.
Alüminyum adı Latince alümen (cins case aluminis) kelimesinden gelir. Şap olarak adlandırılan, kumaşları boyarken mordan olarak kullanılan çift potasyum-alüminyum sülfat KAl (SO 4) 2 12H 2 O). Latince adı muhtemelen Yunan "halme" - tuzlu su, tuzlu su çözeltisine geri döner. İngiltere'de alüminyumun alüminyum olduğu ve ABD'de alüminyum olduğu merak ediliyor.
Kimya üzerine birçok popüler kitapta, adı tarihi korunmayan belirli bir mucidin, MS 14-27'de Roma'yı yöneten imparator Tiberius'a gümüş rengine benzeyen bir metalden yapılmış bir kase getirdiğine dair bir efsane var. daha hafif. Bu hediye efendinin hayatına mal oldu: Tiberius, yeni metalin imparatorluk hazinesindeki gümüşün değerini düşürmesinden korktuğu için onu idam etmesini ve atölyeyi yok etmesini emretti.
Bu efsane, Romalı bir yazar ve bilim adamı olan Yaşlı Pliny'nin hikayesine dayanmaktadır. doğal Tarih- eski zamanların doğa bilimleri bilgisinin ansiklopedileri. Pliny'ye göre, yeni metal "kil topraktan" elde edildi. Ancak kil alüminyum içerir.
Modern yazarlar neredeyse her zaman tüm bu hikayenin güzel bir peri masalından başka bir şey olmadığı konusunda çekince yapar. Ve bu şaşırtıcı değil: Kayalardaki alüminyum oksijene son derece güçlü bir şekilde bağlıdır ve onu serbest bırakmak için çok fazla enerji gerekir. Ancak, içinde son zamanlar Antik çağda metalik alüminyum elde etmenin temel olasılığı hakkında yeni veriler ortaya çıktı. Spektral analizle gösterildiği gibi, 3. yüzyılın başında ölen Çinli komutan Zhou-Zhu'nun mezarındaki süslemeler. AD, % 85 alüminyum olan bir alaşımdan yapılmıştır. Eskiler ücretsiz alüminyum elde etmiş olabilir mi? Herşey bilinen yollar(elektroliz, geri kazanım sodyum metali veya potasyum) otomatik olarak elimine edilir. Doğal alüminyum, örneğin altın, gümüş, bakır külçeleri gibi antik çağda bulunabilir mi? Bu da hariç tutulmuştur: doğal alüminyum, ihmal edilebilir miktarlarda oluşan en nadir mineraldir, bu nedenle eski ustalar bu tür külçeleri doğru miktarda bulamamış ve toplayamamıştır.
Ancak, Pliny'nin hikayesinin başka bir açıklaması da mümkündür. Alüminyum, sadece elektrik ve alkali metallerin yardımıyla cevherlerden geri kazanılabilir. Eski zamanlardan beri mevcut ve yaygın olarak kullanılan bir indirgeyici ajan vardır - bu, birçok metalin oksitlerinin ısıtıldığında serbest metallere indirgendiği kömürdür. 1970'lerin sonlarında, Alman kimyagerler, antik çağda alüminyumun kömürle indirgenerek yapılıp yapılamayacağını test etmeye karar verdiler. Kömür tozu ve ortak tuz veya potasyum (potasyum karbonat) ile kil karışımını bir pota içinde kırmızı bir sıcaklığa kadar ısıttılar. Sadece antik çağda mevcut olan madde ve yöntemleri kullanmak için deniz suyundan tuz ve bitki külünden potas elde edildi. Bir süre sonra, pota yüzeyinde alüminyum bilyeli cüruf yüzdü! Metalin çıktısı küçüktü, ancak eski metalürjistlerin "20. yüzyılın metalini" bu şekilde elde etmeleri mümkündü.
alüminyum özellikleri. Saf alüminyumun rengi gümüşe benzer, çok hafif bir metaldir: yoğunluğu sadece 2,7 g / cm3'tür. Alüminyumdan daha hafif olan sadece alkali ve toprak alkali metaller (baryum hariç), berilyum ve magnezyumdur. Alüminyum da kolayca erir - 600°C'de (sıradan bir mutfak brülöründe ince bir alüminyum tel eritilebilir), ancak yalnızca 2452°C'de kaynar. Elektriksel iletkenlik açısından, alüminyum 4. sırada, ikinci sırada sadece gümüş (ilk sırada), bakır ve altın, düşük alüminyum maliyeti göz önüne alındığında büyük pratik öneme sahip. Metallerin ısıl iletkenliği aynı sırayla değişir. Bir alüminyum kaşığı sıcak çaya daldırarak alüminyumun yüksek ısı iletkenliğini doğrulamak kolaydır. Ve bu metalin bir diğer dikkat çekici özelliği: pürüzsüz, parlak yüzeyi ışığı mükemmel bir şekilde yansıtır: dalga boyuna bağlı olarak spektrumun görünür bölgesinde %80 ila %93. Ultraviyole bölgesinde, alüminyumun bu açıdan eşiti yoktur ve sadece kırmızı bölgede gümüşten biraz daha düşüktür (ultraviyolede, gümüş çok düşük bir yansıtıcılığa sahiptir).
Saf alüminyum oldukça yumuşak bir metaldir - bakırdan neredeyse üç kat daha yumuşaktır, bu nedenle nispeten kalın alüminyum plakaların ve çubukların bile bükülmesi kolaydır, ancak alüminyum alaşım oluşturduğunda (çok sayıda vardır), sertliği on kat artabilir.
Alüminyumun karakteristik oksidasyon durumu +3'tür, ancak doldurulmamış 3'ün varlığından dolayı R- ve 3 d-orbitaller alüminyum atomları ek verici-alıcı bağları oluşturabilir. Bu nedenle, küçük bir yarıçapa sahip Al 3+ iyonu, çeşitli katyonik ve anyonik kompleksler oluşturarak kompleks oluşumuna çok yatkındır: AlCl 4 – , AlF 6 3– , 3+ , Al(OH) 4 – , Al(OH) 6 3 – , AlH 4 – ve diğerleri. Organik bileşiklerle kompleksler de bilinmektedir.
Alüminyumun kimyasal aktivitesi çok yüksektir; elektrot potansiyelleri serisinde, magnezyumun hemen arkasındadır. İlk bakışta, böyle bir ifade garip görünebilir: sonuçta, bir alüminyum tava veya kaşık havada oldukça kararlıdır ve kaynar suda çökmez. Alüminyum, demirin aksine paslanmaz. Havada metalin, metali oksidasyondan koruyan renksiz, ince ama güçlü bir oksit "zırhı" ile kaplandığı ortaya çıktı. Bu nedenle, brülör alevine 0,5–1 mm kalınlığında kalın bir alüminyum tel veya levha sokulursa, metal erir, ancak alüminyum oksit torbasında kaldığı için akmaz. Alüminyumu koruyucu filmden yoksun bırakırsanız veya gevşetirseniz (örneğin, bir cıva tuzları çözeltisine daldırarak), alüminyum hemen gerçek özünü gösterecektir: zaten oda sıcaklığındayken su ile kuvvetli bir şekilde reaksiyona girmeye başlayacaktır. hidrojen: 2Al + 6H20 2Al (OH) 3 + 3H2 . Havada, koruyucu film içermeyen alüminyum, gözlerimizin hemen önünde gevşek bir oksit tozuna dönüşür: 2Al + 3O 2 2Al 2 O 3. Alüminyum özellikle ince bölünmüş halde aktiftir; alüminyum tozu, aleve üflendiğinde anında yanar. Alüminyum tozunu sodyum peroksit ile seramik bir tabakta karıştırır ve karışımın üzerine su damlatırsanız alüminyum da alevlenir ve beyaz bir alevle yanar.
Alüminyumun oksijen için çok yüksek afinitesi, bir dizi başka metalin oksitlerinden oksijeni "almasına" ve onları geri kazanmasına izin verir (alüminotermi yöntemi). En ünlü örnek, yanma sırasında ortaya çıkan demirin eritildiği çok fazla ısı açığa çıkan termit karışımıdır: 8Al + 3Fe 3 O 4 4Al 2 O 3 + 9Fe. Bu reaksiyon 1856'da N.N. Beketov tarafından keşfedildi. Bu şekilde, Fe 2 O 3 , CoO, NiO, MoO 3 , V 2 O 5 , SnO 2 , CuO ve bir dizi başka oksit metallerini geri yüklemek mümkündür. Cr 2 O 3 , Nb 2 O 5 , Ta 2 O 5 , SiO 2 , TiO 2 , ZrO 2 , B 2 O 3'ü alüminyum ile indirgediğinde, reaksiyonun ısısı, reaksiyon ürünlerini erime noktalarının üzerinde ısıtmak için yeterli değildir.
Alüminyum, seyreltik mineral asitlerde kolayca çözünür ve tuzlar oluşturur. Konsantre nitrik asit, alüminyum yüzeyi oksitleyerek oksit filmin kalınlaşmasına ve sertleşmesine (metal pasivasyonu olarak adlandırılır) katkıda bulunur. Bu şekilde işlenen alüminyum, hidroklorik asit ile bile reaksiyona girmez. Alüminyum yüzeyinde elektrokimyasal anodik oksidasyon (anotlama) kullanarak farklı renklerde kolayca boyanabilen kalın bir film oluşturabilirsiniz.
Diğer sözlüklerde "alüminyum" un ne olduğunu görün
Walter Dannecker, Hamburg Prof. Hans-Günter Dessler, Freital Klaus-Stephan Dreyer, Hamburg Lutz-Karsten Finse, Grossenhain-Wisnitz Sandra Grande, Heidelberg Prof. Günther Hoffmann, Eberswalde Prof. , Leipzig Prof. Reinhard Kramolovsky, Hamburg Wolfgang Eberhard Kraus, Dresden Wolfgang Liebscher, Berlin Anna Schleitzer, Swabian Market Prof. Helmut Schmiers, Freiberg Prof. Martina Vanshott, Hannover Prof. Rainer Vulpius, Freiberg Prof. Manfred Weissenfels, Dresden Klaus-Peter Wendlandt, Merseburg Prof.
Alüminyum tarafından tuz çözeltilerinden daha az aktif metallerin yer değiştirmesi genellikle alüminyum yüzeyinde koruyucu bir film tarafından engellenir. Bu film bakır klorür tarafından hızla yok edilir, bu nedenle reaksiyon kolayca ilerler.
3CuCl 2 + 2Al 2AlCl 3 + 3Cu,
yoğun ısı eşlik eder. Güçlü alkali çözeltilerde, alüminyum hidrojen salınımı ile kolayca çözünür:
2Al + 6NaOH + 6H20 2Na 3 + 3H2
(diğer anyonik hidrokso kompleksleri de oluşur). Alüminyum bileşiklerinin amfoterik doğası, taze çökeltilmiş oksit ve hidroksitin alkalilerde kolay çözünmesinde de kendini gösterir. Kristal oksit (korindon) asitlere ve alkalilere karşı çok dirençlidir. Alkalilerle kaynaştığında susuz alüminatlar oluşur:
Al203 + 2NaOH 2NaAlO2 + H20.
Magnezyum alüminat Mg (AlO 2) 2, genellikle çok çeşitli renklerde safsızlıklarla renklendirilmiş yarı değerli bir spinel taşıdır.
Alüminyum halojenlerle şiddetli reaksiyona girer. 1 ml bromlu bir test tüpüne ince bir alüminyum tel sokulursa, kısa bir süre sonra alüminyum tutuşur ve parlak bir alevle yanar. Alüminyum ve iyot tozlarının bir karışımının reaksiyonu, bir damla su ile başlatılır (iyotlu su, oksit filmini yok eden bir asit oluşturur), ardından mor iyot buharı kulüpleri ile parlak bir alev belirir. Sulu çözeltilerdeki alüminyum halojenürler hidroliz nedeniyle asidiktir: AlCl 3 + H 2 O
Al(OH)Cl2 + HCl.Alüminyumun azot ile reaksiyonu, AlN nitrür oluşumu ile sadece 800 ° C'nin üzerinde, 200 ° C'de kükürt ile (Al 2 S 3 sülfür oluşur), 500 ° C'de fosfor ile (AlP fosfit oluşur) gerçekleşir. Erimiş alüminyuma bor eklendiğinde, AlB2 ve AlB 12 bileşiminin borürleri oluşur - asitlere dayanıklı refrakter bileşikler. Hidrit (AlH) x (x = 1.2), atomik hidrojenin alüminyum buharı ile reaksiyonunda sadece düşük sıcaklıklarda vakumda oluşur. Oda sıcaklığında nem olmadığında stabil olan AlH3 hidrit, susuz bir eter çözeltisinde elde edilir: AlCl 3 + LiH AlH 3 + 3LiCl. Fazla LiH ile, organik sentezde kullanılan çok güçlü bir indirgeyici ajan olan tuz benzeri lityum alüminyum hidrit LiAlH 4 oluşur. Su ile anında ayrışır: LiAlH 4 + 4H 2 O LiOH + Al (OH) 3 + 4H 2.
Alüminyum almak. Alüminyumun belgelenmiş keşfi 1825'te gerçekleşti. Danimarkalı fizikçi Hans Christian Oersted, bu metali ilk olarak potasyum amalgamın susuz alüminyum klorür (klorun sıcak bir alüminyum oksit ve kömür karışımından geçirilmesiyle elde edilen) üzerindeki etkisiyle izole ettiğinde elde etti. Cıvayı uzaklaştırdıktan sonra Oersted, yabancı maddelerle kirlenmiş alüminyum elde etti. 1827'de Alman kimyager Friedrich Wöhler, potasyum heksafloroalüminatı indirgeyerek toz halinde alüminyum elde etti:
Na 3 AlF 6 + 3K Al + 3NaF + 3KF.
Daha sonra parlak metal bilyeler şeklinde alüminyum elde etmeyi başardı. 1854'te Fransız kimyager Henri Etienne Saint-Clair Deville, sodyum tetrakloroalüminatın eriyiğini azaltarak alüminyum üretmek için ilk endüstriyel yöntemi geliştirdi: NaAlCl 4 + 3Na Al + 4NaCl. Ancak alüminyum son derece nadir ve pahalı bir metal olmaya devam etti; altından çok daha ucuz değil ve demirden 1500 kat daha pahalı (şimdi sadece üç kat). Altın, alüminyum ve değerli taşlar 1850'lerde Fransız İmparatoru III. Napolyon'un oğlu için yapılmıştır. 1855'te ne zaman dünya sergisi Paris'te yeni bir yöntemle elde edilen büyük bir alüminyum külçe sergilendi, ona bir mücevher gibi baktılar. ABD başkentindeki Washington Anıtı'nın üst kısmı (piramit şeklinde) değerli alüminyumdan yapılmıştır. O zamanlar alüminyum gümüşten çok daha ucuz değildi: örneğin, ABD'de 1856'da pound başına 12 dolar (454 g) ve gümüş 15 dolardan satıldı. Ünlülerin 1. cildinde ansiklopedik sözlük Brockhaus ve Efron, "alüminyumun hâlâ öncelikli olarak ... lüks eşyaların giydirilmesi için kullanıldığını" söyledi. O zamana kadar, dünya çapında yılda sadece 2,5 ton metal çıkarıldı. Sadece 19. yüzyılın sonlarına doğru, elektrolitik yöntem alüminyum elde ederek, yıllık üretimi binlerce tona ulaşmaya başladı ve 20. yüzyılda. – milyon ton. Bu, alüminyumu yaygın olarak bulunan yarı değerli bir metal haline getirdi.
Alüminyum üretmenin modern yöntemi, 1886'da genç bir Amerikalı araştırmacı Charles Martin Hall tarafından keşfedildi. Çocukken kimyaya ilgi duymaya başladı. Babasının eski kimya ders kitabını bularak, onu özenle incelemeye ve deney yapmaya başladı, bir kez annesinden yemek masası örtüsüne zarar verdiği için bir azar bile aldı. Ve 10 yıl sonra, onu tüm dünyada yücelten olağanüstü bir keşif yaptı.
16 yaşında öğrenci olan Hall, hocası F.F. Jewett'ten, eğer birisi alüminyum elde etmek için ucuz bir yol geliştirmeyi başarırsa, bu kişinin sadece insanlığa büyük bir hizmet sağlamakla kalmayıp, aynı zamanda büyük bir kazanç sağlayacağını duydu. talih. Jewett neden bahsettiğini biliyordu: Daha önce Almanya'da eğitim görmüştü, Wöhler için çalıştı ve onunla alüminyum elde etme sorunlarını tartıştı. Onunla Amerika'ya Jewett, öğrencilerine gösterdiği nadir bir metal örneğini de getirdi. Aniden, Hall yüksek sesle ilan etti: "Bu metali alacağım!"
Altı yıllık sıkı çalışma devam etti. Hall alüminyum almaya çalıştı farklı yöntemler, ancak başarısız. Sonunda bu metali elektroliz yoluyla çıkarmaya çalıştı. O zamanlar elektrik santralleri yoktu, akımın kömür, çinko, nitrik ve sülfürik asitlerden büyük ev yapımı piller kullanılarak elde edilmesi gerekiyordu. Hall, küçük bir laboratuvar kurduğu bir ahırda çalıştı. Kardeşinin deneyleriyle çok ilgilenen kız kardeşi Julia ona yardım etti. Keşfin tarihini kelimenin tam anlamıyla günden güne izlemenize izin veren tüm mektuplarını ve çalışma günlüklerini tuttu. İşte anılarından bir alıntı:
“Charles her zaman iyi bir ruh halindeydi ve en kötü günlerde bile şanssız mucitlerin kaderine gülebildi. Başarısızlık zamanlarında teselliyi eski piyanomuzda bulurdu. Ev laboratuvarında uzun saatler ara vermeden çalıştı; ve kiti bir süreliğine bırakabildiğinde, biraz oynamak için uzun evimize koştu... Böyle bir çekicilik ve duygu ile oynarken, sürekli işini düşündüğünü biliyordum. Ve müzik ona bu konuda yardımcı oldu.
En zor kısım elektroliti bulmak ve alüminyumu oksidasyondan korumaktı. Altı aylık yorucu bir çalışmanın ardından, sonunda potada birkaç küçük gümüş top belirdi. Hall hemen yanına koştu. eski öğretmen başarı hakkında konuşmak için. "Profesör, anladım!" diye bağırdı elini uzatarak: avucunun içinde bir düzine küçük alüminyum top vardı. Bu 23 Şubat 1886'da oldu. Ve tam olarak iki ay sonra, aynı yılın 23 Nisan'ında, Fransız Paul Héroux, bağımsız ve neredeyse aynı anda yaptığı benzer bir buluş için bir patent aldı (diğer iki tesadüf dikkat çekicidir: her ikisi de). Hall ve Héroux 1863'te doğdu ve 1914'te öldü).
Şimdi Hall tarafından elde edilen ilk alüminyum toplar, Pittsburgh'daki Amerikan Alüminyum Şirketi'nde ulusal bir kalıntı olarak tutuluyor ve kolejinde, alüminyumdan yapılmış bir Hall anıtı var. Daha sonra Jewett şunları yazdı: “En önemli keşfim insanın keşfiydi. 21 yaşında, cevherden alüminyumu geri kazanmanın bir yolunu keşfeden ve böylece şu anda dünya çapında yaygın olarak kullanılan harika bir metal olan alüminyumu yapan Charles M. Hall'dı. Jewett'in kehaneti gerçekleşti: Hall geniş çapta tanındı, birçok bilimsel topluluğun onursal üyesi oldu. Ancak kişisel hayatı başarısız oldu: gelin, nişanlısının her zaman laboratuvarda geçirdiği gerçeğine katlanmak istemedi ve nişanı kırdı. Hall, hayatının geri kalanında çalıştığı yerel kolejinde teselli buldu. Charles'ın erkek kardeşinin yazdığı gibi, "Kolej onun karısı, çocukları ve tüm hayatı boyunca her şeydi." Hall ayrıca mirasının çoğunu koleje bıraktı - 5 milyon dolar.Hall 51 yaşında lösemiden öldü.
Hall'un yöntemi, büyük ölçekte elektrik kullanarak nispeten ucuz alüminyum elde etmeyi mümkün kıldı. 1855'ten 1890'a kadar sadece 200 ton alüminyum elde edildiyse, sonraki on yılda Hall yöntemine göre tüm dünyada bu metalden 28.000 ton elde edildi! 1930'a gelindiğinde, dünya yıllık alüminyum üretimi 300.000 tona ulaşmıştı. Şimdi yılda 15 milyon tondan fazla alüminyum üretiliyor. 960–970 ° C sıcaklıktaki özel banyolarda, bir alümina çözeltisi (teknik Al 2 O 3), kısmen mineral şeklinde ve kısmen özel olarak çıkarılan erimiş kriyolit Na 3 AlF 6 içinde elektrolize tabi tutulur. sentezlendi. Sıvı alüminyum, banyonun (katot) dibinde birikir, yavaş yavaş yanan karbon anotlarında oksijen salınır. Düşük voltajda (yaklaşık 4,5 V), elektrolizörler büyük akımlar tüketir - 250.000 A'ya kadar! Bir gün boyunca bir elektrolizör yaklaşık bir ton alüminyum üretir. Üretim büyük miktarda elektrik gerektirir: 1 ton metal üretmek için 15.000 kilovat saat elektrik harcanır. Bu miktarda elektrik, bir ay boyunca 150 dairelik büyük bir binayı tüketir. Alüminyum üretimi çevreye zararlıdır, çünkü atmosferik hava uçucu flor bileşikleri ile kirlenmiş.
Alüminyum kullanımı. Daha Fazla D.I. Mendeleev, "büyük hafifliğe ve dayanıklılığa ve havada düşük değişkenliğe sahip olan metal alüminyumun bazı ürünler için çok uygun olduğunu" yazdı. Alüminyum en yaygın ve en ucuz metallerden biridir. Onsuz hayal etmek zor modern hayat. Alüminyumun 20. yüzyılın metali olarak adlandırılmasına şaşmamalı. İşleme için uygundur: dövme, damgalama, haddeleme, çekme, presleme. Saf alüminyum oldukça yumuşak bir metaldir; için elektrik telleri, yapısal parçalar, folyo yapmak için kullanılır. Gıda Ürünleri, mutfak eşyaları ve "gümüş" boya. Bu güzel ve hafif metal, inşaat ve havacılık teknolojisinde yaygın olarak kullanılmaktadır. Alüminyum ışığı çok iyi yansıtır. Bu nedenle, bir vakumda metal biriktirme yoluyla aynaların imalatında kullanılır.
Uçak ve makine mühendisliğinde, bina yapılarının imalatında çok daha fazlası sert alaşımlar alüminyum. En ünlülerinden biri, bakır ve magnezyumlu bir alüminyum alaşımıdır (duralumin veya basitçe "duralumin"; adı Alman şehri Düren'den gelir). Bu alaşım sertleştikten sonra özel bir sertlik kazanır ve yaklaşık 7 kat daha güçlü hale gelir. saf alüminyum. Aynı zamanda demirden neredeyse üç kat daha hafiftir. Alüminyumun küçük bakır, magnezyum, manganez, silikon ve demir ilaveleriyle alaşımlanmasıyla elde edilir. Siluminler yaygındır - alüminyumun silikonlu döküm alaşımları. Yüksek mukavemetli, kriyojenik (donmaya karşı dayanıklı) ve ısıya dayanıklı alaşımlar da üretilmektedir. Ürünler için alüminyum alaşımları koruyucu ve dekoratif kaplamalar kolaylıkla uygulanır. Alüminyum alaşımlarının hafifliği ve sağlamlığı özellikle havacılık teknolojisinde kullanışlıydı. Örneğin, helikopter pervaneleri bir alüminyum, magnezyum ve silikon alaşımından yapılır. Nispeten ucuz alüminyum bronz (%11 Al'e kadar) yüksek mekanik özelliklere sahiptir, deniz suyunda ve hatta seyreltik hidroklorik asitte bile stabildir. 1926'dan 1957'ye kadar SSCB'de alüminyum bronzdan madeni paralar 1, 2, 3 ve 5 kopek cinsinden basıldı.
Şu anda, tüm alüminyumun dörtte biri inşaat ihtiyaçları için kullanılıyor, aynı miktar nakliye mühendisliği tarafından tüketiliyor, yaklaşık %17'si ambalaj malzemelerine ve tenekelere, %10'u ise elektrik mühendisliğine harcanıyor.
Alüminyum ayrıca birçok yanıcı ve patlayıcı karışım içerir. Alüminyum tozu ile trinitrotoluenin bir döküm karışımı olan Alumotol, en güçlü endüstriyel patlayıcılardan biridir. Amonal, amonyum nitrat, trinitrotoluen ve alüminyum tozundan oluşan patlayıcı bir maddedir. Yakıcı bileşimler alüminyum ve oksitleyici bir madde - nitrat, perklorat içerir. Piroteknik bileşimler "Zvezdochka" ayrıca toz alüminyum içerir.
Alüminyum tozunun metal oksitlerle (termit) bir karışımı, yanıcı mühimmatta kaynak rayları için belirli metalleri ve alaşımları elde etmek için kullanılır.
Alüminyum da bulundu pratik kullanım roket yakıtı olarak. 1 kg alüminyumun tam yanması, 1 kg kerosenden neredeyse dört kat daha az oksijen gerektirir. Ek olarak, alüminyum sadece serbest oksijen tarafından değil, aynı zamanda su veya karbondioksitin bir parçası olan bağlı oksijen tarafından da oksitlenebilir. Alüminyumun suda "yanması" sırasında, 1 kg ürün başına 8800 kJ salınır; bu, metalin saf oksijende yakılmasından 1,8 kat daha az, ancak havada yakılmasından 1,3 kat daha fazladır. Bu, bu tür yakıtın tehlikeli ve pahalı bileşikler yerine oksitleyici olarak kullanılabileceği anlamına gelir. sade su. Alüminyumun yakıt olarak kullanılması fikri, 1924 yılında Rus bilim adamı ve mucit F.A. Zander tarafından önerildi. Planına göre alüminyum elemanlar kullanılabilir uzay gemisi ek yakıt olarak. Bu cesur proje henüz pratikte uygulanmadı, ancak şu anda bilinen katı roket iticilerinin çoğu, ince bölünmüş bir toz şeklinde alüminyum metal içeriyor. Yakıta %15 alüminyum eklenmesi, yanma ürünlerinin sıcaklığını bin derece yükseltebilir (2200'den 3200 K'ye); motor memesinden yanma ürünlerinin egzoz oranı da belirgin şekilde artar - roket yakıtının verimliliğini belirleyen ana enerji göstergesi. Bu bağlamda, yalnızca lityum, berilyum ve magnezyum alüminyumla rekabet edebilir, ancak hepsi alüminyumdan çok daha pahalıdır.
Alüminyum bileşikleri de yaygın olarak kullanılmaktadır. Alüminyum oksit, seramik üretimi için bir hammadde olan refrakter ve aşındırıcı (zımpara) bir malzemedir. Lazer malzemeleri, saat yatakları, mücevher taşları (yapay yakutlar) da ondan yapılır. Kalsine alüminyum oksit, gazları ve sıvıları temizlemek için bir adsorban ve bir dizi organik reaksiyon için bir katalizördür. Susuz alüminyum klorür, yüksek saflıkta alüminyum elde etmek için başlangıç malzemesi olan organik sentezde (Friedel-Crafts reaksiyonu) bir katalizördür. Su arıtma için alüminyum sülfat kullanılır; içerdiği kalsiyum bikarbonat ile reaksiyona girerek:
Al 2 (SO 4) 3 + 3Ca (HCO 3) 2 2AlO (OH) + 3CaSO 4 + 6CO 2 + 2H 2 O,
yerleştiğinde, yüzeydeki sudaki asılı safsızlıkları ve hatta mikroorganizmaları yakalayan ve emen oksit-hidroksit pulları oluşturur. Ek olarak, alüminyum sülfat, kumaşların boyanmasında, deri tabaklamasında, ahşabın korunmasında ve kağıdın boyutlandırılmasında mordan olarak kullanılır. Kalsiyum alüminat, Portland çimentosu da dahil olmak üzere bağlayıcıların bir bileşenidir. İtriyum alüminyum granat (YAG) YAlO 3 bir lazer malzemesidir. Alüminyum nitrür, elektrikli fırınlar için refrakter bir malzemedir. Sentetik zeolitler (alüminosilikatlara aittirler) kromatografide ve katalizörlerde adsorbanlardır. Organoalüminyum bileşikleri (örneğin trietilalüminyum), yüksek kaliteli sentetik kauçuk da dahil olmak üzere polimerlerin sentezi için kullanılan Ziegler-Natta katalizörlerinin bileşenleridir.
Tikhonov V.N. Alüminyumun analitik kimyası. M., "Bilim", 1971
popüler kitaplık kimyasal elementler . M., "Bilim", 1983
Craig N.C. Charles Martin Hall ve Metall'i. J.Chem.Educ. 1986, cilt. 63, No.7
Kumar V., Milewski L. Charles Martin Hall ve Büyük Alüminyum Devrimi. J.Chem.Educ., 1987, cilt. 64, sayı 8


