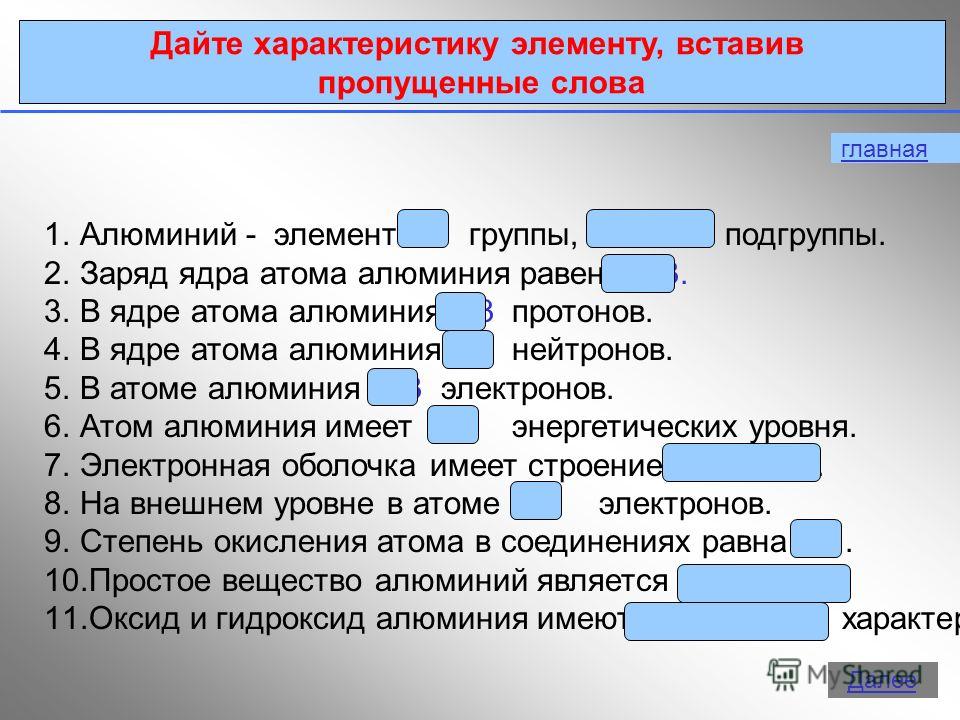
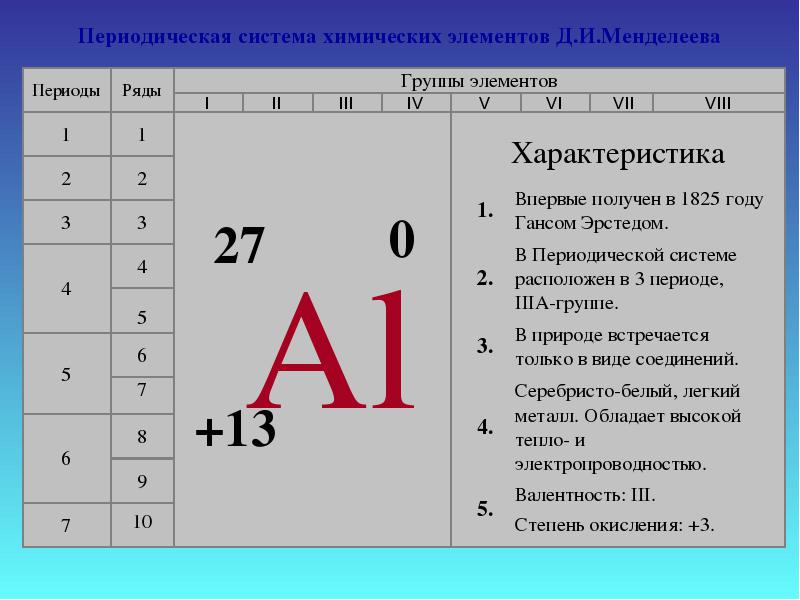
3 ana Elemanı eksik kelimeleri girerek karakterize edin 1. Alüminyum, ana alt grup olan grup III'ün bir elemanıdır. 2. Bir alüminyum atomunun çekirdeğinin yükü, bir alüminyum atomunun çekirdeğindeki 13 protondur. 4. Bir alüminyum atomunun çekirdeğinde 14 nötron vardır. 5. Bir alüminyum atomunda 13 elektron vardır. 6. Bir alüminyum atomunun 3 enerji seviyesi vardır. 7. Elektron kabuğunun yapısı 2e, 8e, 3e'dir. 8. Atomun dış seviyesinde 3 elektron vardır. 9. Bileşiklerdeki bir atomun oksidasyon durumu eşittir.Basit madde alüminyum bir metaldir. 11. Alüminyum oksit ve hidroksit doğaları gereği amfoteriktir. Daha öte
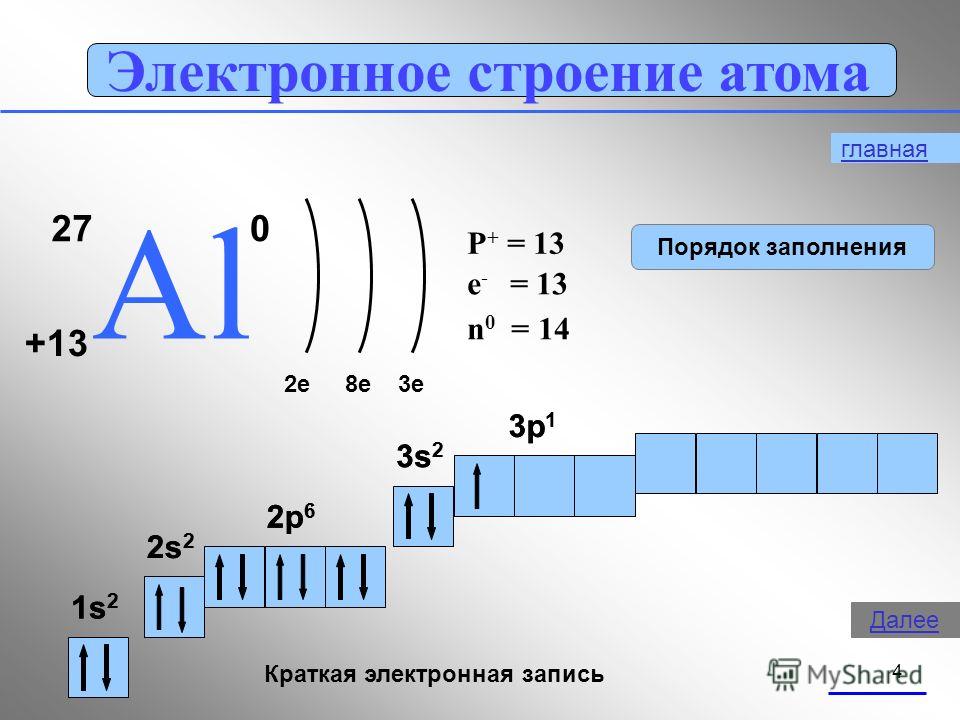
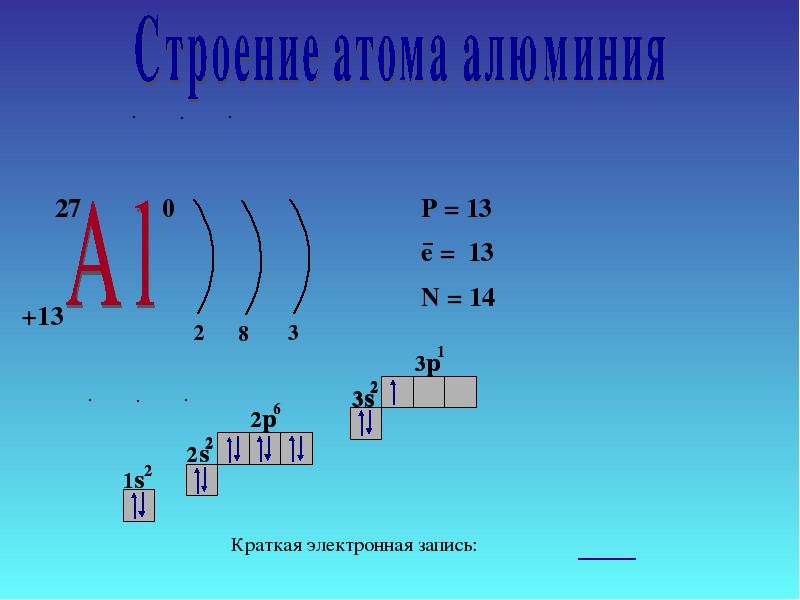
4 Atomun elektronik yapısı 27 AlAl e8e3e P + = 13 n 0 = 14 e - = 13 1s21s2 2s22s2 2p 6 3s 2 3p 1 Kısa elektronik kayıt 1s21s2 2s22s2 2p 6 3s 2 3p 1 Dolum sırası ana Sonraki
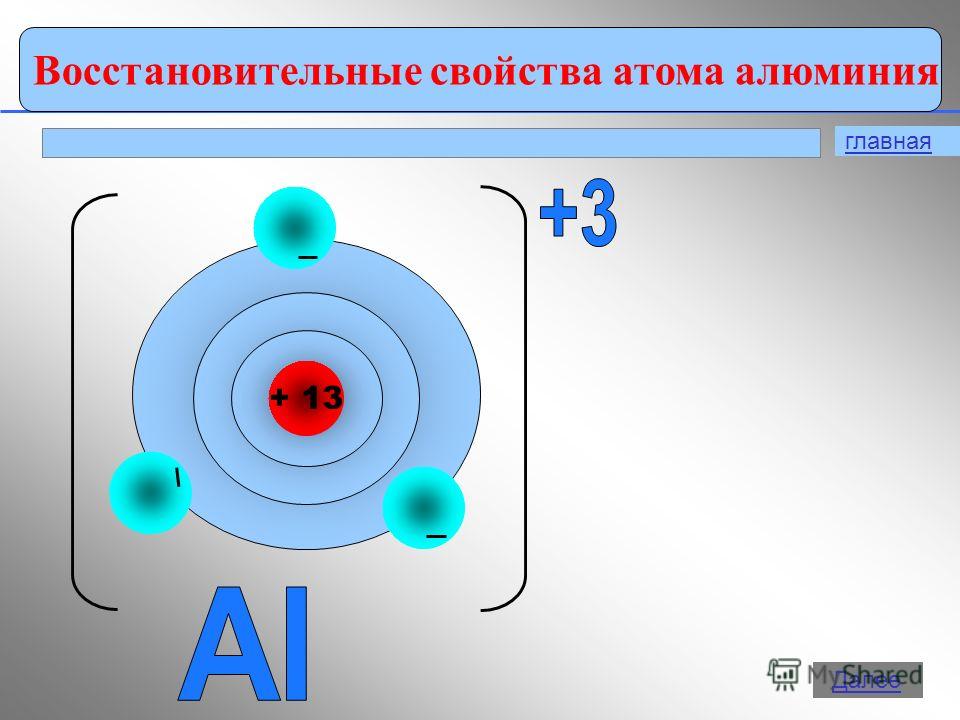

7 Keşif tarihinden Ana Sonraki Alüminyumun keşfi sırasında - metal altından daha pahalıydı. İngilizler, büyük Rus kimyager D.I. Mendeleev'i zengin bir hediye ile onurlandırmak istediler, ona bir bardağın altından, diğerinin alüminyumdan yapıldığı kimyasal bir denge verdiler. Alüminyumdan yapılmış bir bardak altından daha pahalı hale geldi. Ortaya çıkan "kilden gümüş" sadece bilim adamlarını değil, aynı zamanda sanayicileri ve hatta Fransa imparatorunu da ilgilendirdi. Daha öte



12 1. Gümüş-beyaz metal 2. Metalik parlaklık 3. En sert metal 4. Erime noktası +660 °C 5. Plastik 6. Bıçakla kesilmesi kolay 7. İletken elektrik 8. Hafif 9. Isıyı iletir 10. Mıknatıslanması ve manyetize edilmesi kolaydır 11. Yumuşak Alüminyumun fiziksel özellikleriyle ilgili bu özelliklerin numaralarını seçin ve yazın




Dersin Hedefleri:
eğitici - fiziksel çalışma ve Kimyasal özellikler alüminyum ve uygulamaları. Karakteristik düşünün kimyasal element alüminyum ve atomun yapısını inceleyin.
gelişmekte - bir deney yapma, bilimsel ve eğitici bir metnin içeriğini diyagram biçiminde aktarma becerilerini geliştirmek; iletişim becerilerinin gelişimi, dinleme becerileri, düşüncelerini doğru bir şekilde ifade etme yeteneği.
eğitici - ile çalışma kültürünü teşvik etmek kimyasallar, güvenlik yönetmeliklerine uygunluk, işte bilinçli disiplin, açıklık ve organizasyon geliştirmek.
Öğrenciler şunları bilmelidir:
alüminyum atomunun yapısı, basit bir madde olarak alüminyumun fiziksel ve kimyasal özellikleri, uygulama alanları.
Öğrenciler şunları yapabilmelidir:
Hem kimyasal bir element hem de basit bir madde olan alüminyumu karakterize etmek. Alüminyumun kimyasal özelliklerini moleküler ve redoks formunda kanıtlayan reaksiyon denklemlerini yazın.
Ders türü:
yeni materyal öğrenmek.
Organizasyon şekli Öğrenme aktiviteleriöğrenciler:
grup çalışması, bireysel, kimyasal deney.
Öğretim yöntem ve teknikleri:
arama, kısmi araştırma, gösteri kimyasal deneyi, grup çalışması, tahtada sözlü cevaplar, bağımsız iş metinlerle, karşılıklı kontrol.
Ders ekipmanı:
ders konusuyla ilgili bilimsel ve eğitici metinler, görev kartları bireysel sorular her grup için malzeme çalışma planı, PSCE,
Koleksiyon "Alüminyum ve bileşikleri", alüminyum folyo, hidroklorik asit ve sodyum hidroksit, alüminyum, laboratuvar ekipmanı.
1. zaman düzenleme.
Öğretmen öğrencileri selamlar.
2. Temel bilgilerin gerçekleştirilmesi, konunun iletişimi, dersin görevleri ve yapısı:
Öğretmenin tanıtım konuşması
Kendi başınıza, çalışarak, her şeyi yapacaksınız.
hem sevdikleriniz için hem kendiniz için
ve emekte başarı yoksa,
Başarısızlık sorun değil, tekrar deneyin.
D.I. Mendeleyev.
Büyük bir çalışmaya devam ediyoruz ve önemli konu"Metaller". Bugün derste, çocukluktan beri sizin için iyi bilinen metalle tanışmamız gerekiyor. Bu ders Efsane ile başlamak istiyorum.
“Bir gün Roma imparatoru Tiberius'a bir yabancı geldi. İmparatora hediye olarak gümüş kadar parlak ama son derece hafif bir metalden yaptığı bir fincan getirdi. Usta bu metali Clay Earth'ten aldığını söyledi. Ancak imparator, altın ve gümüşünün değer kaybetmesinden korkarak, efendiye kafasının kesilmesini ve atölyesinin yıkılmasını emretti. Hangi metalden bahsediyoruz?
(Alüminyum hakkında)
Öğretmen:
Böylece dersimizin konusu: "Alüminyum kimyasal bir element ve basit bir maddedir."
Dersin hedefleri formüle edilir.
Konuyu gruplar halinde incelemeyi planlayın:
- Fiziksel özellikler alüminyum.
- Alüminyumun kimyasal özellikleri.
- Alüminyumun kullanımı ve doğadaki varlığı.
Grup çalışma planı:
Metni inceleyin ve sorunuzla ilgili bilgileri vurgulayın;
- önerilen görevleri tamamlayın;
- Sunumun kısalığına, açıklığına ve netliğine dayalı olarak, konunuzla ilgili bir sunum hazırlayın
Materyal çalışması üzerinde grup çalışması.
Konunuzla ilgili bir sunum hazırlamak.
Grup 1.
PSCE'deki konumu ile kimyasal element alüminyumun özellikleri.
Egzersiz yapmak:
- Metni inceleyin.
- Plana göre PSCE'deki pozisyona göre alüminyumun bir tanımını verin:
A) seri numarası.
B) atom kütlesi.
C) dönem (küçük, büyük).
D) grup (alt grup: ana veya ikincil).
D) kimyasal işaret
E) Atomun yapısı (çekirdek yükü, proton sayısı, elektronlar, nötronlar, elektronik formül).
1) oksitler.
K) uçucu hidrojen bileşikleri.
2. Grupta sonuçları tartışın ve soruları yanıtlayın:
- Bir alüminyum atomunun dış seviyesinde kaç elektron var?
- Alüminyum bu elektronları bağışlayacak mı yoksa kabul edecek mi?
- Bu durumda alüminyum iyonu hangi oksidasyon durumunu elde edecek?
- Sonuç: Alüminyum hangi sınıf bileşiklere aittir (metal veya metal olmayan)
- Alüminyum kimyasal elementinin aktivitesini aynı periyodun 1. ve 2. grup elementleri ile karşılaştırın.
- Bu konuya dayalı olarak bir sunum hazırlayın. sunumun kısalığı, netliği ve netliği hakkında.
2. Grup
Alüminyumun fiziksel özellikleri.
Egzersiz yapmak:
- Metni inceleyin.
- Sorunuzla ilgili materyali vurgulayın.
- "Alüminyum ve alaşımları" koleksiyonunu düşünün.
- Aşağıdaki soruları bir grupta tartışın:
- a) Agreganın durumu, rengi, parlaklığı, yoğunluğu (hafif veya ağır), eriyebilirlik (kolay veya refrakter), elektriksel ve termal iletkenlik, plastik.
- b) Elde edilen verileri diyagram şeklinde çiziniz.
5. Konuya dayalı olarak bir sunum hazırlayın. kısalık ve netlik üzerine.
Grup 3.
Alüminyumun kimyasal özellikleri.
Egzersiz yapmak:
- Metni inceleyin.
- Sorunuzla ilgili materyali vurgulayın.
- Alüminyumun karmaşık maddelere göre nasıl davrandığını inceleyin?
- Talimatları kullanarak laboratuvarı tamamlayın
Egzersiz yapmak:
a) Deneyi yapın.
b) Grupta gözlemlenen fenomenleri tartışın.
C) Reaksiyon denklemini yazınız.
D) Sonuç çıkarmak
5. Bu konuda bir sunum hazırlamak, sunumun kısalığına, açıklığına ve netliğine dayalıdır.
Grup 4
Alüminyum kullanımı.
Egzersiz yapmak:
- Metni inceleyin.
- Sorunuzla ilgili materyali vurgulayın.
- Grubunuzda aşağıdaki soruları tartışın:
a) Alüminyumun insan hayatındaki rolü nedir?
b) Alüminyumun basit bir madde olarak kullanılması.
- Alüminyumun kapsamını karakterize eden bir diyagram yapın.
- Bu konuda bir konuşma hazırlayın, sunumun kısalığına, netliğine ve netliğine dayalı
- Çalışılan konularda grupların raporları.
Tüm görevleri tamamlayan her grup, tartışma ve yorumlarla sorusunun şematik bir sunumunu sunar, öğrenciler notlar alır, önerilen şemaları defterlere aktarır, tüm grupların sonucunda, referans özeti dersin konusu hakkında.
Dersin konusuyla ilgili sonuçlar:
Bir alüminyum atomunun dış enerji seviyesinde kaç elektron vardır.
Bir alüminyum atomunun oksidasyon numarası nedir? Neden? Niye? Ve iyon?
- Alüminyumun aktif bir metal olduğunu hangi deneylerle kanıtladık?
Hangi maddelere amfoterik denir?
- Aşağıdaki uygulamalar hangi özelliklere dayanmaktadır?
Alüminyum vücutta en çok nerede bulunur?
- Mümkün mü uzun zaman yiyecekleri alüminyum kaplarda saklamak?
- Ev ödevi: § 13 ila sayfa 60, ? 1, 4. Alüminyum kullanımı ile ilgili bir sunum hazırlayın.
- Son sözöğretmenler.
Öğretmen işbirliği için öğrencilere teşekkür eder, konuşmacıları tahtaya işaretler.
Referans.
Alüminyum.
Grup III'ün ana alt grubu elementleri içerir: bor, alüminyum, galyum, indiyum, talyum. Dış elektron katmanında, bu elementlerin atomları üç elektron (…ns2np1) içerir. Onlar p-elementleridir. Reaksiyonlarda, oksitleyici bir ajan olabilen metal olmayan bor hariç, bu elementlerin atomları indirgeyici ajanlardır. Bu alt grubun tüm elemanları en yüksek oksidasyon durumunu +3 sergiler. oluştururlar daha yüksek oksitler Amfoterik özellikler sergileyen E2O3 ve E(OH)3 hidroksitler. Alüminyum, bu alt grupta en çok ilgi çeken şeydir.
Alüminyum serbest formunda gümüşi beyaz bir metaldir, parlaklığa, yüksek ısı ve elektrik iletkenliğine (bu açıdan bakırdan daha düşük), hafif (yoğunluk 2,7 g/cm3) ve aynı zamanda dayanıklı bir metaldir. Yumuşak, sünek bir metaldir, folyoya sarılabilir, tel haline getirilebilir. 6600C'de erir. 6000C'de alüminyum kırılgan hale gelir ve öğütülerek tane veya toz haline getirilebilir.
Alüminyum, yüzeyi genellikle ince, dayanıklı bir oksit film ile kaplanmış bir metaldir. Talaş ve toz şeklinde havada parlak bir şekilde yanar ve büyük miktarda ısı yayar.
Oda sıcaklığında halojenlerle aktif olarak reaksiyona girer; ısıtıldığında kükürt (2000C), azot (8000C) ve diğer metal olmayanlarla etkileşime girer.
Alüminyumun karmaşık maddelere oranı:
Alüminyum, herhangi bir konsantrasyondaki hidroklorik asitte çözünür:
Alüminyum alkali çözeltilerde çözünür:
Alüminyum insan yaşamında önemli bir biyolojik rol oynar. Epitel ve bağ dokularının yapımında görev alır. İnsan vücudundaki alüminyum içeriği (70 kg vücut ağırlığı başına) 61 mg'dır. Tüm organ ve dokularda bulunur: en çok karaciğerde, akciğerlerde, beyin kemiklerinde. Vücuttaki ana alüminyum alımı gıdadır - bunlar ekmek ürünleri, çay (100 g ürün başına 20 - 200 mg arasında), patates - 100 g başına 4 mg. ürün, sarı şalgam - 100 g ürün başına 46 mg.
Alüminyum kaplarda yemek pişirirken ve saklarken, ürünlerdeki alüminyum içeriği iki katına çıkar. Kandaki alüminyum içeriğindeki bir artış, merkezin uyarılmasına neden olur. gergin sistem. Vücutta aşırı alüminyum ile motor aktivite, kasılmalar, hafıza bozukluğu, karaciğer ve böbrek hastalığı bozulur. Alüminyum içeriğinde bir azalma ile merkezi sinir sistemi inhibe edilir.
Alüminyumun uygulama alanları çok fazladır. Hafifliği ve sağlamlığından dolayı alüminyum ve alaşımları uçak ve roket yapımında (alüminyuma kanatlı metal denir), gemi ve otomobil yapımında; inşaatta - pencere çerçeveleri ve kapıların üretimi için, elektrik hatları için elektrik tellerinin imalatında alüminyumun hafifliği ve iyi elektrik iletkenliği kullanılır. Alüminyum tencere ve saklama folyosu üretiminde termal iletkenlik ve toksik olmama önemlidir. Gıda Ürünleri. Alüminyum tozu, demir ürünleri korozyondan korumak için gümüş boya üretiminin temelidir. Alüminyumun havada parlak bir alevle yanabilme özelliği, renkli havai fişeklerin hazırlanmasında ve maytap imalatında kullanılır.
BELEDİYE BÜTÇE EĞİTİM KURULUŞU
GENEL EĞİTİM OKULU № 81
Alüminyum. alüminyumun konumu periyodik sistem ve atomunun yapısı. Doğada bulmak. Alüminyumun fiziksel ve kimyasal özellikleri.
Kimya hocası
MBOU orta okulu №81
2013
Ders konusu: Alüminyum. Alüminyumun periyodik sistemdeki konumu ve atomunun yapısı. Doğada bulmak. Alüminyumun fiziksel ve kimyasal özellikleri.
Dersin Hedefleri:
alüminyumun doğadaki dağılımını, fiziksel ve kimyasal özelliklerini ve ayrıca oluşturduğu bileşiklerin özelliklerini göz önünde bulundurun.
İlerlemek
1. Dersin örgütsel anı. 2. Yeni materyal öğrenmek. Alüminyumana alt grup III periyodik sistem grupları bor (B), (A) oluşturur l), galyum (Ga), indiyum (In) ve talyum (Tl). Verilen verilerden de anlaşılacağı gibi, tüm bu unsurlar içinde açılmıştır. XIX yüzyıl.Ana alt grubun metallerinin keşfi
III
gruplar

AT
Bor ametaldir. Alüminyum bir geçiş metalidir, galyum, indiyum ve talyum ise tam metallerdir. Böylece, periyodik sistemin her bir grubunun elementlerinin atom yarıçaplarındaki bir artışla, metalik özellikler basit maddeler yoğunlaştırmak.Bu dersimizde alüminyumun özelliklerine daha yakından bakacağız.1. Alüminyumun D. I. Mendeleev tablosundaki konumu. Atomun yapısı, oksidasyon durumları gösterilmiştir. Alüminyum eleman şurada bulunur: III grup, ana "A" alt grubu, periyodik sistemin 3. periyodu, seri numarası No. 13, bağıl atom kütlesi Ar(Al ) = 27. Tabloda soldaki komşusu tipik bir metal olan magnezyum ve sağda artık metal olmayan silikondur. Bu nedenle, alüminyum bazı ara nitelikte özellikler sergilemelidir ve bileşikleri amfoteriktir.Al +13) 2 ) 8) 3 , p bir elementtir,
Temel durum
1 sn 2 2 sn 2 2 p 6 3 sn 2 3 p 1
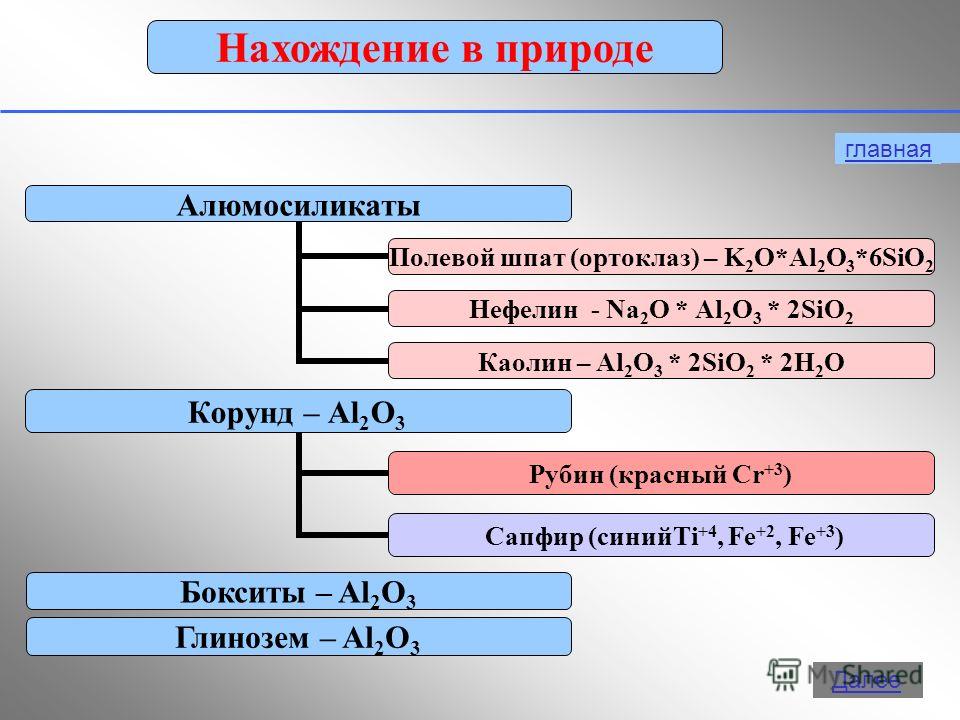
Alüminyum, bileşiklerde +3 oksidasyon durumu sergiler: Al 0 - 3 e - → Al +3 2. Fiziksel özellikler Serbest biçimli alüminyum, yüksek termal ve elektrik iletkenliğine sahip gümüşi beyaz bir metaldir. Erime noktası 650 hakkında C. Alüminyumun yoğunluğu düşüktür (2,7 g/cm2) 3 ) - demir veya bakırdan yaklaşık üç kat daha az ve aynı zamanda dayanıklı bir metaldir.3. Doğada olmak Doğadaki yaygınlık açısından, kaplarMetaller arasında 1. ve elementler arasında 3. sadece oksijen ve silikondan sonra ikinci. içindeki alüminyum yüzdesi yerkabuğuçeşitli araştırmacılara göre, yer kabuğunun kütlesinin %7,45 ila %8,14'ü kadardır.Doğada alüminyum sadece bileşikler halinde bulunur. (mineraller). Bazıları: Boksitler - Al 2 O 3 H 2 O (SiO 2 , Fe 2 O 3 , CaCO 3 safsızlıkları ile) Nefelinler - KNa 3 4 Alunitler - KAl(SO 4 ) 2 2Al(OH) 3 Alümina (kum SiO ile kaolinlerin karışımları) 2 , kalker CaCO 3 , manyezit MgCO 3 ) Korindon - Al 2 O 3 Feldspat (ortoklaz) - K 2 O×Al 2 O 3 ×6SiO 2 Kaolinit - Al 2 O 3 ×2SiO 2 × 2H 2 O Alunit - (Na,K) 2 SO 4 ×Al 2 (SO 4 ) 3 ×4Al(OH) 3… Beril - 3BeO Al 2 O 3 6SiO 2Boksit
4. Alüminyum ve bileşiklerinin kimyasal özellikleri Alüminyum normal koşullarda oksijenle kolayca etkileşir ve üzeri bir oksit film ile kaplanır (mat bir görünüm verir).Kalınlığı 0,00001 mm'dir ancak bu sayede alüminyum paslanma yapmaz. Alüminyumun kimyasal özelliklerini incelemek için oksit film çıkarılır. (Zımpara kağıdı kullanarak veya kimyasal olarak: önce oksit filmini çıkarmak için bir alkali çözeltisine daldırarak ve ardından bir alüminyum-cıva alaşımı - bir amalgam oluşturmak için bir cıva tuzları çözeltisine daldırarak).ben . Basit maddelerle etkileşim Zaten oda sıcaklığında olan alüminyum, tüm halojenlerle aktif olarak reaksiyona girerek halojenürler oluşturur. Isıtıldığında, bir katalizör varlığında kükürt (200 °C), azot (800 °C), fosfor (500 °C) ve karbon (2000 °C) ile iyot ile etkileşime girer - su: 2A l + 3 S \u003d A l 2 S 3 (alüminyum sülfit), 2A l + N 2 \u003d 2A lN (alüminyum nitrür), A l + P = A l P (alüminyum fosfit), 4A l + 3C \u003d A l 4 C 3 (alüminyum karbür). 2 Al + 3 I 2 \u003d 2 A lI 3 (alüminyum iyodür)Tüm bu bileşikler, alüminyum hidroksit ve buna bağlı olarak hidrojen sülfür, amonyak, fosfin ve metan oluşumu ile tamamen hidrolize edilir: Al 2 S 3 + 6H 2 O = 2Al(OH) 3 + 3H 2 SAl 4 C 3 + 12H 2 O = 4Al(OH) 3 + 3CH 4 Talaş veya toz şeklinde havada parlak bir şekilde yanar ve büyük miktarda ısı yayar: 4A l + 3 O 2 \u003d 2A l 2 O 3 + 1676 kJ.
II. Karmaşık maddelerle etkileşim su ile etkileşim : 2 Al + 6 H20 \u003d 2 Al (OH) 3 + 3 H2 oksit filmi olmadan Metal oksitlerle etkileşim: Alüminyum, aktif metallerden biri olduğu için iyi bir indirgeyici ajandır. Alkali toprak metallerinden hemen sonra aktivite serisindedir. Bu yüzdenmetalleri oksitlerinden geri yükler . Böyle bir reaksiyon - alüminotermi - tungsten, vanadyum vb. gibi saf nadir metalleri elde etmek için kullanılır. 3 Fe 3 O 4 + 8 Al \u003d 4 Al 2 O 3 + 9 Fe + Q termit karışımı Fe 3 Ö 4 ve Al (toz) - termit kaynağında da kullanılır. C r 2 O 3 + 2A l \u003d 2C r + A l 2 O 3 asitlerle etkileşim : Sülfürik asit çözeltisi ile: 2 Al + 3 H 2 SO 4 \u003d Al 2 (SO 4) 3 + 3 H 2 Soğuk konsantre sülfürik ve azotlu (pasifler) ile reaksiyona girmez. Bu nedenle nitrik asit alüminyum tanklarda taşınır. Alüminyum ısıtıldığında hidrojen salmadan bu asitleri indirgeyebilir: 2A l + 6H 2 SO 4 (kons) \u003d A l 2 (SO 4) 3 + 3 SO 2 + 6H 2 O, A l + 6H NO 3 (kons) \u003d A l (NO 3) 3 + 3 NO 2 + 3H2O. Alkalilerle etkileşim . 2 Al + 2 NaOH + 6 H20 \u003d 2 Na Al (OH) 4 + 3 H2 Na[ANCAK ben(O) 4 ] – sodyum tetrahidroksoalüminat Kimyager Gorbov'un önerisiyle, Rus-Japon Savaşı sırasında, bu reaksiyon balonlar için hidrojen üretmek için kullanıldı. Tuz çözeltileri ile: 2 Al + 3 CuSO 4 \u003d Al 2 (SO 4) 3 + 3 Cu Alüminyum yüzeyi cıva tuzu ile ovulursa, aşağıdaki reaksiyon meydana gelir: 2 Al + 3 HgCl 2 = 2 AlCl 3 + 3 hgSerbest kalan cıva, alüminyumu çözerek bir amalgam oluşturur. 5. Alüminyum ve bileşiklerinin uygulanması

Alüminyumun fiziksel ve kimyasal özellikleri, teknolojide yaygın olarak kullanılmasına yol açmıştır.Havacılık endüstrisi, alüminyumun önemli bir tüketicisidir. : 2/3 uçak alüminyum ve alaşımlarından yapılmıştır. Çelikten yapılmış bir uçak çok ağır olurdu ve çok daha az yolcu taşıyabilirdi.Bu nedenle alüminyum kanatlı metal olarak adlandırılır. Kablolar ve teller alüminyumdan yapılmıştır : aynı elektriksel iletkenliğe sahip, kütleleri karşılık gelen bakır ürünlerden 2 kat daha azdır.Alüminyumun korozyon direnci göz önüne alındığında,nitrik asit için aparat ve kapların parçalarının imalatı . Alüminyum tozu, demir ürünleri korozyondan korumak ve ısı ışınlarını yansıtmak için gümüş boya üretiminin temelidir, bu boya yağ depolama tesislerini ve itfaiyeci kıyafetlerini kaplamak için kullanılır.Alüminyum oksit, alüminyum üretmek için ve ayrıca bir refrakter malzeme olarak kullanılır.Alüminyum hidroksit, mide suyunun asitliğini azaltan iyi bilinen Maalox, Almagel ilaçlarının ana bileşenidir. Alüminyum tuzları yüksek oranda hidrolize olur. Bu özellik su arıtma sürecinde kullanılır. Oluşan asidi nötralize etmek için saflaştırılacak suya alüminyum sülfat ve az miktarda sönmüş kireç eklenir. Sonuç olarak, çökelerek askıya alınmış bulanıklık ve bakteri parçacıklarını alan hacimsel bir alüminyum hidroksit çökeltisi salınır.Bu nedenle, alüminyum sülfat bir pıhtılaştırıcıdır.6. Alüminyum elde etmek 1) Alüminyum üretmek için modern, uygun maliyetli yöntem, 1886'da American Hall ve Fransız Héroux tarafından icat edildi. Erimiş kriyolit içindeki bir alüminyum oksit çözeltisinin elektrolizinden oluşur. Erimiş kriyolit Na 3 AlF 6, Al 2 O 3'ü çözer, su şekeri nasıl eritir Erimiş kriyolit içindeki bir alüminyum oksit "çözeltisinin" elektrolizi, kriyolit sadece bir çözücü ve alüminyum oksit bir elektrolitmiş gibi ilerler. 2Al 2 O 3 elektrik akımı → 4Al + 3O 2 Erkek ve Kız İngiliz Ansiklopedisi'nde alüminyum hakkında bir makale şu sözlerle başlar: “23 Şubat 1886'da medeniyet tarihinde yeni bir metal çağı başladı - alüminyum çağı. Bu gün, 22 yaşındaki kimyager Charles Hall, elinde bir düzine küçük gümüşi beyaz alüminyum bilye ile ilk öğretmeninin laboratuvarına geldi ve bu metali üretmenin bir yolunu bulduğu haberini verdi. ucuza ve bol miktarda. Böylece Hall, Amerika'nın kurucusu oldu. alüminyum endüstrisi ve Anglo-Sakson Ulusal kahraman bilimden büyük bir iş çıkarmış bir adam olarak. 2) 2Al 2 O 3 + 3 C \u003d 4 Al + 3 CO 2 BU İLGİNÇ:
- Metalik alüminyum ilk olarak 1825'te Danimarkalı fizikçi Hans Christian Oersted tarafından izole edildi. Oersted, gaz halindeki kloru kömürle karıştırılmış bir sıcak alümina tabakasından geçirerek en ufak bir nem izi olmadan alüminyum klorürü izole etti. Metalik alüminyumu eski haline getirmek için Oersted'in alüminyum klorürü potasyum amalgam ile işlemesi gerekiyordu. 2 yıl sonra Alman kimyager Friedrich Wöller. Potasyum amalgamı saf potasyumla değiştirerek yöntemi geliştirdi.
18. ve 19. yüzyıllarda alüminyum, ana mücevher metaliydi. 1889'da Londra'da D.I. Mendeleev, kimyanın gelişimine yaptığı hizmetler için değerli bir hediye aldı - altın ve alüminyumdan yapılmış teraziler.
1855'te Fransız bilim adamı Saint-Clair Deville, elde etmek için bir yöntem geliştirmişti. metal alüminyum teknik ölçekte. Ancak yöntem çok pahalıydı. Deville, Fransa İmparatoru III. Napolyon'un özel himayesinden yararlandı. Bağlılığının ve minnettarlığının bir işareti olarak, Deville, Napolyon'un oğlu, yeni doğan prens için, alüminyumdan yapılmış ilk "tüketici ürünü" olan zarif bir şekilde oyulmuş bir çıngırak yaptı. Napolyon, muhafızlarını alüminyum zırhlarla donatmayı bile planladı, ancak fiyatı yasaktı. O zaman, 1 kg alüminyum 1000 mark, yani. Gümüşten 5 kat daha pahalı. Alüminyumun geleneksel metaller kadar değerli hale gelmesi elektrolitik işlemin icadına kadar değildi.
İnsan vücuduna giren alüminyumun sinir sistemi bozukluğuna neden olduğunu biliyor muydunuz? Fazlalığı ile metabolizma bozulur. Koruyucu maddeler ise C vitamini, kalsiyum, çinko bileşikleridir.
Alüminyum oksijen ve flor içinde yandığında çok fazla ısı açığa çıkar. Bu nedenle roket yakıtına katkı maddesi olarak kullanılır. Satürn roketi, uçuşu sırasında 36 ton alüminyum tozu yakar. Metalleri roket yakıtının bir bileşeni olarak kullanma fikri ilk olarak F.A. Zander tarafından önerildi.
Düşünmek! Bu reaksiyon neden sulu bir çözelti içinde gerçekleştirilemez? №2. Kimyasal reaksiyonların denklemlerini tamamlayın:
Al + H 2 SO 4 (çözelti) ->
Al + CuCl 2 ->
Al + HNO3 (kons.) - t ->
Al + NaOH + H20 -> Hayır. 3. Sorunu çözün:
Bir alüminyum-bakır alaşımı, ısıtılırken fazla miktarda konsantre sodyum hidroksit çözeltisine maruz bırakıldı. 2,24 litre gaz (b.b.s.) serbest bırakıldı. Toplam kütlesi 10 g ise alaşımın yüzde bileşimini hesaplayın?4. Ödev Not: Derste bir sunum kullanılabilir"Alüminyum. Alüminyumun periyodik sistemdeki konumu ve atomunun yapısı. Doğada bulmak. Alüminyumun fiziksel ve kimyasal özellikleri.»
2.1.1 Alüminyumun periyodik sistemdeki konumu ve atomunun yapısı
Alüminyum, grup III'ün ana alt grubundadır. Enerji seviyelerinin yerleşimi aşağıdaki gibidir:
3 Al 2e - , 8e - ,3e -
Alüminyum atomları dış seviyede 3 elektrona sahip olduğundan, bileşiklerde alüminyum 4-3 oksidasyon durumu sergiler.
Elektronların atomlardaki hareketinin doğası ve bunların yalnızca enerji seviyelerinde değil, aynı zamanda alt seviyelerdeki konumları hakkındaki fikirlerin rehberliğinde aynı sonuca varıyoruz. Bir alüminyum atomunda, 3s 2 elektronu kolayca bozulur ve bir elektron 3p yörüngesini geçer:
Sonuç, eşleşmemiş üç elektrondur. 1. soruyu yanıtlayın (s. 138).
2.1.2 Alüminyumun doğada bulunması, üretimi ve özellikleri
Alüminyum, yerkabuğunda en bol bulunan üçüncü elementtir. Sadece bileşiklerde oluşur. Bunlardan en önemlileri Şekil 19'da gösterilmektedir.
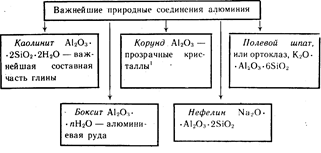
Renkli kırmızı Al 2 O 3 kristalleri - yakut, mavi renkli- safirler.
Fiş
1827'de Alman kimyager F. Wöhler, alüminyum klorürü alkali metallerle potasyum veya sodyum ile hava olmadan ısıtarak alüminyum elde etti.
AlCl 3 +3K 3KCl + Al
İçin endüstriyel üretim alüminyum, bu yöntemler ekonomik olarak kârsızdır, bu nedenle boksitlerden alüminyum elde etmek için elektrokimyasal bir yöntem geliştirilmiştir.
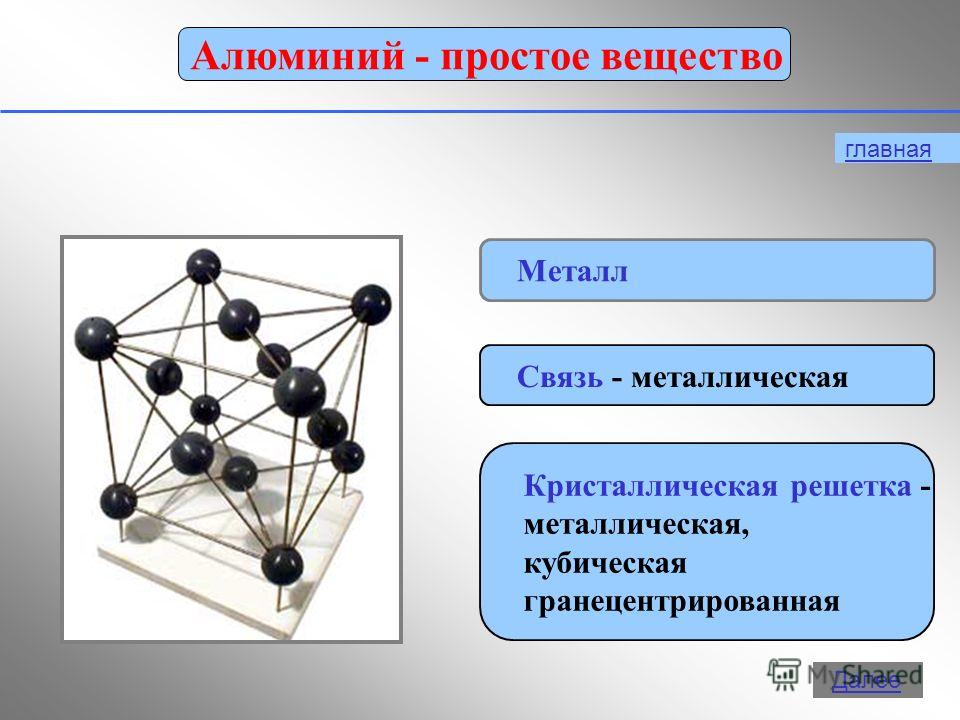
Fiziksel özellikler
Alüminyum gümüşi beyaz bir metaldir, hafif (r = 2,7 g/cm3), 660 °C'de erir. Çok plastiktir, kolayca tel haline getirilir ve tabaka ve folyo şeklinde fırınlanır. Elektriksel iletkenlik açısından, alüminyum yalnızca gümüş ve bakırdan sonra ikinci sıradadır (bakırın elektrik iletkenliğinin 2/3'ü kadardır).
Kimyasal özellikler
Elektrokimyasal gerilim serisinde alüminyum en aktif metallerin arkasına yerleştirilmiştir. Bununla birlikte, günlük deneyimlerden, alüminyum ürünlerin (tabaklar, vb.), kaynama sıcaklığında bile oksijenden veya sudan etkilenmediği bilinmektedir. Alüminyum ayrıca konsantre soğuk nitrik asitten etkilenmez. Bunun nedeni, alüminyum yüzeyinde onu daha fazla oksidasyondan koruyan ince bir oksit filminin bulunmasıdır. Alüminyum yüzeyi cıva tuzu ile ovulursa, aşağıdaki reaksiyon meydana gelir:
2А1 + 3HgCl 2 ® 2А1С1 3 + 3Hg
Serbest kalan cıva alüminyumu çözer ve cıva ile alaşımı oluşur - alüminyum amalgam. Film, birleştirilmiş yüzeyde tutulmaz, bu nedenle alüminyum normal koşullar altında suyla reaksiyona girer (Şekil 46):
2А1 + 6НОН ® 2А1(ОН) 3 ¯ + 3Н 2
Yüksek sıcaklıklarda alüminyum, birçok metal olmayan ve karmaşık maddelerle birleşme olmaksızın reaksiyona girer:

Başvuru
Alüminyum, çeşitli alaşımların üretiminde kullanılmaktadır. En yaygın olanları bakır ve magnezyum içeren duraluminler ve siluminler - silikonlu alüminyum alaşımlarıdır. Bu alaşımların ana avantajları hafiflik ve yüksek mukavemettir. Bahsedilen alaşımlar uçak, otomobil, gemi ve alet yapımında, roket teknolojisinde ve inşaatta yaygın olarak kullanılmaktadır. Saf metal formundaki alüminyum, elektrik tellerinin ve çeşitli kimyasal ekipmanların imalatında kullanılır.
Alüminyum ayrıca aluminizasyon için, yani çelik ve dökme demir ürünlerin yüzeylerini korozyondan korumak için alüminyum ile doyurmak için kullanılır.
Uygulamada, termit sıklıkla kullanılır (alüminyum tozu ile Fe3 O 4 oksit karışımı). Bu karışım ateşe verilirse (bir magnezyum bant kullanılarak), serbest bırakılmasıyla şiddetli bir reaksiyon meydana gelir. Büyük bir sayı sıcaklık:
8Al + 3Fe 3 O 4 ® 4Al 2 O 3 + 9Fe
Bu işlem, termit kaynağı olarak adlandırılan kaynakta ve ayrıca bazı metallerin serbest formda elde edilmesinde kullanılır.
2-6. soruları yanıtlayın (s. 138). 1 - 2 problemlerini çözün (s. 138).
2.1.3 En önemli alüminyum bileşikleri
Alüminyum oksit
Al 2 O 3 aşağıdaki yollarla elde edilebilir:
1. Alüminyum metal tozunun doğrudan yakılmasıyla (alüminyum tozunun brülör alevine üflenmesiyle):
4Al + 3O 2 ® 2А1 2 O 3
2. Aşağıdaki şemaya göre dönüşümle:
Alüminyum oksit katı, ateşe dayanıklı (sıcaklık pl. 2050 °C) bir maddedir Beyaz renk.
Kimyasal özelliklerine göre amfoterik bir oksittir (I, § 37). Asitlerle reaksiyona girer, bazik oksitlerin özelliklerini gösterir:
A1 2 O 3 + 6HC1 2A1C1 3 + 3H 2 O
Al 2 O 3 + 6H + + 6С1 - 2Al 3+ + 6С1 - + 3Н 2 O
A1 2 O 3 + 6H + 2A1 3+ + 3H 2 O
Alüminyum oksit alkalilerle reaksiyona girer ve asidik oksitlerin özelliklerini gösterir. Ayrıca, füzyon sırasında, metaalüminyum asit HA1O2 tuzları, yani meta-alüminatlar oluşur:
Al 2 O 3 + 2NaOH 2NaA10 2 + H 2 0
Su varlığında reaksiyon farklı şekilde ilerler:
A1 2 O 3 + 2NaOH + H 2 O ® 2
Bunun nedeni, sulu bir çözeltide sodyum alüminat NaA1O 2'nin bir veya iki su molekülü bağlamasıdır, bu aşağıdaki gibi gösterilebilir:
a) NaAlO2-H20 veya NaH2AlO3; b) NaA1O2 -2H20 veya NaAl (OH) 4.
alüminyum hidroksit
Alüminyum hidroksit A1 (OH) 3, bir alkali çözeltisinin alüminyum tuzlarının çözeltileri ile reaksiyona sokulmasıyla elde edilir (bir alkali çözeltisi fazla alınamaz):
AlCl 3 + NaOH ® Al(OH) 3 ¯ + 3NaCl
A1 3+ + 3Cl - + 3Na + + 3OH - ® Al(OH) 3 ¯ + 3Na + + 3С1 -
Al 3+ + 3OH - ® A1 (OH) 3 ¯
Beyaz jöle benzeri alüminyum hidroksit kütlesi çözeltiden izole edilir ve kurutulursa, pratik olarak suda çözünmeyen beyaz kristal bir madde elde edilir.
Alüminyum hidroksit (oksidi gibi) amfoterik özelliklere sahiptir. Tüm bazlar gibi, alüminyum hidroksit de asitlerle reaksiyona girer. Alüminyum hidroksit alkalilerle birleştiğinde metaalüminatlar oluşur ve sulu çözeltiler- metaalüminatların hidratları:
-1(OH) 3 + NaOH NaА1O 2 + 2H 2 O
A1 (OH) 3 + NaOH ® NaH 2 A1O 3 + H 2 O
Alüminyum tuzları, esas olarak metalik alüminyumun asitlerle etkileşimi ile elde edilir. Fiziksel özelliklerine göre bunlar, suda kolayca çözünen katı kristal maddelerdir. Alüminyum tuzlarının kimyasal özellikleri diğer tuzlarınkine benzerdir (, s. 98-99). Alüminyum tuzları zayıf bir baz ve kuvvetli bir asitten oluştuğu için sulu çözeltilerde hidrolize uğrarlar (s. 18).
7-10 arasındaki soruları yanıtlayın (s. 138). 3. sorunu çözün (s. 138).
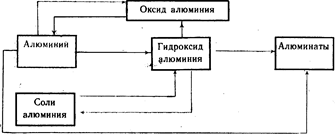
Alüminyum ve en önemli bileşikleri arasındaki genetik ilişki (Şema 20).
Böylece, yukarıdakilerden şu sonuca varılabilir: Okul müfredatı bu konunun çalışmasına çok az saat ayrılmıştır ve bunun dışında, bu konunun çevresel yönleri hakkında pratikte hiçbir bilgi yoktur.
Azot, resmi olarak +1 ila +5 arasındaki tüm olası oksidasyon durumlarına karşılık gelen bir dizi oksit oluşturur: N 2 O, NO, N 2 O 3, NO 2, N 2 O 5, ancak bunlardan sadece ikisi nitrik oksittir ( II) ve oksit nitrojen(IV) sadece normal koşullar altında kararlı olmakla kalmaz, aynı zamanda doğal ve endüstriyel nitrojen döngülerinde aktif olarak yer alır.
2.2.1 Bazı azot bileşikleri ve özellikleri 1.2.1.1. azot oksitler
N 2 +1 O - nitrik oksit (I), azot oksit, "gülen" gaz, tuz oluşturmayan oksit. Amonyum nitratın ayrıştırılmasıyla N 2 O elde edin:
N 2 O hafif hoş bir kokuya ve tatlı bir tada sahiptir. Oksijen, su, asit ve alkali çözeltileri ile reaksiyona girmez. 500 °C'nin üzerindeki sıcaklıklarda elementlere ayrışır, yani oldukça kararlıdır.
Yapı: oksijenin 2 eşleşmemiş elektronu vardır, azotun 3'ü vardır - bir çift bağ oluşur ve kalanında bir eşleşmemiş elektron bulunur. NO moleküllerinin eşleşeceği ve dimerik bir ONNO molekülü oluşturacağı varsayılabilir. Molekül yapısı: merkezi N atomunun dört değerli olduğu doğrusal molekül O=N=N. İki çift bağ oluşturur: biri tipik bir kovalent bağ oluşturma şemasına göre oksijenle (iki nitrojen elektronu, iki oksijen elektronu), diğeri nitrojen atomuyla (üç eşleşmemiş elektronundan ikisini eşleştirir ve boş bir yörünge oluşturur. buna), bağlardan biri kovalent, ikincisi verici-alıcıdır (Şekil 1).
Nitrik oksit (I) üretimi için kurulum, raflar, test tüpleri, gaz çıkış tüplü bir tıkaç, bir kristalleştirici, bir silindir ve bir alkol lambasından oluşur (Şekil 2). NH 4 NO 3 bir test tüpüne yerleştirilir, gaz çıkış tüplü bir tıpa ile kapatılır ve ısıtılır. Gaz, suyla dolu bir silindirde toplanır.

Pirinç. 1. Nitrik oksit molekülü (I) - N 2 O
Oksit N 2 O ısıtıldığında ayrışır:
Oksit N 2 O, hidrojen ile reaksiyona girer:
N +2 O - nitrik oksit (II), tuz oluşturmayan oksit. NO, bakırın asit HNO3 (fark) ile reaksiyona girmesiyle elde edilir (Şekil 3).
kristal hücre moleküler; molekül hafif, zayıf polardır (oksijen elektronegatifliği nitrojeninkinden biraz daha yüksektir). Molekülün polaritesi elektrostatik çekim kuvvetlerini basit moleküller arası kuvvetlere bağlamayı mümkün kıldığı için, erime ve kaynama noktalarının düşük, ancak nitrojeninkinden daha yüksek olacağı varsayılabilir. Bir dimer oluşumu da kaynama noktasında bir artışa katkıda bulunur. Molekülün yapısı ayrıca suda düşük bir çözünürlük gösterir. Nitrik oksit (II) renksiz ve kokusuzdur.
Nitrik oksit (II) elde etmek için bir test tüpüne birkaç bakır talaşı yerleştirilir ve seyreltik nitrik asit dökülür. Test tüpü, gaz çıkış tüplü bir tıpa ile kapatılır ve bir tripoda sabitlenir. Gaz çıkış borusunun ucu su ile kalıba ve ardından silindire indirilir (Şekil 3). Isıtıldığında NO açığa çıkar. NO, hava oksijeni tarafından kolayca oksitlenir, yani indirgeyici madde olarak işlev görür:
![]()
ile reaksiyona girerek ekşi gaz oksit NO - oksitleyici ajan:
![]()
N +2 2 O 3 - nitrik oksit (III), nitröz anhidrit (nitröz asit HNO 2 ve nitrit tuzlarına karşılık gelir); asidik bir oksittir, asidik oksitlerin tüm özelliklerine sahiptir. Reaksiyonla oksit N 2 O 3 alın:
NO 2 + NO N 2 O 3.
N +4 O 2 - nitrik oksit (IV), nitrojen dioksit, kahverengi gaz (toksik).
NO molekülündeki nitrojen elektronlarını düşünün. Bu eşleşmemiş bir elektron, bir serbest elektron çifti ve oksijene bağlı iki elektron daha - toplam beş. Ve "temas eden" oksijen atomunun dört yörüngede altı elektronu vardır. Bunları birer birer düzenlerseniz, bir yörünge serbest kalacaktır. Azot atomunun bir çift elektronu tarafından işgal edilen bu boşluktur (Şekil 4, 5).
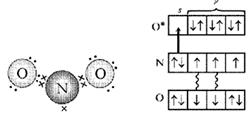
Pirinç. 4. Şema elektronik yapı NO2 molekülleri (ilk seçenek). (Noktalar O atomlarının elektronlarını, çarpılar N atomunun elektronlarını gösterir)
Pirinç. 5. NO 2 molekülünün elektronik yapısının şeması (ikinci versiyon). (Yıldız, uyarılmış O atomunu gösterir, ok, verici-alıcı bağını gösterir.
S-yörüngesinde bulunan bir çift elektron "bağlandığından", hibridizasyona girmesi gerekir. Soru ortaya çıkıyor: atom ne tür hibridizasyon kullanıyor? Cevap: Üç elektronik nitrojen yörüngesi, sp 2 hibridizasyonu durumundadır. NO2 molekülü açısaldır, açı 134°'dir (1 elektron bağ elektronlarını bir çift elektrondan daha zayıf ittiği için açı 120°'den büyüktür) (Şekil 6, 7).
Kristal kafes molekülerdir, ancak molekülün kendisi NO'dan daha ağır olduğundan ve dimerleşme eğilimi belirgin şekilde daha yüksek olduğundan, bu madde belirgin şekilde daha yüksek sıcaklıklarda erimeli ve kaynamalıdır. Kaynama noktası 21 ° C'dir, bu nedenle normal koşullar altında - 20 ° C ve 760 mm Hg. Sanat. – nitrik oksit (IV) sıvısı.
Nitrik oksit (IV) suda çözünür, onunla aynı anda reaksiyona girer ve bu durumda aynı anda iki asit elde edilir.


Pirinç. 6. NO 2 molekülü - üstten görünüm
Pirinç. 7. NO2 molekülü - donör-alıcı bağının yanından yandan görünüm. (İkinci oksijen atomu, nitrojen atomunun yörüngelerinin ötesinde görünmez. Gölgeli daireler, okuyucuya doğru bakan hibritleştirilmiş atomik yörüngelerdir.)
Nitrik oksit (IV), hem karakteristik keskin bir kokuya hem de konsantrasyona bağlı olarak tonları birbirinden farklı olan kırmızımsı kahverengi bir renge sahiptir. Bu renk için atmosfere azot oksit emisyonları "tilki kuyrukları" olarak adlandırılır.
NO2 oksit reaksiyonları
1) Su ile:
2NO 2 + H 2 O \u003d HNO 3 + HNO 2.
2) Alkalilerle:
2NO 2 + 2NaOH \u003d NaNO 3 + NaNO 2 + H20.
3) Soğutmada dimerizasyon:
![]()
-11 °C sıcaklıkta denge tamamen sağa, +140 °C'de tamamen sola kayar.
N +5 2 O 5 - nitrik oksit (V), nitrik anhidrit, asit oksit, güçlü oksitleyici ajan. Oksit N 2 O 5 kolayca ayrışır:
2N 2 O 5 \u003d 4NO 2 + O 2.
2.2.1.2 Nitrik asit
Azot hidroksitlerden en çok tonajlı - nitrik asidi ele alacağız.
Nitrik asit molekülü polardır (oksijen ve hidrojenin farklı elektronegatifliği nedeniyle, çünkü nitrojen adeta molekülün içinde gizlidir) ve asimetriktir. Azot ve oksijen bağları arasında bulunan üç açı da farklıdır. Azotun formal oksidasyon durumu en yüksek (+5)'tir. Ancak aynı zamanda azot atomunda diğer atomlarla sadece 4 bağ vardır - azotun değeri 4'tür.
Bir molekülün yapısını, onu elde etme sürecini göz önünde bulundurursak anlamak daha kolaydır. Nitrik asit, nitrik oksidin (IV) suyla (oksijen varlığında) reaksiyonu ile elde edilir: iki NO2 molekülü, eşlenmemiş elektronlarıyla su molekülüne aynı anda "saldırır", sonuç olarak hidrojen ve oksijen arasındaki bağ her zamanki gibi kırılmamış (oksijendeki bir çift elektron ve "çıplak proton") ve bir NO2 molekülü elektronuyla hidrojen alır, diğeri - OH radikali (Şekil 8). İki asit oluşur: her iki asit de güçlüdür, her ikisi de protonlarını en yakın su moleküllerine hızla bağışlar ve nihayetinde NO2 - ve NO3 - iyonları şeklinde kalır. NO 2 iyonu kararsızdır, iki HNO 2 molekülü suya, NO 2 ve NO'ya ayrışır. NO oksit oksijenle reaksiyona girerek NO2'ye dönüşür ve bu şekilde sadece nitrik asit elde edilene kadar devam eder.
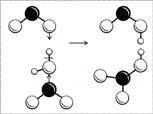
Pirinç. 8. Nitrik ve nitröz asit moleküllerinin oluşum şeması. (Siyah top N atomudur, büyük beyaz toplar O atomlarıdır, küçük beyaz toplar H atomlarıdır.)
Resmi olarak, bir nitrojen atomunun bir oksijen atomuna bir çift bağla ve diğeriyle - sıradan bir tek bağla (bu oksijen atomu da bir hidrojen atomuna bağlanır) bağlı olduğu ortaya çıktı. HNO3'teki azot, bir donör olarak hareket eden azot atomu ile bir donör-alıcı bağı ile üçüncü oksijen atomuna bağlanır. Bu durumda nitrojen atomunun hibridizasyonu, yapıyı belirleyen bir çift bağın varlığından dolayı sp 2 olmalıdır - düz bir üçgen. Gerçekte, bir nitrojen atomunun ve üç oksijen atomunun bir parçasının gerçekten de düz bir üçgen olduğu ortaya çıktı, sadece bir nitrik asit molekülünde bu üçgen yanlıştır - üç ONO açısının tümü farklıdır, bu nedenle üçgenin farklı tarafları. Molekül ayrıldığında, üçgen düzenli, eşkenar olur. Bu, içindeki oksijen atomlarının eşdeğer hale geldiği anlamına gelir. Tüm bağlantılar aynı hale gelir.
Nitrik asidin fiziksel özellikleri
İyonize bir bileşiğin kısmen de olsa gaza dönüştürülmesi zordur. Bu nedenle kaynama noktası yeterince yüksek olmalıdır, ancak bu kadar küçük bir moleküler ağırlıkla erime noktası yüksek olmamalıdır. Bu nedenle, 20°C'deki agregasyon durumu sıvıdır. Çözünürlük ile ilgili olarak, diğer birçok polar sıvı gibi, nitrik asit su ile herhangi bir oranda kolayca karışır. Saf nitrik asit renksiz ve kokusuzdur. Bununla birlikte, içinde çözünen oksijen ve nitrik okside (IV) ayrışması nedeniyle, sıradan konsantre nitrik asidin sarı-kahverengi bir renge ve NO 2'nin keskin bir kokusuna sahip olduğunu söyleyebiliriz. Nitrik asit molekülünün yapısının kimyasal özelliklerini nasıl etkilediğini görelim.
HNO 3 güçlü bir oksitleyici ajandır
HNO3 metaller (M) ile etkileşime girdiğinde hidrojen salınmaz:
M + HNO 3 ® tuz + su + gaz.
1:3 (1V HNO3 + 3V HCl) hacim oranında HNO3 (kons.) ile HCl (kons.) karışımına "aqua regia" denir.
Au + HNO 3 + 3HCl = AuCl 3 + NO + 2H 2 O.
Nitrik asit, diğer asitlerle değişim veya bileşik reaksiyonları şeklinde reaksiyona girmez. Bununla birlikte, güçlü bir oksitleyici ajan olarak reaksiyona girme yeteneğine sahiptir. Konsantre nitrik ve hidroklorik asit karışımında, tersinir reaksiyonlar, özü denklemle genelleştirilebilir:
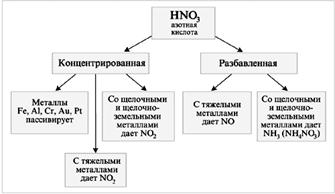
Ortaya çıkan atomik klor çok aktiftir ve metal atomlarından elektronları kolayca alır ve klorür iyonu, elde edilen metal iyonlarıyla kararlı kompleks iyonlar oluşturur. Bütün bunlar, altının bile çözeltiye aktarılmasını sağlar. Güçlü bir dehidrasyon ajanı olarak konsantre H2S04, nitrik asidin nitrik oksit (IV) ve oksijene ayrışmasının reaksiyonunu destekler. Nitrik asit, güçlü inorganik asitlerden biridir ve doğal olarak alkalilerle reaksiyona girer. Çözünmeyen hidroksitler ve bazik oksitlerle de reaksiyona girer.
“Azot” konusunu incelerken. Azot bileşikleri”, G.E. tarafından düzenlenen kimya ders kitabını kullanır. Rudzitis, F.G. Feldman, ayrıca 9. sınıf için bir ders kitabı, N.S. Ahmetov. didaktik malzeme A. M. Radetsky, V. P. Gorshkov tarafından düzenlenen 8-9. sınıflar için kimya kitabı olarak hizmet eder; 9. sınıf için kimyada bağımsız çalışma görevleri kullanılır, R.P. Surovtseva, S.V. sofronova; kimyada bir problemler topluluğu için kullanılır lise ve üniversitelere başvuranlar için, G.P. Khomchenko, I.G. Khomchenko. Bu konunun incelenmesi için 7 saat ayrılmıştır.
3. BÖLÜM III VE V GRUP D.I.
Bor doğada hiçbir zaman serbest halde bulunmaz, her zaman oksijenle ilişkili olduğu ortaya çıkar. Bu formda volkanik bölgelerdeki kaplıcaların sularında bulunan borik asit H 3 BO 3'te bulunur. Ek olarak, doğada çok sayıda borik asit tuzu yaygındır. Bu tuzlardan en iyi bilineni boraks veya tinkal Na 2 B 4 O 7'dir. 10H 2 O. Borasit 2Mg 3 B 8 O 15 teknik öneme sahiptir. MgCl 2, pandermit Ca 2 B 6 O 11. 3H 2 O, kolemanit Ca 2 B 6 O 11. 5H 2 O, kernit Na 2 B 4 O 7. 4H 2 O.
Borik asit türevleri olan aşağıdaki mineralleri belirtmek gerekir: borokalsit CaB 4 O 7. 4H 2 O, boron-natrokalsit NaCaB 5 O 9. 6H 2 O, hidroborasit MgCaB 6 O 11. 6H 2 O, boromagnezit 2Mg 5 B 4 O 11. 5H 2 O, singalit MgAlBO 4 ve diğerleri.
3.1.1.2 Biyokimyasal rol
Bor ve bileşikleri büyük önem içinde ulusal ekonomi. Nötronları emen 5 10 B izotopu, nükleer teknolojide nükleer zincir reaksiyonlarını yavaşlatmak için kullanılır. Boraks ve borik asit tıpta antiseptik olarak uzun süredir kullanılmaktadır.
Borun fizyolojik ve biyolojik aktivitesi çok yüksektir. Bor etkileyebilir kritik süreçler hayvan ve bitki biyokimyası. Mn, Cu, Zn ve Mo ile birlikte bor, beş temel eser elementten biridir. Bor kemik ve dişlerde, kaslarda, kemik iliğinde, karaciğerde ve tiroid bezinde yoğunlaşır. Organizmaların büyümesini ve gelişmesini hızlandırması muhtemeldir. Bu, borun bitkiler üzerindeki etkisinden görülebilir. Bor açlığı ile verim ve özellikle tohum sayısı önemli ölçüde azalır. Hayvanların yaşamı için sütte (inek) ve yumurta sarısında bulunması önemlidir. tavuk yumurtaları. Bazı bitkiler (yem otları ve şeker pancarı) hektar başına birkaç gram bor toplar. Bor zenginleştirilmiş meralarda otlayan bazı hayvanların yağ dokularında önemli miktarda bulunur. Vücuttaki bor bileşiklerinin bileşimi bilinmemektedir. Borun bağırsak amilazını ve bağırsak proteinazlarını inhibe ettiği, insülinin etkisini arttırdığı ve adrenalinin oksidasyonunu engellediği, B 2 ve B 12 vitaminlerini zayıflattığı tespit edilmiştir. Bor fazlalığı ile borik enterit ortaya çıkar. Aşırı bor içeriği bitki hastalığına yol açar. Buğday ve yulaf, 0.7 - 0.8 mgV/kg toprak varlığında zarar görür. Bor ile toprak tuzlanmasına karşı mücadele, borlu toprakların yıkanmasıyla gerçekleştirilir.
Ve eğitim organizasyonunun didaktik temelleri, "Elektrodinamiğin Temelleri" konusunu incelerken fizik derslerinde incelenen materyali daha kolay açıklamayı mümkün kılar. analiz çeşitli teknolojiler bir grup eğitim biçiminde öğrencilerin diyalojik iletişime odaklanmasını geliştirmek için bir yazarın teknolojisini tasarlamayı mümkün kıldı. Kullanırken öğrenme sürecinin ne kadar doğru inşa edileceğinden ...
Bununla birlikte, bir ortaokul dersinde moleküler fizik ve kimya arasındaki ilişki konusunu ele almak gerekli hale gelir. Moleküler fizik çalışmasında, kimya ile ilişkisi iki ana yönde kendini gösterir. Bunlardan ilki, moleküler fiziğin temel hükümlerini kanıtlamak için kimya eğitimi sürecinde öğrencilerin edindiği bilgileri materyal olarak kullanmaktır. İkinci...
Dersin Hedefleri:
Alüminyumu kimyasal elementlerin periyodik tablosundaki konumuna göre tanımlayın.
Atomun yapısına dayanarak, fiziksel ve kimyasal özelliklerini göz önünde bulundurun.
Alüminyum üretiminin endüstriyel yöntemini tanımak ve uygulama alanlarını belirtmek.

Alüminyumun keşfi tarihinden ... "Kilden gümüş"
Alüminyumun keşfi sırasında bu metal altından daha pahalıydı. İngilizler, büyük Rus kimyagerini zengin bir hediye ile onurlandırmak istediler.
D.I. Mendeleev, ona bir bardağın altından, diğerinin alüminyumdan yapıldığı kimyasal bir denge verdi. Alüminyumdan yapılmış bir bardak altından daha pahalı hale geldi. Ortaya çıkan "kilden gümüş" sadece bilim adamlarını değil, aynı zamanda sanayicileri ve hatta Fransa imparatorunu da ilgilendirdi.


Alüminyum uygulaması






askeri sanayi

İnşaat

Doğada alüminyum bulmak
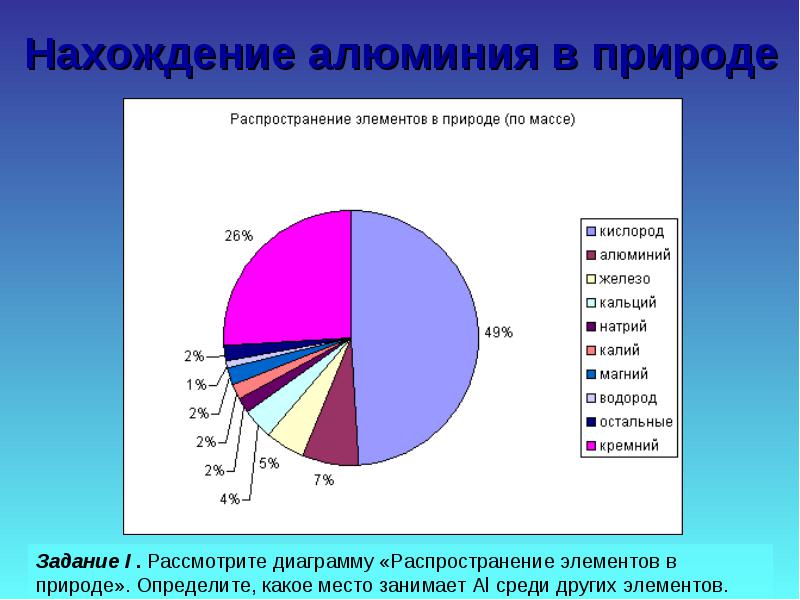
Doğal alüminyum bileşikleri
Görev II. Doğal bileşik örneklerini göz önünde bulundurun, bunları sertlik, güç, renk açısından karşılaştırın, bazılarındaki Al içeriğini hesaplayın.
Nefelinler-KNa34
- Alümina (kum SiO2, kireçtaşı CaCO3, manyezit MgCO3 ile kaolin karışımları)
- Korundum (safir, yakut, zımpara) - Al2O3
- Feldspatlar - (K,Na)2O Al2O3 6SiO2, Ca
- Kaolinit - Al2O3 2SiO2 2H2O
- Beril (zümrüt, akuamarin) - 3BeO Al2O3 6SiO2

Alüminyumun fiziksel özellikleri. Laboratuvar işi.
talimat kartı.
2. Alüminyumun kümelenme durumunu belirleyin.
3. Plaka ne renk?
4. Bu plakanın parlak olup olmadığını belirleyin.
5. Kaydı uzunluğunun ¼'ü kadar bir bardak sıcak suya 10-15 saniye batırın.
Plakayı sudan çıkarın, peçeteyle silin ve alüminyumun ısı iletkenliği olup olmadığını belirleyin?
6. Alüminyum folyoyu tutun. Alüminyumun sünek olup olmadığını belirleyin? Hafif bir metal mi?
7. Bir bardak soğuk suya bir alüminyum levha koyun, birkaç kez çevirin. Alüminyumun erimesi gözlemleniyor mu?
8. Plana göre gözlemlerinizi kısaca yazın:
- kümelenme durumu,
- renk,
- parlamak,
- termal iletkenlik,
- plastisite,
- sudaki çözünürlük.


Laboratuvar işi: "Alüminyumun Kimyasal Özellikleri".
talimat kartı.
1. İki test tüpü alın. Her birine bir parça alüminyum koyun. Birine 1-2 ml hidroklorik asit çözeltisi, diğerine aynı miktarda sülfürik asit çözeltisi dökün. Ne izliyorsun? Test tüplerini hafifçe ısıtın. Karşılık gelen reaksiyonların denklemlerini yazın.
2. Bir deney tüpüne bir parça alüminyum koyun. 1.5 ml konsantre sülfürik asit ekleyin. Ne izliyorsun? Reaksiyon denklemini yazın.
3. Test tüpüne bir parça alüminyum yerleştirin ve alkali solüsyonu ekleyin. Test tüpünün içeriğini ısıtın. Ne oluyor? Reaksiyon denklemini yazın.
4. Yapılan işin sonuçlarını bir tabloya koyun:


Sanayide alüminyum elde etmek

Ölçek
1. Alüminyum atomunun elektronik konfigürasyonu nedir?
A) 1s22s22p1 B) 1s22s22p3
B) 1s22s22p63s23p1 D) 1s22s22p63s23p63d14s2
2. Alüminyum aşağıdaki maddelerden hangisiyle tepkimeye girer?
A) CaO B) HCl
B) Cl2 D) NaOH
3. Belirtilen metallerden hangisi daha aktiftir,
alüminyumdan daha mı?
A) Na B) Cu
B) Ca D) Fe
4. Alüminyumun en karakteristik oksidasyon durumu:
A) +1 B) +2
C) +3 D) +4
5. Kimyasal reaksiyonlarda alüminyum aşağıdaki özellikleri gösterir:
A) oksitleyici bir ajan B) bir inert bileşik
C) indirgeyici madde D) oksitleyici madde ve indirgeyici madde
6. Endüstride alüminyum elde edilir:
A) indirgeyici ajan olarak sodyum metali kullanmak
B) erimiş alüminyum oksitin elektrolizi
C) indirgeyici ajan olarak karbon monoksit (P) kullanılması
D) bir alüminyum tuzları çözeltisinin elektrolizi