За първи път метален алуминийе получен по химичен път от немския химик Ф. Вьолер през 1821 г. (редукция от алуминиев хлорид с метален калий при нагряване). През 1854 г. френският учен Saint-Clair Deville предлага електрохимичен метод за производство на алуминий чрез редуциране на алуминиево-натриевия двоен хлорид с натрий.
Производство и производство на алуминий
Метален алуминий се получава на три етапа:
- Получаване на алуминий (Al 2 O 3) от алуминиеви руди;
- Получаване на алуминий от алуминий;
- рафиниране на алуминий.
Получаване на алуминиев оксид
Около 95% от целия алуминиев оксид се получава от бокситни руди.
Боксит(френски боксит) (след името на областта Baux в Южна Франция) - алуминиева руда, състояща се от алуминиеви хидроксиди, оксиди на желязо и силиций, суровини за производство на алуминиев оксид и огнеупорни материали, съдържащи алуминий. Съдържанието на алуминиев триоксид в търговските боксити варира от 40% до 60% и повече. Използва се и като флюс в черната металургия.
Снимка 1 - Бокситова руда
Обикновено бокситът е земна, подобна на глина маса, която може да има ивици, пизолит (подобна на грах) или еднаква текстура. При нормални атмосферни условия фелдшпатовете (минералите, които съставляват по-голямата част от земната кораи като алумосиликати) се разлагат с образуването на глини, но при горещ климат и висока влажност бокситът може да се окаже краен продукт от тяхното разлагане, тъй като такава среда благоприятства отстраняването на основи и силициев диоксид, особено от сиенити или габро. Бокситите се преработват в алуминий на етапи: първо се получава алуминиев оксид (алуминиев оксид), а след това метален алуминий ( електролитнов присъствието на криолит).
Основните примеси в бокситите са Fe 2 O 3 , SiO 2 , TiO 2 . Малките примеси на бокситите включват: Na 2 O, K 2 O, CaO, MgO, редкоземни елементи, Cr, P, V, F, органични вещества.
Обикновено бокситите се класифицират:
- по цвят;
- от основния минерал (по-често те се смесват);
- по възраст.
Основни критерии качествата на алуминиевата руда са:
- Силициев модул (Msi = Al 2 O 3 /SiO 2 (% тегл.)). Колкото по-голям е силиконовият модул, толкова по-добро качество(Msi = 7);
- Съдържание на желязо по отношение на Fe 2 O 3 . Ако съдържанието на Fe 2 O 3 е около 18 тегл.%, тогава бокситът се счита с високо съдържание на желязо. Колкото по-голямо е съдържанието на желязо, толкова по-трудно е да се добиват боксити;
- Съдържание на сяра. Наличието на голямо количество сяра затруднява обработката на боксит;
- Съдържанието на карбонати по отношение на CO 3 (2-) . Наличието на голямо количество карбонати усложнява обработката на боксита.
Използват се боксити:
- в производството на алуминиев триоксид;
- в производството на абразивни материали;
- в производството на огнеупорни материали;
- като флюс за топене на мартенова стомана;
- за сушене на газове и почистване на масло от сяра;
- като багрило.
Към днешна дата основните доставчици на боксит са:
- Австралия - има и огромни находища на Fe, Au, U, Ni, Co, Cu и др. По-изгодно е да купувате суровини от Австралия, отколкото да обработвате свои собствени.
- Гвинея - Русия има няколко закупени места.
- Централна Америка: Гвиана, Ямайка, Суриман.
- Бразилия.
В Европа всички депозити са изчерпани. Бокситите се доставят от Гърция, но тази суровина е с лошо качество.
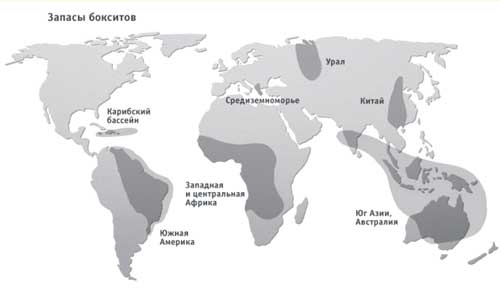
Фигура 2 - Запаси от боксит в света
По-долу са основните находища на алуминиеви руди в Русия.
- Първото находище е открито през 1914 г. близо до Санкт Петербург, близо до град Тихвин. На това находище са построени 6 завода. Най-големият е Волховският алуминиев завод. Към днешна дата Тихвинското находище е изчерпано и работи главно с вносни суровини.
- През 1931 г. е открито уникалното Северо-Уралско находище на висококачествен боксит (СУБР). Той послужи като основа за изграждането през 1939 г. на Уралския алуминиев завод (УАЗ). И на базата на южноуралската бокситна мина (ЮБР) е построена алуминиевата топилна Богословски (БАЗ).
- Североонежското поле се намира на пътя за Колския полуостров. Има го в Плана, но датата на построяване не е известна.
- Висловското находище е чисто глинесто находище от типа каолит. Не се използва за алуминиев оксид.
- Тиманско поле (Република Коми, Варкута). Канадците се интересуват от тази област, така че планират да строят фабрики (Коми Суал е холдингова компания).
Получаване на алуминиев оксид от бокситни руди
Тъй като алуминият е амфотерен, алуминият се произвежда по три начина:
- алкална,
- киселина;
- електролитен.
Най-разпространен е алкалния метод (методът на К. И. Байер, разработен в Русия в края на миналия век и използван за обработка на висококачествени боксити с малко количество (до 5–6%) силициев диоксид). От тогава техническо изпълнениетой е значително подобрен. Схемата за производство на алуминиев триоксид по метода на Байер е показана на фигура 3.
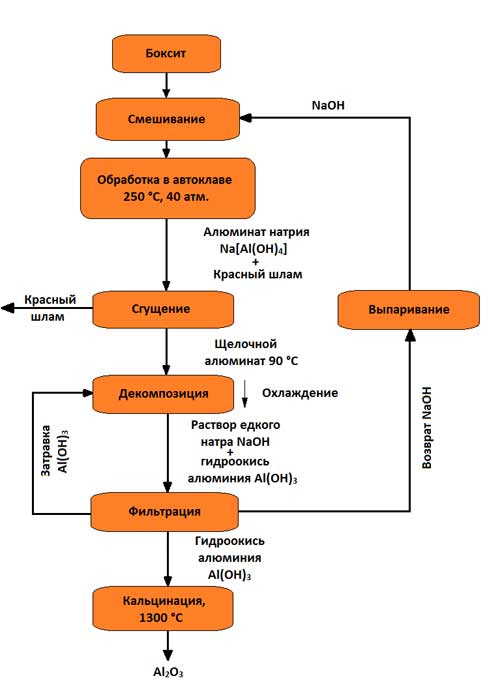
Фигура 3 - Схема за получаване на алуминиев триоксид по метода на Байер
Същността на метода е, че алуминиевите разтвори бързо се разлагат, когато в тях се въведе алуминиев хидроксид, а разтворът, останал от разлагането след неговото изпаряване при условия на интензивно смесване при 169–170 °C, може отново да разтвори съдържащия се в боксити алуминиев оксид. Този метод се състои от следните основни операции:
1. Приготвяне на боксит, което се състои в раздробяването и смилането му в мелници; мелниците се доставят с боксит, каустична основа и не голям бройвар, който подобрява отделянето на Al 2 O 3 ; полученият пулп се подава за излугване;
2. Излугване на боксит (в последните временаизползваните до момента автоклавни блокове с кръгла форма са частично заменени от тръбни автоклави, в които излугването става при температури 230–250 ° C (500–520 K), което се състои в химическото му разлагане от взаимодействие с воден разтворалкали; хидратите на алуминиевия оксид, когато взаимодействат с алкали, преминават в разтвор под формата на натриев алуминат:
AlOOH+NaOH→NaAlO2 +H2O
Al(OH)3 +NaOH→NaAlO2 +2H2O;
SiO2 +2NaOH→Na2SiO3 +H2O;
в разтвор натриевият алуминат и натриевият силикат образуват неразтворим натриев алумосиликат; титанови и железни оксиди преминават в неразтворимия остатък, придавайки на остатъка червен цвят; този остатък се нарича червена кал. След завършване на разтварянето, полученият натриев алуминат се разрежда с воден разтвор на алкали, като се понижава температурата със 100 ° C;
3. Отделяне на алуминатния разтвор от червена кал, обикновено се извършва чрез промиване в специални сгъстители; в резултат на това червената кал се утаява, а алуминатният разтвор се отцежда и след това се филтрира (избистря). В ограничени количества утайката се използва например като добавка към цимента. В зависимост от марката на боксита, на 1 тон произведен алуминиев триоксид се пада 0,6 - 1,0 тона червена кал (сух остатък);
4. Разлагане на алуминатния разтвор. Филтрира се и се изпомпва в големи съдове с бъркалки (разложители). Алуминиевият хидроксид Al(OH) 3 се екстрахира от свръхнаситен разтвор при охлаждане до 60 °C (330 K) и постоянно разбъркване. Тъй като този процес протича бавно и неравномерно и образуването и растежа на кристали от алуминиев хидроксид има голямо значениепри по-нататъшната му обработка се добавя голямо количество твърд хидроксид към разложителите - семена:
Na2O Al2O3 + 4H2O→Al(OH)3 + 2NaOH;
5. Разпределение на алуминиев хидроксид и неговата класификация; това се случва в хидроциклони и вакуумни филтри, където от алуминатния разтвор се отделя утайка, съдържаща 50 - 60% Al(OH) 3 частици. Значителна част от хидроксида се връща в процеса на разлагане като семенен материал, който остава в циркулация в непроменени количества. Остатъкът след измиване с вода отива за калциниране; филтратът също се връща в циркулация (след концентриране в изпарители - за извличане на нови боксити);
6. Дехидратация на алуминиев хидроксид (калциниране); това е крайната операция на производството на алуминиев триоксид; извършва се в тръбни ротационни пещи, а напоследък и в пещи с турбулентно движение на материала при температура 1150 - 1300 °C; суров алуминиев хидроксид, преминаващ през въртяща се пещ, изсушен и дехидратиран; при нагряване се случват последователно следните структурни трансформации:
Al(OH) 3 → AlOOH → γ-Al 2 O 3 → α-Al 2 O 3
200 °C - 950 °C - 1200 °C.
Крайният калциниран алуминиев оксид съдържа 30 - 50% α-Al2O3 (корунд), останалото е γ-Al 2 O 2 .
Този метод извлича 85 - 87% от целия произведен алуминиев оксид. Полученият алуминиев оксид е силен химично съединениес точка на топене 2050°C.
Получаване на алуминий чрез електролиза
Електролитната редукция на алуминиев оксид, разтворен в стопилка на базата на криолит, се извършва при 950–970 °C в електролитна клетка. Електролизаторът се състои от вана, облицована с въглеродни блокове, на дъното на която a електричество. Течният алуминий, освободен на дъното, служещ като катод, е по-тежък от стопилката на електролитната сол, поради което се събира върху въглищна основа, откъдето периодично се изпомпва (Фигура 4). Отгоре въглеродните аноди са потопени в електролита, които изгарят в атмосферата на кислород, освободен от алуминиев оксид, освобождавайки въглероден оксид (CO) или въглероден диоксид (CO 2). На практика се използват два вида аноди:
- самоизпичащи се аноди Zederberg, състоящи се от брикети, така наречените "хлябове" от масата Zederberg (нископепелни въглища с 25 - 35% смола от каменовъглен катран), пълнени в алуминиева обвивка; под действието на висока температура анодната маса се изпича (синтерува);
- изстреляни или "непрекъснати" аноди, направени от големи въглеродни блокове (например 1900 × 600 × 500 mm, с тегло около 1,1 тона).

Фигура 4 - Схема на електролизатора
Силата на тока на електролизерите е 150 000 A. Те са свързани към мрежата последователно, т. е. получава се система (серия) - дълъг ред електролизатори.
Работното напрежение на ваната, което е 4 - 5 V, е много по-високо от напрежението, при което алуминиевият оксид се разлага, тъй като загубите на напрежение в процеса са неизбежни. различни частисистеми. Балансът на суровини и енергия при получаване на 1 тон алуминий е показан на Фигура 5.
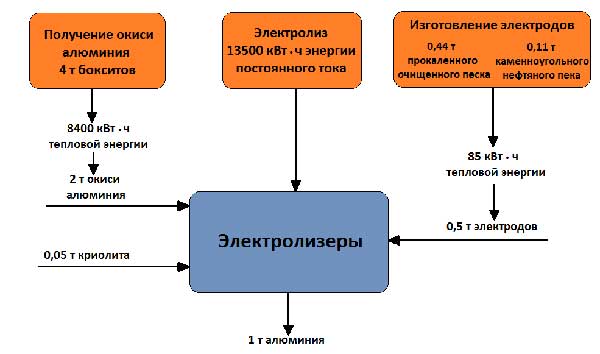
Снимка 5 - Балансът на суровини и енергия при производството на 1 тон алуминий
В реакционния съд алуминиевият оксид първо се превръща в алуминиев хлорид. След това, в плътно изолирана баня, се извършва електролизата на AlCl 3 , разтворен в разтопените соли на KCl, NaCl. Освободеният при този процес хлор се изсмуква и се подава за рециклиране; алуминият се отлага върху катода.
Предимствата на този метод пред съществуващата електролиза на течна криолит-алуминиева стопилка (Al 2 O 3 , Na 3 AlF 6 разтворени в криолит) са: спестяване на до 30% енергия; възможността за използване на алуминиев оксид, който не е подходящ за традиционна електролиза (например Al 2 O 3 с високо съдържание на силиций); замяна на скъпия криолит с по-евтини соли; елиминиране на опасността от излъчване на флуорид.
Получаване на рафиниран алуминий
За алуминия не е възможна електролиза за рафиниране с разлагане на водни солеви разтвори. Тъй като за някои цели степента на пречистване на промишления алуминий (Al 99.5 - Al 99.8), получен чрез електролиза на стопилка криолит-алуминий, е недостатъчна, тогава се получава още повече от промишлен алуминий или метални отпадъци чрез рафиниране. чист алуминий(Al 99.99R). Най-известният метод за рафиниране е трислойната електролиза.
Рафиниране чрез трислойна електролиза
Облицована със стоманена ламарина, работеща на постоянен ток (Фигура 6), рафиниращата баня се състои от въглищно огнище с токови проводници и топлоизолираща магнезитова облицовка. За разлика от електролизата на стопилка криолит-алуминиев триоксид, анодът тук по правило е разтопен рафиниран метал (долен аноден слой). Електролитът е съставен от чисти флуориди или смес от бариев хлорид и алуминиеви и натриеви флуориди (среден слой). Алуминият, разтварящ се от анодния слой в електролита, се освобождава над електролита (горен катоден слой). Чистият метал служи като катод. Токът се подава към катодния слой от графитен електрод.

Фигура 6 - Схема на електролитна клетка с предно огнище за рафиниране на алуминий (по Fulda - Ginzberg)
1 - алуминиева стопилка; 2 – електролит; 3 - високочестотен рафиниран алуминий; 4 – графитен катод; 5 - магнезитова стена; 6 - преден рог; 7 - изолационен слой; 8 - странична изолация; 9 - въглищно огнище; 10 – аноден проводник; 11 - изолация на огнището; 12 - желязна кутия; 13 - капак
Ваната работи при 750 - 800 ° C, консумацията на енергия е 20 kWh на 1 kg чист алуминий, т.е. малко по-висока, отколкото при конвенционалната електролиза на алуминий.
Анодният метал съдържа 25–35% Cu; 7 – 12% Zn; 6 – 9% Si; до 5% Fe и малко количество манган, никел, олово и калай, останалото (40 - 55%) е алуминий. Всички тежки метали и силиций остават в анодния слой по време на рафинирането. Наличието на магнезий в електролита води до нежелани промени в състава на електролита или до силното му шлаковане. За отстраняване на магнезий шлаките, съдържащи магнезий, се обработват с флюс или газообразен хлор.
В резултат на рафинирането се получава чист алуминий (99,99%) и продукти на сегрегация (продукт Ziger), които съдържат тежки метали и силиций и се изолират под формата на алкален разтвор и кристален остатък. Алкалният разтвор е отпадък, а твърдият остатък се използва за обезкиселяване.
Рафинираният алуминий обикновено има следния състав, %: Fe 0,0005 - 0,002; Si 0,002 - 0,005; Cu 0,0005 - 0,002; Zn 0,0005 - 0,002; Mg следи; Ал почивка.
Рафинираният алуминий се преработва в полуфабрикат в посочения състав или легиран с магнезий (таблица 1).
Таблица 1 - Химичен състав на алуминий с висока чистота и първичен алуминий съгласно DIN 1712, лист 1
|
Допустими примеси*, % |
||||||||
|
включително |
||||||||
* Доколкото е възможно да се определи конвенционални методиизследвания.
** Чистият алуминий за електротехника (алуминиеви проводници) се доставя под формата на първичен алуминий 99.5, съдържащ не повече от 0,03% (Ti + Cr + V + Mn); обозначен в този случай като E-A1, материален номер 3.0256. В противен случай отговаря на VDE-0202.
Рафиниране чрез органоалуминиеви комплексни съединения и зоново топене
Алуминий с по-висока степен на чистота A1 99,99 R може да бъде получен чрез рафиниране на електролиза на чист или търговски чист алуминий, като се използват сложни алуминиеви органични съединения като електролит. Електролизата протича при температура от около 1000°C между твърди алуминиеви електроди и е подобна по принцип на рафиниращата електролиза на медта. Естеството на електролита диктува необходимостта от работа без въздух и при ниска плътност на тока.
Този вид рафинираща електролиза, използвана първоначално само в лабораторен мащаб, вече се извършва в малък индустриален мащаб - произвеждат се няколко тона метал годишно. Номиналната степен на пречистване на получения метал е 99,999 -99,9999%. Потенциални области на приложение на метал с тази чистота са криогенната електротехника и електроника.
Възможно е да се използва разглежданият метод на рафиниране при галваничното покритие.
Дори повече висока чистота- номинално до A1 99,99999 - може да се получи чрез последващо зоново топене на метала. При преработката на алуминий с висока чистота в полуфабрикат, лист или тел е необходимо, предвид ниската температура на прекристализация на метала, да се вземат специални предпазни мерки. Забележително свойство на рафинирания метал е неговата висока електропроводимост в областта на криогенните температури.
Алуминият се получава чрез електролиза на алуминиев триоксид, разтворен в разтопен електролит, чийто основен компонент е криолитът.. В чистия криолит Na 3 AlF 6 (3NaF AlF 3) съотношението NaF: AlF 3 е 3, за да се пести електроенергия, е необходимо това съотношение да е в диапазона 2,6-2,8 по време на електролиза, следователно, алуминиевият флуорид AlF 3 е добавен към криолита.
Освен това към електролита се добавят малко CaF 2 , MgF 2 и понякога NaCl, за да се понижи точката на топене. Съдържанието на основните компоненти в промишления електролит е в следните граници, %: Na 3 AlF 6 75-90; AlF 3 5-12; MgF 2 2-5; CaF 2 2-4; Al 2 O 3 2-10. С увеличаване на съдържанието на Al 2 Около 3 повече от 10%, инфузионността на електролита рязко се увеличава, при съдържание по-малко от 1,3% се нарушава нормалният режим на електролиза.
Електролизната баня или клетка, където се извършва електролиза с цел получаване на алуминий, има правоъгълна форма в план. Диаграмата на напречното сечение на ваната е показана на фиг. 1. Корпус 1 от стоманена ламарина покрива стените на ваната, а за големи вани се изработва с дъно. Вътре има слой от шамот 2 и след това стените са облицовани с въглищни плочи 4, а дъното е оформено от въглищни блокове на огнището 3. Ваната с дълбочина 0,5-0,6 m е пълна с електролит и слой течен алуминий под нея.
Въглеродният анод 6 (понякога има няколко от тях) е окачен върху стоманени пръти 8, така че долният му край е потопен в електролита, токът се подава към анода през прътите 8 от гуми 7.
Мощността на електролизера (вана), определена от силата на тока, подаван към него, варира от 30 kA за бани с ниска мощност до 250 kA за вани голяма мощ. Тъй като допустимата специфична плътност на тока, преминаващ през анода, е 0,65-1,0 A/cm 2, с увеличаване на мощността на ваните, анодната площ се увеличава; размерите на напречното сечение на анода на мощни вани достигат 2,8x9 m, размерите на банята (вътре) - 3,8x10 m.
Съществуващите вани се различават по мощност и дизайн на анода: вани с един самоизпичащ се анод и горно захранване на ток, със същия анод и странично токозахранване и вани с анод от печени блокове. На фиг. 2, а. Анодът с правоъгълно сечение непрекъснато нараства.
Корпусът му е от стоманена ламарина, отгоре в корпуса се зареждат брикети от въглеродна електродна маса (нефтен кокс с катран). В горната част масата се топи, а в долната част на корпуса, където са високи температури, се синтерува, коксува и се превръща в твърд блок. В нея се изпичат стоманени щифтове 7, потопени в електродната маса на различна дълбочина, разположени на два до четири реда по протежение на ваната.
Тези пръти служат за подаване на ток към анода и за задържането му над ваната; корпусът на анода е прикрепен отделно над ваната. По време на горенето на анода най-дълбоко разположените щифтове се изваждат последователно от втвърдената маса и се фиксират към повече високо ниво, след известно време се синтероват с втвърдяваща се маса.
Тъй като долната част на анода изгаря, тя се спуска с помощта на специален механизъм, докато анодът се плъзга надолу вътре в корпуса. Към долната част на корпуса на анода е прикрепен звънец за събиране на газ, предназначен да улавя газовете, отделяни около анода.
Ваните за електролиза с предварително изпечени аноди (фиг. 2, б) имат аноден възел, съставен от няколко (до 20 или повече) въглеродни или графитни блока, подредени в два реда. Всеки блок има четири стоманени нипели 9, свързани към пръта 11; това устройство служи за подаване на ток и за спиране на блока. Изгорелите блокове се заменят с нови. Над ваната има кутия за събиране на газ.
Използването на изпечени аноди направи възможно увеличаването на единичния капацитет на ваните и значително намаляване на отделянето на вредни канцерогенни вещества, които се образуват по време на коксуването на самоизпичаща се електродна смола.
Електролизните вани се поставят в цеха в един ред с няколко десетки бани подред.. Електролизата се извършва при напрежение 4-4,3 V и, както е отбелязано, при специфична плътност на тока, преминаващ през анода, равна на 0,65-1,0 A/cm 2 . Дебелината на електролитния слой във ваната е 150-250 мм. Температурата на ваната се поддържа в диапазона от 950-970 ° C поради топлината, отделяна при преминаването на постоянен шок през електролита. Такива температури се появяват под анода и на границата с въздуха се образува кора от втвърден електролит, а близо до стените на ваната се образува втвърден слой от електролит 10 (череп).
Необходима температура на банята, т.е. утаяване в електролитния слой необходимата суматоплината се осигурява при определено електрическо съпротивление на електролитния слой. Такова електрическо съпротивление се постига чрез поддържане на състава на електролита и дебелината на неговия проводящ слой в определените граници, т.е. разстоянието между анода и слоя течен алуминий в рамките на 40-60 mm (увеличаването, например, на това разстояние, т.е. електрическото съпротивление на електролитния слой, причинява увеличаване на генерирането на топлина по време на преминаване на ток и, съответно прегряване на електролита).
Когато се приложи напрежение към катода и анода, компонентите на течния електролит претърпяват електролитна дисоциация, а стопилката се състои от множество катиони и аниони. Съставът на електролита е избран така, че в съответствие със стойностите на разрядните потенциали на електродите, само Al 3+ катиони и O 2- аниони, които се образуват по време на дисоциацията на Al 2 O 3 в електролита , може да се изписва. Съответно, електрохимичният процес върху електродите се описва със следните уравнения:
- на катода 2Al 3+ + 6e -> 2Al
- при анода 3O 2- - 6e -> 3O
Алуминият, изпуснат на катода, се натрупва на дъното на ваната под електролитния слой. Освободеният от анода кислород взаимодейства с въглерода на анода, за да образува CO и CO 2 газове, т.е. в този случай дъното на анода се окислява и следователно анодът периодично се спуска. Газовете CO и CO 2 излизат изпод анодите по страничните им повърхности, те съдържат токсични флуорни съединения, отделяни от електролита и алуминиевия прах (вредните смолисти пари попадат в тях и от самоизпичащите се аноди); тези газове се улавят и почистват от прах и флуорни съединения.
По време на процеса във ваната периодично зареждайте алуминиев оксид; контролирайте състава на електролита чрез въвеждане на коригиращи добавки; с помощта на регулатори поддържайте оптималното разстояние между анодите и течния алуминий (в рамките на 40-50 мм). Алуминият се зарежда във ваните отгоре, като за целта се пробива кората на синтерован електролит с помощта на машини, движещи се покрай ваните.
Течният алуминий се отстранява от ваните веднъж дневно или след 2-3 дни с помощта на вакуумни кофи. Вакуумната кофа е (фиг. 3) съдържаща 1,5-5 тона алуминий
съд, облицован с шамот, в който се създава вакуум от ~ 70 kPa. Всмукателната тръба, свързана към гнездото 6 на черпака, се потапя отгоре в слой течен алуминий във ваната и поради разреждане алуминият се засмуква в черпака.
Освободените анодни газове се насочват първо към горелките, където се изгарят сублимите на CO и катран, а след това към газоочистването, където се улавят прах и флуорни съединения.
Производителността на съвременните електролизни вани е 500-1200 кг алуминий на ден. За получаване на 1 тон алуминий се изразходва:
- ~ 1,95 тона алуминиев триоксид,
- ~ 25 кг криолит,
- 25 кг алуминиев флуорид,
- 0,5-0,6 тона анодна маса,
- 14-16 MWh електроенергия.
Сравнително наскоро (преди малко повече от век) алуминият се смяташе за един от най-скъпите метали. И това се дължи не на малките запаси от суровини, а на сложния процес на производство на този метал. Днес алуминият се превърна в един от най-евтините метали, благодарение както на големите запаси от суровини, така и на подобреното производство. Той заема водеща позиция в производството на цветни метали и се използва широко в много индустрии, както в чист вид, така и под формата на сплави. Как се получава алуминият днес? Нека го разберем.
От какво се прави алуминият?
В зависимост от суровините, използвани за получаване на този метал, алуминият се разделя на първичен и вторичен.
За производството на първичен алуминий се използват минерални руди, които съдържат алуминиев оксид: боксити, нефелини, алунити.
Бокситът е най-обогатената руда на алуминиев оксид – съдържа повече от 50% алуминиев оксид. До 30% оксид съдържа нефелини. А най-малкото им съдържание (до 20%) е в алунити.
Вторичен алуминий също алуминиеви сплавиполучени чрез преработка на алуминиеви отпадъци и скрап. За производството му се претопяват алуминиеви стърготини, фолио и тел, остатъци от метални листове и тръби.
Как се произвежда първичният алуминий?
Първичният алуминий се получава по метод, наречен "електролиза на алуминиева стопилка в криолит". Производството на алуминий е многоетапно технологичен процес, което включва получаване на междинни суровини: алуминиев триоксид - криолит и флуоридни соли - въглищни продукти - електролитен алуминий.
Основните звена на тази технологична верига са алуминиевият и електролитен алуминий. Основното производствено устройство е електролизер или алуминиева вана. Плътността на алуминия е по-висока от плътността на криолита. Следователно, в процеса на електролиза, той се отделя от стопилката криолит-алуминиев триоксид. Отделен, металът се утаява на дъното на ваната, откъдето се събира с вакуумни черпаци. След това събраният метал се почиства чрез хлориране и от него се отливат блокове.
Как се прави алуминият от скрап?
Вторичният алуминий се произвежда чрез топене. За да направите това, отпадъците се събират и сортират, след което се почистват чрез студена обработка. По време на процеса на рециклиране всички примеси (метали и неметали) се отстраняват от отпадъците, а след това скрапът се топи в горивни или електрически топилни пещи. Готовият продукт се излива в специални леярски блокове.
Тъй като производството на този метал изисква много енергия, в близост до водноелектрически централи се изграждат алуминиеви топилни предприятия, които осигуряват най-евтината електроенергия. По същата причина предприятията за производство на алуминий се намират в близост до находищата на алуминиеви руди.
Още повече информация по тази и други подобни теми ще намерите в статиите на нашия раздел.
Получаване на алуминий чрез електролиза.
Електролизата на алуминиев триоксид се извършва в течен криолит в електролитна клетка (фиг. 1).
Фиг. 1. Схема на електролитна клетка за производство на алуминий
Електролизаторът има катодни и анодни устройства. Катодно устройство - 1 представлява вана в стоманен корпус, облицована на дълбочина 400-600 мм отвътре с въглищни блокове. Медните пръти са свързани към въглищното дъно на банята с помощта на стоманени щифтове за източване на електрическия ток. По време на работа на електролизера течен алуминий се събира на дъното на ваната, която служи като катод, а електролитът се намира под него. За нормална работа на клетката нивото на метала над огнището трябва да бъде най-малко 25-30 см, а нивото на електролита 17-20 см. Анодното устройство - 2 се състои от вертикално монтиран анод, долната част на който е потопена в електролита. Към анода се подава постоянен електрически ток, който се използва в процеса на електролиза, а също така поддържа температурата на електролита при 950 ... 970 0 C поради джауловата топлина, развивана от тока в електролитния слой между анода и катода . Повечето съвременни електролизатори имат един самоизпичащ се непрекъснат анод. Тялото при анода на определена височина е затворено в кожух под формата на правоъгълник от алуминиев лист. Твърдата част на анода се простира от долната част на корпуса, която се спуска в електролита, а вътре в корпуса анодната маса (въглища и 28-30% смола, която служи като свързващо вещество) е първо в течно състояние , а след това самоизпичане и втвърдяване. Повдигащият механизъм - 3 движи анода при изгаряне, а суровата анодна маса периодично се натоварва отгоре.
Стоманените щифтове, поддържащи анода, променят позицията си, докато се движи надолу. Чрез щифтовете към анода (за различни вани) се подава електрически ток от 45 000 до 155 000 A. Работното напрежение на нормално работеща баня е 4,0-4,5 V.
Електролитът е съставен от криолит-алуминиева стопилка, която съдържа 8...10% алуминиев триоксид. За подобряване на свойствата на електролита към него се добавят флуорни съединения на Al, Na, Ca и Mg и Na хлорид. Най-ниската точка на топене на електролита е 935 0 C. При 950 0 C плътността на електролита е по-ниска от плътността на алуминия.
Разтопеният електролит (1500-3000 kg) се излива в клетъчната баня върху предварително заредените флуоридни и хлоридни соли. При охлаждане върху повърхността на електролита се образува здрава кора, върху която се зарежда слой от алуминиев триоксид за предварително загряване. За известно време след стартиране се установява нормална работа на електролизера. По време на електролизата, под въздействието на регулирано електрическо поле, катиони Na +, Al 3+, Ca 2+ Mg 2+ се придвижват към катода, но на катода се изхвърлят само алуминиеви катиони, като най-положителните. Анионите Al F 6 3- , F - , Cl - и кислород-съдържащите йони се придвижват към анода. Тъй като кислородсъдържащите йони се разреждат, въглеродът на анода се окислява.
Образуваният по време на електролизата алуминий се събира на дъното на клетъчната баня под електролитния слой, откъдето периодично се взема с помощта на вакуумен черпак, в който се създава вакуум от 200-250 mm Hg. Изкуство. Избор на алуминий от ваната, произведен за 2-4 дни; някои заводи практикуват ежедневен подбор на алуминий.
След това във ваната се зарежда пресен криолит на прах и се добавят солни добавки. Алуминият се зарежда по време на работа след разрушаването на кората на повърхността на електролита. За получаване на 1 кг алуминий се изразходват 16500-18500 kWh. електричество.
Алуминият има много свойства, които го правят един от най-използваните материали в света. Той е широко разпространен в природата, заемайки първо място сред металите. Изглежда, че не трябва да има никакви трудности с неговото производство. Но високата химическа активност на метала води до факта, че той не може да се намери в чиста форма, но е труден, енергоемък и скъп за производство.
Суровини за производство
От каква суровина се произвежда алуминият? Производството на алуминий от всички минерали, които го съдържат, е скъпо и нерентабилно. Добива се от боксити, които съдържат до 50% и лежат директно върху повърхността на земята в значителни маси.
Тези са доста сложни химичен състав. Те съдържат алуминиев оксид в количество от 30-70% от общата маса, силициев диоксид, който може да бъде до 20%, железен оксид в диапазона от 2 до 50%, титан (до 10%).
Алуминиев оксид, а това е алуминиев оксид, се състои от хидроксиди, корунд и каолинит.
Напоследък се получават алуминиеви оксиди от нефелини, които също съдържат оксиди на натрий, калий, силиций и алунити.
За производството на 1 тон чист алуминий са необходими около два тона алуминий, който от своя страна се получава от около 4,5 тона боксит.
Бокситни находища
Запасите на боксит в света са ограничени. На всичко Глобусътсамо седем области с богатите си находища. Това са Гвинея в Африка, Бразилия, Венецуела и Суринам Южна Америка, Ямайка в Карибите, Австралия, Индия, Китай, Гърция и Турция в Средиземно море и Русия.
В страни, където има богати залежи на боксит, може да се развие и производството на алуминий. Русия добива боксити в Урал, в териториите Алтай и Красноярск, в един от районите на Ленинградска област, нефелин - на Колския полуостров.
Най-богатите находища са на руската обединена компания UC RUSAL. Следват гигантите Rio Tinto (Англия-Австралия), който се сля с канадския Alcan и CVRD. На четвърто място е Chalco от Китай, следван от американо-австралийската корпорация Alcoa, които също са големи производители на алуминий.
Произходът на производството
Датският физик Ерстед е първият, който изолира свободния алуминий през 1825 г. Химическата реакция се осъществява с калиева амалгама, вместо която две години по-късно германският химик Вьолер използва метален калий.
Калият е доста скъп материал, следователно при промишленото производство на алуминий французинът Saint-Clair Deville вместо калий през 1854 г. използва натрий, елемент много по-евтин и устойчив двоен хлорид на алуминий и натрий.
Руският учен Н. Н. Бекетов успя да измести алуминия от разтопен криолит с магнезий. В края на осемдесетте години на същия век това химическа реакцияизползван от германците в първия алуминиев завод. През втората половина на 18 век по химични методи са получени около 20 тона чист метал. Беше много скъп алуминий.
Производството на алуминий с помощта на електролиза възниква през 1886 г., когато почти идентични заявки за патент са подадени едновременно от основателите на този метод, американския учен Хол и французина Еру. Те предложиха да се разтваря алуминий в разтопен криолит и след това да се произвежда алуминий чрез електролиза.
Това е началото на алуминиевата индустрия, която се превърна в един от най-големите отрасли на металургията за повече от век история.
Основните етапи на производствената технология
AT в общи линииТехнологията за производство на алуминий не се е променила от създаването си.
Процесът се състои от три етапа. Върху първата от алуминиевите руди, било то боксит или нефелин, се получава алуминиев оксид - алуминиев оксид Al 2 O 3.
След това от оксида се изолира индустриален алуминийсъс степен на пречистване 99,5%, което не е достатъчно за някои цели. 
Следователно алуминият се рафинира на последния етап. Производството на алуминий приключва с пречистването му до 99,99%.
Получаване на алуминиев оксид
Има три начина за получаване на алуминиев оксид от руди:
киселина;
Електролитен;
Алкална.
Последният метод е най-разпространеният, разработен още през същия 18-ти век, но оттогава многократно е модифициран и значително подобрен и се използва за обработка на висок клас боксит. Така се получава около 85% от алуминиев оксид.
Същността на алкалния метод се състои във факта, че алуминиевите разтвори се разлагат с висока скорост, когато в тях се въведе алуминиев хидроксид. Разтворът, останал след реакцията, се изпарява при висока температура от около 170°С и отново се използва за разтваряне на алуминиев триоксид;
Първо, бокситът се раздробява и смила в мелници с каустична основа и вар, след това в автоклави при температури до 250 ° C, той се разлага химически и се образува натриев алуминат, който се разрежда с алкален разтвор вече при по-ниска температура - само 100 ° C. Алуминатният разтвор се измива в специални сгъстители, отделени от утайката. След това има неговото разлагане. Разтворът се изпомпва през филтрите в съдове с бъркалки за постоянно смесване на състава, в които се добавя твърд алуминиев хидроксид за засяване.
В хидроциклоните и вакуумните филтри се отделя алуминиев хидроксид, част от който се връща като зародишен материал, а част отива за калциниране. Филтратът, останал след отделяне на хидроксида, също се връща в циркулация за излугване на следващата партида боксити. 
Процесът на калциниране (дехидратация) на хидроксида във въртящи се пещи протича при температури до 1300°C.
За получаване на два тона алуминиев оксид се изразходват 8,4 kWh електроенергия.
Силно химическо съединение, чиято точка на топене е 2050 ° C, все още не е алуминий. Предстои производство на алуминий.
Електролиза с алуминиев оксид
Основното оборудване за електролиза е специална вана, облицована с въглеродни блокове. Към него се подава електричество. Въглеродните аноди се потапят във ваната, които изгарят, когато чистият кислород се освободи от оксида и образуват въглероден оксид и въглероден диоксид. Ваните или електролизерите, както ги наричат специалистите, са свързани последователно към електрическата верига, образувайки серия. Силата на тока в този случай е 150 хиляди ампера.
Анодите могат да бъдат два вида: изстреляни от големи въглищни блокове, чиято маса може да бъде повече от един тон, и самоизпичащи се, състоящи се от въглищни брикети в алуминиева обвивка, които се синтероват по време на електролиза при високи температури. 
Работното напрежение във ваната обикновено е около 5 волта. Той взема предвид както напрежението, необходимо за разлагане на оксида, така и неизбежните загуби в обширна мрежа.
От алуминиевия оксид, разтворен в стопилката на базата на криолит, която е по-тежка от електролитните соли, той се утаява върху въглищната основа на банята. Периодично се изпомпва. 
Процесът на производство на алуминий изисква много електроенергия. За да получите един тон алуминий от алуминий, трябва да изразходвате около 13,5 хиляди kWh DC електричество. Ето защо друго условие за създаване на големи производствени центрове е близката мощна електроцентрала.
Рафиниране на алуминий
Най-известният метод е трислойната електролиза. Провежда се и в електролизни вани с въглищни дъна, облицовани с магнезит. Анодът в процеса е самият разтопен метал, който се подлага на пречистване. Намира се в долния слой върху проводящо огнище. Чистият алуминий, който се разтваря от електролита в анодния слой, се поема и служи като катод. Токът се подава към него с помощта на графитен електрод.
Електролитът в междинния слой е алуминиеви флуориди, чисти или с добавка на натриев и бариев хлорид. Загрява се до температура от 800°C.
При трислойно рафиниране е 20 kWh на kg метал, тоест са необходими 20 хиляди kWh на тон. Ето защо, както никое друго метално производство, алуминият изисква не просто източник на електричество, а голяма електроцентрала в непосредствена близост.
Рафинираният алуминий съдържа много малки количества желязо, силиций, мед, цинк, титан и магнезий.
След рафиниране алуминият се преработва в продаваеми продукти. Това са блокове, и тел, и листове, и слитъци. 
Получените в резултат на рафинирането продукти на сегрегация, отчасти под формата на твърда утайка, се използват за деоксидация, а отчасти остават под формата на алкален разтвор.
Абсолютно чист алуминий се получава чрез последващо зоново топене на метала в инертен газ или вакуум. Неговата забележителна характеристика е високата електрическа проводимост при криогенни температури.
Рециклиране
Една четвърт от общото търсене на алуминий се покрива от рециклирането на суровини. Оформените отливки се изливат от рециклирани продукти.
Предварително сортираните суровини се претопяват в прагова пещ. Съдържа метали, които имат по-висока точка на топене от алуминия, като никел и желязо. Различни неметални включвания се отстраняват от разтопения алуминий чрез продухване с хлор или азот.
Повече топими метални примеси се отстраняват чрез добавяне на магнезий, цинк или живак и вакуумиране. Магнезият се отстранява от стопилката с хлор.
Дадена леярска сплав се получава чрез въвеждане на добавки, които се определят от състава на разтопения алуминий.
Центрове за производство на алуминий
По потребление на алуминий Китай се нарежда на първо място, оставяйки далеч зад второто САЩ и третата Германия.
Китай също е страна с производство на алуминий, водеща в тази област с огромен марж.
В челната десетка, освен Китай, влизат Русия, Канада, ОАЕ, Индия, САЩ, Австралия, Норвегия, Бразилия и Бахрейн.
В Русия монополът в производството на алуминий и алуминий е комбинираният. Той произвежда до 4 милиона тона алуминий годишно и изнася продукти в седемдесет страни и присъства на пет континента в седемнадесет страни.
Американската компания Alcoa притежава два металургични завода в Русия.
Най-големият производител на алуминий в Китай е Chalco. За разлика от чуждестранните конкуренти, всичките му активи са съсредоточени в родната страна.

Подразделението Hydro Aluminium на норвежката компания Norsk Hydro притежава алуминиеви топилни предприятия в Норвегия, Германия, Словакия, Канада и Австралия.
Австралийската BHP Billiton притежава производство на алуминий в Австралия, Южна Африкаи Южна Америка.
Alba (Aluminium Bahrain B. S. C.) се намира в Бахрейн - може би най-голямото производство. Алуминият на този производител представлява повече от 2% от общия обем "крилати" метал, произведен в света.
Така че, обобщавайки, можем да кажем, че основните производители на алуминий са международни компании, които притежават запаси от боксит. А самият изключително енергоемък процес се състои в получаване на алуминиев оксид от алуминиеви руди, производство на флуоридни соли, които включват криолит, въглеродна анодна маса и въглероден анод, катод, материали за облицовка и действителното електролитно производство на чист метал, който е Основен компонент на алуминиевата металургия.


