DEFINICJA
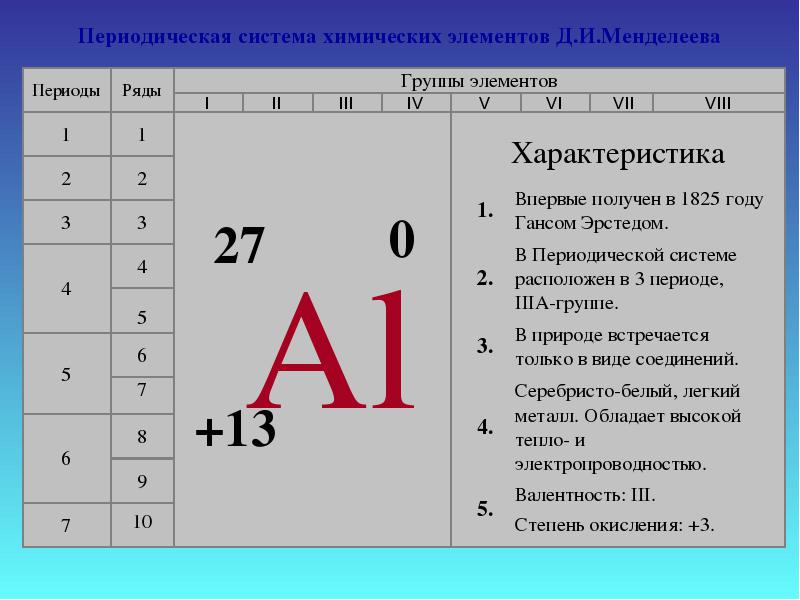
Aluminium znajduje się w trzecim okresie, grupie III głównej (A) podgrupy układu okresowego. Jest to pierwszy element p trzeciego okresu.
Metal. Oznaczenie - Al. Numer seryjny - 13. Względny masa atomowa- 26 981 amu
Struktura elektronowa atomu glinu
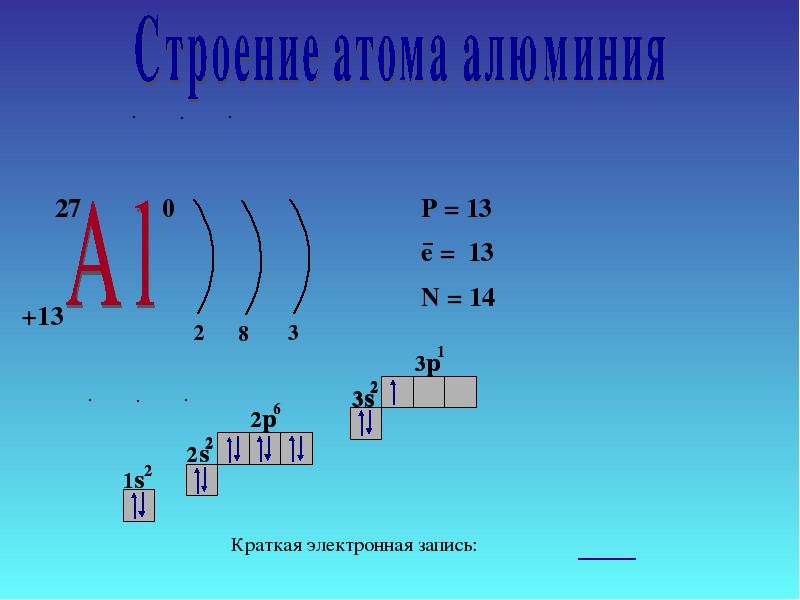
Atom glinu składa się z dodatnio naładowanego jądra (+13), wewnątrz którego znajduje się 13 protonów i 14 neutronów. Jądro otoczone jest trzema powłokami, przez które porusza się 13 elektronów.
Ryż. 1. Grafika ze schematem budowa atomu glinu.
Rozkład elektronów pomiędzy orbitalami jest następujący:
13Al) 2) 8) 3;
1S 2 2S 2 2P 6 3S 2 3P 1 .
Zewnętrzny poziom energii aluminium zawiera trzy elektrony, wszystkie elektrony trzeciego podpoziomu. Wykres energetyczny przyjmuje następującą postać:

Stan wzbudzony jest teoretycznie możliwy dla atomu glinu ze względu na obecność wolnego miejsca 3 D-orbitale. Jednak parowanie elektronów 3 S-podpoziom w rzeczywistości nie występuje.
Przykłady rozwiązywania problemów
PRZYKŁAD 1
Cele Lekcji:
Scharakteryzuj aluminium ze względu na jego położenie w układzie okresowym pierwiastków chemicznych.
Opierając się na budowie atomu, rozważ jego właściwości fizyczne i chemiczne.
Zapoznaj się z przemysłową metodą wytwarzania aluminium i wskaż obszary jej zastosowania.

Z historii odkrycia aluminium... „Srebro z gliny”
W momencie odkrycia aluminium metal ten był droższy od złota. Brytyjczycy chcieli uhonorować wielkiego rosyjskiego chemika bogatym prezentem
D.I. Mendelejew podarował mu wagę chemiczną, w której jedna filiżanka była wykonana ze złota, druga z aluminium. Kubek aluminiowy stał się droższy od złotego. Powstałe „srebro z gliny” zainteresowało nie tylko naukowców, ale także przemysłowców, a nawet cesarza Francji.


Zastosowanie aluminium






Przemysł militarny

Budowa

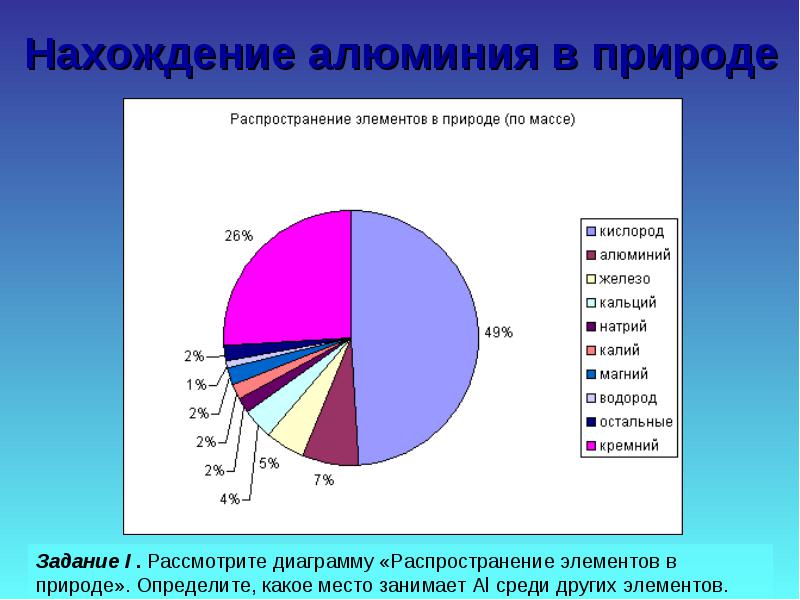
Znalezienie aluminium w przyrodzie
Naturalne związki aluminium
Zadanie II. Rozważ próbki związków naturalnych, porównaj je pod względem twardości, wytrzymałości, koloru, oblicz zawartość Al w niektórych z nich.
Nefeliny- KNa34
- Tlenek glinu (mieszaniny kaolinów z piaskiem SiO2, wapieniem CaCO3, magnezytem MgCO3)
- Korund (szafir, rubin, szmergiel) - Al2O3
- Skaleń - (K,Na)2O Al2O3 6SiO2, Ca
- Kaolinit - Al2O3 2SiO2 2H2O
- Beryl (szmaragd, akwamaryn) - 3BeO Al2O3 6SiO2

Właściwości fizyczne aluminium. Praca laboratoryjna.
Karta instruktażowa.
2. Określić stan skupienia substancji aluminiowej.
3. Jakiego koloru jest talerz?
4. Ustal, czy ta płyta ma połysk?
5. Zanurz płytkę do ¼ jej długości w szklance gorącej wody na 10-15 sekund.
Wyjmij płytkę z wody, wytrzyj ją serwetką i sprawdź, czy aluminium ma przewodność cieplną?
6. Weź w dłonie folię aluminiową. Ustalić, czy aluminium ma plastyczność? Czy to metal lekki?
7. Umieść aluminiową płytkę w szklance zimnej wody i obróć ją kilka razy. Czy aluminium się rozpuszcza?
8. Krótko zapisz swoje obserwacje zgodnie z planem:
- stan skupienia,
- kolor,
- świecić,
- przewodność cieplna,
- plastyczność,
- rozpuszczalność w wodzie.


Praca laboratoryjna: „Właściwości chemiczne aluminium”.
Karta instruktażowa.
1. Weź dwie probówki. Włóż do każdego kawałek aluminium. Do jednego z nich wlać 1-2 ml roztworu kwasu solnego i taką samą ilość roztworu kwasu siarkowego do drugiego. Co obserwujesz? Lekko ogrzej probówki. Zapisz równania odpowiednich reakcji.
2. Umieść kawałek aluminium w probówce. Dodać 1,5 ml stężonego kwasu siarkowego. Co obserwujesz? Zapisz równanie reakcji.
3. Umieść kawałek aluminium w probówce i dodaj roztwór alkaliczny. Podgrzej zawartość probówki. Co się dzieje? Zapisz równanie reakcji.
4. Przedstaw wyniki wykonanej pracy w tabeli:


Produkcja aluminium w przemyśle

Test
1. Jaka jest konfiguracja elektronowa atomu glinu?
A) 1s22s22p1 B) 1s22s22p3
B) 1s22s22p63s23p1 D) 1s22s22p63s23p63d14s2
2. Z którą z poniższych substancji reaguje aluminium?
A) CaO B) HCl
B) Cl2 D) NaOH
3. Które z tych metali są bardziej aktywne?
niż aluminium?
A) Na B) Cu
B) Ca D) Fe
4. Najbardziej charakterystyczny stopień utlenienia aluminium:
A) +1 B) +2
C) +3 D) +4
5. Aluminium wykazuje w reakcjach chemicznych następujące właściwości:
A) utleniacz B) związek obojętny
C) środek redukujący D) środek utleniający i redukujący
6. W przemyśle aluminium produkowane jest:
A) stosując sód metaliczny jako środek redukujący
B) elektroliza stopionego tlenku glinu
C) przy użyciu tlenku węgla (P) jako środka redukującego
D) elektroliza roztworu soli glinu

Data___________ Klasa______________
Temat: Aluminium. Pozycja glinu w układzie okresowym i budowa jego atomu. Będąc w naturze. Właściwości fizyczne i chemiczne aluminium.Cele Lekcji:
rozważyć rozmieszczenie aluminium w przyrodzie, jego właściwości fizyczne i chemiczne, a także właściwości związków, które tworzy.
Postęp
1. Organizowanie czasu lekcja. 2. Studiowanie nowego materiału. AluminiumGłówna podgrupa III grupy układ okresowy składa się z boru (B), aluminium (A l), gal (Ga), ind (In) i tal (T l). Jak widać z powyższych danych, wszystkie te pierwiastki odkryto w XIX wiek. Odkrycie metali głównej podgrupy III grupy| 1806 | 1825 | 1875 | 1863 | 1861 |
| G. Lussaca, | GH Ørsted | L. de Boisbaudran | F. Reicha, | W. Crooks |
| L. Tenarda | (Dania) | (Francja) | I.Richter | (Anglia) |
| (Francja) | (Niemcy) |
| Stan podniecenia 1 s 2 2 s 2 2 s 6 3 s 1 3 s 2 |
| Glin 2 O 3 | Korund |
| Rubin |
|
| Szafir |
I . Interakcja z substancjami prostymi Już w temperaturze pokojowej aluminium aktywnie reaguje ze wszystkimi halogenami, tworząc halogenki. Po podgrzaniu reaguje z siarką (200°C), azotem (800°C), fosforem (500°C) i węglem (2000°C), z jodem w obecności katalizatora – wody: 2A l + 3 S = ZA l 2 S 3 (siarczek glinu), 2A l + N 2 = 2A lN (azotek glinu), ZA l + P = ZA l P (fosforek glinu), 4A l + 3C = ZA l 4 do 3 (węglik aluminium). 2 Al + 3 Ja 2 = 2 A Li 3 (jodek glinu)Wszystkie te związki ulegają całkowitej hydrolizie, tworząc wodorotlenek glinu i odpowiednio siarkowodór, amoniak, fosfinę i metan: Glin 2 S 3 + 6H 2 O = 2Al(OH) 3 + 3H 2 SGlin 4 C 3 +12H 2 O = 4Al(OH) 3 +3CH 4 W postaci wiórów lub proszku pali się jasno w powietrzu, uwalniając się duża liczba ciepło: 4A l + 3 O 2 = 2A l 2 O 3 + 1676 kJ.
II. Interakcja z substancjami złożonymi Interakcja z wodą : 2 Al + 6 H 2 O = 2 Al (OH) 3 + 3 H 2 bez warstwy tlenkowej Interakcja z tlenkami metali: Aluminium jest dobrym środkiem redukującym, ponieważ jest jednym z metali aktywnych. Plasuje się w szeregu aktywności bezpośrednio po metalach ziem alkalicznych. Dlategoodtwarza metale z ich tlenków . Ta reakcja, aluminotermia, jest wykorzystywana do produkcji czystych metali rzadkich, takich jak wolfram, wanad itp. 3 Fe 3 O 4 + 8 Al = 4 Al 2 O 3 + 9 Fe + Q Mieszanka termitów Fe 3 O 4 i Al (proszek) – stosowany także przy spawaniu termitem. do r 2 O 3 + 2A l = 2C r + ZA l 2 O 3 Interakcja z kwasami : Z roztworem kwasu siarkowego: 2 Al + 3 H 2 SO 4 = Al 2 (SO 4 ) 3 + 3 H 2 Nie reaguje z zimnymi stężonymi siarkami i azotem (pasywaty). Dlatego kwas azotowy transportowany jest w zbiornikach aluminiowych. Po podgrzaniu aluminium jest w stanie zredukować te kwasy bez uwalniania wodoru: 2A l + 6H 2 SO 4 (stęż.) = A l 2 (SO 4 ) 3 + 3 SO 2 + 6H 2 O, A l + 6H NO 3 (stęż.) = ZA l (NO 3 ) 3 + 3 NO 2 + 3H2O. Interakcja z alkaliami . 2 Al + 2 NaOH + 6 H 2 O = 2 Na Al(OH) 4 + 3 H 2 Nie[A l(ON) 4 ] – tetrahydroksyglinian sodu Za namową chemika Gorbowa podczas wojny rosyjsko-japońskiej reakcję tę wykorzystano do produkcji wodoru do balonów. Z roztworami soli: 2 Al + 3 CuSO 4 = Al 2 (SO 4 ) 3 + 3 Cu Jeśli powierzchnię aluminium pociera się solą rtęciową, zachodzi następująca reakcja: 2 Glin + 3 HgCl 2 = 2 AlCl 3 + 3 HgUwolniona rtęć rozpuszcza aluminium, tworząc amalgamat. 5. Zastosowanie aluminium i jego związków
Właściwości fizyczne i chemiczne aluminium doprowadziły do jego szerokiego zastosowania w technologii.Przemysł lotniczy jest głównym konsumentem aluminium : 2/3 samolotu składa się z aluminium i jego stopów. Samolot stalowy byłby zbyt ciężki i mógł przewozić znacznie mniej pasażerów.Dlatego aluminium nazywane jest metalem skrzydlatym. Kable i przewody wykonane są z aluminium : przy tej samej przewodności elektrycznej ich masa jest 2 razy mniejsza niż odpowiednie produkty miedziane.Biorąc pod uwagę odporność aluminium na korozję, takprodukcja części maszyn i zbiorników na kwas azotowy . Proszek aluminiowy jest podstawą do produkcji srebrnej farby zabezpieczającej wyroby żelazne przed korozją, a odbijającej promienie cieplne farbą tą używa się do pokrywania zbiorników magazynujących ropę i kombinezonów strażackich.Tlenek glinu służy do produkcji aluminium, a także jako materiał ogniotrwały.Wodorotlenek glinu jest głównym składnikiem znanych leków Maalox i Almagel, które zmniejszają kwasowość soku żołądkowego. Sole glinu są silnie hydrolizowane. Właściwość tę wykorzystuje się w procesie oczyszczania wody. Do oczyszczanej wody dodaje się siarczan glinu i niewielką ilość wapna gaszonego w celu zneutralizowania powstałego kwasu. W rezultacie uwalnia się obszerny osad wodorotlenku glinu, który osiadając, niesie ze sobą zawieszone cząstki zmętnienia i bakterie.Zatem siarczan glinu jest koagulantem.6. Produkcja aluminium 1) Nowoczesną, ekonomiczną metodę produkcji aluminium wynaleźli Amerykanin Hall i Francuz Héroux w 1886 roku. Polega na elektrolizie roztworu tlenku glinu w stopionym kriolicie. Stopiony kriolit Na 3 AlF 6 rozpuszcza Al 2 O 3, Jak woda rozpuszcza cukier. Elektroliza „roztworu” tlenku glinu w stopionym kriolicie zachodzi tak, jakby kriolit był tylko rozpuszczalnikiem, a tlenek glinu elektrolitem. 2Al 2 O 3 prąd elektryczny → 4Al + 3O 2 W angielskiej „Encyklopedii dla chłopców i dziewcząt” artykuł na temat aluminium zaczyna się następującymi słowami: „23 lutego 1886 roku rozpoczęła się nowa era metalu w historii cywilizacji – era aluminium. Tego dnia Charles Hall, 22-letni chemik, wszedł do laboratorium swojego pierwszego nauczyciela z tuzinem małych kulek srebrzystobiałego aluminium w dłoni i wiadomością, że znalazł sposób na tanie i w dużych ilościach." W ten sposób Hall stał się założycielem Amerykanina przemysł aluminiowy i anglosaski bohater narodowy jako osobę, która zrobiła na nauce świetny biznes. 2) 2Al 2 O 3 + 3 C = 4 Al + 3 CO 2 TO JEST INTERESUJĄCE:
- Aluminium metaliczne zostało po raz pierwszy wyizolowane w 1825 roku przez duńskiego fizyka Hansa Christiana Oersteda. Przepuszczając gazowy chlor przez warstwę gorącego tlenku glinu zmieszanego z węglem, Oersted wyodrębnił chlorek glinu bez najmniejszego śladu wilgoci. Aby przywrócić metaliczne aluminium, Oersted musiał poddać działaniu chlorku glinu amalgamatem potasu. 2 lata później niemiecki chemik Friedrich Woeller. Udoskonalił tę metodę, zastępując amalgamat potasowy czystym potasem.
W XVIII i XIX wieku aluminium było głównym metalem do produkcji biżuterii. W 1889 r. D.I. Mendelejew w Londynie otrzymał cenny prezent za zasługi w rozwoju chemii - wagę wykonaną ze złota i aluminium.
W 1855 roku francuski naukowiec Saint-Clair Deville opracował metodę otrzymywania aluminium, metal w skali technicznej. Ale metoda była bardzo kosztowna. Deville cieszył się szczególnym patronatem cesarza Francji Napoleona III. Na znak swego oddania i wdzięczności Deville wykonał dla syna Napoleona, nowonarodzonego księcia, elegancko grawerowaną grzechotkę – pierwszy „produkt konsumencki” wykonany z aluminium. Napoleon zamierzał nawet wyposażyć swoich strażników w aluminiowy kirys, lecz cena okazała się zaporowa. 1 kg aluminium kosztował wówczas 1000 marek, czyli ok. 5 razy droższe od srebra. Dopiero po wynalezieniu procesu elektrolitycznego aluminium zrównało się wartością ze zwykłymi metalami.
Czy wiesz, że aluminium dostając się do organizmu człowieka powoduje zaburzenia? system nerwowy. Gdy jest go w nadmiarze, metabolizm zostaje zaburzony. A środkami ochronnymi są witamina C, związki wapnia i cynku.
Kiedy aluminium spala się w tlenie i fluorze, wydziela się dużo ciepła. Dlatego jest stosowany jako dodatek do paliwa rakietowego. Rakieta Saturn podczas lotu spala 36 ton proszku aluminiowego. Pomysł wykorzystania metali jako składnika paliwa rakietowego jako pierwszy zaproponował F. A. Zander.
Myśleć! Dlaczego tej reakcji nie można przeprowadzić w roztworze wodnym? №2. Uzupełnij równania reakcji chemicznych:
Al + H 2 SO 4 (roztwór) ->
Al + CuCl2 ->
Al + HNO 3 (stęż.) - t ->
Al + NaOH + H 2 O -> Nie. 3. Rozwiąż problem:
Stop aluminium i miedzi poddano podczas ogrzewania działaniu nadmiaru stężonego roztworu wodorotlenku sodu. Wydobyło się 2,24 litra gazu (n.o.). Oblicz skład procentowy stopu, jeśli jego całkowita masa wynosiła 10 g?4. Praca domowa s. 42, np. 1-11. Zadania 1-3 na stronie 131



Właściwości fizyczne Aluminium jest srebrzystobiałym metalem. Topi się w temperaturze 660 o C. Bardzo plastyczny, łatwo ciągliwy w drut i zwijany w folię. Ma bardzo wysoką przewodność elektryczną i cieplną. Tworzy światło i trwałe stopy




Z historii odkrycia W okresie odkrycia aluminium metal był droższy od złota. Brytyjczycy chcieli uhonorować wielkiego rosyjskiego chemika D.I. Mendelejewa bogatym prezentem, podarowali mu wagę chemiczną, w której jedna miseczka była wykonana ze złota, druga z aluminium. Kubek aluminiowy stał się droższy od złotego. Powstałe „srebro z gliny” zainteresowało nie tylko naukowców, ale także przemysłowców, a nawet cesarza Francji.


Sprawdź się 1. Ile elektronów znajduje się w atomie aluminium? a) 1 b) 6 c) 13 d) 3 2. Stopień utlenienia atomu glinu w związku Al 2 O 3 a) -3 b) -2 c) +3 d)+2 3. Do wodorotlenków amfoterycznych zaliczamy: a) Mg (OH) 2 b) Al(OH) 3 c) H 2 Cr 2 O 7 d) Na OH 4. Utlenianie aluminium w środowisku alkalicznym powoduje... a) Al 3+ b) Al 2 O 3 c) - d) Al H 3 5. Tlenek glinu - ... a) ciało stałe biały b) bezbarwny i bezwonny gaz c) czerwone ciało stałe d) niskowrząca ciecz
 Podsumowanie Mając takie właściwości jak lekkość, wytrzymałość, odporność na korozję, odporność na silne chemikalia - aluminium znalazło szerokie zastosowanie w lotnictwie i transporcie kosmicznym oraz w wielu gałęziach przemysłu Gospodarka narodowa. Aluminium i jego stopy zajmują szczególne miejsce w elektrotechnice, a za nimi kryje się przyszłość naszej nauki i technologii.
Podsumowanie Mając takie właściwości jak lekkość, wytrzymałość, odporność na korozję, odporność na silne chemikalia - aluminium znalazło szerokie zastosowanie w lotnictwie i transporcie kosmicznym oraz w wielu gałęziach przemysłu Gospodarka narodowa. Aluminium i jego stopy zajmują szczególne miejsce w elektrotechnice, a za nimi kryje się przyszłość naszej nauki i technologii.

Cele Lekcji:
Edukacyjny - badać właściwości fizyczne i chemiczne aluminium oraz obszary jego zastosowań. Zobacz cechy pierwiastek chemiczny aluminium i badać strukturę atomu.
Rozwojowe – kształcić umiejętności przeprowadzania eksperymentów, przenoszenia treści tekstów naukowych i edukacyjnych na formę diagramów; rozwój umiejętności komunikacyjnych, umiejętności słuchania, umiejętności prawidłowego wyrażania swoich myśli.
Edukacyjny - rozwijać kulturę pracy chemikalia, przestrzeganie przepisów bezpieczeństwa, kultywuj świadomą dyscyplinę, jasność i organizację pracy.
Studenci powinni wiedzieć:
budowa atomu glinu, właściwości fizyczne i chemiczne aluminium jako prosta substancja, Obszary zastosowań.
Studenci powinni potrafić:
charakteryzują aluminium, będące zarówno pierwiastkiem chemicznym, jak i substancją prostą. Zapisz równania reakcji potwierdzające właściwości chemiczne aluminium w postaci molekularnej i redoks.
Typ lekcji:
nauka nowego materiału.
Forma organizacji Działania edukacyjne studenci:
praca grupowa, indywidualna, eksperyment chemiczny.
Metody i techniki nauczania:
eksploracyjne, częściowo badawcze, pokazowy eksperyment chemiczny, praca w grupach, odpowiedzi ustne na tablicy, niezależna praca z tekstami, wzajemna kontrola.
Wyposażenie lekcji:
teksty naukowo-dydaktyczne na temat lekcji, karty zadań dot indywidualne pytania plan przestudiowania materiału dla każdej grupy, PSHE,
Kolekcja „Aluminium i jego związki”, folia aluminiowa, kwas solny i wodorotlenek sodu, aluminium, sprzęt laboratoryjny.
1. Moment organizacyjny.
Nauczyciel wita uczniów.
2. Aktualizacja podstawowej wiedzy, przekazanie tematu, celów i struktury lekcji:
Mowa inauguracyjna nauczyciela
Sam, pracując, zrobisz wszystko
zarówno dla bliskich, jak i dla siebie,
a jeśli w pracy nie będzie powodzenia,
awaria nie jest problemem, spróbuj ponownie.
DI Mendelejew.
Kontynuujemy naukę na dużych i ważny temat„Metale”. Dziś na lekcji zapoznamy się z metalem, który znasz dobrze od dzieciństwa. Ta lekcja Chcę zacząć od legendy.
„Pewnego dnia do rzymskiego cesarza Tyberiusza przybył nieznajomy. W prezencie dla cesarza przyniósł wykonaną przez siebie misę, wykonaną z metalu błyszczącego jak srebro, ale niezwykle lekkiego. Mistrz powiedział, że otrzymał ten metal od „Glinianej Ziemi”. Cesarz jednak, obawiając się, że jego złoto i srebro stracą na wartości, nakazał mistrzowi ściąć głowę i zniszczyć jego warsztat”. O jakim metalu mówimy?
(O aluminium)
Nauczyciel:
Zatem temat naszej lekcji brzmi: „Aluminium jest pierwiastkiem chemicznym i prostą substancją”.
Cele lekcji są sformułowane.
Zaplanuj studiowanie tematu w grupach:
- Właściwości fizyczne aluminium.
- Właściwości chemiczne aluminium.
- Zastosowanie aluminium i jego występowanie w przyrodzie.
Plan pracy grupy:
Przestudiuj tekst i zaznacz informacje istotne dla Twojego pytania;
- wykonać zaproponowane zadania;
- przygotuj przemówienie na swój temat, kierując się zwięzłością, przejrzystością i przejrzystością prezentacji
Praca w grupach w celu przestudiowania materiału.
Przygotuj przemówienie na swój temat.
Grupa 1.
Charakterystyka pierwiastka chemicznego aluminium ze względu na jego pozycję w PSHE.
Ćwiczenia:
- Przeczytaj tekst.
- Scharakteryzuj aluminium ze względu na jego położenie w PSHE zgodnie z planem:
A) numer seryjny.
B) masa atomowa.
B) okres (mały, duży).
D) grupa (podgrupa: główna lub drugorzędna).
D) znak chemiczny.
E) Budowa atomu (ładunek jądrowy, liczba protonów, elektronów, neutronów, wzór elektronowy).
I) tlenki.
J) lotne związki wodoru.
2. Omów uzyskane wyniki w grupie i odpowiedz na pytania:
- Ile elektronów znajduje się na zewnętrznym poziomie atomu glinu?
- Czy aluminium odda czy przyjmie te elektrony?
- Jaki stopień utlenienia osiągnie jon glinu w tym przypadku?
- Wyciągnij wniosek: Do jakiej klasy związków należy aluminium (metal czy niemetal)
- Porównaj aktywność pierwiastka chemicznego aluminium z pierwiastkami z grup 1 i 2 tego samego okresu.
- Przygotuj przemówienie na ten temat na podstawie na zwięzłość, przejrzystość i przejrzystość prezentacji.
Grupa 2.
Właściwości fizyczne aluminium.
Ćwiczenia:
- Przeczytaj tekst.
- Zaznacz materiał odnoszący się do Twojego pytania.
- Rozważ kolekcję „Aluminium i jego stopy”.
- Omów w swojej grupie następujące pytania:
- a) Stan fizyczny, kolor, połysk, gęstość (lekka lub ciężka), topliwość (łatwa lub ogniotrwała), przewodność elektryczna i cieplna, plastyczność.
- b) Uzyskane dane przedstawić w formie diagramu.
5. Przygotuj przemówienie na zadane pytanie w oparciu o na zwięzłość i przejrzystość prezentacji.
Grupa 3.
Właściwości chemiczne aluminium.
Ćwiczenia:
- Przeczytaj tekst.
- Zaznacz materiał odnoszący się do Twojego pytania.
- Zbadać, jak aluminium zachowuje się w stosunku do substancji złożonych?
- Wykonaj laboratorium, korzystając z instrukcji
Ćwiczenia:
A) Wykonaj doświadczenia.
B) Omówcie w grupie zaobserwowane zjawiska.
C) Zapisz równanie reakcji.
D) Wyciągnij wnioski.
5. Przygotuj wystąpienie na ten temat, w oparciu o zwięzłość, przejrzystość i przejrzystość prezentacji.
Grupa 4.
Zastosowanie aluminium.
Ćwiczenia:
- Przeczytaj tekst.
- Zaznacz materiał odnoszący się do Twojego pytania.
- Omówcie w grupie następujące pytania:
a) Jaka jest rola aluminium w życiu człowieka?
b) Zastosowanie aluminium jako substancji prostej.
- Narysuj diagram opisujący zastosowania aluminium.
- Przygotuj przemówienie na ten temat, w oparciu o zwięzłość, przejrzystość i przejrzystość prezentacji
- Raport grupowy dotyczący badanych zagadnień.
Każda grupa po wykonaniu wszystkich zadań przedstawia schematyczną prezentację swojego pytania wraz z dyskusją i komentarzami, uczniowie robią notatki, przenoszą zaproponowane diagramy do zeszytów, a w wyniku wszystkich grup powstaje rysunek krok po kroku podsumowanie referencyjne na temat lekcji.
Wnioski na temat lekcji:
Ile elektronów znajduje się na zewnętrznym poziomie energii atomu aluminium?
- Na jakim stopniu utlenienia znajduje się atom glinu? Dlaczego? A co z jonami?
- Za pomocą jakich eksperymentów udowodniliśmy, że aluminium jest metalem aktywnym?
- Jakie substancje nazywane są amfoterycznymi?
- Na jakich właściwościach opierają się poniższe aplikacje?
- Gdzie w organizmie znajduje się najwięcej aluminium?
- Czy to możliwe długi czas przechowywać żywność w aluminiowych pojemnikach?
- Praca domowa:§ 13 do str. 60, ? 1, 4. Przygotuj prezentację na temat zastosowania aluminium.
- Ostatnie słowo nauczyciele.
Nauczyciel dziękuje uczniom za współpracę i ocenia prelegentów na tablicy.
Odniesienie.
Aluminium.
Główna podgrupa grupy III obejmuje pierwiastki: bor, aluminium, gal, ind, tal. Na zewnętrznej warstwie elektronowej atomy tych pierwiastków zawierają trzy elektrony (…ns2np1). Są to elementy p. W reakcjach atomy tych pierwiastków są środkami redukującymi, z wyjątkiem niemetalicznego boru, który może być środkiem utleniającym. Wszystkie pierwiastki tej podgrupy wykazują najwyższy stopień utlenienia +3. Tworzą się wyższe tlenki E2O3 i wodorotlenki E(OH)3, które wykazują właściwości amfoteryczne. Największym zainteresowaniem w tej podgrupie cieszy się aluminium.
Aluminium w postaci wolnej jest metalem o srebrzystobiałym kolorze, ma połysk, wysoką przewodność cieplną i elektryczną (pod tym względem gorszą od miedzi), jest lekkie (gęstość 2,7 g/cm3), a jednocześnie jest metalem trwałym. Jest to metal miękki, ciągliwy, można go zwinąć w folię lub przeciągnąć na drut. Topi się w temperaturze 6600C. W temperaturze 6000°C aluminium staje się kruche i można je rozkruszyć na ziarna lub proszek.
Aluminium to metal, którego powierzchnia jest zwykle pokryta cienką, trwałą warstwą tlenku. W postaci wiórów i proszku pali się jasno w powietrzu, wydzielając dużą ilość ciepła.
W temperaturze pokojowej aktywnie reaguje z halogenami, po podgrzaniu oddziałuje z siarką (2000C), azotem (8000C) i innymi niemetalami.
Stosunek glinu do substancji złożonych:
Aluminium rozpuszcza się w kwasie solnym o dowolnym stężeniu:
Aluminium rozpuszcza się w roztworach alkalicznych:
Aluminium odgrywa ważną rolę biologiczną w życiu człowieka. Bierze udział w budowie tkanki nabłonkowej i łącznej. Zawartość glinu w organizmie człowieka (na 70 kg masy ciała) wynosi 61 mg. Występuje we wszystkich narządach i tkankach: przede wszystkim w wątrobie, płucach, kościach i mózgu. Głównym źródłem aluminium w organizmie jest żywność - są to wypieki, herbata (od 20 - 200 mg na 100 g produktu), ziemniaki - 4 mg na 100 g. produktu, rzepa żółta – 46 mg na 100 g produktu.
Podczas gotowania i przechowywania żywności w aluminiowych naczyniach zawartość aluminium w żywności podwaja się. Wzrost zawartości glinu we krwi powoduje pobudzenie centralnego układu nerwowego. Przy nadmiarze aluminium w organizmie dochodzi do upośledzenia aktywności ruchowej, drgawek, utraty pamięci, chorób wątroby i nerek. Kiedy zawartość glinu spada, centralny układ nerwowy zostaje zahamowany.
Obszary zastosowań aluminium są bardzo liczne. Ze względu na swoją lekkość i wytrzymałość aluminium i jego stopy wykorzystywane są w produkcji samolotów i rakiet (aluminium nazywane jest metalem skrzydlatym), przy budowie statków i samochodów; w budownictwie - do produkcji stolarki okiennej i drzwi, lekkość i dobre przewodnictwo elektryczne aluminium wykorzystuje się do produkcji przewodów elektrycznych dla linii energetycznych. Przewodność cieplna i nietoksyczność są ważne przy produkcji aluminiowych naczyń kuchennych i folii do przechowywania produkty żywieniowe. Proszek aluminiowy jest podstawą do produkcji srebrnej farby zabezpieczającej wyroby żelazne przed korozją. Zdolność aluminium do spalania się w powietrzu jasnym płomieniem wykorzystywana jest do przygotowania kolorowych fajerwerków i produkcji zimnych ogni.


