Państwo instytucja edukacyjna przeciętny Szkoła ogólnokształcąca № 325
Dzielnica Frunzensky w Petersburgu
STRESZCZENIE O CHEMII
"TLENEK GLINU"
Pracę wykonał uczeń 9 „A”
Erszowa Maria
Doradca naukowy:
Rogova E.V.
Konsultant naukowy:
Golovko N.V.
Petersburg
1. Wstęp……………………………………………………….3
3. Kamienie szlachetne i ich powstawanie……………………….6
Korund..………………………………………………….……..6
Szafiry………………………………………………………..7
Rubiny…………………………………………………….……8
4. Właściwości fizyczne……………………………………....…..9
5. Właściwości chemiczne ……………………..............................10
6. Wniosek…………………….. ………………………..…..12
Produkcja aluminium………………………………………….…..12
Wykorzystanie właściwości fizycznych Al 2 O 3 ………………......15
7. Wniosek……………………………………………….…....17
8. Źródła informacji…………………………..……..18
Wstęp
Biżuteria- symbol specjalnego statusu, zdobią korony królów, jako wizualne przypomnienie bogactwa i dobrobytu tego, kto je nosi, a także tych, którzy je widzą.
Szamani i uzdrowiciele przypisują niektórym drogocennym kamieniom magiczna moc. Legendy o słynnych kamieniach, o szczęściu i kłopotach, które przynieśli swoim właścicielom, urzekają naszą wyobraźnię.
Klejnoty- to jest skarb. Ich unikalne właściwości doceniany przez cały czas i na całym świecie. Cenione są do dziś. Być może uwagę tego, który pierwszy podniósł klejnot, przyciągnął jego jasny kolor lub krystaliczna forma, a może kolor skały, w której był zamknięty.
Różnorodność kolorów korundu urzeka i przyciąga większość ludzi, a zwłaszcza panie.
Czysty korund jest bezbarwny. Jednak korund jest używany nie tylko jako klejnot, ale istnieje wiele innych zastosowań tego minerału. A raczej z czego się składa.
Cel: do analizy właściwości tlenku glinu i jego zastosowania w przemyśle i życiu codziennym.
Zadania :
1. Przeanalizuj literaturę na temat „Tlenek glinu”
2. Zbadanie historycznego aspektu zjawiska materii.
3. Poznaj zastosowanie tlenku glinu.
4. Wyciągnij wnioski na temat.
Pod względem rozpowszechnienia w skorupa Ziemska aluminium zajmuje pierwsze miejsce wśród metali i trzecie wśród wszystkich pierwiastków (po tlenie i krzemie), stanowi około 8,8% masy skorupy ziemskiej. Aluminium jest dwa razy więcej niż żelaza i 350 razy więcej niż miedzi, cynku, chromu, cyny i ołowiu razem wziętych! Glin wchodzi w skład ogromnej liczby minerałów, głównie glinokrzemianów i skał. Związki glinu zawierają granity, bazalty, gliny, skalenie itp. W sumie znanych jest ponad 250 minerałów zawierających glin; większość z nich to glinokrzemiany, z których powstaje głównie skorupa ziemska.
Związki glinu znane są człowiekowi od czasów starożytnych. Jednym z nich były spoiwa, do których należy ałun glinowo-potasowy КAl(SO 4) 2 . Są szeroko stosowane. Używany jako zaprawa i jako korek krwi. Impregnacja drewna roztworem ałunu potasowego sprawiła, że jest ono niepalne. Znane interesujące fakt historyczny. Archelaus, dowódca z Rzymu, w czasie wojny z Persami nakazał posmarować ałunem wieże, które służyły jako budowle obronne. Persom nigdy nie udało się ich spalić.
Podczas wietrzenia glinokrzemianów glina, który jest oparty na minerale kaolinit Al2O3 2SiO2 2H2O. Skład chemiczny glinka zmienia się w szerokim zakresie, a tlenki, z których zbudowane są glinki, w różny sposób wpływają na proces uzyskiwania ostatecznych właściwości ceramiki. Tlenek glinu (tlenek glinu - A1 2 0 3) wraz ze zwiększoną zawartością w glinie prowadzi do wzrostu temperatury wypalania i interwału spiekania. A produkty o niskiej zawartości tlenku glinu mają niską wytrzymałość. Zanieczyszczenia żelazne zwykle zabarwiają glinę na brązowo, ale występuje też biała glinka - kaolin, z którego wykonuje się wyroby porcelanowe i fajansowe.
Glinka, Al 2 O s - biała substancja krystaliczna, nierozpuszczalna w wodzie, t pl \u003d 2050 o C. Występuje w naturze w postaci minerałów - korund(bezbarwny), rubinowy (czerwony), szafirowy (niebieski). O korundze porozmawiamy w następnym rozdziale.
Najważniejszym minerałem aluminium jest boksyt, Al 2 O 3 x H 2 O. Największe złoża boksytu znajdują się w Australii, Brazylii, Gwinei i Jamajce; produkcja przemysłowa prowadzona jest również w innych krajach. Boksyt (fr. boksyt) (od nazwy obszaru Baux na południu Francji) to ruda aluminium, surowiec do produkcji tlenku glinu i materiałów ogniotrwałych zawierających tlenek glinu. Zawartość tlenku glinu w komercyjnych boksytach waha się od 40% do 60% i więcej. Jest również stosowany jako topnik w metalurgii żelaza.
Ale oto paradoks: z ogromną liczbą minerałów i skał zawierających aluminium, złoża boksytu - główny surowiec do produkcja przemysłowa aluminium są dość rzadkie. W Rosji na Syberii i Uralu znajdują się złoża boksytów. Mają także znaczenie przemysłowe. ałunici oraz nefeliny .
(Alunit, kamień ałunowy (fr. ałunit - ałun) - minerał o składzie K 2 SO 4 * Al 2 (SO 4) 3 * 4Al (OH) 3 lub KAl 3 (SO 4) 2 (OH) 6. Kolor biały , szary .
Nefelina (eleolit) jest minerałem skałotwórczym, glinokrzemianem potasu i sodu kwasu ortokrzemowego (Na,K)AlSiO 4).
Edukacja kamienie szlachetne
Rodzina korundów, do której należą rubin i szafir, ma bardzo prostą wzór chemiczny- Al 2 O 3: cząsteczka korundu zawiera dwa atomy glinu i trzy atomy tlenu.
Czysty korund jest substancją bezbarwną, ale idealne kamienie szlachetne rzadko powstają w naturze i zwykle korund jest barwiony. Chrom i wanad to bardzo dodatki, które nadają rubinowi charakterystyczny czerwony kolor; niebieski szafir zawdzięcza swój kolor żelazu i tytanowi, natomiast zielone, żółte i różowe szafiry zawdzięczają swój kolor innym kombinacjom elementów satelitarnych.
 Nazwa „korund” pochodzi od starożytnych nazw tego minerału: od tamilskiego kurundam i kurund w języku hindi.
Nazwa „korund” pochodzi od starożytnych nazw tego minerału: od tamilskiego kurundam i kurund w języku hindi.
Starożytni Grecy wydobywali korund na wyspie Naxos na Morzu Egejskim, a dziś Naxos pozostaje głównym dostawcą szmergla ściernego, używanego w przemyśle w postaci proszku, w życiu codziennym spotykamy go w postaci pilników do paznokci.
Czysty korund jest bezbarwny, dziś używany jest jako kamień ozdobny, w zegarmistrzostwie oraz jako materiał ścierny.
W wielu krajach świata znajdują się złoża korundu.
 W życiu codziennym słowo „szafir” kojarzy się wyłącznie z niebieskimi kamieniami. Tradycyjne kolory szafirów wahają się od jasnoniebieskiego do głębokiego błękitu (indygo). Szafiry w innych kolorach są powszechnie określane jako „fantasy apphires” i obejmują czarny, fioletowy, zielony, szarobrązowy, żółty, pomarańczowy i biały. Szafiry, jako kamienie szlachetne, zostały rozpoznane już w VIII wieku p.n.e. Władcy starożytnej Persji wierzyli, że niebo jest niebieskie, ponieważ odbijały się w nim szafiry. Różne odcienie szafirów są spowodowane domieszką żelaza i tytanu, są też kamienie w paski i nakrapiane. Inkluzje obecne w szafirach odbijają światło, dając efekt zwany „jedwabem”. Najbardziej przezroczysta i bezbarwna odmiana szafiru nazywana jest leukozafirem.
W życiu codziennym słowo „szafir” kojarzy się wyłącznie z niebieskimi kamieniami. Tradycyjne kolory szafirów wahają się od jasnoniebieskiego do głębokiego błękitu (indygo). Szafiry w innych kolorach są powszechnie określane jako „fantasy apphires” i obejmują czarny, fioletowy, zielony, szarobrązowy, żółty, pomarańczowy i biały. Szafiry, jako kamienie szlachetne, zostały rozpoznane już w VIII wieku p.n.e. Władcy starożytnej Persji wierzyli, że niebo jest niebieskie, ponieważ odbijały się w nim szafiry. Różne odcienie szafirów są spowodowane domieszką żelaza i tytanu, są też kamienie w paski i nakrapiane. Inkluzje obecne w szafirach odbijają światło, dając efekt zwany „jedwabem”. Najbardziej przezroczysta i bezbarwna odmiana szafiru nazywana jest leukozafirem.
 Zwykle szafiry występują w postaci kryształów o kształcie piramidalnym lub romboedrycznym tabelarycznym, a także w kształcie beczki. Szafiry charakteryzują się wielokrotnym bliźniaczeniem. Wszystkie szafiry są pleochroiczne: po obróceniu kamienia zmienia się jego kolor.
Zwykle szafiry występują w postaci kryształów o kształcie piramidalnym lub romboedrycznym tabelarycznym, a także w kształcie beczki. Szafiry charakteryzują się wielokrotnym bliźniaczeniem. Wszystkie szafiry są pleochroiczne: po obróceniu kamienia zmienia się jego kolor.
Kamienie w kształcie gwiazdy to takie, w których kilka wtrąceń rutylu, podobnych do cienkich igieł, odbija światło w taki sposób, że pojawia się migocząca sześcioramienna gwiazda. Ten efekt nazywa się asteryzmem.
Najcenniejsze szafiry wydobywane są w Kaszmirze. Te szafiry mają bogaty, aksamitny połysk.
Od 1902 roku zaczęto produkować syntetyczne szafiry otrzymywane ze stopionego tlenku glinu z dodatkiem tytanu.
Szafirowy padparadsza
Padparadscha to niezwykle rzadka odmiana szafiru o delikatnej różowo-pomarańczowej barwie ze względu na obecność niewielkich ilości chromu, żelaza i wanadu. Nazwa pochodzi od syngaleskiego padmaragaya, co oznacza „kwiat lotosu”.
Najdroższy kamień ze wszystkich szafirów. Jest wydobywany na Sri Lance.
 Rubiny to niezwykle rzadkie kamienie szlachetne. Rubiny są znane różne odcienie kolor czerwony - od różowawego do brązowo-czerwonego. Intensywność koloru czerwonego zależy od ilości chromu, który wzmacnia kolor. Brązowawy odcień rubinu wskazuje na obecność w nich żelaza. Nazwa pochodzi od łacińskiego słowa ruber, co oznacza czerwony.
Rubiny to niezwykle rzadkie kamienie szlachetne. Rubiny są znane różne odcienie kolor czerwony - od różowawego do brązowo-czerwonego. Intensywność koloru czerwonego zależy od ilości chromu, który wzmacnia kolor. Brązowawy odcień rubinu wskazuje na obecność w nich żelaza. Nazwa pochodzi od łacińskiego słowa ruber, co oznacza czerwony.
Rubiny są wymienione w Biblii. Na Sri Lance wydobywają od ponad dwóch i pół tysiąca lat, a w Birmie od VI wieku.
Rubiny znajdują się w krystalicznym wapieniu wraz z grafitem miki, pirotynem itp.
Rubin jest twardym kamieniem, ale bliźniacze kryształy dość łatwo pękają.
W 1902 roku francuski chemik Auguste Verneuil opracował metodę wytwarzania syntetycznych rubinów z tlenku glinu i barwnika.
Właściwości fizyczne
Tlenek glinu Al 2 O 3 jest białym proszkiem ogniotrwałym o temperaturze topnienia 2044°C, temperaturze wrzenia 3530°C, gęstości 4 g/cm3, twardości zbliżonej do diamentu. Znanych jest kilka postaci krystalicznych tlenku glinu, do 2044°C krystaliczna odmiana α-Al 2 O 3 - korund jest stabilna.
Jego struktura krystaliczna jest dwuwarstwowym najgęstszym sferycznym upakowaniem jonów tlenu, w oktaedrycznych pustkach, w których znajdują się jony glinu, sieć jest romboedryczna.
Właściwości chemiczne Al 2 O 3
W powietrzu aluminium pokryte jest najcieńszą, ale bardzo gęstą warstwą tlenku, która chroni metal przed dalszym utlenianiem. Pod tym względem jego powierzchnia zwykle nie ma błyszczącego, ale matowego wyglądu.
Warstewka tlenkowa utworzona na powierzchni aluminium w warunkach atmosferycznych ma zwykle grubość mniejszą niż 1 nm, ale jest bardzo silnie związana z metalem. Filmy sztucznie uzyskane dzięki działaniu środków utleniających są znacznie grubsze. Dobrą folię ochronną można uzyskać np. zanurzając aluminium w roztworze zawierającym 20% Na 2 SO 4 i 10% HNO 3 . Za pomocą wybranych wypełniaczy takim filmom można nadać różne kolory.
Wręcz przeciwnie, po kontakcie aluminium z roztworem HgCl2 film ten staje się tak luźny, że nie chroni już metalu przed dalszym utlenianiem. W efekcie szybko zarasta „brodą” wodnego tlenku (Al 2 O 3 ·xH 2 O) i stopniowo całkowicie się utlenia. Powstały wodny tlenek, zarówno sam, jak i po odwodnieniu przez ogrzewanie, ma wysoką aktywność sorpcyjną.
Po podgrzaniu odporność warstwy tlenkowej jest znacznie zmniejszona. Na szczególną uwagę zasługuje możliwość zauważalnej rozpuszczalności aluminium podczas gotowania z rozcieńczonymi roztworami niektórych kwasów organicznych.
Łatwość rozpuszczania aluminium w silnych alkaliach wynika z usunięcia z niego ochronnej warstwy tlenku zgodnie ze schematem:
Al2O3 + 2KOH - + 3 H2O = 2K.
Al 2 O 3 + 2 OH - + 3 H 2 O \u003d 2 Al (OH) 4 -
Ponieważ Al znajduje się znacznie bardziej na lewo od wodoru w szeregu napięć, ekspozycji czystej powierzchni metalu towarzyszą natychmiast reakcje według schematów:
2Al + 6H + (z wody) \u003d 2Al + 3 + 3H 2 i 2Al + 3 + 8 OH - \u003d 2Al (OH) 4 -.
Bilans pierwszego z nich stale przesuwa się w prawo ze względu na drugi. Podobnie przebiega rozpuszczanie w alkaliach innych metali aktywnych, których wodorotlenki są amfoteryczne (Sn, Zn itp.).
Tlenek glinu jest białą, bardzo ogniotrwałą i nierozpuszczalną w wodzie masą. Naturalny Al2O3(minerał korund), a także sztucznie pozyskiwany, a następnie silnie kalcynowany, wyróżnia się dużą twardością i nierozpuszczalnością w kwasach.
Tlenek glinu – tlenek amfoteryczny z przewagą właściwości podstawowych; nie reaguje z wodą.
1. Reaguje z kwasami i roztworami zasad:
a. Jako podstawowy tlenek:
Al 2 O 3 + 6HCl \u003d 2AlCl 3 + 3H 2 O
b. Jako tlenek kwasowy:
Al 2 O 3 + 2NaOH + 3H 2 O \u003d 2Na
2) Stopy z alkaliami lub węglanami metali alkalicznych:
Al 2 O 3 + Na 2 CO 3 = 2NaAlO 2 (glinian sodu) + CO 2
Al 2 O 3 + 2NaOH \u003d 2NaAlO 2 + H 2 O
Al 2 O 3 + 2KOH \u003d 2KAlO 2 (metalumian K) + H 2 O
Łącząc Al 2 O 3 z alkaliami otrzymuje się metaoksogliniany o wysokiej masie cząsteczkowej.
W glinokrzemianach aluminium odgrywa taką samą rolę jak krzem: oba te pierwiastki tworzą mieszany związek - glinokrzemian.
Krystaliczne modyfikacje Al 2 O 3 są chemicznie bardzo stabilne i nie oddziałują z wodą i kwasami. Tlenek glinu (półtoratlenek) można przekształcić w stan rozpuszczalny przez stopienie z alkaliami lub K 2 S 2 O 7 zgodnie z reakcjami:
Al 2 O 3 + 2 NaOH \u003d H 2 O + 2 NaAlO 2
Al 2 O 3 + 3 K 2 S 2 O 7 \u003d Al 2 (SO 4) 3 + 3 K 2 SO 4.
Zastosowanie Al 2 O 3
1. Tlenek glinu - surowiec do produkcji aluminium; produkowane z rud zawierających aluminium, preim. boksyty. Glin otrzymuje się również z nefelinów, kaolinu, ałunitów metodą glinianową lub chlorkową. Surowiec do produkcji aluminium, katalizator, adsorbent, materiał ogniotrwały i ścierny.
Pierwsze próby pozyskania aluminium podjęto dopiero w połowa dziewiętnastego wiek. Próba duńskiego naukowca H.K. Oersteda zakończyła się sukcesem. Aby go uzyskać, użył połączonego potasu jako środka redukującego tlenek glinu. Ale jaki metal został wtedy uzyskany, nie można było się dowiedzieć. Jakiś czas później aluminium otrzymał niemiecki chemik Wöhler, który uzyskał aluminium przez ogrzewanie bezwodnego chlorku glinu metalicznym potasem.
Wieloletnia praca niemieckiego naukowca nie poszła na marne. Przez 20 lat potrafił przygotować metal sypki. Okazał się podobny do srebra, ale był od niego znacznie lżejszy. Aluminium było bardzo drogim metalem, a do początku XX wieku jego wartość była wyższa niż złota. Dlatego od wielu, wielu lat aluminium wykorzystywane jest jako eksponat muzealny.
Około 1807 r. Davy próbował przeprowadzić elektrolizę tlenku glinu, otrzymał metal, który nazwano aluminium (Alumium) lub aluminium (Aluminum), co z łaciny tłumaczy się jako ałun.
Pozyskiwanie aluminium z glin zainteresowało nie tylko chemików, ale także przemysłowców. Bardzo trudno było oddzielić aluminium od innych substancji, przez co było droższe od złota. W 1886 r. chemik Ch.M. Hall zaproponował metodę, która umożliwiła pozyskiwanie metalu w dużych ilościach. Prowadząc badania rozpuścił tlenek glinu w wytopie kriolitowym AlF 3 nNaF. Otrzymaną mieszaninę umieszczono w granitowym naczyniu i przepuszczono przez stałą topnienia Elektryczność. Bardzo się zdziwił, gdy po pewnym czasie na dnie naczynia znalazł blaszki. czyste aluminium. Ta metoda jest nadal główną metodą produkcji aluminium na skalę przemysłową. Powstały metal był dobry na wszystko, z wyjątkiem siły, która była niezbędna dla przemysłu. I ten problem został rozwiązany. Niemiecki chemik Alfred Wilm połączył aluminium z innymi metalami: miedzią, manganem i magnezem. W rezultacie powstał stop, który był znacznie mocniejszy niż aluminium. Na skalę przemysłową taki stop uzyskano w niemieckim mieście Düren. Stało się to w 1911 roku. Stop ten został nazwany duraluminium, po mieście.
W przemyśle aluminium otrzymuje się przez elektrolizę roztworu tlenku glinu Al 2 O 3 w stopionym kriolicie Na 3 AlF 6 . Proces prowadzony jest w temperaturach około 1000 °C w specjalnych piecach elektrycznych. Elektrolizę Al 2 O 3 można przedstawić za pomocą następującego schematu warunkowego. W roztworze tlenek dysocjuje na jony
Al 2 O 3 ↔Al 3+ + AlO 3- 3
Jony Al 3+ są rozładowywane na katodzie: Al 3+ +3e - \u003d Al 0
Proces zachodzi na anodzie: 4AlO 3- 3 - 12e - \u003d 2Al 2 O 3 + 3O 2
Tlen jest uwalniany na anodzie, a płynne aluminium jest uwalniane na katodzie. Ten ostatni jest gromadzony na dnie pieca, skąd jest okresowo uwalniany. Katoda to korpus elektrolizera, na który uwalniane jest płynne aluminium. Tlen jest uwalniany na anodzie grafitowej, która utlenia grafit do tlenków węgla. Gdy anoda się wypala, jest zwiększana. Ponieważ płynne aluminium ma większą gęstość niż stop, gromadzi się na dnie ogniwa elektrolitycznego.
Oczyszczanie aluminium z zanieczyszczeń jest trudne, dlatego konieczne jest, aby same surowce były czyste, aby je uzyskać. Kriolit jest zwykle wytwarzany sztucznie przez wspólne rozpuszczenie Al (OH) 3 i sody w kwasie fluorowodorowym zgodnie z reakcją:
3 Na 2 CO 3 + 2 Al (OH) 3 + 12 HF \u003d 2 Na 3 AlF 6 + 3 CO 2 + 9 H 2 O.
Naturalne boksyty, które zawierają 50-60% Al 2 O 3 oraz szereg zanieczyszczeń (SiO 2 , Fe 2 O 3 , itp.) poddawane są wstępnej obróbce chemicznej w celu wyizolowania z nich wystarczająco czystego półtoratlenku glinu (nie zawierającego więcej niż 0,2% SiO 2 i 0,04% Fe 2 O 3). Metody takiego przetwarzania są silnie uzależnione od składu pierwotnego boksytu i są dość złożone.
Piec do wytapiania aluminium składa się z żelaznej skrzyni, której wewnętrzne ściany i dno wyłożone są warstwą termoizolacyjną z materiałów ogniotrwałych, a na wierzchu grubą wykładziną węglową, która służy jako katoda podczas elektrolizy. Jako anoda używana jest masywna elektroda węglowa. Proces prowadzi się w temperaturze ok. 960°C, napięciu ok. 5 V i natężeniu prądu ok. 140 tys. A. Uwolniony tlen tworzy CO i CO 2 z węglem anodowym. Jednocześnie uzyskuje się niewielkie ilości CF 4 ze względu na niewielkie uwalnianie fluoru. Ze względu na spalanie anody należy ją stopniowo obniżać. Boczne ściany piekarnika (i większość powierzchnie cieczy) pokryte są stałą skorupą elektrolitu, co zapobiega ich oddzieleniu przez gazy uwalniane na anodzie i chroni stopiony materiał przed wychłodzeniem. Podczas pracy pieca okresowo dodaje się do niego Al 2 O 3 (i trochę kriolitu), a stopiony metal jest usuwany.
Wytop aluminium jest bardzo energochłonny: tona metalu wymaga około 10 tys. kWh energii elektrycznej. Jego pierwotne czyszczenie odbywa się poprzez wdmuchiwanie chloru. Sprzedawany metal zawiera zwykle 99,7% aluminium. Wraz z innymi zanieczyszczeniami (głównie Si i Fe) zawiera również śladowe ilości galu.
Stałe i stale rosnące zapotrzebowanie na aluminium w latach 80. nie było już w stanie zaspokoić rezerw boksytu. Według naukowców do połowy XXI wiekźródło boksytu zacznie wysychać. Istnieje pilna potrzeba znalezienia innych rodzajów surowców. Po raz pierwszy w praktyce światowej, w obliczu tego samego problemu, w ZSRR zaczęto pozyskiwać tlenek glinu (tlenek glinu - Al 2 O 3) z ałunitu - białego lub szarawo-żółtego ałunu (zawierającego wodorosiarczany potasu i glinu do 37% Al 2 O 3 .
2. Wysoka siła wiązania Al-O-Al i gęsta struktura krystaliczna determinują wysoką temperaturę topnienia (około 2050°C), twardość i ogniotrwałość tlenku glinu. Tak więc korund ustępuje tylko diamentowi pod względem twardości i jest używany jako materiał ścierny w postaci kółek korundowych i szmergla. Jako materiał ogniotrwały jest również szeroko stosowany sztucznie, pozyskiwany z boksytu, silnie kalcynowanego Al 2 O 3, zwanego alundem. Ze względu na wysoką twardość monokryształy korundu (w szczególności rubiny) są sztucznie otrzymywane jako kamienie odniesienia w precyzyjnych mechanizmach. Sztuczne rubiny są wykorzystywane jako generatory kwantowe (lasery).
Zwykle do produkcji ściernic, prętów itp. stosuje się naturalny korund zanieczyszczony tlenkiem żelaza, ze względu na swoją ekstremalną twardość. W postaci drobno pokruszonej nazywany jest szmerglem do czyszczenia powierzchni metalowych i wytwarzania papieru ściernego. Do tych samych celów często stosuje się tlenek glinu, otrzymywany przez stapianie boksytu (nazwa techniczna - alund).
Czysty tlenek glinu (tt 2050, temperatura wrzenia 3500°C) jest bezpośrednio stosowany do produkcji cementów dentystycznych. Tak więc proszek jednego z rodzajów wysokiej jakości cementu dentystycznego otrzymuje się przez stopienie w temperaturze 700-800 ° C, a następnie zmielenie starannie przygotowanej mieszaniny o następującym składzie: 28,4% Al 2 O 3, 20,9-SiO 2, 19,7-Na2SiF6, 19,0-CaSiF6, 3,9-CaCO3, 4,1-H3PO4, 4,0-H3AsO4. Płynem do mieszania takiego cementu jest mocny roztwór Al(H 2 PO 4) 3 .
Produkty z tlenku glinu mają bardzo wysoką wytrzymałość mechaniczną i utrzymują ją do 1800 °C. Ich odporność chemiczna jest również wyjątkowo wysoka. Jednak dobrze przewodzą ciepło i tolerują wahania temperatury. Poprzez napylanie stopionego tlenku glinu można stworzyć skuteczną powłokę ochronną na metalach.
Fuzję równych masowych ilości Al 2 O 3 i SiO 2 z późniejszym rozdmuchem ich stopu otrzymano włókno szklane („ fiberfrax”), charakteryzujący się wysoką stabilnością termiczną i wysoką odpornością chemiczną. Nie zmienia swoich właściwości do 1250°C, topi się dopiero powyżej 1600°C i jest szczególnie odpowiedni do produkcji materiałów termoizolacyjnych.
Na bazie korundu zaprojektowano wytrzymały sztuczny kamień - „ mikrolit”. Składa się z bardzo drobnych (rzędu mikronów) ziaren korundu z niewielkim dodatkiem szklistego materiału wiążącego. Frezy mikrolityczne zachowują swoją ekstremalną twardość do 1200 °C, dzięki czemu umożliwiają bardzo wysokie prędkości obróbki metalu.
Pomysł optycznego generatora kwantowego zrealizowano po raz pierwszy (1960) na krysztale rubinowym („ laser”) - urządzenie, które tworzy ukierunkowaną wiązkę promieniowania monochromatycznego (tj. O jednej określonej długości fali) w widzialnym obszarze widma lub w jego pobliżu. Działanie lasera (a także związanego z nim „masera”, który generuje podobną wiązkę krótkich fal radiowych) polega na uwolnieniu energii w wyniku pewnego spadku poziomu energii wielu identycznych cząstek, który występuje jednocześnie.
Wniosek
Zakres tlenku glinu jest bardzo szeroki, fascynująca historia jego odkrycie sięga czasów starożytnych. Także w starożytny Rzym ludzie starali się poznać tę substancję, dowiadując się coraz więcej o jej właściwościach. A już teraz pojawiają się nowe nanotechnologie, w których gra tlenek glinu Wiodącą rolę. Być może w przyszłości za pomocą tej substancji zostaną opracowane Nowa technologia, pojawi się jeszcze jeden, a może i kilka rodzajów kamieni szlachetnych, pozyskiwanych w taki sam sposób jak istniejące, sztucznie.
Źródła informacji
1. Encyklopedia. Geologia M., "Avanta +" 1995, s. 304 306 357.
2. Achmetow N.S. Chemia ogólna i nieorganiczna M., "Wyższa Szkoła" 1998. s. 430-432.
3. Starsza.K. Atlas klejnotów.
4. Komkowa E.G. Grupa chemicznych asteroid.M., „Oświecenie” 1984. s. 404,405
5. Strona internetowa: http://schoolchemistry.by.ru Tlenek glinu.
6. Strona internetowa: http://www.alhimikov.net Aluminium.
Autor Encyklopedia chemiczna ur. I.L.KnunyantsTLENEK GLINU(tlenek glinu) AI 2 O 3 , bezbarwne kryształy; temperatura topnienia 2044°C; temperatura wrzenia 3530 °C. Jedyna stabilna do 2044 °C krystaliczna. modyfikacja TLENKU ALUMINIUM o.-Al 2 O 3 (korund): sieć romboedryczna, a \u003d 0,512 nm, \u003d 55,25 ° (dla instalacji sześciokątnej a \u003d 0,475 nm, c \u003d 1,299 nm, grupa przestrzenna D 6 3d, z = 2); gęstość 3,99 g/cm3;N°pl 111,4 kJ/mol; równania zależności od temperatury: pojemność cieplna C ° p \u003d \u003d 114,4 + 12,9 * 10 -3 T - 34,3 * 10 5 T 2 JDmol * K) (298T 1800 K), ciśnienie pary Igp (Pa) \u003d -54800 /7 + 1,68 (do ~3500 K); współczynnik temperaturowy rozszerzalności liniowej (7,2-8,6) * 10 -6 K -1 (300T1200 K); przewodność cieplna próbki spiekanej w 730°C 0,35 W/(mol*K); twardość Mohsa 9; współczynnik załamania dla zwykłej wiązki wynosi n 0 1,765, dla niezwykłej wiązki 1,759. Zobacz tabelę.
WŁAŚCIWOŚCI TERMODYNAMICZNE TLENEKÓW GLINU 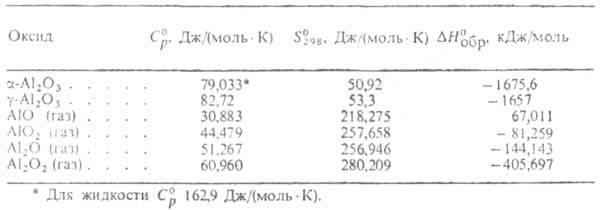
Modyfikacja-Al 2 O 3 występuje w naturze w postaci mineralnego korundu, który często zawiera w rozpuszczonej postaci tlenki innych metali, nadając mu inny kolor. Przezroczyste kolorowe kryształy - kamienie szlachetne (szafiry, rubiny itp.). Korund można otrzymać sztucznie w wyniku termodynamicznego rozkładu rombu. modyfikacja diaspora AlOOH lub przemiany polimorficzne metastabilnych form Al 2 O 3 (itp.), które powstają podczas rozkładu krystalicznego. modyfikacje Al (OH) 3 -gibbsytu i bajerytu oraz AlOOH-behmit (patrz Wodorotlenek glinu). Procesy te można przedstawić na poniższym diagramie: 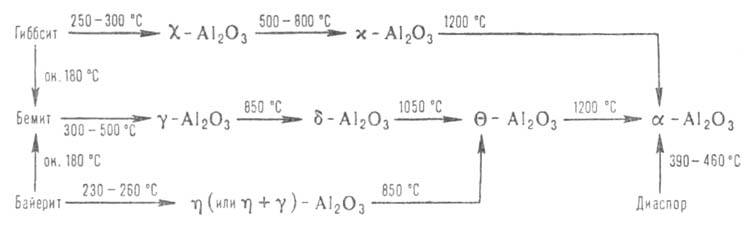
Modyfikacja Al 2 O 3 ma tetragon, krystaliczny. sieć typu spinel (a = 0,562 nm, c = 0,780 nm); gęstość 3,3-3,4 g/cm3; zawiera strukturalnie związaną wodę w ilości 1-2%. Istnieje również amorficzny TLENEK ALUMINIUM. - alumożel powstający podczas odwadniania żelopodobnego Al(OH) 3, który jest substancją porowatą, czasem przezroczystą. TLENEK GLINU około. nierozpuszczalny w wodzie, dobrze rozpuszczalny w stopionym kriolicie. Amfoteren. Z NH3-H2O nie reaguje. Aktywność chemiczna syntetyczna. A. o. znacznie spada wraz ze wzrostem temperatury. Naturalny i sztuczny (powstający powyżej 1200 ° C) korund w powietrzu w normalnych warunkach są chemicznie obojętne i niehigroskopijne. OK. 1000°C intensywne oddziaływanie z alkaliami i węglanami metali alkalicznych, dając gliniany. Powoli reaguje z SiO 2 i kwaśnymi żużlami tworząc glinokrzemiany. Podczas fuzji interakcja z KHSO 4 . Korund, powstały z diaspor w temperaturze 500-600 ° C, oddziałuje również z roztworami kwasów i zasad. Alumogel i Al 2 O 3 otrzymane przez wypalanie wodorotlenków Al w temperaturze ~550°C są bardzo higroskopijne i aktywne chemicznie, reagują z roztworami kwasów i zasad.
Surowce do otrzymywania TLENKU ALUMINIUM. - boksyty, nefeliny, alunity itp. (patrz Aluminium ^ Przy stosunku w rudach Al 2 O 3: SiO 2 > 6-7, są one przetwarzane zgodnie z metodą Bayera (metoda główna), z Al 2 O 3: SiO 2< 6 (высококремнистое сырье) - спеканием с известью и содой.
Zgodnie z metodą Bayera boksyt rozdrobniony w młynach kulowych jest ługowany w autoklawach zawróconym alkalicznym roztworem glinianu Na (po oddzieleniu z niego części Al 2 O 3 ) w temperaturze 225-250°C. W tym przypadku aluminium przechodzi do roztworu w postaci glinianu Na. W przypadku boksytu zawierającego gibbsyt ługowanie można prowadzić w temperaturze 105°C i pod normalnym ciśnieniem w aparacie z mieszadłem. Roztwory glinianów są rozcieńczane wodą, osad jest oddzielany i poddawany rozkładowi w aparatach z mieszadłem lub podnośnikiem powietrznym przez 30-70 godz. 1/2 powstałego AI(OH)3. Jest odfiltrowywany i kalcynowany w piecach obrotowych lub w złożu fluidalnym w temperaturze ~1200°C. Rezultatem jest tlenek glinu zawierający 15-60% Al 2 O 3 . Ług macierzysty jest odparowywany i podawany do ługowania nowej partii boksytu.
Zgodnie z drugą metodą, kruszona ruda o wysokiej zawartości krzemu (nefelin itp.) jest mieszana z sodą i wapieniem i spiekana w piecach obrotowych w temperaturze 1250-1300: C. Otrzymaną masę ługuje się wodnym roztworem alkalicznym, roztworem glinianu Na jest oddzielany od szlamu, a następnie uwalniany od SiO2, wytrącając go w autoklawie pod ciśnieniem ok. 0,6 MPa, a następnie wapnem pod ciśnieniem atmosferycznym i rozłożyć glinian gazowym CO 2 . Powstały Al(OH)3 oddziela się od roztworu i kalcynuje w temperaturze ok. 5,5°C. 1200°C. Podczas przetwarzania nefelinu, oprócz tlenku glinu, otrzymuje się Na 2 CO 3 , K 2 CO 3 i cement. Przy produkcji tlenku glinu z ałunitów otrzymuje się jednocześnie H 2 SO 4 i K 2 SO 4 . Ruda ałunitu jest wypalana w temperaturze 500-580°C w celu odnowienia. w atmosferze i potraktowano roztworem NaOH zgodnie z metodą Bayera. Monokryształy hoduje się metodą topienia strefowego według metody Verneuila lub Czochralskiego.
Syntetyczny Al 2 O 3 - półprodukt w produkcji Al (główny obszar zastosowania), materiał ogniotrwały i ścierny. Wykorzystywany jest również w produkcji ceramiki. przecinarki, elektrotechnika. ceramika. Monokryształy - materiał laserowy, kamienie referencyjne mechanizmów zegarków, kamienie jubilerskie. Naturalny materiał korundowo-ścierny (krążki korundowe, szmergiel) i materiał ogniotrwały. Alumogel, Al 2 O 3 i jego mieszanina z -Al 2 O 3 - adsorbentami do suszenia gazów (na przykład H 2 , Ag, C 2 H 2) i cieczy (węglowodory aromatyczne, nafta itp.) W chromatografii; katalizatory (np. odwodnienie alkoholi, izomeryzacja olefin, rozkład H2S); nośniki katalizatorów (na przykład Co-MoO 3 , Pd, Pt).
Światowa produkcja TLENKU ALUMINIUM o. OK. 30 mln ton/rok (1980). Znane są również inne A. o. (patrz tabela) istniejące w fazie gazowej.
Encyklopedia chemiczna. Tom 1 >>
Izolacja z tlenku glinu należy do klasy odporności cieplnej C. Ponieważ temperatura topnienia tlenku glinu jest bardzo wysoka, około 2050 C, możliwe jest podgrzanie utlenionego drutu aluminiowego do temperatury topnienia metalu (patrz str. Jednak wady izolacji z tlenku glinu są jego niską elastycznością i zauważalną higroskopijnością porowatości folii. W przypadkach, w których nie jest wymagana szczególnie wysoka odporność termiczna, izolację tlenkową można impregnować i lakierować.
Fizyczne właściwości tlenków zmieniają się regularnie, a zatem zmiana właściwości pierwiastków według okresów i grup. Na ryc. 80 pokazuje zależność temperatury topnienia tlenków od numeru seryjnego elementu. W zwykłych temperaturach tlenki metali są stałymi substancjami krystalicznymi, tlenki niemetali mogą znajdować się w stanach skupienia w stanie gazowym (SOa, CO itp.), ciekłym (H2O itp.) i stałym (PaOz, P2O5, SiO2 itp.). .
Podobnie, katalizatory wanadowe i molibdenowe nie mogą być łatwo zredukowane etylenem w jego temperaturze polimeryzacji, tak więc dla uzyskania wysokiej aktywności musi być stosowany promotor służący jako czynnik redukujący. Jak pokazano w tabeli. 6, temperatura topnienia tlenku gwałtownie wzrasta wraz z przejściem od chromu do wanadu i molibdenu. Niska temperatura topnienia CrO3 zapewnia jego ruchliwość na powierzchni tlenku krzemu, a tym samym wysoką dyspersję.
Powyższe warunki określają wymagania dla metalu przetwarzanego przez cięcie tlenowe. Przede wszystkim temperatura topnienia metalu musi być wyższa niż temperatura topnienia tlenków.
Zachowanie tlenku umożliwia do pewnego stopnia przewidzenie reakcji takiego lub innego kationu podczas kalcynacji na węglu. Na przykład związki manganu nie będą sublimować, ponieważ temperatura topnienia tlenku manganu wynosi 1650 C. Można uzyskać sublimacje talu i germanu, ponieważ tlenek talu topi się w temperaturze 300 C, dając czarną sublimację, a tlenek germanu jest w stanie sublimować z w stanie stałym w temperaturze 700 C. Te metale nie są ujęte w powyższej tabeli, ponieważ są rzadko spotykane w praktyce. analiza jakościowa. Powstawanie kulki wiąże się ze zdolnością do redukcji tlenku metalu przez węgiel. Na przykład gal nie da chrząszcza, ponieważ jego tlenki nie są redukowane przez węgiel.
Po ogólnym oczyszczeniu gaz prażący uzyskany z pirytu musi zostać poddany specjalnemu oczyszczeniu w celu usunięcia pyłu i pozostałości mgły, a przede wszystkim związków arsenu i selenu, które następnie są utylizowane. Specjalne oczyszczanie gazu obejmuje operacje chłodzenia go do temperatury poniżej temperatur topnienia tlenku arsenu (315 C) i selenu (340 C) w wieżach nawadnianych kolejno 50% i 20% kwasem siarkowym, usuwanie mgły kwasu siarkowego w elektrofiltrach mokrych oraz końcowe odwodnienie gazu w skruberach nawadnianych 95% kwasem siarkowym. Gaz prażący opuszcza specjalny system oczyszczania w temperaturze 140 - 50 C.
W ostatnich trzech przypadkach tej tabeli (Al, Mg i Zn) temperatura anody i katody jest określona przez temperaturę topnienia tlenków, którymi pokrywane są odpowiednie metale podczas wyładowania łukowego w powietrzu.
Aby zapewnić normalny przebieg procesu cięcia tlenowo-paliwowego, muszą być spełnione następujące warunki. Temperatura zapłonu metalu musi być niższa od temperatury topnienia. Temperatura topnienia tlenków metali musi być niższa niż temperatura topnienia samego metalu. Tlenki muszą być płynne. Ciepło uwalniane podczas spalania metalu musi być wystarczająco duże, aby utrzymać ciągły proces. Warunki te w pełni spełniają stale niskowęglowe. Stale konstrukcyjne niskostopowe tną zadowalająco. Stale wysokostopowe chromowe i chromowo-niklowe, żeliwo i metale nieżelazne nie nadają się do konwencjonalnego cięcia tlenem. Do cięcia gazowego tych metali stosuje się topniki, które rozpuszczają stosunkowo ogniotrwałe tlenki i zwiększają wytwarzanie ciepła podczas cięcia.
Właściwości ochronne folii chlorkowych są niskie, w niektórych przypadkach metale zapalają się w strumieniu chloru. W tabeli. 6.4 pokazuje temperatury topnienia soli chlorkowych wielu metali. Dla porównania podano temperatury topnienia tlenków i siarczków.
Jeśli weźmiemy pod uwagę właściwości metali w stanie o stopniu utlenienia 5, należy zauważyć, że tlenki są gęstymi, stabilnymi, obojętnymi substancjami. Pod względem wielkości atomu i jonu niob i tantal są blisko siebie. Znajduje to również odzwierciedlenie we właściwościach tlenków, których temperatura powstawania jest wysoka dla niobu i tantalu, a także temperatura topnienia tlenków oraz wyższe tlenki NbsOs i Ta2O5 są praktycznie nierozpuszczalne w wodzie. Jeśli porównamy jony o tym samym stopniu utlenienia, zauważymy wzrost właściwości metalicznych. Właściwości kwasowe wodorotlenków są wyższe niż w podgrupie tytanu i spadają od wanadu do tantalu. Wodorotlenek wanadu jest słabym kwasem, podczas gdy wodorotlenek niobu i tantalu są związkami amfoterycznymi. Ponieważ te elementy nie mają wypełnionych orbitali d, oznacza to, że są zdolne do formowania złożone związki. Atom niobu w NbF5 ma ładunek dodatni, ponieważ fluor odciąga elektrony od Nb.
Spawanie aluminium i jego stopów jest trudne ze względu na jego szczególne właściwości termofizyczne. W kontakcie z powietrzem na powierzchni aluminium tworzy się gęsta cienka warstwa tlenku Al2O3, która chroni metal przed dalszą korozją, ale jednocześnie pogarsza warunki spawania, ponieważ temperatura topnienia tlenku glinu wynosi 2050 C, dlatego tlenek należy usunąć z powierzchni aluminium przed spawaniem. Aluminium łatwo utlenia się podczas spawania, a warstewka tlenków powstająca na kroplach i w kąpieli zanieczyszcza szew. W stanie stopionym aluminium dobrze rozpuszcza wodór, który przy zwiększonej szybkości chłodzenia spowodowanej wysoką przewodnością cieplną metalu nie ma czasu na uwolnienie w momencie krystalizacji i powoduje porowatość.
(łac. aluminium) - pierwiastek chemiczny Grupa III układ okresowy Mendelejew, liczba atomowa 13, masa atomowa 26,981.
Skorupa ziemska zawiera 8,80% aluminium; jest trzecim najliczniej występującym pierwiastkiem na naszej planecie po tlenie i krzemie. Wchodzi w skład glin, skaleni, miki. Najważniejszy minerał aluminium - boksyt zawiera 28-60% tlenku glinu - tlenek glinu Al2O3.
- najpopularniejszy metal w przyrodzie, ale w czysta forma po raz pierwszy uzyskał go duński fizyk X. Oersted dopiero w 1825 r., później niż wiele metali. Aluminium to lekki, srebrzysty metal, który dobrze przewodzi ciepło i elektryczność. Aluminium jest reaktywne. Łatwo utlenia się tlenem, jednak tylko na powierzchni. Powłoka tlenkowa A12O3 niezawodnie chroni metal przed dalszym utlenianiem. Ale jeśli proszek aluminiowy lub folia aluminiowa mocno nagrzany, a następnie metal płonie olśniewającym płomieniem, zamieniając się w ten sam tlenek. Glin rozpuszcza się w kwasie solnym i siarkowym, a także w roztwory wodne zasady. Aktywnie reaguje z halogenami. Wodorotlenek glinu A1 (OH) 3 - typowy związek amfoteryczny - biała, półprzezroczysta, galaretowata substancja.
W większości związków glin jest trójwartościowy, ale w wysokich temperaturach może również wykazywać stopień utlenienia + 1. Spośród związków tego metalu, oczywiście najważniejszy jest tlenek A12O. Formuła ta wyraża skład zarówno tlenku glinu, jak i bardzo twardego mineralnego korundu. Kryształy korundu zabarwione zanieczyszczeniami w Kolor niebieski, zwany szafirem, w kolorze czerwono - rubinowym. Rubiny i szafiry są obecnie produkowane sztucznie na skalę przemysłową.

Długo po uzyskaniu aluminium w czystej postaci metal ten pozostawał bardzo rzadki i drogi. Wybierz to z związki naturalne trudne, gdyż jest w nich bardzo mocno związany z tlenem i innymi pierwiastkami. Aluminium można otrzymać przez elektrolizę stopu tlenek glinu, ale ta substancja topi się dopiero w 2050°C. dlatego wymagane jest zbyt dużo energii.
Aluminium mogłoby stać się ważnym technicznie metalem tylko wtedy, gdy znaleziono sposób na obniżenie temperatury topnienia tlenku glinu do co najmniej 1000°C. Taki „objazd” znaleźli niemal jednocześnie Amerykanin C. Hall i Francuz P. Eru. Odkryli, że tlenek glinu dobrze rozpuszcza się w stopionym kriolicie, minerału o składzie P3 3KaR. Ten stop jest poddawany elektrolizie w temperaturze ~ 950°C przez produkcja aluminium. To prawda, wkrótce po odkryciu Halla i Eru stało się jasne, że zasoby kriolitu na Ziemi są bardzo ograniczone. Zorganizowano produkcję syntetycznego kriolitu, a teraz aluminium jest najtańszym ze wszystkich metali nieżelaznych.
Większość aluminium produkowanego na świecie jest wykorzystywana do produkcji stopów lekkich, do aluminium dodaje się miedź, magnez, krzem i cynk. mangan, aby zwiększyć jego siłę. Aluminium jest dziś nazywane głównym metalem techniki lotniczej, jest również potrzebne w inżynierii transportu, w przemyśle chemicznym i elektrotechnice. Aluminium jest metalem bardzo trwałym: można je przetwarzać pod ciśnieniem w normalnych i lekko podwyższonych temperaturach, produkty z niego można wytwarzać przez walcowanie, ciągnienie, tłoczenie, kucie, prasowanie.


