Aluminium należy do głównej podgrupy grupy III. Układ poziomów energii jest następujący:
3 Al 2e - , 8e - , 3e -
Ponieważ atomy glinu mają 3 elektrony na poziomie zewnętrznym, glin w związkach wykazuje stopień utlenienia 4-3.
Dochodzimy do tego samego wniosku, kierując się wyobrażeniami o naturze ruchu elektronów w atomach i ich lokalizacji nie tylko na poziomach energetycznych, ale także na podpoziomach. W atomie aluminium elektrony 3s 2 łatwo ulegają zniszczeniu i jeden elektron przechodzi przez orbital 3p:
Rezultatem są trzy niesparowane elektrony. Odpowiedz na pytanie 1 (s. 138).
> Odnalezienie aluminium w przyrodzie, jego produkcji i właściwości
Aluminium jest trzecim najliczniej występującym pierwiastkiem w skorupa Ziemska. Występuje tylko w związkach. Najważniejsze z nich pokazano na rysunku 19.
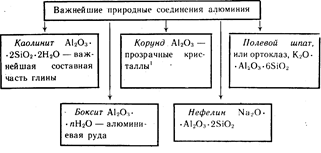
Kolorowe kryształy Al 2 O 3 czerwone - rubiny, koloru niebieskiego- szafiry.
Paragon fiskalny
W 1827 r. niemiecki chemik F. Wöhler uzyskał aluminium przez ogrzewanie chlorku glinu z metalami alkalicznymi z potasem lub sodem bez dostępu do powietrza.
AlCl3 +3K 3KCl + Al
Do produkcja przemysłowa aluminium, metody te są ekonomicznie nieopłacalne, dlatego opracowano metodę elektrochemiczną do otrzymywania aluminium z boksytów.
Właściwości fizyczne
Aluminium to srebrzystobiały metal, lekki (= 2,7 g/cm3), topi się w temperaturze 660 °C. Jest bardzo plastyczny, łatwo wciągany w drut i pieczony w arkuszach i folii. Pod względem przewodności elektrycznej aluminium ustępuje tylko srebru i miedzi (stanowi 2/3 przewodności elektrycznej miedzi).
Właściwości chemiczne
W serii napięć elektrochemicznych aluminium znajduje się za najbardziej aktywnymi metalami. Jednak z codziennego doświadczenia wiadomo, że na produkty aluminiowe (naczynia itp.) nie ma wpływu ani tlen, ani woda, nawet w temperaturze wrzenia. Na aluminium nie ma również wpływu stężony zimny kwas azotowy. Wynika to z obecności cienkiej warstwy tlenku na powierzchni aluminium, która chroni ją przed dalszym utlenianiem. Jeśli powierzchnię aluminium pociera się solą rtęci, następuje następująca reakcja:
2А1 + 3HgCl2 2А1С1 3 + 3Hg
Uwolniona rtęć rozpuszcza aluminium i powstaje jego stop z rtęcią - amalgamat aluminiowy. Folia nie zatrzymuje się na połączonej powierzchni, dlatego aluminium w normalnych warunkach reaguje z wodą (rys. 46):
2А1 + 6НОН 2А1(OH)3 + 3Н2
W podwyższonych temperaturach aluminium reaguje z wieloma niemetalami i złożonymi substancjami bez amalgamacji:
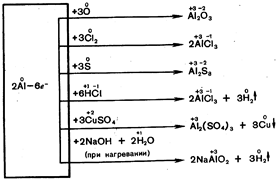
Wniosek
Aluminium wykorzystywane jest do produkcji różnych stopów. Najbardziej rozpowszechnione są duraluminium zawierające miedź i magnez oraz silumin – stopy aluminium z krzemem. Głównymi zaletami tych stopów są lekkość i wysoka wytrzymałość. Wspomniane stopy są szeroko stosowane w budowie samolotów, samochodów, statków i przyrządów, w technologii rakietowej oraz w budownictwie. Aluminium w postaci czystego metalu jest wykorzystywane do produkcji przewodów elektrycznych i różnych urządzeń chemicznych.
Aluminium stosuje się również do aluminizacji, czyli nasycania aluminium powierzchni wyrobów stalowych i żeliwnych w celu zabezpieczenia ich przed korozją.
W praktyce często stosowany jest termit (mieszanina tlenku Fe 3 O 4 z proszkiem aluminiowym). Jeśli ta mieszanina zostanie podpalona (za pomocą taśmy magnezowej), następuje gwałtowna reakcja z uwolnieniem duża liczba ciepło:
8Al + 3Fe 3 O 4 4Al 2 O 3 + 9Fe
Proces ten wykorzystywany jest w tzw. spawaniu termitowym, a także do otrzymywania niektórych metali w postaci swobodnej.
Odpowiedz na pytania 2-6 (s. 138). Rozwiąż zadania 1 - 2 (s. 138).
Aluminium. Stanowisko w układzie okresowym, fizyczne i Właściwości chemiczne
Wprowadzenie 3
1. Właściwości fizyczne i chemiczne aluminium 5
2. Uzyskanie aluminium 9
3. Aluminium w naturze 10
4. Zastosowanie aluminium i jego stopów 12
Wniosek 16
Referencje 18
Wstęp
Publiczność po raz pierwszy zapoznała się z aluminium na Wystawie Światowej w Paryżu w 1855 roku, gdzie zaprezentowano małe sztabki nowego metalu. Opinia publiczna była rozczarowana. Gazety pisały: „Paryska wystawa miała położyć kres opowieści o srebrze z gliny. Aluminium było tam pokazywane publicznie, a dzięki temu stało się jasne, że bardzo to, co o nim powiedziano, należy przypisać fantazji i łatwowierności ogółu społeczeństwa. Zamiast oczekiwanych gór aluminium było tylko 12 małych bloków o łącznej wadze około kilograma, co oczywiście nie jest zbyt wiele jak na odkrycie, które wydawało się, że może zmienić świat”. Jednak stopniowo z rzadkiej ciekawostki, niegdyś cenionej na równi z metale szlachetne, aluminium stało się nieodzownym materiałem dla architektów, konstruktorów i projektantów. Tak więc w 1967 roku amerykański projektant Oscar de la Renta zrobił furorę w świecie mody, prezentując publiczności kostium kąpielowy wykonany z najcieńszej aluminiowej nici.
Ten metal o zadziwiająco różnorodnych właściwościach w zaledwie dwa stulecia od swojego powstania zdołał podbić świat, stając się synonimem postępu technologicznego. A XXI wiek, pod każdym względem, zapowiada się na wiek aluminium.
Obecnie aluminium jest droższe niż zwykła stal węglowa, ale tańsze niż stal nierdzewna. Jeśli policzymy koszt wyrobów aluminiowych i stalowych, biorąc pod uwagę ich wagę i względną odporność na korozję, okazuje się, że dziś w wielu przypadkach znacznie bardziej opłaca się stosować aluminium niż stal.
Aluminium to metal trzeciego tysiąclecia. Trwałe, wytrzymałe i lekkie, odporne na korozję, odkształcenia i wpływy środowiska, estetyczne i łatwe w utrzymaniu, aluminium jest jednym z najbardziej poszukiwanych metali we współczesnym przemyśle.
1. Właściwości fizyczne i chemiczne aluminium
W układzie okresowym D. I. Mendelejewa na 110 pierwiastków 87 to metale. Są w grupach I, II, III, w podgrupach drugorzędnych wszystkich grup. Ponadto metale są najcięższymi pierwiastkami IV, V, VI i Grupa VII. Jednak wiele metali jest amfoterycznych i czasami zachowują się jak niemetale.
Aluminium jest elementem III okresu głównej podgrupy grupy III.
Jest oznaczony symbolem Al (łac. Aluminium).
Należy do rodziny elementów p. Elektrony walencyjne aluminium znajdują się na podpoziomach s i p zewnętrznej warstwy elektronowej. Są trzy takie elektrony, więc aluminium może tworzyć trzy wiązania walencyjne, co jest dla niego najbardziej typowe. Dlatego w przypadku aluminium zwykle stopień utlenienia wynosi +3. W niektórych związkach ma stopnie utlenienia +2 i +1.
według koloru czyste aluminium przypominający srebro, jest bardzo lekkim metalem: jego gęstość to tylko 2,7 g/cm3. Lżejsze od aluminium są tylko metale alkaliczne i ziem alkalicznych (z wyjątkiem baru), beryl i magnez. Aluminium również łatwo się topi - w temperaturze 600°C (cienki drut aluminiowy topi się na zwykłym palniku kuchennym), ale wrze dopiero w temperaturze 2452°C. Pod względem przewodności elektrycznej aluminium plasuje się na 4 miejscu, ustępując tylko srebru (jest na pierwszym miejscu), miedź i złoto, co ze względu na taniość aluminium ma ogromne znaczenie praktyczne. Przewodność cieplna metali zmienia się w tej samej kolejności. Łatwo jest zweryfikować wysoką przewodność cieplną aluminium, zanurzając aluminiową łyżkę w gorącej herbacie. I jeszcze jedna niezwykła właściwość tego metalu: jego gładka, błyszcząca powierzchnia doskonale odbija światło: od 80 do 93% w widzialnym obszarze widma, w zależności od długości fali. W zakresie ultrafioletowym aluminium nie ma sobie równych pod tym względem i tylko w obszarze czerwonym jest nieco gorsze od srebra (w ultrafiolecie srebro ma bardzo niski współczynnik odbicia) ..............
Lista wykorzystanej literatury
1. Berdonosow S.S. Poradnik chemii dla uczniów. - M.: Akwarium, 2006. - 572 s.
2. Buszkow N.N. Chemia. Dodatek dla uczestników. - M.: Knorus, 2007. 455 s.
3. Davidyants A.P. Trzynasty element // Ekonomia i życie. - 2002.- luty (N 7). - S. 2-3.
4. Karapetyants M.Kh. Ogólne i chemia nieorganiczna: podręcznik dla technologa chemicznego. specjalista. uniwersytety. - M.: Chemia, 2006. - 592 s.
5. Streltsov A. Skrzydlaty metal // Ekonomia i życie. - 2002.- luty (N 7). - S. 1.
Strona 1
Aluminium należy do głównej podgrupy grupy III. Układ poziomów energii jest następujący:
3Al 2e-, 8e-, 3e-
Ponieważ atomy glinu mają 3 elektrony na poziomie zewnętrznym, glin w związkach wykazuje stopień utlenienia 4-3.
Dochodzimy do tego samego wniosku, kierując się wyobrażeniami o naturze ruchu elektronów w atomach i ich lokalizacji nie tylko na poziomach energetycznych, ale także na podpoziomach. W atomie aluminium elektrony 3s2 łatwo ulegają zniszczeniu, a jeden elektron przechodzi przez orbital 3p:
Rezultatem są trzy niesparowane elektrony. Odpowiedz na pytanie 1.
Odnalezienie aluminium w przyrodzie, jego produkcji i właściwości
Aluminium jest trzecim najobficiej występującym pierwiastkiem w skorupie ziemskiej. Występuje tylko w związkach. Najważniejsze z nich pokazano na rysunku 19.
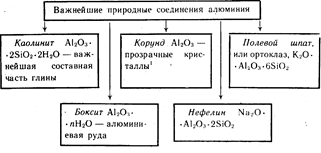
Kolorowe kryształki Al2O3 koloru czerwonego - rubiny, niebieskiego - szafiry.
Paragon fiskalny
W 1827 r. niemiecki chemik F. Wöhler uzyskał aluminium przez ogrzewanie chlorku glinu z metalami alkalicznymi z potasem lub sodem bez dostępu do powietrza.
AlCl3 +3K 3KCl + Al
W przypadku przemysłowej produkcji aluminium metody te nie są ekonomicznie opłacalne, dlatego opracowano elektrochemiczną metodę wytwarzania aluminium z boksytów.
Właściwości fizyczne
Aluminium to srebrzystobiały metal, lekki (r = 2,7 g/cm3), topi się w temperaturze 660°C. Jest bardzo plastyczny, łatwo wciągany w drut i pieczony w arkuszach i folii. Pod względem przewodności elektrycznej aluminium ustępuje tylko srebru i miedzi (stanowi 2/3 przewodności elektrycznej miedzi).
Właściwości chemiczne
W serii napięć elektrochemicznych aluminium znajduje się za najbardziej aktywnymi metalami. Jednak z codziennego doświadczenia wiadomo, że na produkty aluminiowe (naczynia itp.) nie ma wpływu ani tlen, ani woda, nawet w temperaturze wrzenia. Na aluminium nie ma również wpływu stężony zimny kwas azotowy. Wynika to z obecności cienkiej warstwy tlenku na powierzchni aluminium, która chroni ją przed dalszym utlenianiem. Jeśli powierzchnię aluminium pociera się solą rtęci, następuje następująca reakcja:
2А1 + 3HgCl2 ® 2А1С13 + 3Hg
Uwolniona rtęć rozpuszcza aluminium i powstaje jego stop z rtęcią - amalgamat aluminiowy. Folia nie zatrzymuje się na połączonej powierzchni, dlatego w normalnych warunkach aluminium reaguje z wodą (rys. 46):
2А1 + 6НОН ® 2А1(ОН)3¯ + 3Н2
W podwyższonych temperaturach aluminium reaguje z wieloma niemetalami i złożonymi substancjami bez amalgamacji:

Wniosek
Aluminium wykorzystywane jest do produkcji różnych stopów. Najbardziej rozpowszechnione są duraluminium zawierające miedź i magnez oraz silumin – stopy aluminium z krzemem. Głównymi zaletami tych stopów są lekkość i wysoka wytrzymałość. Wspomniane stopy są szeroko stosowane w budowie samolotów, samochodów, statków i przyrządów, w technologii rakietowej oraz w budownictwie. Aluminium w postaci czystego metalu jest wykorzystywane do produkcji przewodów elektrycznych i różnych urządzeń chemicznych.
Aluminium stosuje się również do aluminizacji, czyli nasycania aluminium powierzchni wyrobów stalowych i żeliwnych w celu zabezpieczenia ich przed korozją.
W praktyce często stosowany jest termit (mieszanina tlenku Fe3O4 z proszkiem aluminiowym). Jeśli ta mieszanina zostanie podpalona (za pomocą taśmy magnezowej), następuje gwałtowna reakcja z uwolnieniem dużej ilości ciepła:
8Al + 3Fe3O4 ® 4Al2O3 + 9Fe
Proces ten wykorzystywany jest w tzw. spawaniu termitowym, a także do otrzymywania niektórych metali w postaci swobodnej.
Odpowiedz na pytania 2-6 (s. 138). Rozwiąż zadania 1 - 2 (s. 138).
Najważniejsze związki glinu
Tlenek glinu
Al2O3 można uzyskać w następujący sposób:
1. Proszek do bezpośredniego spalania metalowe aluminium(przez wdmuchiwanie proszku aluminiowego w płomień palnika):
4Al + 3O2 ® 2А12O3
2. Przez przekształcenie według poniższego schematu:
Tlenek glinu jest stałą, ogniotrwałą (temp. pl. 2050 °C) białą substancją.
Zgodnie ze swoimi właściwościami chemicznymi jest tlenkiem amfoterycznym (I, § 37). Reaguje z kwasami, wykazuje właściwości tlenków zasadowych:
A12O3 + 6HC1 2A1C13 + 3H2O
Al2O3 + 6H+ +6С1- 2Al3+ + 6С1- + 3Н2O
Aktualizacja na temat edukacji:
Pierwiastki III-A grupy układu okresowego
Aluminium Al (łac. Aluminium, od łac. alumen - ałun). Al - element III grupy III okresu układ okresowy D. I. Mendelejew, s. s. 13, masa atomowa 26.9815 ma jeden stabilny izotop 27Al (100%). Metaliczny Al uzyskano w 1827 roku. Wohlera. Według zawartości w skorupie ziemskiej (8,8%) Al zajmuje ...
Zróżnicowanie poziomu szkolenia na podstawie obowiązkowych wyników
Technologia ta proponuje wprowadzenie dwóch standardów: edukacyjnego (poziom, który szkoła powinna zapewnić zainteresowanemu, zdolnemu i pracowitemu absolwentowi) oraz standard obowiązkowej edukacji ogólnej (poziom, który każdy powinien osiągnąć). Przestrzeń między poziomami...
System kształcenia inżynierskiego w USA
Generalnie Stany Zjednoczone przyjęły system wieloetapowy wyższa edukacja, zgodnie z którym trening podzielony jest na kilka cykli. Pierwsza – licencjacka – trwa cztery lata i kończy się uzyskaniem tytułu licencjata. Od pierwszych dwóch lat studenci studiują dyscypliny ogólnokształcące, około ...
Cel zajęć: stworzenie uczniom warunków do badania fizycznych i chemicznych właściwości aluminium w oparciu o strukturę jego atomu.
Cele Lekcji:
1. Rozważ aluminium jako pierwiastek chemiczny i prostą substancję; utrwalić wiedzę o budowie metali, ich ogólnych właściwościach fizycznych i chemicznych, umiejętność pisania równań reakcje chemiczne, przeczytaj je, określ rodzaj, rozważ w świetle wyobrażeń o procesach utleniania i redukcji.
2. Rozwijać mentalne operacje analizy, syntezy, porównania, a także logiki, uwagi i obserwacji.
3. Formowanie naukowego światopoglądu, umiejętność podejścia do rozwiązywania codziennych problemów z: punkt naukowy wizję, zastosuj swoją wiedzę.
Metoda nauczania: problematyczna.
Formy organizacyjne: rozmowa, praca samodzielna, praca praktyczna.
Pomoce dydaktyczne: mapa dojazdu, instrukcje, sprzęt chemiczny, tabele.
Sprzęt demonstracyjny: stoły, stojak demonstracyjny, drut aluminiowy, gwóźdź żelazny, probówki z wodą, lampka alkoholowa, zapałki, plastelina, źródło prądu, klucz, żarówka.
Wyposażenie na stołach uczniów: aluminium, roztwór wodorotlenku sodu, kwas solny, stojak na probówki, dwie probówki z wodą z drutem aluminiowym i gwoździem żelaznym, lampka spirytusowa, zapałki, uchwyt na probówki.
Podczas zajęć
I. Etap okołomotywacyjny (motywacja, aktualizacja wiedzy).
1. wprowadzenie nauczyciele. Pozdrowienia.
- Chłopaki, teraz przeczytam wam wiersz, a wy słuchacie go uważnie i wymienicie dany pierwiastek chemiczny.
Przedmiot ukryty w pudełku
Nie mogę bez tego zjeść obiadu.
Rzecz jest niezastąpiona.
Rzecz jest konieczna.
Jeśli usiądziemy do jedzenia
Naprawdę potrzebujemy tego przedmiotu.
Z czego pochodzi ten przedmiot?
Srebrny biały kolor
Będziesz mógł odpowiedzieć.
- Jaki jest temat? (Prawidłowy, o aluminiowej łyżce.)
- A więc, chłopaki, tematem lekcji jest „Aluminium: pierwiastek chemiczny i prosta substancja”.
Jak myślisz, czego możesz się nauczyć o aluminium na lekcji?
2. Sprawdzanie pracy domowej.
Ale zanim zaczniemy uczyć się nowego materiału, przypomnijmy sobie, czego nauczyłeś się na poprzedniej lekcji. W tym celu proszę o odpowiedź na następujące pytania (gwiazdki dla prawidłowej odpowiedzi).
1. Opowiedz o pozycji żelaza w D.I. Mendelejew.
2. Napisz budowę atomu żelaza i jego konfigurację elektronową.
3. Posłuchajmy krótkich wiadomości o związkach żelaza.
4. Jakich odczynników można użyć do oznaczenia jonów żelaza Fe 2 + Fe 3 w roztworze? ( dwuwartościowy i trójwartościowy.)
- Dobra robota chłopcy! Dobrze opanowałeś materiał z ostatniej lekcji. Na koniec lekcji pokaż mi swoje gwiazdy. Przejdźmy do badania nowego materiału. Każdy z nas ma swój adres: to ulica, dom, mieszkanie. Pierwiastki chemiczne też mają swój „dom”. Jak to jest nazywane? Jakie „adresy” pierwiastki chemiczne? Dziś poznamy jednego z „lokatorów” tego domu. I w tym celu udamy się w podróż, aby zapoznać się z niesamowitym pierwiastkiem chemicznym - aluminium i prostą substancją przez niego utworzoną. Aby to zrobić, będziesz potrzebować mapy trasy.
II.
Etap operacyjny i wykonawczy(nauka nowego materiału)Zapisz na mapie trasy termin naszej wycieczki i temat lekcji.
1) Jesteś na stacji o nazwie „Wizytówka pierwiastka chemicznego”. Zadanie jest indywidualne dla każdego: znajdź aluminium w PSCE i wypełnij pierwszą część mapy trasy. Czas wykonania to 3 minuty, kto pierwszy wykona zadanie poprawnie - gwiazdka. Sprawdźmy twoje notatki (proszę do tablicy...).
Czy miałeś trudności w sporządzeniu diagramu rozmieszczenia elektronów atomu glinu na orbitalach atomowych?
W pierwszym schemacie nie ma trudności. A co oznacza 2. schemat: Al *. Kiedy atom przechodzi w stan wzbudzony, elektron z podpoziomu 3s przechodzi na wolny orbital podpoziomu 3p. Następnie formuła elektroniczna zmiany atomu aluminium.
Jaki jest stopień utlenienia aluminium? (+3)
- Jakie właściwości ma ten pierwiastek - metaliczne czy niemetaliczne? ( metal.)
Jaka prosta substancja tworzy pierwiastek o właściwościach metalicznych? ( Metal.)
Więc aluminium jest metalem. Spójrz na pierwiastki chemiczne otaczające aluminium w PSCE. Po lewej stronie znajdują się aktywne metale, po prawej - niemetale.
- Wyciągnij wniosek na temat działania aluminium. (Glin - metal nieaktywny.)
Przejdźmy do elektrochemicznego szeregu napięć metali. Tutaj aluminium znajduje się zaraz za metalami aktywnymi, a za nim są też metale dość aktywne.
Jaka jest aktywność aluminium? (Glin – aktywny metal.)
Na moim stole są dwie szklanki wody. Tydzień temu w wodzie umieszczono żelazny gwóźdź i drut aluminiowy.
– Co widzimy? ( Żelazo wchodziło w interakcję z wodą, zmieniło kolor, ale nic się nie stało z drutem aluminiowym.)
- Spójrz jeszcze raz na elektrochemiczne serie napięć metali.
- Który z metali - Al czy Fe - jest bardziej aktywny? ( Okazuje się, że Glin.)
- Dlaczego drut aluminiowy nie reaguje, a żelazny gwóźdź wchodzi z nim w interakcję?
Czy aluminium jest aktywnym metalem? - to jest problem, który musimy dziś rozwiązać.
Ponieważ informacje uzyskane na stacji „Pierwiastek Visitka” nie wystarczą do wyciągnięcia ostatecznego wniosku o aktywności aluminium, przejdziemy do kolejnej stacji – „Właściwości fizyczne prostej substancji”.
2) Teraz musisz pracować w parach. Weź drut aluminiowy, zbadaj go, spróbuj zmienić jego kształt.
I tak niepostrzeżenie zbliżyliśmy się do drugiej stacji naszej trasy, która nazywa się „Właściwości fizyczne prostej substancji”.
Teraz musicie pracować w parach z tekstem podręcznika. Otwórz swój podręcznik na s. 57 i przeczytaj tylko jeden akapit, który zaczyna się od słów „Aluminium to prosta substancja”.
W oparciu o tekst i swoje życiowe doświadczenia opisz fizyczne właściwości aluminium i zapisz je. W przypadku trudności postaw ołówkiem znak zapytania przed odpowiednią nieruchomością. (Kto robi to pierwszy - podnosi rękę - dla prawidłowej odpowiedzi - gwiazdka.)
Aluminium nazywane jest metalem „skrzydlatym”, ponieważ ze względu na swoją lekkość, wytrzymałość stopów i odporność na korozję jest wykorzystywane w produkcji samolotów i rakiet.
Jak już powiedziałeś, aluminium nadal ma wysoką przewodność cieplną. Aby udowodnić przewodność cieplną aluminium, zademonstruję eksperyment. (Zamocuję poziomo drut aluminiowy w nodze statywu demonstracyjnego, do którego przymocuję dwie zapałki z plasteliną. Koniec drutu podgrzeję w płomieniu lampki alkoholowej. Po chwili zapałki wpadają skręcać.)
- Czy wiedza uzyskana na tej stacji pozwala na wyciągnięcie wniosków na temat działania aluminium? ( Nie.)
3) Kolejna stacja naszej podróży jest nie mniej ciekawa niż poprzednia i nazywa się „Właściwości chemiczne prostej substancji”.
Podczas dość długiego postoju na tej stacji miniesz dwa etapy. W pierwszym etapie poznasz interakcję aluminium z proste substancje, na drugim - ze złożonymi.
A więc pierwszy etap. Napisz trzy równania dla reakcji aluminium z prostymi substancjami z tlenem, siarką i chlorem i pokaż zmianę stopnia utlenienia pierwiastków. Wypełnij tabelę na mapie trasy.
(Tę reakcję można zaobserwować podczas palenia ognie i fajerwerków - proszek aluminiowy zapala się i pali oślepiającym płomieniem przy silnym podgrzaniu.)
- Czym jest glin w tych reakcjach - utleniaczem czy reduktorem? ( Aktywny środek redukujący.)
Wszystkie te reakcje zachodzą po podgrzaniu.
W drugim etapie badamy oddziaływanie glinu z substancjami złożonymi: kwasem solnym i roztworem wodorotlenku sodu.
Chłopaki, czy aluminium wchodzi w interakcje z wodą? Widzę, że nie potrafisz odpowiedzieć na to pytanie.
– Czy podczas wlewania wody do aluminiowej miski zachodzi reakcja chemiczna? Czy podczas deszczu coś się dzieje z aluminiowymi przewodami elektrycznymi?
- Wymienione produkty nie zmieniają się pod wpływem wody, ponieważ aluminium pokryte jest silnym filmem tlenkowym. Jeśli ten film zostanie usunięty, aluminium będzie reagowało z wodą (i niektórymi prostymi substancjami) nawet w normalnych warunkach.
Folię tę można usunąć, to znaczy zniszczyć papierem ściernym lub chemicznie (na przykład roztworem alkalicznym) lub przetrzeć solą rtęci na powierzchni aluminium, wówczas zachodzi następująca reakcja:
2Al + 3HqCl 2 –> AlCl 3 + 3Hq
Uwolniona rtęć rozpuszcza aluminium i tworzy jego stop z rtęcią - amalgamat aluminium. Folia nie zatrzymuje się na połączonej powierzchni, dlatego aluminium w normalnych warunkach reaguje z wodą:
2Al + 6HOH –> 2Al(OH) 3 + 3H 2
Glin dobrze rozpuszcza się w rozcieńczonych kwasach HCl i H2SO4. Jednak stężone kwasy H 2 SO 4 i HN 0 3 pasywują kwasy, tworząc na powierzchni metalu film tlenkowy, co uniemożliwia dalszy przebieg reakcji. Dlatego kwasy te transportowane są w cysternach aluminiowych.
Doświadczenie I. Oddziaływanie glinu z roztworem kwasu HCl.
Umieść dwa kawałki aluminium i jeden ml w probówce. roztwór kwasu. Jeśli nie nastąpi żadna reakcja, lekko podgrzej zawartość probówki.
2Al + 6HCl \u003d 2AlO 3 + 3H 2
(2Al + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2)
Doświadczenie II. Oddziaływanie aluminium z roztworem alkalicznym.
Umieść dwa kawałki aluminium i jeden ml w probówce. roztwór alkaliczny. Jeśli nie nastąpi żadna reakcja, podgrzej.
W obu eksperymentach I i II reakcje nie zachodzą natychmiast, chociaż aluminium jest metalem aktywnym, ponieważ przeszkadza film tlenkowy, następuje gwałtowna reakcja, ponieważ film ulega zniszczeniu.
(2Al + 2NaOH + 2H 2 O \u003d 2NaAlO 2 + 3H 2) - glinian sodu
Twórz schematy równań reakcji.
- Jakie wnioski można wyciągnąć z aktywności metalu? ( aktywny metal.)
Aluminium jest aktywne chemicznie, może reagować z niemetalami, wodą, kwasami.
Chłopaki, naukowcy udowodnili, że:
Aluminium powoduje skurcze
A pamięć u ludzi się zmniejsza.
Hamuje szereg enzymów
Zwłaszcza ośrodki hematopoetyczne,
A demencja to jego praca!
Dlaczego w takim razie naczynia są wykonane z aluminium?
Okazuje się, że nie można używać naczyń aluminiowych? To możliwe, bo co powstaje na jego powierzchni? Folia tlenkowa! Który chroni aluminium przed wpływem czynników środowiskowych. Tylko nie da się w nim gotować kwaśnych i zasadowych potraw, co oznacza, że ziemniaki (zawierające skrobię) mogą.
Aby aluminium zaczęło reagować, należy usunąć z jego powierzchni warstwę tlenku. Czasami w aluminiowych patelniach na dnie widzimy czarne plamy, warstwa tlenku została zniszczona. To jest rodzaj dania, którego nie możesz użyć.
III. Podstawowy sprawdzian opanowania wiedzy.
Następna stacja - "Wybierz zadanie". W ciągu 4 min. musisz wykonać jedno z trzech zadań w twoim wariancie (opcjonalnie). Wybierz tylko to zadanie, które potrafisz obsłużyć. (Zobacz mapę trasy.)
Uzupełnij równanie reakcji. Napisz to w pełnej i skróconej formie jonowej:
Al + HCl –> ... (wariant I);
Al + H 2 SO 4 –> ... (wariant II).
Napisz równania reakcji zgodnie ze schematem:
Al –> Al 2 O 3 –> Al (NO 3) 3 (wariant I);
Al –> AlCl 3 –> Al(NO 3) 3 (wariant II).
Określ nieznaną substancję i zapisz równania reakcji zgodnie ze schematem:
Al –> ... –> Al(OH) 3 (wariant I);
Al –> ... –> AlCl 3 (wariant II).
IV.
Podstawowa konsolidacja wiedzyDotarłeś do ostatniej stacji. W twoich notatnikach okazało się streszczenie odniesienia lekcja.
– Gdybyśmy kontynuowali naszą podróż, jakie stacje musielibyście jeszcze odwiedzić? ( „Znajdywanie w naturze”, „Zdobywanie”, „Korzystanie”.)
Aluminium jest najczęściej występującym metalem w skorupie ziemskiej. Stanowi 8,8% jego masy. Jednak przemysłowa metoda jego produkcji została odkryta stosunkowo niedawno. W 1886 roku młody amerykański inżynier Charles Martin Hall podbiegł do profesora Yvette, trzymając na wyciągniętej dłoni 12 małych kulek aluminium, po raz pierwszy uzyskanych przez elektrolizę ...
Ale przestudiujesz ten materiał w następnej lekcji.
v.
Podsumowując lekcję. OdbicieWróćmy do tematu dzisiejszej lekcji.
Jaki problem stawialiśmy na początku?
Czy udało nam się go rozwiązać?
- Do jakiego wniosku doszliśmy?
dodatek
Pierwiastki i atomy
W zajętym kręgu Mendelejewa
Uczyniła chemię najbogatszą.
I najbardziej kreatywna z nauk.
(G.Sannikow)
Mapa trasy
Cel: zbadanie położenia aluminium w układzie okresowym, struktury atomu pierwiastka, właściwości fizycznych i chemicznych prostej substancji.
Stacja 1. „Wizytówka pierwiastka chemicznego”
Czas postoju 3 minuty. Pracując indywidualnie, określ położenie pierwiastka w układzie okresowym, sporządź wzór elektronowy atomu. Robić notatki:
aluminium
pierwiastek chemiczny
znak chemiczny: masa atomowa Ar(Al) =
numer seryjny:
Kropka:
Grupa:
wiersz podgrupy:
struktura atomu:
elektroniczna Konfiguracja:
prosta sprawa
wzór chemiczny:
masa cząsteczkowa Mr(Al) –
Stacja 2. „Właściwości fizyczne prostej substancji”
Czas parkowania 5 minut. Pracuj w parach. Zapisz fizyczne właściwości substancji na mapie trasy
kolor:
stan skupienia:
Plastikowy:
metaliczny połysk:
przewodność cieplna:
przewodnictwo elektryczne:
gęstość:
temperatura topnienia:
stopy:
Stanowisko 3. „Właściwości chemiczne substancji prostej”
Czas postoju 10 minut. Pracując w 4-osobowych grupach, napisz równanie reakcji chemicznej między glinem a substancjami. Wyciągnij własne wnioski. Napisz jedno równanie reakcji chemicznej w postaci redoks. Pokaż przejście elektronów.
Oddziaływania aluminium |
|
z prostymi substancjami |
ze złożonymi substancjami Al –> A1 2 O 3 –> Al(HO 3) 3 (wariant I); Al –> AlCl 3 –> Al(HO 3) 3 (wariant II). Określ nieznaną substancję i zapisz równania reakcji zgodnie ze schematem: Al –> ... –> Al(OH) 3 (wariant I); Al –> ... –> AlCl 3 (wariant II). Dziękujemy za Twoją pracę! Twój Praca domowa. Opierając się na materiałach podręcznika i odnośnikach, napisz opowiadanie na ten temat „Czy powinienem używać aluminiowych naczyń kuchennych?”. Podaj argumenty za i przeciw. |


