คุณสมบัติทางกายภาพ
โซเดียมไฮดรอกไซด์
อุณหพลศาสตร์ของการแก้ปัญหา
Δ H0การละลายของสารละลายในน้ำที่เจือจางอย่างอนันต์ -44.45 kJ / mol
จากสารละลายในน้ำที่ 12.3 - 61.8 ° C โมโนไฮเดรตตกผลึก (ซินโกนีขนมเปียกปูน) จุดหลอมเหลว 65.1 ° C; ความหนาแน่น 1.829 g/cm³; ΔH 0 อาร์-734.96 kJ / mol) ในช่วง -28 ถึง -24 ° C - heptahydrate จาก -24 ถึง -17.7 ° C - pentahydrate จาก -17.7 ถึง -5.4 ° C - tetrahydrate ( การปรับเปลี่ยน α) จาก -5.4 ถึง 12.3 องศาเซลเซียส ความสามารถในการละลายในเมทานอล 23.6 g/l (t=28°C) ในเอทานอล 14.7 g/l (t=28°C) NaOH 3.5H 2 O (จุดหลอมเหลว 15.5 ° C);
คุณสมบัติทางเคมี
(โดยทั่วไป ปฏิกิริยาดังกล่าวสามารถแสดงด้วยสมการไอออนิกอย่างง่าย ปฏิกิริยาเกิดขึ้นจากการปลดปล่อยความร้อน (ปฏิกิริยาคายความร้อน): OH - + H 3 O + → 2H 2 O.)
- ด้วยแอมโฟเทอริกออกไซด์ที่มีทั้งคุณสมบัติพื้นฐานและกรด และความสามารถในการทำปฏิกิริยากับด่าง เช่นเดียวกับของแข็งเมื่อหลอมรวม:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O
และด้วยวิธีแก้ปัญหา:
ZnO + 2NaOH (สารละลาย) + H 2 O → Na 2 (สารละลาย)+H2
(ไอออนที่เป็นผลลัพธ์เรียกว่า tetrahydroxozincate ion และเกลือที่สามารถแยกได้จากสารละลายคือโซเดียม tetrahydroxozincate โซเดียมไฮดรอกไซด์ก็ทำปฏิกิริยาเช่นเดียวกันกับแอมโฟเทอริกออกไซด์อื่น ๆ )
- ด้วยกรดออกไซด์ - ด้วยการก่อตัวของเกลือ คุณสมบัตินี้ใช้เพื่อทำความสะอาดการปล่อยก๊าซเรือนกระจกทางอุตสาหกรรมจากก๊าซกรด (เช่น CO 2 , SO 2 และ H 2 S):
2Na + + 2OH - + Cu 2+ + SO 4 2- → Cu(OH) 2 ↓+ Na 2 SO 4
โซเดียมไฮดรอกไซด์ใช้ในการตกตะกอนโลหะไฮดรอกไซด์ ตัวอย่างเช่น นี่คือวิธีที่ได้อะลูมิเนียมไฮดรอกไซด์ที่มีลักษณะคล้ายเจลโดยทำปฏิกิริยากับโซเดียมไฮดรอกไซด์บนอะลูมิเนียมซัลเฟตใน สารละลายน้ำ. โดยเฉพาะอย่างยิ่ง ใช้เพื่อทำให้น้ำบริสุทธิ์จากสารแขวนลอยชั้นดี

เอสเทอร์ไฮโดรไลซิส
- ด้วยไขมัน (สะพอนิฟิเคชั่น) ปฏิกิริยานี้ไม่สามารถย้อนกลับได้ เนื่องจากกรดที่เกิดกับด่างจะก่อตัวเป็นสบู่และกลีเซอรีน ต่อมากลีเซอรีนถูกสกัดจากสบู่สุราโดยการระเหยด้วยสุญญากาศและการทำให้บริสุทธิ์จากการกลั่นเพิ่มเติมของผลิตภัณฑ์ที่ได้รับ วิธีการทำสบู่นี้เป็นที่รู้จักในตะวันออกกลางตั้งแต่ศตวรรษที่ 7:
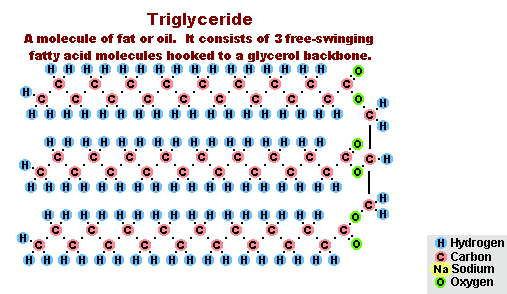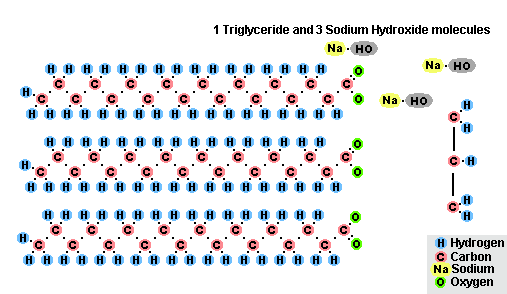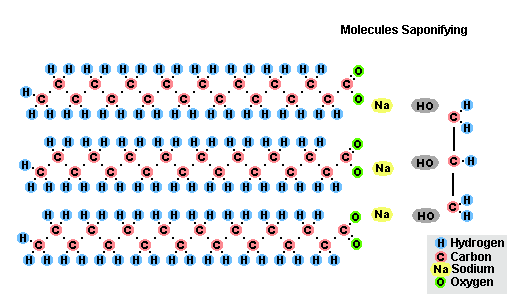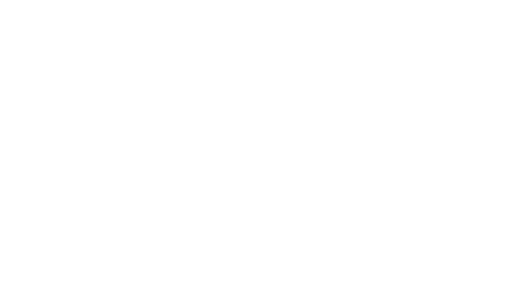
กระบวนการสะพอนิฟิเคชั่นของไขมัน
เป็นผลมาจากการทำงานร่วมกันของไขมันกับโซเดียมไฮดรอกไซด์ สบู่ที่เป็นของแข็งจะได้รับ (ใช้ในการผลิตสบู่ก้อน) และกับโพแทสเซียมไฮดรอกไซด์ทั้งที่เป็นของแข็งหรือ สบู่เหลวขึ้นอยู่กับองค์ประกอบของไขมัน
HO-CH 2 -CH 2 OH + 2NaOH → NaO-CH 2 -CH 2 -ONa + 2H 2 O
2NaCl + 2H 2 O \u003d H 2 + Cl 2 + 2NaOH,ในปัจจุบัน โซดาไฟและคลอรีนผลิตโดยวิธีเคมีไฟฟ้าสามวิธี สองวิธีคืออิเล็กโทรลิซิสที่มีแร่ใยหินที่เป็นของแข็งหรือพอลิเมอร์แคโทด (วิธีการผลิตไดอะแฟรมและเมมเบรน) วิธีที่สามคืออิเล็กโทรลิซิสที่มีแคโทดเหลว (วิธีการผลิตปรอท) ในวิธีการผลิตไฟฟ้าเคมีหลายวิธี วิธีที่ง่ายและสะดวกที่สุดคือการแยกอิเล็กโทรไลซิสด้วยแคโทดปรอท แต่วิธีนี้ทำให้เกิดอันตรายอย่างมาก สิ่งแวดล้อมอันเป็นผลมาจากการระเหยและการรั่วซึมของโลหะปรอท วิธีการผลิตเมมเบรนเป็นวิธีที่มีประสิทธิภาพมากที่สุด ใช้พลังงานน้อยที่สุด และเป็นมิตรกับสิ่งแวดล้อมมากที่สุด แต่ยังต้องใช้วัตถุดิบที่มีความบริสุทธิ์สูงโดยเฉพาะอย่างยิ่งตามอำเภอใจโดยเฉพาะอย่างยิ่ง
ด่างกัดกร่อนที่ได้จากอิเล็กโทรไลซิสด้วยแคโทดปรอทเหลวนั้นสะอาดกว่าที่ได้จากวิธีไดอะแฟรมมาก สำหรับบางอุตสาหกรรม นี่เป็นสิ่งสำคัญ ดังนั้นในการผลิตเส้นใยประดิษฐ์จึงสามารถใช้สารกัดกร่อนที่ได้จากอิเล็กโทรลิซิสที่มีแคโทดปรอทเหลวเท่านั้น ในทางปฏิบัติของโลก ใช้ทั้งสามวิธีในการรับคลอรีนและโซดาไฟ โดยมีแนวโน้มที่ชัดเจนในการเพิ่มส่วนแบ่งของอิเล็กโทรไลซิสของเมมเบรน ในรัสเซีย ประมาณ 35% ของโซดาไฟที่ผลิตได้ทั้งหมดผลิตโดยอิเล็กโทรลิซิสด้วยแคโทดปรอท และ 65% โดยอิเล็กโทรลิซิสด้วยแคโทดที่เป็นของแข็ง (วิธีไดอะแฟรมและเมมเบรน)
ประสิทธิภาพของกระบวนการผลิตไม่เพียงคำนวณจากผลผลิตของโซดาไฟเท่านั้น แต่ยังคำนวณจากผลผลิตของคลอรีนและไฮโดรเจนที่ได้จากอิเล็กโทรลิซิสด้วย อัตราส่วนของคลอรีนและโซเดียมไฮดรอกไซด์ที่เอาต์พุตคือ 100/110 ปฏิกิริยาจะเกิดขึ้นใน อัตราส่วนดังต่อไปนี้:
1.8 NaCl + 0.5 H 2 O + 2.8 MJ = 1.00 Cl 2 + 1.10 NaOH + 0.03 H 2,ตัวชี้วัดหลักของวิธีการผลิตต่างๆ แสดงไว้ในตาราง:
| ดัชนีต่อ NaOH . 1 ตัน | วิธีปรอท | วิธีไดอะแฟรม | วิธีเมมเบรน |
|---|---|---|---|
| คลอรีนเอาท์พุท% | 97 | 96 | 98,5 |
| ไฟฟ้า (kWh) | 3 150 | 3 260 | 2 520 |
| ความเข้มข้นของ NaOH | 50 | 12 | 35 |
| ความบริสุทธิ์ของคลอรีน | 99,2 | 98 | 99,3 |
| ความบริสุทธิ์ของไฮโดรเจน | 99,9 | 99,9 | 99,9 |
| เศษส่วนมวลของ O 2 ในคลอรีน% | 0,1 | 1-2 | 0,3 |
| เศษส่วนมวลของ Cl - ใน NaOH, % | 0,003 | 1-1,2 | 0,005 |
โครงร่างเทคโนโลยีของอิเล็กโทรไลซิสด้วยแคโทดที่เป็นของแข็ง
วิธีไดอะแฟรม - ช่องของเซลล์ที่มีแคโทดที่เป็นของแข็งถูกแบ่งโดยพาร์ติชั่นที่มีรูพรุน - ไดอะแฟรม - เข้าไปในพื้นที่แคโทดและแอโนดโดยที่แคโทดและแอโนดของเซลล์ตั้งอยู่ตามลำดับ ดังนั้นอิเล็กโทรไลเซอร์ดังกล่าวจึงมักถูกเรียกว่าอิเล็กโทรไลต์ไดอะแฟรม และวิธีการผลิตคืออิเล็กโทรไลซิสไดอะแฟรม กระแสของอะโนไลต์อิ่มตัวจะเข้าสู่พื้นที่แอโนดของเซลล์ไดอะแฟรมอย่างต่อเนื่อง เป็นผลมาจากกระบวนการไฟฟ้าเคมี คลอรีนถูกปล่อยออกมาที่ขั้วบวกเนื่องจากการสลายตัวของเฮไลต์ และไฮโดรเจนถูกปล่อยออกมาที่แคโทดเนื่องจากการสลายตัวของน้ำ คลอรีนและไฮโดรเจนจะถูกลบออกจากอิเล็กโทรไลเซอร์แยกกัน โดยไม่ต้องผสม:
2Cl - - 2 อี\u003d Cl 2 0, H 2 O - 2 อี− 1/2 O 2 \u003d H 2
ในกรณีนี้ บริเวณใกล้แคโทดจะอุดมด้วยโซเดียมไฮดรอกไซด์ สารละลายจากโซนแคโทดที่เรียกว่าอิเล็กโทรไลต์น้ำด่างซึ่งมีอะโนไลต์ที่ยังไม่ย่อยสลายและโซเดียมไฮดรอกไซด์จะถูกกำจัดออกจากอิเล็กโทรไลเซอร์อย่างต่อเนื่อง ในขั้นตอนต่อไปสุราอิเล็กโทรไลต์จะระเหยและเนื้อหาของ NaOH ในนั้นจะถูกปรับเป็น 42-50% ตามมาตรฐาน ฮาไลต์และโซเดียมซัลเฟตที่มีความเข้มข้นของโซเดียมไฮดรอกไซด์ตกตะกอนเพิ่มขึ้น สารละลายโซดาไฟจะถูกแยกออกจากตะกอนและถ่ายโอนเป็นผลิตภัณฑ์สำเร็จรูปไปยังคลังสินค้าหรือไปยังขั้นตอนการระเหยเพื่อให้ได้ผลิตภัณฑ์ที่เป็นของแข็ง ตามด้วยการหลอม หลอมเป็นชิ้น หรือเป็นแกรนูล ผลึกเฮไลต์ (เกลือย้อนกลับ) จะกลับสู่อิเล็กโทรไลซิสเพื่อเตรียมน้ำเกลือที่เรียกว่าย้อนกลับ จากนั้นเพื่อหลีกเลี่ยงการสะสมของซัลเฟตในสารละลายซัลเฟตจะถูกสกัดก่อนเตรียมน้ำเกลือที่ส่งคืน การสูญเสียอะโนไลต์จะได้รับการชดเชยด้วยการเติมน้ำเกลือสดที่ได้จากการชะล้างชั้นเกลือใต้ดินหรือโดยการละลายของเฮไลต์ที่เป็นของแข็ง ก่อนที่จะผสมกับน้ำเกลือย้อนกลับ น้ำเกลือสดจะถูกทำความสะอาดจากสารแขวนลอยทางกลและแคลเซียมและแมกนีเซียมไอออนส่วนสำคัญ คลอรีนที่ได้จะถูกแยกออกจากไอน้ำ บีบอัดและป้อนไปยังผลิตภัณฑ์ที่มีคลอรีนหรือเพื่อทำให้เป็นของเหลว
วิธีเมมเบรน - คล้ายกับไดอะแฟรม แต่ช่องว่างขั้วบวกและขั้วลบถูกคั่นด้วยเมมเบรนแลกเปลี่ยนไอออนบวก อิเล็กโทรไลซิสของเมมเบรนให้สารกัดกร่อนที่บริสุทธิ์ที่สุด
ระบบเทคโนโลยี อิเล็กโทรไลซิสขั้นตอนทางเทคโนโลยีหลักคืออิเล็กโทรไลซิส อุปกรณ์หลักคืออ่างอิเล็กโทรไลต์ซึ่งประกอบด้วยอิเล็กโทรไลเซอร์ ตัวย่อยสลายและปั๊มปรอท ซึ่งเชื่อมต่อกันด้วยการสื่อสาร ในอ่างอิเล็กโทรไลต์ภายใต้การกระทำของปั๊มปรอท ปรอทจะไหลเวียนผ่านอิเล็กโทรไลเซอร์และตัวย่อยสลาย แคโทดของอิเล็กโทรไลเซอร์เป็นกระแสของปรอท แอโนด - กราไฟท์หรือการสึกหรอต่ำ เมื่อรวมกับปรอทแล้ว กระแสอะโนไลต์ - สารละลายเฮไลต์ - จะไหลผ่านอิเล็กโทรไลเซอร์อย่างต่อเนื่อง อันเป็นผลมาจากการสลายตัวทางไฟฟ้าเคมีของเฮไลต์ Cl ไอออนจะเกิดขึ้นบนขั้วบวกและปล่อยคลอรีน:
2 Cl - - 2 อี= Cl 2 0 ,
ซึ่งถูกกำจัดออกจากอิเล็กโทรไลเซอร์และสารละลายโซเดียมที่อ่อนแอในปรอทจะเกิดขึ้นบนแคโทดปรอทที่เรียกว่าอมัลกัม:
นา + + e \u003d นา 0 nNa + + nHg - = นา + Hgอะมัลกัมไหลอย่างต่อเนื่องจากอิเล็กโทรไลเซอร์ไปยังตัวย่อยสลาย ตัวย่อยสลายยังมาพร้อมกับน้ำบริสุทธิ์ที่ดีอย่างต่อเนื่อง ในนั้นโซเดียมอะมัลกัมซึ่งเป็นผลมาจากกระบวนการไฟฟ้าเคมีที่เกิดขึ้นเองนั้นถูกย่อยสลายเกือบทั้งหมดด้วยน้ำด้วยการก่อตัวของปรอทสารละลายโซดาไฟและไฮโดรเจน:
Na + Hg + H 2 0 = NaOH + 1/2H 2 + Hgสารละลายโซดาไฟที่ได้จากวิธีนี้ซึ่งเป็นผลิตภัณฑ์เชิงพาณิชย์ไม่มีสารเจือปนที่เป็นเฮไลต์ซึ่งเป็นอันตรายต่อการผลิตสารละลาย้เหนียว ปรอทเกือบจะปราศจากโซเดียมอะมัลกัมและกลับสู่เซลล์อิเล็กโทรไลต์ ไฮโดรเจนจะถูกลบออกเพื่อทำให้บริสุทธิ์ อะโนไลต์ที่ออกจากอิเล็กโทรไลเซอร์จะอิ่มตัวด้วยเฮไลต์สด สิ่งเจือปนที่นำเข้ามา เช่นเดียวกับการชะออกจากแอโนดและวัสดุโครงสร้าง จะถูกลบออกจากมันและกลับสู่อิเล็กโทรไลซิส ก่อนการคืนสภาพ คลอรีนที่ละลายในคลอรีนจะถูกสกัดจากอะโนไลต์ด้วยกระบวนการสองหรือสามขั้นตอน
วิธีการทางห้องปฏิบัติการสำหรับการได้รับ
ในห้องปฏิบัติการ โซเดียมไฮดรอกไซด์ถูกผลิตขึ้นโดยวิธีทางเคมีที่มีประวัติศาสตร์มากกว่าความสำคัญในทางปฏิบัติ
วิธีมะนาว การผลิตโซเดียมไฮดรอกไซด์ประกอบด้วยปฏิกิริยาระหว่างสารละลายโซดากับน้ำนมมะนาวที่อุณหภูมิประมาณ 80 องศาเซลเซียส กระบวนการนี้เรียกว่าโซดาไฟ มันถูกอธิบายโดยปฏิกิริยา:
นา 2 C0 3 + Ca (OH) 2 \u003d 2NaOH + CaC0 3อันเป็นผลมาจากปฏิกิริยาจะเกิดสารละลายโซเดียมไฮดรอกไซด์และการตกตะกอนของแคลเซียมคาร์บอเนต แคลเซียมคาร์บอเนตถูกแยกออกจากสารละลายซึ่งถูกระเหยเพื่อให้ได้ผลิตภัณฑ์หลอมเหลวที่มี NaOH ประมาณ 92% NaOH หลอมเหลวถูกเทลงในถังเหล็กที่แข็งตัว
ทางเฟอริติก อธิบายโดยสองปฏิกิริยา:
นา 2 C0 3 + เฟ 2 0 3 = นา 2 0 เฟ 2 0 3 + C0 2 (1) Na 2 0 Fe 2 0 3 -f H 2 0 \u003d 2 NaOH + Fe 2 O 3 (2)(1) - กระบวนการเผาโซดาแอชกับไอรอนออกไซด์ที่อุณหภูมิ 1100-1200 องศาเซลเซียส ในกรณีนี้ โซเดียมจุดเฟอร์ไรต์จะเกิดขึ้นและปล่อยก๊าซคาร์บอนไดออกไซด์ ถัดไปเค้กได้รับการบำบัด (ชะล้าง) ด้วยน้ำตามปฏิกิริยา (2); ได้สารละลายโซเดียมไฮดรอกไซด์และการตกตะกอนของ Fe 2 O 3 ซึ่งหลังจากแยกออกจากสารละลายจะกลับสู่กระบวนการ สารละลายประกอบด้วย NaOH ประมาณ 400 กรัม/ลิตร ระเหยเพื่อให้ได้ผลิตภัณฑ์ที่มี NaOH ประมาณ 92%
วิธีทางเคมีในการผลิตโซเดียมไฮดรอกไซด์มี ข้อบกพร่องที่สำคัญ: บริโภคแล้ว จำนวนมากของเชื้อเพลิง, โซดาไฟที่เกิดขึ้นจะถูกปนเปื้อนด้วยสิ่งสกปรก, การบำรุงรักษาอุปกรณ์นั้นลำบาก ปัจจุบันวิธีการเหล่านี้ถูกแทนที่โดยวิธีการผลิตไฟฟ้าเคมีเกือบทั้งหมด
ตลาดโซดาไฟ
การผลิตทั่วโลกโซดาไฟ ปี 2548| ผู้ผลิต | ปริมาณการผลิต ล้านตัน | มีส่วนร่วมในการผลิตโลก |
|---|---|---|
| DOW | 6.363 | 11.1 |
| บริษัทเคมีออกซิเดนทัล | 2.552 | 4.4 |
| พลาสติกฟอร์โมซา | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| ไบเออร์ | 1.507 | 2.6 |
| อั๊คโซ่ โนเบล | 1.157 | 2.0 |
| โทโซ | 1.110 | 1.9 |
| อาร์เคมา | 1.049 | 1.8 |
| โอลิน | 0.970 | 1.7 |
| รัสเซีย | 1.290 | 2.24 |
| จีน | 9.138 | 15.88 |
| อื่น | 27.559 | 47,87 |
| ทั้งหมด: | 57,541 | 100 |
TR - ปรอทที่เป็นของแข็ง (เกล็ด);
TD - ไดอะแฟรมที่เป็นของแข็ง (หลอมรวม);
RR - สารละลายปรอท
РХ - สารละลายเคมี
RD - สารละลายไดอะแฟรม
| ชื่อของตัวบ่งชี้ | TR OKP 21 3211 0400 | TD OKP 21 3212 0200 | RR OKP 21 3211 0100 | РХ 1 เกรด OKP 21 3221 0530 | РХ 2 เกรด OKP 21 3221 0540 | RD เกรดสูงสุด OKP 21 3212 0320 | RD ชั้นประถมศึกษาปีแรก OKP 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| รูปร่าง | มวลสเกล สีขาว. อนุญาตให้ใช้สีอ่อน | มวลสีขาวละลาย อนุญาตให้ใช้สีอ่อน | ของเหลวใสไม่มีสี | ของเหลวไม่มีสีหรือสี อนุญาตให้ตกผลึกได้ | ของเหลวไม่มีสีหรือสี อนุญาตให้ตกผลึกได้ | ของเหลวไม่มีสีหรือสี อนุญาตให้ตกผลึกได้ | |
| เศษส่วนมวลของโซเดียมไฮดรอกไซด์ % ไม่น้อยกว่า | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
| ชื่อธุรกิจ | 2548 พันตัน | 2006 พันตัน | ส่วนแบ่ง 2005% | ส่วนแบ่งในปี 2549 |
|---|---|---|---|---|
| JSC "Kaustik" , สเตอร์ลิทาแมค | 239 | 249 | 20 | 20 |
| JSC "Kaustik", โวลโกกราด | 210 | 216 | 18 | 18 |
| JSC "สายันสค์คมพลาส" | 129 | 111 | 11 | 9 |
| อุสลีคิมพรหม LLC | 84 | 99 | 7 | 8 |
| OAO ซิบูร์-เนฟเตคิม | 87 | 92 | 7 | 8 |
| อ.ส.ค. "ขิมพรหม" เชบอคสารี | 82 | 92 | 7 | 8 |
| VOAO "Khimprom", โวลโกกราด | 87 | 90 | 7 | 7 |
| ZAO อิลิมคิมพรหม | 70 | 84 | 6 | 7 |
| กสทช. "เคชเคก" | 81 | 79 | 7 | 6 |
| แนค "อาซอท" | 73 | 61 | 6 | 5 |
| OAO Kimpro, Kemerovo | 42 | 44 | 4 | 4 |
| ทั้งหมด: | 1184 | 1217 | 100 | 100 |
| ชื่อธุรกิจ | 2005 ตัน | 2006 ตัน | ส่วนแบ่ง 2005% | ส่วนแบ่งในปี 2549 |
|---|---|---|---|---|
| JSC "Kaustik", โวลโกกราด | 67504 | 63510 | 62 | 60 |
| JSC "Kaustik" , สเตอร์ลิทาแมค | 34105 | 34761 | 31 | 33 |
| OAO ซิบูร์-เนฟเตคิม | 1279 | 833 | 1 | 1 |
| VOAO "Khimprom", โวลโกกราด | 5768 | 7115 | 5 | 7 |
| ทั้งหมด: | 108565 | 106219 | 100 | 100 |
แอปพลิเคชัน
ไบโอดีเซล

Cod Lutefisk ในงานฉลองวันรัฐธรรมนูญนอร์เวย์

เบเกิลเยอรมัน
โซเดียมไฮดรอกไซด์ใช้ในอุตสาหกรรมที่หลากหลายและสำหรับความต้องการภายในประเทศ:
- โซดาไฟใช้ใน อุตสาหกรรมเยื่อและกระดาษสำหรับการแยกส่วน (ปฏิกิริยาคราฟท์) ของเซลลูโลสในการผลิตกระดาษ, กระดาษแข็ง, เส้นใยประดิษฐ์, แผ่นใยไม้อัด,
- สำหรับการย่อยไขมัน การผลิตสบู่ แชมพู และสารซักฟอกอื่นๆ. ในสมัยโบราณขี้เถ้าถูกเติมลงในน้ำในระหว่างการล้างและเห็นได้ชัดว่าแม่บ้านสังเกตว่าถ้าขี้เถ้ามีไขมันที่เข้าไปในเตาระหว่างการปรุงอาหารจานจะถูกล้างอย่างดี อาชีพทำสบู่ (saponarius) ถูกกล่าวถึงครั้งแรกเมื่อประมาณปี ค.ศ. 385 อี ธีโอดอร์ พริสเซียนัส. ชาวอาหรับทำสบู่จากน้ำมันและโซดามาตั้งแต่ศตวรรษที่ 7 ปัจจุบันสบู่ทำในลักษณะเดียวกับเมื่อ 10 ศตวรรษก่อน
- ที่ อุตสาหกรรมเคมี- เพื่อทำให้กรดเป็นกลางและกรดออกไซด์ เป็นน้ำยาหรือกับชุดไวนิลหรือยาง
MAC ของโซเดียมไฮดรอกไซด์ในอากาศคือ 0.5 มก./ลบ.ม.
วรรณกรรม
- เทคโนโลยีเคมีทั่วไป เอ็ด I. P. Mukhlenova. หนังสือเรียนเฉพาะทางเทคโนโลยีเคมีของมหาวิทยาลัย - ม.: บัณฑิตวิทยาลัย.
- พื้นฐาน เคมีทั่วไป, v. 3, B. V. Nekrasov. - ม.: เคมี, 1970.
- เทคโนโลยีเคมีทั่วไป Furmer I. E. , Zaitsev V. N. - M.: Higher School, 1978
- คำสั่งของกระทรวงสาธารณสุขของสหพันธรัฐรัสเซียเมื่อวันที่ 28 มีนาคม 2546 N 126 "ในการอนุมัติรายการปัจจัยการผลิตที่เป็นอันตรายภายใต้อิทธิพลของการใช้นมหรือผลิตภัณฑ์อาหารที่เทียบเท่าอื่น ๆ เพื่อวัตถุประสงค์ในการป้องกัน"
- พระราชกฤษฎีกาของหัวหน้าแพทย์สุขาภิบาลแห่งสหพันธรัฐรัสเซียเมื่อวันที่ 4 เมษายน 2546 N 32“ ในการออกกฎสุขาภิบาลสำหรับองค์กร การขนส่งสินค้าในการขนส่งทางรถไฟ SP 2.5.1250-03".
- กฎหมายของรัฐบาลกลางฉบับที่ 116-FZ วันที่ 21 กรกฎาคม 1997 "ว่าด้วยความปลอดภัยในโรงงานอุตสาหกรรมของสิ่งอำนวยความสะดวกในการผลิตที่เป็นอันตราย" (แก้ไขเพิ่มเติมเมื่อ 18 ธันวาคม 2549)
- คำสั่งของกระทรวงทรัพยากรธรรมชาติของสหพันธรัฐรัสเซียเมื่อวันที่ 2 ธันวาคม 2545 N 786 "ในการอนุมัติแค็ตตาล็อกการจำแนกประเภทของเสียของรัฐบาลกลาง" (แก้ไขและเพิ่มเติมเมื่อวันที่ 30 กรกฎาคม 2546)
- พระราชกฤษฎีกาของคณะกรรมการแรงงานแห่งรัฐสหภาพโซเวียตเมื่อวันที่ 25 ตุลาคม พ.ศ. 2518 N 298 / P-22 "ในการอนุมัติรายชื่ออุตสาหกรรมการประชุมเชิงปฏิบัติการวิชาชีพและตำแหน่งที่มีสภาพการทำงานที่เป็นอันตรายงานที่ให้สิทธิในการลาเพิ่มเติมและการทำงานที่สั้นลง วัน” (แก้ไขเพิ่มเติมเมื่อ 29 พฤษภาคม 2534 )
- พระราชกฤษฎีกาของกระทรวงแรงงานของรัสเซียเมื่อวันที่ 22 กรกฎาคม 2542 N 26 "ในการอนุมัติมาตรฐานอุตสาหกรรมมาตรฐานสำหรับเสื้อผ้าพิเศษรองเท้าพิเศษและอุปกรณ์ป้องกันส่วนบุคคลอื่น ๆ สำหรับคนงานในอุตสาหกรรมเคมี"
- พระราชกฤษฎีกาของหัวหน้าแพทย์สุขาภิบาลแห่งสหพันธรัฐรัสเซียลงวันที่ 30 พฤษภาคม 2546 N 116 ในการมีผลบังคับใช้ของ GN 2.1.6 อากาศในบรรยากาศพื้นที่ที่มีประชากร” (แก้ไขเพิ่มเติมเมื่อ 3 พฤศจิกายน 2548) พจนานุกรมสารานุกรมภาพประกอบ
โซเดียมไฮดรอกไซด์- (โซดาไฟ, โซดาไฟ, โซดาไฟ) สารผลึกของแข็งไม่มีสี NaOH ความหนาแน่น 2130 กก. ม. t = 320 ° C; เมื่อมันละลายในน้ำความร้อนจำนวนมากจะถูกปล่อยออกมา ส่งผลเสียต่อผิวหนัง ผ้า กระดาษ อันตราย ... ... สารานุกรมโปลีเทคนิคที่ยิ่งใหญ่
- (โซดาไฟ, โซดาไฟ), NaOH, เบสแก่ (ด่าง) คริสตัลไม่มีสี (ผลิตภัณฑ์ทางเทคนิคมวลทึบแสงสีขาว) ดูดความชื้น ละลายในน้ำ ปล่อยความร้อนจำนวนมาก. ได้จากอิเล็กโทรไลซิสของสารละลาย ... พจนานุกรมสารานุกรม
โซเดียมไฮดรอกไซด์- natrio hidroksidas statusas T sritis chemija สูตรė NaOH atitikmenys: engl. โซดาไฟ; โซเดียมไฮดรอกไซด์. โซดาไฟ; โซดาไฟ; โซเดียมโซดาไฟ; โซเดียมไฮดรอกไซด์ ryšiai: sinonimas - natrio šarmas sinonimas - kaustinė โซดา ... Chemijos ปลายทาง aiskinamasis žodynas
- (โซดาไฟ, โซดาไฟ), NaOH, เบสแก่ (ด่าง) ดีที่สุด คริสตัล (ผลิตภัณฑ์ทางเทคนิคมวลทึบแสงสีขาว) ดูดความชื้น ละลายในน้ำ ปล่อยความร้อนจำนวนมาก. ได้จากอิเล็กโทรไลซิสของสารละลายโซเดียมคลอไรด์ ... วิทยาศาสตร์ธรรมชาติ. พจนานุกรมสารานุกรม
- (โซดาไฟ) NaOH ไม่มีสี คริสตัล; ขนมเปียกปูนทนได้ถึง 299 °C การปรับเปลี่ยน (a = 0.33994 nm, c = 1.1377 nm) สูงกว่า 299 o ด้วย monoclinic; DH0 ของการเปลี่ยนแปลงหลายรูปแบบ 5.85 kJ/โมล; เอ็มพี 323 °С, b.p. 1403 °С; หนาแน่น 2.02 ก./ซม.3; … สารานุกรมเคมี
โซดาไฟ, โซดาไฟ, ผลึกไม่มีสี NaOH มวล ความหนาแน่น 2130 kg/m3, t Pl 320 °C, ความสามารถในการละลายในน้ำ 52.2% (ที่ 20 °C) ฐานที่แข็งแกร่ง ทำลายเนื้อเยื่อสัตว์; การหยด N. g. เข้าตาเป็นอันตรายอย่างยิ่ง ... ... พจนานุกรมสารานุกรมขนาดใหญ่
ด่างเข้มข้น นิยมใช้เป็นสารทำความสะอาด เมื่อโซเดียมไฮดรอกไซด์สัมผัสกับผิวหนัง จะทำให้เกิดแผลไหม้จากสารเคมีอย่างรุนแรง ในกรณีนี้จำเป็นต้องล้างบริเวณที่ได้รับผลกระทบของผิวหนังทันทีในปริมาณมาก ... ... เงื่อนไขทางการแพทย์
โซเดียมไฮดรอกไซด์, โซดาไฟ- (โซดาไฟ) ด่างแก่ ใช้เป็นสารทำความสะอาด เมื่อโซเดียมไฮดรอกไซด์สัมผัสกับผิวหนัง จะทำให้เกิดแผลไหม้จากสารเคมีอย่างรุนแรง ในกรณีนี้จำเป็นต้องล้างบริเวณที่ได้รับผลกระทบจากผิวหนังทันที ... ... พจนานุกรมในการแพทย์
ทั้งโซเดียมไฮดรอกไซด์และด่างอื่นๆ ชื่อ "โซดาไฟ" เกิดจากคุณสมบัติในการกัดกร่อนผิวหนัง กระดาษ แก้ว และทำให้เกิดแผลไหม้อย่างรุนแรง จนถึงศตวรรษที่ 17 ด้วยด่าง (fr. ด่าง) เรียกอีกอย่างว่าโซเดียมและโพแทสเซียมคาร์บอเนต ในนักวิทยาศาสตร์ชาวฝรั่งเศส A. L. Duhamel du Monceau สารเหล่านี้มีความโดดเด่นในตอนแรก: โซเดียมไฮดรอกไซด์เรียกว่าโซดาไฟ, โซเดียมคาร์บอเนตเรียกว่าโซดาแอช (ตามพืช Salsola Soda ซึ่งสกัดจากเถ้า) และโพแทสเซียมคาร์บอเนตเรียกว่าโปแตช . ปัจจุบันโซดามักเรียกกันว่า เกลือโซเดียมกรดคาร์บอนิก ในภาษาอังกฤษและ ภาษาฝรั่งเศสคำว่าโซเดียมหมายถึงโซเดียมโพแทสเซียม - โพแทสเซียม
คุณสมบัติทางกายภาพ
โซเดียมไฮดรอกไซด์
อุณหพลศาสตร์ของการแก้ปัญหา
Δ H0การละลายของสารละลายในน้ำที่เจือจางอย่างอนันต์ -44.45 kJ / mol
จากสารละลายในน้ำที่ 12.3 - 61.8 ° C โมโนไฮเดรตตกผลึก (ซินโกนีขนมเปียกปูน) จุดหลอมเหลว 65.1 ° C; ความหนาแน่น 1.829 g/cm³; ΔH 0 อาร์-734.96 kJ / mol) ในช่วง -28 ถึง -24 ° C - heptahydrate จาก -24 ถึง -17.7 ° C - pentahydrate จาก -17.7 ถึง -5.4 ° C - tetrahydrate ( การปรับเปลี่ยน α) จาก -5.4 ถึง 12.3 องศาเซลเซียส ความสามารถในการละลายในเมทานอล 23.6 g/l (t=28°C) ในเอทานอล 14.7 g/l (t=28°C) NaOH 3.5H 2 O (จุดหลอมเหลว 15.5 ° C);
คุณสมบัติทางเคมี
(โดยทั่วไป ปฏิกิริยาดังกล่าวสามารถแสดงด้วยสมการไอออนิกอย่างง่าย ปฏิกิริยาเกิดขึ้นจากการปลดปล่อยความร้อน (ปฏิกิริยาคายความร้อน): OH - + H 3 O + → 2H 2 O.)
- ด้วยแอมโฟเทอริกออกไซด์ที่มีทั้งคุณสมบัติพื้นฐานและกรด และความสามารถในการทำปฏิกิริยากับด่าง เช่นเดียวกับของแข็งเมื่อหลอมรวม:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O
และด้วยวิธีแก้ปัญหา:
ZnO + 2NaOH (สารละลาย) + H 2 O → Na 2 (สารละลาย)+H2
(ไอออนที่เป็นผลลัพธ์เรียกว่า tetrahydroxozincate ion และเกลือที่สามารถแยกได้จากสารละลายคือโซเดียม tetrahydroxozincate โซเดียมไฮดรอกไซด์ก็ทำปฏิกิริยาเช่นเดียวกันกับแอมโฟเทอริกออกไซด์อื่น ๆ )
- ด้วยกรดออกไซด์ - ด้วยการก่อตัวของเกลือ คุณสมบัตินี้ใช้เพื่อทำความสะอาดการปล่อยก๊าซเรือนกระจกทางอุตสาหกรรมจากก๊าซกรด (เช่น CO 2 , SO 2 และ H 2 S):
2Na + + 2OH - + Cu 2+ + SO 4 2- → Cu(OH) 2 ↓+ Na 2 SO 4
โซเดียมไฮดรอกไซด์ใช้ในการตกตะกอนโลหะไฮดรอกไซด์ ตัวอย่างเช่น อะลูมิเนียมไฮดรอกไซด์ที่มีลักษณะคล้ายเจลได้ด้วยวิธีนี้โดยทำปฏิกิริยากับโซเดียมไฮดรอกไซด์บนอะลูมิเนียมซัลเฟตในสารละลายที่เป็นน้ำ โดยเฉพาะอย่างยิ่ง ใช้เพื่อทำให้น้ำบริสุทธิ์จากสารแขวนลอยชั้นดี

เอสเทอร์ไฮโดรไลซิส
- ด้วยไขมัน (สะพอนิฟิเคชั่น) ปฏิกิริยานี้ไม่สามารถย้อนกลับได้ เนื่องจากกรดที่เกิดกับด่างจะก่อตัวเป็นสบู่และกลีเซอรีน ต่อมากลีเซอรีนถูกสกัดจากสบู่สุราโดยการระเหยด้วยสุญญากาศและการทำให้บริสุทธิ์จากการกลั่นเพิ่มเติมของผลิตภัณฑ์ที่ได้รับ วิธีการทำสบู่นี้เป็นที่รู้จักในตะวันออกกลางตั้งแต่ศตวรรษที่ 7:

กระบวนการสะพอนิฟิเคชั่นของไขมัน
อันเป็นผลมาจากการทำงานร่วมกันของไขมันกับโซเดียมไฮดรอกไซด์ สบู่ที่เป็นของแข็งจะได้รับ (ใช้ในการผลิตสบู่ก้อน) และกับโพแทสเซียมไฮดรอกไซด์ สบู่ที่เป็นของแข็งหรือของเหลว ขึ้นอยู่กับองค์ประกอบของไขมัน
HO-CH 2 -CH 2 OH + 2NaOH → NaO-CH 2 -CH 2 -ONa + 2H 2 O
2NaCl + 2H 2 O \u003d H 2 + Cl 2 + 2NaOH,ในปัจจุบัน โซดาไฟและคลอรีนผลิตโดยวิธีเคมีไฟฟ้าสามวิธี สองวิธีคืออิเล็กโทรลิซิสที่มีแร่ใยหินที่เป็นของแข็งหรือพอลิเมอร์แคโทด (วิธีการผลิตไดอะแฟรมและเมมเบรน) วิธีที่สามคืออิเล็กโทรลิซิสที่มีแคโทดเหลว (วิธีการผลิตปรอท) ในบรรดาวิธีการผลิตไฟฟ้าเคมี อิเล็กโทรไลซิสแบบปรอทแคโทดเป็นวิธีที่ง่ายและสะดวกที่สุด แต่วิธีนี้ทำให้เกิดความเสียหายต่อสิ่งแวดล้อมอย่างมากเนื่องจากการระเหยและการรั่วของโลหะปรอท วิธีการผลิตเมมเบรนเป็นวิธีที่มีประสิทธิภาพมากที่สุด ใช้พลังงานน้อยที่สุด และเป็นมิตรกับสิ่งแวดล้อมมากที่สุด แต่ยังต้องใช้วัตถุดิบที่มีความบริสุทธิ์สูงโดยเฉพาะอย่างยิ่งตามอำเภอใจโดยเฉพาะอย่างยิ่ง
ด่างกัดกร่อนที่ได้จากอิเล็กโทรไลซิสด้วยแคโทดปรอทเหลวนั้นสะอาดกว่าที่ได้จากวิธีไดอะแฟรมมาก สำหรับบางอุตสาหกรรม นี่เป็นสิ่งสำคัญ ดังนั้นในการผลิตเส้นใยประดิษฐ์จึงสามารถใช้สารกัดกร่อนที่ได้จากอิเล็กโทรลิซิสที่มีแคโทดปรอทเหลวเท่านั้น ในทางปฏิบัติของโลก ใช้ทั้งสามวิธีในการรับคลอรีนและโซดาไฟ โดยมีแนวโน้มที่ชัดเจนในการเพิ่มส่วนแบ่งของอิเล็กโทรไลซิสของเมมเบรน ในรัสเซีย ประมาณ 35% ของโซดาไฟที่ผลิตได้ทั้งหมดผลิตโดยอิเล็กโทรลิซิสด้วยแคโทดปรอท และ 65% โดยอิเล็กโทรลิซิสด้วยแคโทดที่เป็นของแข็ง (วิธีไดอะแฟรมและเมมเบรน)
ประสิทธิภาพของกระบวนการผลิตไม่เพียงคำนวณจากผลผลิตของโซดาไฟเท่านั้น แต่ยังคำนวณจากผลผลิตของคลอรีนและไฮโดรเจนที่ได้จากอิเล็กโทรลิซิสด้วย อัตราส่วนของคลอรีนและโซเดียมไฮดรอกไซด์ที่เอาต์พุตคือ 100/110 ปฏิกิริยาจะเกิดขึ้นใน อัตราส่วนดังต่อไปนี้:
1.8 NaCl + 0.5 H 2 O + 2.8 MJ = 1.00 Cl 2 + 1.10 NaOH + 0.03 H 2,ตัวชี้วัดหลักของวิธีการผลิตต่างๆ แสดงไว้ในตาราง:
| ดัชนีต่อ NaOH . 1 ตัน | วิธีปรอท | วิธีไดอะแฟรม | วิธีเมมเบรน |
|---|---|---|---|
| คลอรีนเอาท์พุท% | 97 | 96 | 98,5 |
| ไฟฟ้า (kWh) | 3 150 | 3 260 | 2 520 |
| ความเข้มข้นของ NaOH | 50 | 12 | 35 |
| ความบริสุทธิ์ของคลอรีน | 99,2 | 98 | 99,3 |
| ความบริสุทธิ์ของไฮโดรเจน | 99,9 | 99,9 | 99,9 |
| เศษส่วนมวลของ O 2 ในคลอรีน% | 0,1 | 1-2 | 0,3 |
| เศษส่วนมวลของ Cl - ใน NaOH, % | 0,003 | 1-1,2 | 0,005 |
โครงร่างเทคโนโลยีของอิเล็กโทรไลซิสด้วยแคโทดที่เป็นของแข็ง
วิธีไดอะแฟรม - ช่องของเซลล์ที่มีแคโทดที่เป็นของแข็งถูกแบ่งโดยพาร์ติชั่นที่มีรูพรุน - ไดอะแฟรม - เข้าไปในพื้นที่แคโทดและแอโนดโดยที่แคโทดและแอโนดของเซลล์ตั้งอยู่ตามลำดับ ดังนั้นอิเล็กโทรไลเซอร์ดังกล่าวจึงมักถูกเรียกว่าอิเล็กโทรไลต์ไดอะแฟรม และวิธีการผลิตคืออิเล็กโทรไลซิสไดอะแฟรม กระแสของอะโนไลต์อิ่มตัวจะเข้าสู่พื้นที่แอโนดของเซลล์ไดอะแฟรมอย่างต่อเนื่อง เป็นผลมาจากกระบวนการไฟฟ้าเคมี คลอรีนถูกปล่อยออกมาที่ขั้วบวกเนื่องจากการสลายตัวของเฮไลต์ และไฮโดรเจนถูกปล่อยออกมาที่แคโทดเนื่องจากการสลายตัวของน้ำ คลอรีนและไฮโดรเจนจะถูกลบออกจากอิเล็กโทรไลเซอร์แยกกัน โดยไม่ต้องผสม:
2Cl - - 2 อี\u003d Cl 2 0, H 2 O - 2 อี− 1/2 O 2 \u003d H 2
ในกรณีนี้ บริเวณใกล้แคโทดจะอุดมด้วยโซเดียมไฮดรอกไซด์ สารละลายจากโซนแคโทดที่เรียกว่าอิเล็กโทรไลต์น้ำด่างซึ่งมีอะโนไลต์ที่ยังไม่ย่อยสลายและโซเดียมไฮดรอกไซด์จะถูกกำจัดออกจากอิเล็กโทรไลเซอร์อย่างต่อเนื่อง ในขั้นตอนต่อไปสุราอิเล็กโทรไลต์จะระเหยและเนื้อหาของ NaOH ในนั้นจะถูกปรับเป็น 42-50% ตามมาตรฐาน ฮาไลต์และโซเดียมซัลเฟตที่มีความเข้มข้นของโซเดียมไฮดรอกไซด์ตกตะกอนเพิ่มขึ้น สารละลายโซดาไฟจะถูกแยกออกจากตะกอนและถ่ายโอนเป็นผลิตภัณฑ์สำเร็จรูปไปยังคลังสินค้าหรือไปยังขั้นตอนการระเหยเพื่อให้ได้ผลิตภัณฑ์ที่เป็นของแข็ง ตามด้วยการหลอม หลอมเป็นชิ้น หรือเป็นแกรนูล ผลึกเฮไลต์ (เกลือย้อนกลับ) จะกลับสู่อิเล็กโทรไลซิสเพื่อเตรียมน้ำเกลือที่เรียกว่าย้อนกลับ จากนั้นเพื่อหลีกเลี่ยงการสะสมของซัลเฟตในสารละลายซัลเฟตจะถูกสกัดก่อนเตรียมน้ำเกลือที่ส่งคืน การสูญเสียอะโนไลต์จะได้รับการชดเชยด้วยการเติมน้ำเกลือสดที่ได้จากการชะล้างชั้นเกลือใต้ดินหรือโดยการละลายของเฮไลต์ที่เป็นของแข็ง ก่อนที่จะผสมกับน้ำเกลือย้อนกลับ น้ำเกลือสดจะถูกทำความสะอาดจากสารแขวนลอยทางกลและแคลเซียมและแมกนีเซียมไอออนส่วนสำคัญ คลอรีนที่ได้จะถูกแยกออกจากไอน้ำ บีบอัดและป้อนไปยังผลิตภัณฑ์ที่มีคลอรีนหรือเพื่อทำให้เป็นของเหลว
วิธีเมมเบรน - คล้ายกับไดอะแฟรม แต่ช่องว่างขั้วบวกและขั้วลบถูกคั่นด้วยเมมเบรนแลกเปลี่ยนไอออนบวก อิเล็กโทรไลซิสของเมมเบรนให้สารกัดกร่อนที่บริสุทธิ์ที่สุด
ระบบเทคโนโลยีอิเล็กโทรไลซิสขั้นตอนทางเทคโนโลยีหลักคืออิเล็กโทรไลซิส อุปกรณ์หลักคืออ่างอิเล็กโทรไลต์ซึ่งประกอบด้วยอิเล็กโทรไลเซอร์ ตัวย่อยสลายและปั๊มปรอท ซึ่งเชื่อมต่อกันด้วยการสื่อสาร ในอ่างอิเล็กโทรไลต์ภายใต้การกระทำของปั๊มปรอท ปรอทจะไหลเวียนผ่านอิเล็กโทรไลเซอร์และตัวย่อยสลาย แคโทดของอิเล็กโทรไลเซอร์เป็นกระแสของปรอท แอโนด - กราไฟท์หรือการสึกหรอต่ำ เมื่อรวมกับปรอทแล้ว กระแสอะโนไลต์ - สารละลายเฮไลต์ - จะไหลผ่านอิเล็กโทรไลเซอร์อย่างต่อเนื่อง อันเป็นผลมาจากการสลายตัวทางไฟฟ้าเคมีของเฮไลต์ Cl ไอออนจะเกิดขึ้นบนขั้วบวกและปล่อยคลอรีน:
2 Cl - - 2 อี= Cl 2 0 ,
ซึ่งถูกกำจัดออกจากอิเล็กโทรไลเซอร์และสารละลายโซเดียมที่อ่อนแอในปรอทจะเกิดขึ้นบนแคโทดปรอทที่เรียกว่าอมัลกัม:
นา + + e \u003d นา 0 nNa + + nHg - = นา + Hgอะมัลกัมไหลอย่างต่อเนื่องจากอิเล็กโทรไลเซอร์ไปยังตัวย่อยสลาย ตัวย่อยสลายยังมาพร้อมกับน้ำบริสุทธิ์ที่ดีอย่างต่อเนื่อง ในนั้นโซเดียมอะมัลกัมซึ่งเป็นผลมาจากกระบวนการไฟฟ้าเคมีที่เกิดขึ้นเองนั้นถูกย่อยสลายเกือบทั้งหมดด้วยน้ำด้วยการก่อตัวของปรอทสารละลายโซดาไฟและไฮโดรเจน:
Na + Hg + H 2 0 = NaOH + 1/2H 2 + Hgสารละลายโซดาไฟที่ได้จากวิธีนี้ซึ่งเป็นผลิตภัณฑ์เชิงพาณิชย์ไม่มีสารเจือปนที่เป็นเฮไลต์ซึ่งเป็นอันตรายต่อการผลิตสารละลาย้เหนียว ปรอทเกือบจะปราศจากโซเดียมอะมัลกัมและกลับสู่เซลล์อิเล็กโทรไลต์ ไฮโดรเจนจะถูกลบออกเพื่อทำให้บริสุทธิ์ อะโนไลต์ที่ออกจากอิเล็กโทรไลเซอร์จะอิ่มตัวด้วยเฮไลต์สด สิ่งเจือปนที่นำเข้ามา เช่นเดียวกับการชะออกจากแอโนดและวัสดุโครงสร้าง จะถูกลบออกจากมันและกลับสู่อิเล็กโทรไลซิส ก่อนการคืนสภาพ คลอรีนที่ละลายในคลอรีนจะถูกสกัดจากอะโนไลต์ด้วยกระบวนการสองหรือสามขั้นตอน
วิธีการทางห้องปฏิบัติการสำหรับการได้รับ
ในห้องปฏิบัติการ โซเดียมไฮดรอกไซด์ถูกผลิตขึ้นโดยวิธีทางเคมีที่มีประวัติศาสตร์มากกว่าความสำคัญในทางปฏิบัติ
วิธีมะนาว การผลิตโซเดียมไฮดรอกไซด์ประกอบด้วยปฏิกิริยาระหว่างสารละลายโซดากับน้ำนมมะนาวที่อุณหภูมิประมาณ 80 องศาเซลเซียส กระบวนการนี้เรียกว่าโซดาไฟ มันถูกอธิบายโดยปฏิกิริยา:
นา 2 C0 3 + Ca (OH) 2 \u003d 2NaOH + CaC0 3อันเป็นผลมาจากปฏิกิริยาจะเกิดสารละลายโซเดียมไฮดรอกไซด์และการตกตะกอนของแคลเซียมคาร์บอเนต แคลเซียมคาร์บอเนตถูกแยกออกจากสารละลายซึ่งถูกระเหยเพื่อให้ได้ผลิตภัณฑ์หลอมเหลวที่มี NaOH ประมาณ 92% NaOH หลอมเหลวถูกเทลงในถังเหล็กที่แข็งตัว
ทางเฟอริติก อธิบายโดยสองปฏิกิริยา:
นา 2 C0 3 + เฟ 2 0 3 = นา 2 0 เฟ 2 0 3 + C0 2 (1) Na 2 0 Fe 2 0 3 -f H 2 0 \u003d 2 NaOH + Fe 2 O 3 (2)(1) - กระบวนการเผาโซดาแอชกับไอรอนออกไซด์ที่อุณหภูมิ 1100-1200 องศาเซลเซียส ในกรณีนี้ โซเดียมจุดเฟอร์ไรต์จะเกิดขึ้นและปล่อยก๊าซคาร์บอนไดออกไซด์ ถัดไปเค้กได้รับการบำบัด (ชะล้าง) ด้วยน้ำตามปฏิกิริยา (2); ได้สารละลายโซเดียมไฮดรอกไซด์และการตกตะกอนของ Fe 2 O 3 ซึ่งหลังจากแยกออกจากสารละลายจะกลับสู่กระบวนการ สารละลายประกอบด้วย NaOH ประมาณ 400 กรัม/ลิตร ระเหยเพื่อให้ได้ผลิตภัณฑ์ที่มี NaOH ประมาณ 92%
วิธีทางเคมีในการผลิตโซเดียมไฮดรอกไซด์มีข้อเสียอย่างมาก: ใช้เชื้อเพลิงจำนวนมาก โซดาไฟที่ปนเปื้อนสารปนเปื้อน และการบำรุงรักษาอุปกรณ์นั้นลำบาก ปัจจุบันวิธีการเหล่านี้ถูกแทนที่โดยวิธีการผลิตไฟฟ้าเคมีเกือบทั้งหมด
ตลาดโซดาไฟ
การผลิตโซดาไฟของโลก พ.ศ. 2548| ผู้ผลิต | ปริมาณการผลิต ล้านตัน | มีส่วนร่วมในการผลิตโลก |
|---|---|---|
| DOW | 6.363 | 11.1 |
| บริษัทเคมีออกซิเดนทัล | 2.552 | 4.4 |
| พลาสติกฟอร์โมซา | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| ไบเออร์ | 1.507 | 2.6 |
| อั๊คโซ่ โนเบล | 1.157 | 2.0 |
| โทโซ | 1.110 | 1.9 |
| อาร์เคมา | 1.049 | 1.8 |
| โอลิน | 0.970 | 1.7 |
| รัสเซีย | 1.290 | 2.24 |
| จีน | 9.138 | 15.88 |
| อื่น | 27.559 | 47,87 |
| ทั้งหมด: | 57,541 | 100 |
TR - ปรอทที่เป็นของแข็ง (เกล็ด);
TD - ไดอะแฟรมที่เป็นของแข็ง (หลอมรวม);
RR - สารละลายปรอท
РХ - สารละลายเคมี
RD - สารละลายไดอะแฟรม
| ชื่อของตัวบ่งชี้ | TR OKP 21 3211 0400 | TD OKP 21 3212 0200 | RR OKP 21 3211 0100 | РХ 1 เกรด OKP 21 3221 0530 | РХ 2 เกรด OKP 21 3221 0540 | RD เกรดสูงสุด OKP 21 3212 0320 | RD ชั้นประถมศึกษาปีแรก OKP 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| รูปร่าง | มวลสเกลสีขาว อนุญาตให้ใช้สีอ่อน | มวลสีขาวละลาย อนุญาตให้ใช้สีอ่อน | ของเหลวใสไม่มีสี | ของเหลวไม่มีสีหรือสี อนุญาตให้ตกผลึกได้ | ของเหลวไม่มีสีหรือสี อนุญาตให้ตกผลึกได้ | ของเหลวไม่มีสีหรือสี อนุญาตให้ตกผลึกได้ | |
| เศษส่วนมวลของโซเดียมไฮดรอกไซด์ % ไม่น้อยกว่า | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
| ชื่อธุรกิจ | 2548 พันตัน | 2006 พันตัน | ส่วนแบ่ง 2005% | ส่วนแบ่งในปี 2549 |
|---|---|---|---|---|
| JSC "Kaustik" , สเตอร์ลิทาแมค | 239 | 249 | 20 | 20 |
| JSC "Kaustik", โวลโกกราด | 210 | 216 | 18 | 18 |
| JSC "สายันสค์คมพลาส" | 129 | 111 | 11 | 9 |
| อุสลีคิมพรหม LLC | 84 | 99 | 7 | 8 |
| OAO ซิบูร์-เนฟเตคิม | 87 | 92 | 7 | 8 |
| อ.ส.ค. "ขิมพรหม" เชบอคสารี | 82 | 92 | 7 | 8 |
| VOAO "Khimprom", โวลโกกราด | 87 | 90 | 7 | 7 |
| ZAO อิลิมคิมพรหม | 70 | 84 | 6 | 7 |
| กสทช. "เคชเคก" | 81 | 79 | 7 | 6 |
| แนค "อาซอท" | 73 | 61 | 6 | 5 |
| OAO Kimpro, Kemerovo | 42 | 44 | 4 | 4 |
| ทั้งหมด: | 1184 | 1217 | 100 | 100 |
| ชื่อธุรกิจ | 2005 ตัน | 2006 ตัน | ส่วนแบ่ง 2005% | ส่วนแบ่งในปี 2549 |
|---|---|---|---|---|
| JSC "Kaustik", โวลโกกราด | 67504 | 63510 | 62 | 60 |
| JSC "Kaustik" , สเตอร์ลิทาแมค | 34105 | 34761 | 31 | 33 |
| OAO ซิบูร์-เนฟเตคิม | 1279 | 833 | 1 | 1 |
| VOAO "Khimprom", โวลโกกราด | 5768 | 7115 | 5 | 7 |
| ทั้งหมด: | 108565 | 106219 | 100 | 100 |
แอปพลิเคชัน
ไบโอดีเซล

Cod Lutefisk ในงานฉลองวันรัฐธรรมนูญนอร์เวย์
โซเดียมเป็นของโลหะอัลคาไลและตั้งอยู่ในกลุ่มย่อยหลักของกลุ่มแรกของ PSE พวกเขา ดี. เมนเดเลเยฟ. ที่ระดับพลังงานภายนอกของอะตอม ในระยะทางที่ค่อนข้างใหญ่จากนิวเคลียส มีอิเล็กตรอนหนึ่งตัว ซึ่งอะตอมของโลหะอัลคาไลยอมให้ปล่อยไปได้ง่าย ๆ กลายเป็นไอออนบวกที่มีประจุเพียงตัวเดียว สิ่งนี้อธิบายกิจกรรมทางเคมีที่สูงมากของโลหะอัลคาไล
วิธีการทั่วไปในการรับด่างคืออิเล็กโทรไลซิสของเกลือที่หลอมละลาย (โดยปกติคือคลอไรด์)
โซเดียมเป็นโลหะอัลคาไล มีความแข็งต่ำ ความหนาแน่นต่ำ และจุดหลอมเหลวต่ำ
โซเดียม ทำปฏิกิริยากับออกซิเจน ส่วนใหญ่เป็นโซเดียมเปอร์ออกไซด์
2 นา + O2 Na2O2
โดยการลดเปอร์ออกไซด์และซูเปอร์ออกไซด์ที่มีโลหะอัลคาไลมากเกินไป จะได้ออกไซด์:
Na2O2 + 2 Na 2 Na2O
โซเดียมออกไซด์ทำปฏิกิริยากับน้ำเพื่อสร้างไฮดรอกไซด์: Na2O + H2O → 2 NaOH
เปอร์ออกไซด์ถูกไฮโดรไลซ์อย่างสมบูรณ์ด้วยน้ำด้วยการก่อตัวของอัลคาไล: Na2O2 + 2 HOH → 2 NaOH + H2O2
เช่นเดียวกับโลหะอัลคาไล โซเดียมเป็นสารรีดิวซ์ที่แรงและมีปฏิกิริยารุนแรงกับอโลหะหลายชนิด (ยกเว้นไนโตรเจน ไอโอดีน คาร์บอน ก๊าซมีตระกูล):
มันทำปฏิกิริยาได้แย่มากกับไนโตรเจนในการปล่อยเรืองแสง ทำให้เกิดสารที่ไม่เสถียรอย่างมาก นั่นคือโซเดียมไนไตรด์
ทำปฏิกิริยากับกรดเจือจางเหมือนโลหะทั่วไป:
ด้วยกรดออกซิไดซ์เข้มข้น ผลิตภัณฑ์รีดักชันจะถูกปล่อยออกมา:
โซเดียมไฮดรอกไซด์ NaOH (ด่างที่กัดกร่อน) เป็นเบสเคมีที่แรง ในอุตสาหกรรม โซเดียมไฮดรอกไซด์ผลิตโดยวิธีเคมีและไฟฟ้าเคมี
วิธีการทางเคมีของการได้รับ:
มะนาวซึ่งประกอบด้วยปฏิกิริยาของสารละลายโซดากับน้ำนมมะนาวที่อุณหภูมิประมาณ 80 องศาเซลเซียส กระบวนการนี้เรียกว่า causticization มันผ่านปฏิกิริยา:
นา 2 CO 3 + Ca (OH) 2 → 2NaOH + CaCO 3
เฟอริติกซึ่งรวมถึงสองขั้นตอน:
Na 2 CO 3 + Fe 2 O 3 → 2NaFeO 2 + CO 2
2NaFeO 2 + xH 2 O \u003d 2NaOH + Fe 2 O 3 * xH 2 O
ในทางเคมีไฟฟ้า โซเดียมไฮดรอกไซด์ได้มาจากอิเล็กโทรไลซิสของสารละลายเฮไลต์ (แร่ธาตุที่ประกอบด้วยเกลือ NaCl ทั่วไปเป็นหลัก) ด้วยการผลิตไฮโดรเจนและคลอรีนพร้อมกัน กระบวนการนี้สามารถแสดงด้วยสูตรสรุป:
2NaCl + 2H 2 O ± 2e- → H 2 + Cl 2 + 2NaOH
โซเดียมไฮดรอกไซด์ทำปฏิกิริยา:
1) การวางตัวเป็นกลาง:
NaOH + HCl → NaCl + H 2 O
2) แลกเปลี่ยนกับเกลือในสารละลาย:
2NaOH + CuSO 4 → Cu (OH) 2 ↓ + Na 2 SO 4
3) ทำปฏิกิริยากับอโลหะ
3S + 6NaOH → 2Na 2 S + Na 2 SO 3 + 3H 2 O
4) ทำปฏิกิริยากับโลหะ
2Al + 2NaOH + 6H 2 O → 3H 2 + 2Na
โซเดียมไฮดรอกไซด์ใช้กันอย่างแพร่หลายในอุตสาหกรรมต่างๆ เช่น การทำเยื่อกระดาษ การทำซาโปนิฟิเคชั่นของไขมันในการผลิตสบู่ เป็นตัวเร่งปฏิกิริยาเคมี ในการผลิตน้ำมันดีเซล ฯลฯ
โซเดียมคาร์บอเนตผลิตในรูปของ Na 2 CO 3 (โซดาแอช) หรือในรูปของผลึก Na 2 CO 3 * 10H 2 O (โซดาคริสตัล) หรือในรูปของ NaHCO 3 ไบคาร์บอเนต (โซดาดื่ม)
โซดามักผลิตโดยวิธีแอมโมเนียคลอไรด์โดยพิจารณาจากปฏิกิริยา:
NaCl + NH 4 HCO 3 ↔NaHCO 3 + NH4Cl
อุตสาหกรรมจำนวนมากใช้โซเดียมคาร์บอเนต: เคมี สบู่ เยื่อกระดาษและกระดาษ สิ่งทอ อาหาร ฯลฯ


