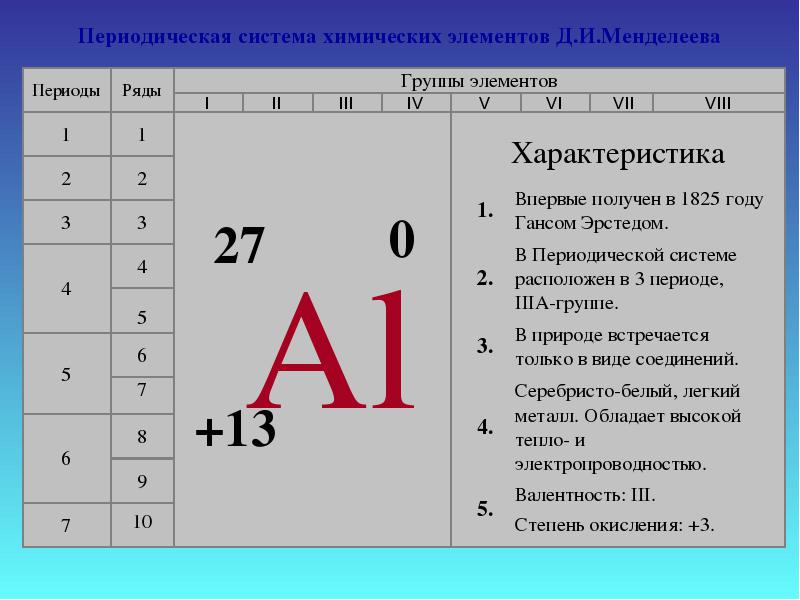
คำนิยาม
อลูมิเนียมตั้งอยู่ในคาบที่ 3 กลุ่มที่ 3 ของกลุ่มย่อยหลัก (A) ของตารางธาตุ นี่คือองค์ประกอบ p แรกของคาบที่ 3
โลหะ. การกำหนด - อัล หมายเลขซีเรียล - 13. ญาติ มวลอะตอม- 26,981 อามู
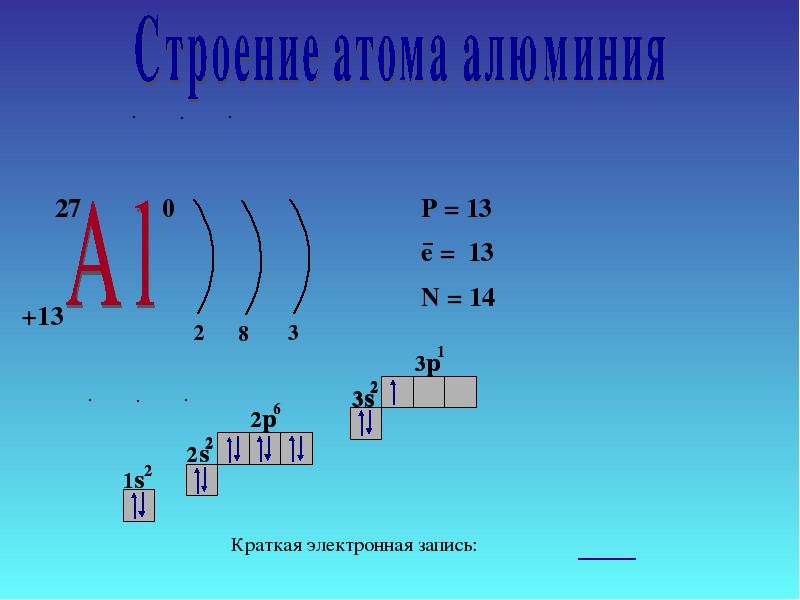
โครงสร้างอิเล็กทรอนิกส์ของอะตอมอะลูมิเนียม
อะตอมอะลูมิเนียมประกอบด้วยนิวเคลียสที่มีประจุบวก (+13) ภายในประกอบด้วยโปรตอน 13 ตัวและนิวตรอน 14 ตัว นิวเคลียสล้อมรอบด้วยเปลือกสามชั้นซึ่งมีอิเล็กตรอน 13 ตัวเคลื่อนที่ผ่าน
ข้าว. 1. ภาพประกอบแผนผังโครงสร้างของอะตอมอะลูมิเนียม
การกระจายตัวของอิเล็กตรอนระหว่างออร์บิทัลมีดังนี้:
13อัล) 2) 8) 3 ;
1ส 2 2ส 2 2พี 6 3ส 2 3พี 1 .
ระดับพลังงานภายนอกของอะลูมิเนียมประกอบด้วยอิเล็กตรอน 3 ตัว ซึ่งเป็นอิเล็กตรอนทั้งหมดในระดับย่อยที่ 3 แผนภาพพลังงานมีรูปแบบดังต่อไปนี้:

อะตอมอะลูมิเนียมจะเกิดสภาวะตื่นเต้นได้ในทางทฤษฎีเนื่องจากมีช่องว่าง 3 ง-ออร์บิทัล อย่างไรก็ตาม การจับคู่อิเล็กตรอน 3 ส-ระดับย่อยไม่ได้เกิดขึ้นจริง
ตัวอย่างการแก้ปัญหา
ตัวอย่างที่ 1
วัตถุประสงค์ของบทเรียน:
จำแนกลักษณะของอลูมิเนียมตามตำแหน่งในตารางธาตุขององค์ประกอบทางเคมี
ขึ้นอยู่กับโครงสร้างของอะตอม ให้พิจารณาคุณสมบัติทางกายภาพและเคมีของมัน
ทำความคุ้นเคยกับวิธีทางอุตสาหกรรมในการผลิตอะลูมิเนียมและระบุขอบเขตการใช้งาน

จากประวัติความเป็นมาของการค้นพบอะลูมิเนียม... “เงินจากดินเหนียว”
ในช่วงเวลาของการค้นพบอะลูมิเนียม โลหะนี้มีราคาแพงกว่าทองคำ ชาวอังกฤษต้องการมอบของขวัญอันล้ำค่าเพื่อเป็นเกียรติแก่นักเคมีชาวรัสเซียผู้ยิ่งใหญ่
D.I. Mendeleev มอบเครื่องชั่งเคมีให้เขา โดยถ้วยหนึ่งทำจากทองคำ ส่วนอีกถ้วยทำจากอลูมิเนียม ถ้วยอลูมิเนียมมีราคาแพงกว่าถ้วยทอง ผลลัพธ์ที่ได้คือ "เงินจากดินเหนียว" ไม่เพียงแต่เป็นที่สนใจของนักวิทยาศาสตร์เท่านั้น แต่ยังรวมถึงนักอุตสาหกรรมและแม้แต่จักรพรรดิแห่งฝรั่งเศสด้วย


การประยุกต์ใช้อลูมิเนียม






อุตสาหกรรมการทหาร

การก่อสร้าง

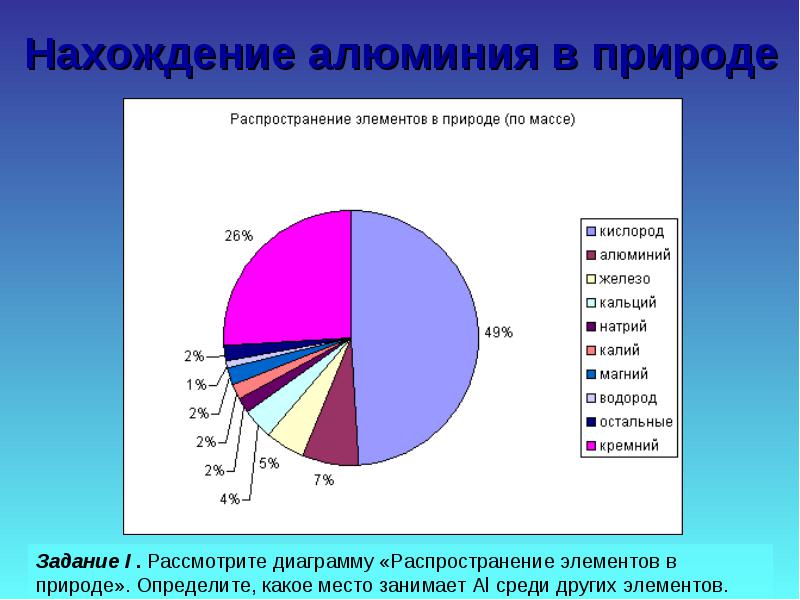
การค้นหาอะลูมิเนียมในธรรมชาติ
สารประกอบอลูมิเนียมธรรมชาติ
ภารกิจที่สอง พิจารณาตัวอย่างสารประกอบธรรมชาติ เปรียบเทียบด้วยความแข็ง ความแข็งแรง สี คำนวณปริมาณอัลในสารประกอบบางส่วน
เนฟีลีน- KNa34
- อลูมินา (ส่วนผสมของดินขาวกับทราย SiO2, หินปูน CaCO3, แมกนีไซต์ MgCO3)
- คอรันดัม (แซฟไฟร์, ทับทิม, กากกะรุน) - Al2O3
- เฟลด์สปาร์ - (K,Na)2O Al2O3 6SiO2, Ca
- ดินขาว - Al2O3 2SiO2 2H2O
- เบริล (มรกต, พลอยสีฟ้า) - 3BeO Al2O3 6SiO2

คุณสมบัติทางกายภาพของอลูมิเนียม งานห้องปฏิบัติการ
การ์ดคำแนะนำ
2. กำหนดสถานะการรวมตัวของสารอะลูมิเนียม
3. จานสีอะไร?
4.ตรวจสอบว่าจานนี้มีความแวววาวหรือไม่?
5. จุ่มจานความยาว 1/4 ลงในแก้วน้ำร้อนประมาณ 10-15 วินาที
นำแผ่นออกจากน้ำเช็ดด้วยผ้าเช็ดปากแล้วตรวจดูว่าอลูมิเนียมมีค่าการนำความร้อนหรือไม่?
6. หยิบอลูมิเนียมฟอยล์ไว้ในมือ ตรวจสอบว่าอลูมิเนียมมีความเหนียวหรือไม่? มันเป็นโลหะเบาหรือเปล่า?
7. วางแผ่นอลูมิเนียมลงในแก้วน้ำเย็นแล้วหมุนหลาย ๆ ครั้ง อลูมิเนียมละลายมั้ย?
8. บันทึกข้อสังเกตของคุณโดยย่อตามแผน:
- สถานะของการรวมตัว
- สี,
- ส่องแสง,
- การนำความร้อน
- ความเป็นพลาสติก
- การละลายในน้ำ.


งานห้องปฏิบัติการ: "คุณสมบัติทางเคมีของอะลูมิเนียม"
การ์ดคำแนะนำ
1. นำหลอดทดลองสองหลอด วางอลูมิเนียมไว้ในแต่ละอัน เทสารละลายกรดไฮโดรคลอริก 1-2 มิลลิลิตรลงในสารละลายหนึ่งและเทสารละลายกรดซัลฟิวริกในปริมาณเท่ากันลงในอีกสารละลายหนึ่ง คุณกำลังสังเกตอะไรอยู่? อุ่นหลอดทดลองเล็กน้อย เขียนสมการของปฏิกิริยาที่สอดคล้องกัน
2. วางชิ้นส่วนอะลูมิเนียมลงในหลอดทดลอง เติมกรดซัลฟิวริกเข้มข้น 1.5 มล. คุณกำลังสังเกตอะไรอยู่? เขียนสมการปฏิกิริยา
3. วางชิ้นส่วนอะลูมิเนียมลงในหลอดทดลองแล้วเติมสารละลายอัลคาไล อุ่นเนื้อหาในหลอดทดลอง เกิดอะไรขึ้น? เขียนสมการปฏิกิริยา
4. นำเสนอผลงานที่ทำเป็นตาราง:


การผลิตอลูมิเนียมในอุตสาหกรรม

ทดสอบ
1. อะตอมอลูมิเนียมมีโครงสร้างทางอิเล็กทรอนิกส์อย่างไร
ก) 1s22s22p1 ข) 1s22s22p3
ข) 1s22s22p63s23p1 ง) 1s22s22p63s23p63d14s2
2. อะลูมิเนียมทำปฏิกิริยากับสารใดต่อไปนี้
A) CaO B) HCl
B) Cl2 D) NaOH
3. โลหะใดต่อไปนี้มีฤทธิ์มากกว่า?
กว่าอลูมิเนียมเหรอ?
ก) นา ข) ลูกบาศ์ก
B) Ca D) เฟ
4. สถานะออกซิเดชันที่มีลักษณะเฉพาะที่สุดของอลูมิเนียม:
ก) +1 ข) +2
ค) +3 ง) +4
5. อะลูมิเนียมมีคุณสมบัติในปฏิกิริยาเคมีดังนี้
ก) ตัวออกซิไดซ์ B) สารประกอบเฉื่อย
C) ตัวรีดิวซ์ D) ตัวออกซิไดซ์และรีดิวซ์
6. ในอุตสาหกรรมมีการผลิตอลูมิเนียม:
A) การใช้โลหะโซเดียมเป็นตัวรีดิวซ์
B) อิเล็กโทรไลซิสของอลูมิเนียมออกไซด์ละลาย
C) ใช้คาร์บอนมอนอกไซด์ (P) เป็นตัวรีดิวซ์
D) อิเล็กโทรไลซิสของสารละลายเกลืออลูมิเนียม

วันที่___________ ชั้นเรียน_______
หัวเรื่อง : อลูมิเนียม. ตำแหน่งของอะลูมิเนียมในตารางธาตุและโครงสร้างของอะตอม อยู่ในธรรมชาติ สมบัติทางกายภาพและเคมีของอะลูมิเนียมวัตถุประสงค์ของบทเรียน:
พิจารณาการกระจายตัวของอะลูมิเนียมในธรรมชาติ คุณสมบัติทางกายภาพและเคมี ตลอดจนคุณสมบัติของสารประกอบที่เกิดขึ้น
ความคืบหน้า
1. เวลาจัดงานบทเรียน. 2. ศึกษาเนื้อหาใหม่ อลูมิเนียมกลุ่มย่อยหลักสาม กลุ่ม ตารางธาตุประกอบด้วยโบรอน (B) อลูมิเนียม (A l) แกลเลียม (Ga) อินเดียม (In) และแทลเลียม (T l) ดังที่เห็นได้จากข้อมูลข้างต้น องค์ประกอบทั้งหมดเหล่านี้ถูกค้นพบในศตวรรษที่สิบเก้า การค้นพบโลหะของกลุ่มย่อยหลัก สาม กลุ่ม| 1806 | พ.ศ. 2368 | พ.ศ. 2418 | พ.ศ. 2406 | พ.ศ. 2404 |
| ก. ลุสซัก | จี.เอช. เออร์สเตด | แอล. เดอ บัวส์โบดรัน | เอฟ. ไรช์ | ว. ครูกส์ |
| แอล. เทนาร์ด | (เดนมาร์ก) | (ฝรั่งเศส) | ไอ.ริกเตอร์ | (อังกฤษ) |
| (ฝรั่งเศส) | (เยอรมนี) |
| รัฐตื่นเต้น 1 วินาที 2 2 วินาที 2 2 หน้า 6 3 วินาที 1 3 หน้า 2 |
| อัล 2 โอ 3 | คอรันดัม |
| ทับทิม |
|
| ไพลิน |
ฉัน . ปฏิกิริยากับสารธรรมดา เมื่ออยู่ที่อุณหภูมิห้อง อลูมิเนียมจะทำปฏิกิริยากับฮาโลเจนทั้งหมดอย่างแข็งขันและเกิดเป็นเฮไลด์ เมื่อถูกความร้อน มันจะทำปฏิกิริยากับซัลเฟอร์ (200 °C) ไนโตรเจน (800 °C) ฟอสฟอรัส (500 °C) และคาร์บอน (2000 °C) โดยมีไอโอดีนเมื่อมีตัวเร่งปฏิกิริยา - น้ำ: 2A l + 3 S = A l 2 S 3 (อลูมิเนียมซัลไฟด์) 2A ลิตร + N 2 = 2A lN (อะลูมิเนียมไนไตรด์)อัล + P = อัล P (อลูมิเนียมฟอสไฟด์) 4A l + 3C = A l 4 C 3 (อลูมิเนียมคาร์ไบด์) 2 อัล + 3 ฉัน 2 = 2 A lI 3 (อะลูมิเนียมไอโอไดด์)สารประกอบทั้งหมดนี้ถูกไฮโดรไลซ์อย่างสมบูรณ์เพื่อสร้างอะลูมิเนียมไฮดรอกไซด์ และตามด้วยไฮโดรเจนซัลไฟด์ แอมโมเนีย ฟอสฟีน และมีเทน: อัล 2 ส 3 + 6ชม 2 O = 2อัล(OH) 3 + 3 ชม 2 สอัล 4 ค 3 +12ชม 2 O = 4อัล(OH) 3 +3ช 4 ในรูปของขี้กบหรือผงจะเผาไหม้อย่างสดใสในอากาศแล้วปล่อยออกมา จำนวนมากความร้อน: 4A ลิตร + 3 O 2 = 2A l 2 O 3 + 1676 กิโลจูล
ครั้งที่สอง. ปฏิกิริยากับสารที่ซับซ้อน ปฏิสัมพันธ์กับน้ำ : 2 อัล + 6 H 2 O = 2 อัล (OH) 3 + 3 H 2 ไม่มีฟิล์มออกไซด์ ปฏิกิริยากับโลหะออกไซด์: อะลูมิเนียมเป็นตัวรีดิวซ์ที่ดี เนื่องจากเป็นโลหะชนิดหนึ่งที่มีฤทธิ์ โดยจัดอยู่ในกลุ่มกิจกรรมรองจากโลหะอัลคาไลน์เอิร์ธ นั่นเป็นเหตุผลคืนโลหะจากออกไซด์ . ปฏิกิริยาอะลูมิเนียมเทอร์โมมิเตอร์นี้ใช้ในการผลิตโลหะหายากบริสุทธิ์ เช่น ทังสเตน วาเนเดียม เป็นต้น 3 เฟ 3 O 4 + 8 อัล = 4 อัล 2 O 3 + 9 เฟ + Q เทอร์ไมต์ผสม Fe 3 โอ 4 และอัล (ผง) – ใช้ในการเชื่อมเทอร์ไมต์ด้วย ค r 2 O 3 + 2A l = 2C r + A l 2 O 3 ปฏิกิริยากับกรด : ด้วยสารละลายกรดซัลฟิวริก: 2 Al + 3 H 2 SO 4 = อัล 2 (SO 4 ) 3 + 3 H 2 ไม่ทำปฏิกิริยากับกำมะถันเข้มข้นและไนโตรเจน (passivates) ที่เย็นจัด ดังนั้นกรดไนตริกจึงถูกขนส่งในถังอลูมิเนียม เมื่อถูกความร้อน อลูมิเนียมสามารถลดกรดเหล่านี้ได้โดยไม่ปล่อยไฮโดรเจนออกมา: 2A l + 6H 2 SO 4 (conc) = A l 2 (SO 4 ) 3 + 3 SO 2 + 6H 2 O, A l + 6H NO 3 (conc) = A l (NO 3 ) 3 + 3 NO 2 + 3H 2 โอ ปฏิสัมพันธ์กับด่าง . 2 อัล + 2 NaOH + 6 H 2 O = 2 นา อัล(OH) 4 + 3 H 2 นา[ก ล(เขา) 4 ] – โซเดียมเตตระไฮดรอกซีอะลูมิเนต ตามคำแนะนำของนักเคมี กอร์บอฟ ในช่วงสงครามรัสเซีย-ญี่ปุ่น ปฏิกิริยานี้ถูกใช้เพื่อผลิตไฮโดรเจนสำหรับลูกโป่ง ด้วยสารละลายเกลือ: 2 อัล + 3 CuSO 4 = อัล 2 (SO 4 ) 3 + 3 CuSO หากพื้นผิวอลูมิเนียมถูด้วยเกลือปรอท จะเกิดปฏิกิริยาต่อไปนี้: 2 อัล + 3 ปรอท 2 = 2 AlCl 3 + 3 ปรอทปรอทที่ปล่อยออกมาจะละลายอะลูมิเนียมจนเกิดเป็นอะมัลกัม 5. การใช้อะลูมิเนียมและสารประกอบอะลูมิเนียม
คุณสมบัติทางกายภาพและเคมีของอะลูมิเนียมทำให้มีการใช้เทคโนโลยีอย่างแพร่หลายอุตสาหกรรมการบินเป็นผู้บริโภคอะลูมิเนียมรายใหญ่ : 2/3 ของเครื่องบินประกอบด้วยอลูมิเนียมและโลหะผสม เครื่องบินเหล็กจะหนักเกินไปและสามารถบรรทุกผู้โดยสารได้น้อยกว่ามากนั่นเป็นเหตุผลว่าทำไมอะลูมิเนียมจึงถูกเรียกว่าโลหะมีปีก สายเคเบิลและสายไฟทำจากอลูมิเนียม : ที่มีค่าการนำไฟฟ้าเท่ากัน มวลของมันจะน้อยกว่าผลิตภัณฑ์ทองแดงที่เกี่ยวข้อง 2 เท่าเมื่อพิจารณาถึงความทนทานต่อการกัดกร่อนของอะลูมิเนียมแล้วก็คือผลิตชิ้นส่วนเครื่องจักรและภาชนะบรรจุกรดไนตริก . ผงอลูมิเนียมเป็นพื้นฐานสำหรับการผลิตสีเงินเพื่อปกป้องผลิตภัณฑ์เหล็กจากการกัดกร่อน และเพื่อสะท้อนรังสีความร้อน สีดังกล่าวจึงถูกนำมาใช้เพื่อปกปิดถังเก็บน้ำมันและชุดนักผจญเพลิงอลูมิเนียมออกไซด์ใช้ในการผลิตอลูมิเนียมและเป็นวัสดุทนไฟอะลูมิเนียมไฮดรอกไซด์เป็นส่วนประกอบหลักของยา Maalox และ Almagel ที่รู้จักกันดีซึ่งช่วยลดความเป็นกรดของน้ำย่อย เกลืออลูมิเนียมมีไฮโดรไลซ์สูง คุณสมบัตินี้ใช้ในกระบวนการทำน้ำให้บริสุทธิ์ เติมอะลูมิเนียมซัลเฟตและปูนขาวจำนวนเล็กน้อยลงในน้ำเพื่อทำให้บริสุทธิ์เพื่อทำให้กรดที่เกิดขึ้นเป็นกลาง เป็นผลให้เกิดการตกตะกอนของอะลูมิเนียมไฮดรอกไซด์จำนวนมากซึ่งเมื่อตกตะกอนจะพาอนุภาคแขวนลอยของความขุ่นและแบคทีเรียไปด้วยดังนั้นอะลูมิเนียมซัลเฟตจึงเป็นสารตกตะกอน6. การผลิตอะลูมิเนียม 1) วิธีการผลิตอะลูมิเนียมที่ทันสมัยและคุ้มค่าถูกคิดค้นโดย American Hall และ Héroux ชาวฝรั่งเศสในปี 1886 โดยเกี่ยวข้องกับการอิเล็กโทรลิซิสของสารละลายอะลูมิเนียมออกไซด์ในไครโอไลท์หลอมเหลว ไครโอไลท์หลอมเหลว Na 3 AlF 6 ละลาย Al 2 O 3 น้ำละลายน้ำตาลอย่างไร อิเล็กโทรไลซิสของ “สารละลาย” ของอะลูมิเนียมออกไซด์ในไครโอไลท์หลอมเหลวเกิดขึ้นราวกับว่าไครโอไลท์เป็นเพียงตัวทำละลาย และอะลูมิเนียมออกไซด์คืออิเล็กโทรไลต์กระแสไฟฟ้า 2Al 2 O 3 → 4Al + 3O 2 ในภาษาอังกฤษ "สารานุกรมสำหรับเด็กชายและเด็กหญิง" บทความเกี่ยวกับอะลูมิเนียมเริ่มต้นด้วยคำต่อไปนี้: "เมื่อวันที่ 23 กุมภาพันธ์ พ.ศ. 2429 ยุคโลหะใหม่เริ่มขึ้นในประวัติศาสตร์ของอารยธรรม - ยุคของอะลูมิเนียม ในวันนี้ ชาร์ลส ฮอลล์ นักเคมีวัย 22 ปี เดินเข้าไปในห้องทดลองของครูคนแรกพร้อมกับลูกบอลอะลูมิเนียมสีขาวเงินจำนวนหนึ่งอยู่ในมือ พร้อมข่าวว่าเขาได้พบวิธีทำโลหะในราคาถูกและ ในปริมาณมาก” ดังนั้นฮอลล์จึงกลายเป็นผู้ก่อตั้งชาวอเมริกัน อุตสาหกรรมอลูมิเนียมและแองโกล-แซ็กซอน วีรบุรุษของชาติในฐานะบุคคลที่สร้างธุรกิจอันยิ่งใหญ่จากวิทยาศาสตร์ 2) 2อัล 2 โอ 3 + 3 C = 4 อัล + 3 CO 2 สิ่งนี้น่าสนใจ:
- โลหะอะลูมิเนียมถูกแยกออกครั้งแรกในปี พ.ศ. 2368 โดยนักฟิสิกส์ชาวเดนมาร์ก ฮันส์ คริสเตียน เออร์สเตด โดยการส่งก๊าซคลอรีนผ่านชั้นอะลูมิเนียมออกไซด์ร้อนผสมกับถ่านหิน อะลูมิเนียมคลอไรด์ที่แยกได้ของ Oersted โดยไม่มีความชื้นแม้แต่น้อย ในการคืนสภาพโลหะอะลูมิเนียม เออร์สเตดจำเป็นต้องบำบัดอะลูมิเนียมคลอไรด์ด้วยโพแทสเซียมอะมัลกัม 2 ปีต่อมา ฟรีดริช โวลเลอร์ นักเคมีชาวเยอรมัน เขาปรับปรุงวิธีการโดยแทนที่โพแทสเซียมอะมัลกัมด้วยโพแทสเซียมบริสุทธิ์
ในศตวรรษที่ 18 และ 19 อลูมิเนียมเป็นโลหะหลักสำหรับทำเครื่องประดับ ในปีพ.ศ. 2432 D.I. Mendeleev ในลอนดอนได้รับของขวัญอันมีค่าสำหรับบริการของเขาในการพัฒนาเคมี - เครื่องชั่งที่ทำจากทองคำและอะลูมิเนียม
ในปี ค.ศ. 1855 นักวิทยาศาสตร์ชาวฝรั่งเศส Saint-Clair Deville ได้พัฒนาวิธีการเพื่อให้ได้มา โลหะอลูมิเนียมในระดับทางเทคนิค แต่วิธีการนี้มีราคาแพงมาก เดวิลล์ได้รับการอุปถัมภ์เป็นพิเศษจากนโปเลียนที่ 3 จักรพรรดิแห่งฝรั่งเศส เพื่อเป็นการแสดงถึงความทุ่มเทและความกตัญญู Deville ได้สร้างสรรค์เครื่องสั่นที่แกะสลักอย่างวิจิตรงดงามให้กับลูกชายของนโปเลียน ซึ่งเป็น "ผลิตภัณฑ์อุปโภคบริโภค" ชิ้นแรกที่ทำจากอะลูมิเนียม นโปเลียนตั้งใจที่จะสวมเสื้อเกราะอะลูมิเนียมให้กับยามของเขา แต่ราคากลับกลายเป็นว่าห้ามปราม ตอนนั้นอลูมิเนียม 1 กิโลกรัมราคา 1,000 มาร์ก เช่น แพงกว่าเงินถึง 5 เท่า หลังจากการประดิษฐ์กระบวนการอิเล็กโทรไลต์เท่านั้น อลูมิเนียมจึงมีมูลค่าเทียบเท่ากับโลหะธรรมดา
คุณรู้หรือไม่ว่าอลูมิเนียมเมื่อเข้าสู่ร่างกายมนุษย์ทำให้เกิดความผิดปกติ? ระบบประสาท. เมื่อมีมากเกินไป ระบบเผาผลาญจะหยุดชะงัก และสารป้องกันได้แก่ วิตามินซี แคลเซียม และสารประกอบสังกะสี
เมื่ออลูมิเนียมเผาไหม้ในออกซิเจนและฟลูออรีน ความร้อนจำนวนมากจะถูกปล่อยออกมา ดังนั้นจึงใช้เป็นสารเติมแต่งให้กับเชื้อเพลิงจรวด จรวดดาวเสาร์เผาไหม้ผงอลูมิเนียม 36 ตันระหว่างการบิน แนวคิดในการใช้โลหะเป็นส่วนประกอบของเชื้อเพลิงจรวดถูกเสนอครั้งแรกโดย F. A. Zander
คิด! เหตุใดจึงไม่สามารถเกิดปฏิกิริยานี้ในสารละลายที่เป็นน้ำได้ №2. เติมสมการปฏิกิริยาเคมีให้สมบูรณ์:
อัล + H 2 SO 4 (สารละลาย) ->
อัล + CuCl 2 ->
อัล + HNO 3 (กระชับ) - t ->
อัล + NaOH + H 2 O -> ไม่ 3. แก้ไขปัญหา:
โลหะผสมอลูมิเนียม-ทองแดงสัมผัสกับสารละลายโซเดียมไฮดรอกไซด์เข้มข้นที่มากเกินไปขณะให้ความร้อน ปล่อยก๊าซ (n.o.) จำนวน 2.24 ลิตร คำนวณองค์ประกอบเปอร์เซ็นต์ของโลหะผสมหากมวลรวมของมันคือ 10 กรัม?4. การบ้าน ป.42 เช่น 1-11. ปัญหา 1-3 ในหน้า 131



คุณสมบัติทางกายภาพ อลูมิเนียมเป็นโลหะสีเงินสีขาว ละลายที่ 660 o C เป็นพลาสติกเนื้อดี ดึงเป็นลวดได้ง่ายและม้วนเป็นฟอยล์ มีค่าการนำไฟฟ้าและความร้อนสูงมาก รูปร่างเบาและ โลหะผสมที่ทนทาน




จากประวัติความเป็นมาของการค้นพบ ในระหว่างการค้นพบอะลูมิเนียมโลหะดังกล่าวมีราคาแพงกว่าทองคำ ชาวอังกฤษต้องการมอบของขวัญมากมายเพื่อเป็นเกียรติแก่ D.I. Mendeleev นักเคมีชาวรัสเซียผู้ยิ่งใหญ่โดยให้เกล็ดเคมีแก่เขาซึ่งถ้วยหนึ่งทำจากทองคำและอีกถ้วยเป็นอลูมิเนียม ถ้วยอลูมิเนียมมีราคาแพงกว่าถ้วยทอง ผลลัพธ์ที่ได้คือ "เงินจากดินเหนียว" ไม่เพียงแต่เป็นที่สนใจของนักวิทยาศาสตร์เท่านั้น แต่ยังรวมถึงนักอุตสาหกรรมและแม้แต่จักรพรรดิแห่งฝรั่งเศสด้วย


ทดสอบตัวเอง 1. อะตอมอะลูมิเนียมมีอิเล็กตรอนกี่ตัว? a) 1 b) 6 c) 13 d) 3 2. สถานะออกซิเดชันของอะตอมอะลูมิเนียมในสารประกอบ Al 2 O 3 a) -3 b) -2 c) +3 d)+2 3. แอมโฟเทอริกไฮดรอกไซด์ ได้แก่: a) Mg (OH) 2 b) Al(OH) 3 c) H 2 Cr 2 O 7 d) Na OH 4. การเกิดออกซิเดชันของอะลูมิเนียมในตัวกลางที่เป็นด่างทำให้เกิด... a) Al 3+ b) Al 2 O 3 c) - d) Al H 3 5. อะลูมิเนียมออกไซด์ - ... a) ของแข็ง สีขาว b) ก๊าซไม่มีสีและไม่มีกลิ่น c) ของแข็งสีแดง d) ของเหลวที่มีจุดเดือดต่ำ
 สรุป มีคุณสมบัติเช่นความเบา ความแข็งแรง ความต้านทานการกัดกร่อน ความต้านทานต่อสารเคมีที่รุนแรง - อลูมิเนียมพบการประยุกต์ใช้อย่างกว้างขวางในการบินและการขนส่งอวกาศและในหลายอุตสาหกรรม เศรษฐกิจของประเทศ. อลูมิเนียมและโลหะผสมครอบครองสถานที่พิเศษในด้านวิศวกรรมไฟฟ้า และเบื้องหลังคืออนาคตของวิทยาศาสตร์และเทคโนโลยีของเรา
สรุป มีคุณสมบัติเช่นความเบา ความแข็งแรง ความต้านทานการกัดกร่อน ความต้านทานต่อสารเคมีที่รุนแรง - อลูมิเนียมพบการประยุกต์ใช้อย่างกว้างขวางในการบินและการขนส่งอวกาศและในหลายอุตสาหกรรม เศรษฐกิจของประเทศ. อลูมิเนียมและโลหะผสมครอบครองสถานที่พิเศษในด้านวิศวกรรมไฟฟ้า และเบื้องหลังคืออนาคตของวิทยาศาสตร์และเทคโนโลยีของเรา

วัตถุประสงค์ของบทเรียน:
เกี่ยวกับการศึกษา -ศึกษาคุณสมบัติทางกายภาพและเคมีของอะลูมิเนียมและลักษณะการใช้งาน ดูลักษณะ องค์ประกอบทางเคมีอะลูมิเนียมและศึกษาโครงสร้างของอะตอม
พัฒนาการ –พัฒนาทักษะในการทำการทดลองถ่ายโอนเนื้อหาของตำราทางวิทยาศาสตร์และการศึกษาในรูปแบบของไดอะแกรม การพัฒนาทักษะการสื่อสาร ทักษะการฟัง ความสามารถในการแสดงความคิดได้อย่างถูกต้อง
เกี่ยวกับการศึกษา -พัฒนาวัฒนธรรมการทำงานด้วย สารเคมีการปฏิบัติตามกฎระเบียบด้านความปลอดภัย ปลูกฝังจิตสำนึก ความชัดเจน และองค์กรในการทำงาน
นักเรียนควรรู้:
โครงสร้างของอะตอมอะลูมิเนียม สมบัติทางกายภาพและเคมีของอะลูมิเนียม สารง่ายๆ,พื้นที่ใช้งาน.
นักเรียนควรจะสามารถ:
ระบุลักษณะของอลูมิเนียมทั้งองค์ประกอบทางเคมีและสารธรรมดา เขียนสมการปฏิกิริยาเพื่อพิสูจน์คุณสมบัติทางเคมีของอะลูมิเนียมในรูปแบบโมเลกุลและรีดอกซ์
ประเภทบทเรียน:
การเรียนรู้เนื้อหาใหม่
รูปแบบขององค์กร กิจกรรมการศึกษานักเรียน:
งานกลุ่ม, รายบุคคล, การทดลองทางเคมี.
วิธีการสอนและเทคนิค:
การสำรวจ การวิจัยบางส่วน การสาธิตการทดลองทางเคมี การทำงานเป็นกลุ่ม การตอบแบบปากเปล่าที่กระดาน งานอิสระด้วยข้อความการควบคุมซึ่งกันและกัน
อุปกรณ์การเรียน:
ตำราทางวิทยาศาสตร์และการศึกษาในหัวข้อบทเรียน มีการ์ดงาน คำถามส่วนบุคคลแผนการศึกษาเนื้อหาแต่ละกลุ่ม สสส.
คอลเลกชัน "อลูมิเนียมและสารประกอบ" อลูมิเนียมฟอยล์,กรดไฮโดรคลอริกและโซเดียมไฮดรอกไซด์,อลูมิเนียม,อุปกรณ์ห้องปฏิบัติการ
1. ช่วงเวลาขององค์กร
ครูทักทายนักเรียน
2. การอัพเดตความรู้พื้นฐาน การสื่อสารหัวข้อ วัตถุประสงค์ และโครงสร้างของบทเรียน:
กล่าวเปิดงานของอาจารย์
ด้วยตัวเองโดยการทำงานคุณจะทำทุกอย่าง
ทั้งเพื่อคนที่คุณรักและเพื่อตัวคุณเอง
และถ้าการงานไม่ประสบผลสำเร็จ
ความล้มเหลวไม่ใช่ปัญหา โปรดลองอีกครั้ง
ดี. ไอ. เมนเดเลเยฟ
เรายังคงศึกษาขนาดใหญ่และ หัวข้อสำคัญ"โลหะ". วันนี้ในบทเรียนเราจะมาทำความคุ้นเคยกับโลหะที่คุณรู้จักดีมาตั้งแต่เด็ก บทเรียนนี้ฉันต้องการที่จะเริ่มต้นด้วยตำนาน
“วันหนึ่งมีคนแปลกหน้าคนหนึ่งมาหาจักรพรรดิไทเบเรียสแห่งโรมัน เพื่อเป็นการเป็นของขวัญแก่จักรพรรดิ เขาได้นำชามที่เขาทำขึ้นมา ซึ่งทำจากโลหะแวววาวราวกับเงิน แต่มีน้ำหนักเบามาก อาจารย์บอกว่าเขาได้รับโลหะนี้มาจาก “ดินเหนียว” แต่จักรพรรดิ์เกรงว่าทองและเงินของเขาจะเสื่อมลง จึงสั่งให้ตัดศีรษะของนายออกและทำลายห้องทำงานของเขา” เรากำลังพูดถึงโลหะอะไร?
(เกี่ยวกับอลูมิเนียม)
ครู:
ดังนั้น หัวข้อบทเรียนของเราคือ “อะลูมิเนียมเป็นองค์ประกอบทางเคมีและเป็นสารเชิงเดี่ยว”
มีการกำหนดวัตถุประสงค์ของบทเรียน
แผนการศึกษาหัวข้อเป็นกลุ่ม:
- คุณสมบัติทางกายภาพของอลูมิเนียม
- คุณสมบัติทางเคมีของอลูมิเนียม
- การใช้อะลูมิเนียมและการเกิดขึ้นตามธรรมชาติ
แผนงานกลุ่ม:
ศึกษาข้อความและเน้นข้อมูลที่เกี่ยวข้องกับคำถามของคุณ
- ดำเนินงานที่เสนอให้เสร็จสิ้น
- เตรียมสุนทรพจน์ในประเด็นของคุณโดยพิจารณาจากความกระชับ ความชัดเจน และความชัดเจนของการนำเสนอ
งานกลุ่มเพื่อศึกษาเนื้อหา
เตรียมคำพูดในประเด็นของคุณ
กลุ่มที่ 1
ลักษณะของธาตุเคมีอะลูมิเนียมตามตำแหน่งใน PSHE
ออกกำลังกาย:
- อ่านข้อความ.
- กำหนดลักษณะอลูมิเนียมตามตำแหน่งใน PSHE ตามแผน:
ก) หมายเลขซีเรียล
B) มวลอะตอม
B) ช่วงเวลา (เล็ก, ใหญ่)
D) กลุ่ม (กลุ่มย่อย: หลักหรือรอง)
D) สัญลักษณ์ทางเคมี
E) โครงสร้างของอะตอม (ประจุนิวเคลียร์ จำนวนโปรตอน อิเล็กตรอน นิวตรอน สูตรอิเล็กทรอนิกส์)
ฉัน) ออกไซด์
J) สารประกอบไฮโดรเจนที่ระเหยได้
2. อภิปรายผลที่ได้รับในกลุ่มและตอบคำถาม:
- มีอิเล็กตรอนอยู่กี่ตัวในระดับภายนอกของอะตอมอะลูมิเนียม?
- อลูมิเนียมจะให้หรือรับอิเล็กตรอนเหล่านี้หรือไม่?
- ในกรณีนี้อะลูมิเนียมไอออนจะได้รับสถานะออกซิเดชันเท่าใด
- สรุป: อะลูมิเนียมจัดอยู่ในประเภทใด (โลหะหรืออโลหะ)
- เปรียบเทียบกิจกรรมของธาตุเคมีอะลูมิเนียมกับธาตุหมู่ 1 และ 2 ในช่วงเวลาเดียวกัน
- เตรียมกล่าวสุนทรพจน์ในประเด็นนี้โดยยึดหลัก เรื่องความกระชับ ความชัดเจน และความชัดเจนของการนำเสนอ
กลุ่มที่ 2.
คุณสมบัติทางกายภาพของอลูมิเนียม
ออกกำลังกาย:
- อ่านข้อความ.
- เน้นเนื้อหาที่เกี่ยวข้องกับคำถามของคุณ
- พิจารณาคอลเลกชัน "อลูมิเนียมและโลหะผสม"
- สนทนาคำถามต่อไปนี้ในกลุ่มของท่าน:
- ก) สถานะทางกายภาพ สี ความเงางาม ความหนาแน่น (เบาหรือหนัก) ความสามารถในการหลอมละลาย (ง่ายหรือทนไฟ) การนำไฟฟ้าและความร้อน พลาสติก
- b) นำเสนอข้อมูลที่ได้รับในรูปแบบของแผนภาพ
5. เตรียมคำพูดสำหรับคำถามที่นำเสนอโดยยึดตาม เรื่องความกระชับและความชัดเจนของการนำเสนอ
กลุ่มที่ 3
คุณสมบัติทางเคมีของอลูมิเนียม
ออกกำลังกาย:
- อ่านข้อความ.
- เน้นเนื้อหาที่เกี่ยวข้องกับคำถามของคุณ
- ศึกษาว่าอลูมิเนียมมีพฤติกรรมอย่างไรสัมพันธ์กับสารเชิงซ้อน?
- ดำเนินการแล็บให้เสร็จสิ้นโดยใช้คำแนะนำ
ออกกำลังกาย:
ก) ทำการทดลอง
ข) อภิปรายปรากฏการณ์ที่สังเกตได้ในกลุ่ม
C) เขียนสมการปฏิกิริยา
D) วาดข้อสรุป
5. เตรียมสุนทรพจน์ในประเด็นนี้ ขึ้นอยู่กับความกระชับ ความชัดเจน และความชัดเจนของการนำเสนอ
กลุ่มที่ 4
การประยุกต์ใช้อลูมิเนียม
ออกกำลังกาย:
- อ่านข้อความ.
- เน้นเนื้อหาที่เกี่ยวข้องกับคำถามของคุณ
- สนทนาคำถามต่อไปนี้เป็นกลุ่ม:
ก) บทบาทของอลูมิเนียมในชีวิตมนุษย์คืออะไร?
ข) การใช้อะลูมิเนียมเป็นสารธรรมดา
- เขียนแผนภาพอธิบายการใช้งานอะลูมิเนียม
- เตรียมปาฐกถาในประเด็นนี้ ขึ้นอยู่กับความกระชับ ความชัดเจน และความชัดเจนของการนำเสนอ
- รายงานกลุ่มประเด็นที่ศึกษา
แต่ละกลุ่มเมื่อทำงานทั้งหมดเสร็จแล้ว นำเสนอแผนผังของคำถามพร้อมการอภิปรายและแสดงความคิดเห็น นักเรียนจดบันทึก ถ่ายโอนไดอะแกรมที่เสนอลงในสมุดบันทึก และจากทุกกลุ่ม การวาดภาพทีละขั้นตอนจะถูกวาดขึ้น สรุปการอ้างอิงในหัวข้อของบทเรียน
ข้อสรุปในหัวข้อของบทเรียน:
ระดับพลังงานภายนอกของอะตอมอะลูมิเนียมมีอิเล็กตรอนกี่ตัว
- อะตอมอะลูมิเนียมมีสถานะออกซิเดชันแบบใด ทำไม แล้วไอออนล่ะ?
- จากการทดลองใดที่เราพิสูจน์ได้ว่าอลูมิเนียมเป็นโลหะที่มีฤทธิ์
- สารอะไรเรียกว่าแอมโฟเทริก?
- คุณสมบัติการใช้งานต่อไปนี้มีพื้นฐานมาจากอะไร?
- อลูมิเนียมพบที่ไหนในร่างกายมากที่สุด?
- เป็นไปได้ไหม เวลานานเก็บอาหารในภาชนะอลูมิเนียม?
- การบ้าน:§ 13 ถึงหน้า 60, ? 1, 4. เตรียมนำเสนอเรื่องการใช้อลูมิเนียม
- คำสุดท้ายครู.
ครูขอบคุณนักเรียนสำหรับความร่วมมือและให้คะแนนวิทยากรในกระดาน
อ้างอิง.
อลูมิเนียม.
กลุ่มย่อยหลักของกลุ่ม III ประกอบด้วยองค์ประกอบ: โบรอน, อลูมิเนียม, แกลเลียม, อินเดียม, แทลเลียม บนชั้นอิเล็กตรอนชั้นนอก อะตอมของธาตุเหล่านี้ประกอบด้วยอิเล็กตรอน 3 ตัว (…ns2np1) พวกมันคือองค์ประกอบ p ในปฏิกิริยา อะตอมของธาตุเหล่านี้คือตัวรีดิวซ์ ยกเว้นโบรอนที่ไม่ใช่โลหะซึ่งสามารถเป็นตัวออกซิไดซ์ได้ องค์ประกอบทั้งหมดของกลุ่มย่อยนี้แสดงสถานะออกซิเดชันสูงสุดที่ +3 พวกมันก่อตัว ออกไซด์ที่สูงขึ้น E2O3 และไฮดรอกไซด์ E(OH)3 ซึ่งแสดงคุณสมบัติแอมโฟเทอริก อลูมิเนียมเป็นที่สนใจมากที่สุดในกลุ่มย่อยนี้
อลูมิเนียมในรูปแบบอิสระเป็นโลหะสีขาวเงิน มีความเงางาม มีการนำความร้อนและไฟฟ้าสูง (ด้อยกว่าทองแดงในเรื่องนี้) มีน้ำหนักเบา (ความหนาแน่น 2.7 g/cm3) และในขณะเดียวกันก็เป็นโลหะที่ทนทาน เป็นโลหะอ่อนและเหนียว สามารถรีดเป็นฟอยล์หรือดึงเป็นลวดได้ ละลายที่อุณหภูมิ 6600C ที่อุณหภูมิ 6,000C อลูมิเนียมจะเปราะและสามารถบดเป็นเมล็ดหรือผงได้
อลูมิเนียมเป็นโลหะที่พื้นผิวมักถูกเคลือบด้วยฟิล์มออกไซด์ที่บางและทนทาน ในรูปแบบของขี้กบและผงจะเผาไหม้ในอากาศอย่างสดใสและปล่อยความร้อนจำนวนมาก
ที่อุณหภูมิห้องจะทำปฏิกิริยาอย่างแข็งขันกับฮาโลเจน เมื่อถูกความร้อน จะมีปฏิกิริยากับซัลเฟอร์ (2000C) ไนโตรเจน (8000C) และอโลหะอื่นๆ
อัตราส่วนของอลูมิเนียมต่อสารเชิงซ้อน:
อลูมิเนียมละลายในกรดไฮโดรคลอริกทุกความเข้มข้น:
อลูมิเนียมละลายในสารละลายอัลคาไล:
อลูมิเนียมมีบทบาททางชีววิทยาที่สำคัญในชีวิตมนุษย์ มีส่วนร่วมในการสร้างเนื้อเยื่อบุผิวและเนื้อเยื่อเกี่ยวพัน ปริมาณอลูมิเนียมในร่างกายมนุษย์ (ต่อน้ำหนักตัว 70 กิโลกรัม) คือ 61 มก. พบได้ในอวัยวะและเนื้อเยื่อทั้งหมด โดยส่วนใหญ่พบในตับ ปอด กระดูก และสมอง การบริโภคอลูมิเนียมเข้าสู่ร่างกายหลักคืออาหาร - ได้แก่ ขนมอบชา (จาก 20 - 200 มก. ต่อผลิตภัณฑ์ 100 กรัม) มันฝรั่ง - 4 มก. ต่อ 100 กรัม ผลิตภัณฑ์ หัวผักกาดสีเหลือง – 46 มก. ต่อ 100 กรัมของผลิตภัณฑ์
เมื่อปรุงอาหารและจัดเก็บอาหารในเครื่องครัวอะลูมิเนียม ปริมาณอะลูมิเนียมในอาหารจะเพิ่มขึ้นสองเท่า การเพิ่มขึ้นของปริมาณอะลูมิเนียมในเลือดทำให้เกิดการกระตุ้นระบบประสาทส่วนกลาง เมื่อมีอลูมิเนียมมากเกินไปในร่างกาย การเคลื่อนไหวของร่างกายจะบกพร่อง อาการชัก สูญเสียความจำ โรคตับและไต เมื่อปริมาณอะลูมิเนียมลดลง ระบบประสาทส่วนกลางจะถูกยับยั้ง
พื้นที่การใช้งานของอลูมิเนียมมีมากมายมาก เนื่องจากความเบาและความแข็งแรง อลูมิเนียมและโลหะผสมจึงถูกนำมาใช้ในการผลิตเครื่องบินและจรวด (อลูมิเนียมเรียกว่าโลหะมีปีก) ในการก่อสร้างเรือและรถยนต์ ในการก่อสร้าง - สำหรับการผลิตกรอบหน้าต่างและประตูจะใช้อลูมิเนียมในการผลิตสายไฟสำหรับสายไฟที่มีความเบาและการนำไฟฟ้าที่ดี การนำความร้อนและความเป็นพิษเป็นสิ่งสำคัญในการผลิตเครื่องครัวอะลูมิเนียมและฟอยล์จัดเก็บ ผลิตภัณฑ์อาหาร. ผงอลูมิเนียมเป็นพื้นฐานในการผลิตสีเงินเพื่อปกป้องผลิตภัณฑ์เหล็กจากการกัดกร่อน ความสามารถของอลูมิเนียมในการเผาไหม้ในอากาศด้วยเปลวไฟที่สว่างจ้าถูกนำมาใช้ในการเตรียมดอกไม้ไฟหลากสีสันและการผลิตดอกไม้ไฟ


