Właściwości fizyczne
Wodorotlenek sodu
Termodynamika roztworów
Δ H0 rozpuszczanie dla nieskończenie rozcieńczonego roztworu wodnego -44,45 kJ / mol.
Z roztworów wodnych w temperaturze 12,3 - 61,8 ° C krystalizuje monohydrat (syngonia rombowa), temperatura topnienia 65,1 ° C; gęstość 1,829 g/cm3; ΔH 0 przył-734,96 kJ / mol), w zakresie od -28 do -24 ° С - heptahydrat, od -24 do -17,7 ° С - pentahydrat, od -17,7 do -5,4 ° С - tetrahydrat ( modyfikacja α), od -5,4 do 12,3 °C. Rozpuszczalność w metanolu 23,6 g/l (t=28°C), w etanolu 14,7 g/l (t=28°C). NaOH 3,5H2O (temperatura topnienia 15,5°C);
Właściwości chemiczne
(ogólnie taką reakcję można przedstawić za pomocą prostego równania jonowego, reakcja przebiega z uwolnieniem ciepła (reakcja egzotermiczna): OH - + H3O + → 2H2O.)
- z tlenkami amfoterycznymi, które mają zarówno właściwości zasadowe, jak i kwasowe, oraz zdolność do reagowania z alkaliami, podobnie jak w przypadku ciał stałych po stopieniu:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O
oraz rozwiązaniami:
ZnO + 2NaOH (roztwór) + H 2 O → Na 2 (roztwór)+H2
(Otrzymany anion nazywa się jonem tetrahydroksozykanu, a sól, którą można wyizolować z roztworu, to tetrahydroksocynkian sodu. Wodorotlenek sodu wchodzi również w podobne reakcje z innymi tlenkami amfoterycznymi.)
- z tlenkami kwasowymi - z tworzeniem soli; ta właściwość jest wykorzystywana do oczyszczania emisji przemysłowych z kwaśnych gazów (na przykład: CO 2 , SO 2 i H 2 S):
2Na + + 2OH - + Cu 2+ + SO 4 2- → Cu(OH) 2 ↓+ Na 2 SO 4
Wodorotlenek sodu służy do wytrącania wodorotlenków metali. Na przykład w ten sposób otrzymuje się żelowaty wodorotlenek glinu działając z wodorotlenkiem sodu na siarczan glinu w roztwór wodny. Służy w szczególności do oczyszczania wody z drobnych zawiesin.

Hydroliza estrów
- w przypadku tłuszczów (zmydlanie) reakcja ta jest nieodwracalna, ponieważ powstały kwas z zasadą tworzy mydło i glicerynę. Gliceryna jest następnie ekstrahowana z ługów mydlanych przez odparowanie próżniowe i dodatkowe oczyszczanie destylacji otrzymanych produktów. Ta metoda wytwarzania mydła znana jest na Bliskim Wschodzie od VII wieku:
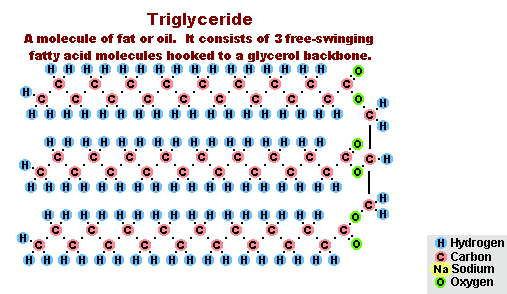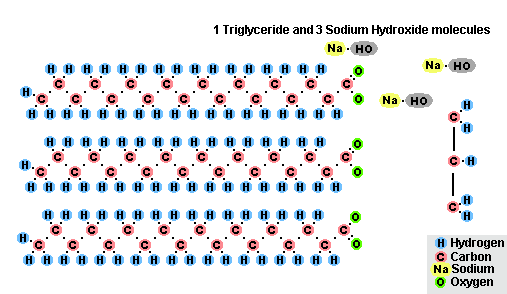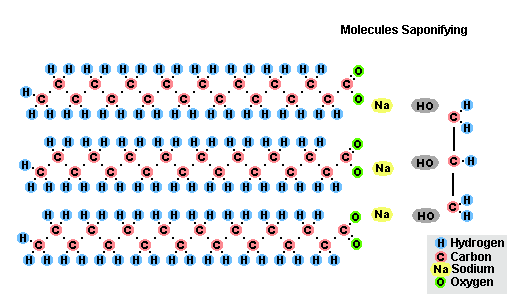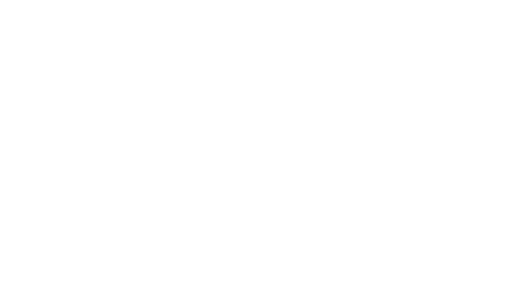
Proces zmydlania tłuszczów
W wyniku oddziaływania tłuszczów z wodorotlenkiem sodu otrzymuje się mydła stałe (są wykorzystywane do produkcji mydła w kostce), a z wodorotlenkiem potasu, stałe lub mydła w płynie w zależności od składu tłuszczu.
HO-CH2-CH2OH + 2NaOH → NaO-CH2-CH2-ONa + 2H2O
2NaCl + 2H2O \u003d H2 + Cl2 + 2NaOH,Obecnie alkaliczną zasadę i chlor wytwarza się trzema metodami elektrochemicznymi. Dwie z nich to elektroliza z katodą stałą azbestową lub polimerową (metoda produkcji membran i membran), trzecia to elektroliza katodą ciekłą (metoda produkcji rtęci). W wielu elektrochemicznych metodach produkcji najłatwiejszą i najwygodniejszą metodą jest elektroliza z katodą rtęciową, ale ta metoda powoduje znaczne szkody. środowisko w wyniku parowania i wycieku rtęci metalicznej. Metoda produkcji membran jest najbardziej wydajna, najmniej energochłonna i najbardziej przyjazna dla środowiska, ale także najbardziej kapryśna, w szczególności wymaga surowców o wyższej czystości.
Alkalia kaustyczne otrzymywane metodą elektrolizy z katodą ciekłą rtęciową są znacznie czystsze niż te otrzymywane metodą membranową. Dla niektórych branż jest to ważne. Tak więc w produkcji sztucznych włókien można stosować tylko kaustykę otrzymaną przez elektrolizę za pomocą ciekłej katody rtęciowej. W praktyce światowej stosowane są wszystkie trzy metody otrzymywania chloru i ługu, z wyraźną tendencją do wzrostu udziału elektrolizy membranowej. W Rosji około 35% całkowitej produkowanej ługu jest wytwarzane przez elektrolizę z katodą rtęciową i 65% przez elektrolizę z katodą stałą (metody membranowe i membranowe).
Wydajność procesu produkcyjnego oblicza się nie tylko wydajnością sody kaustycznej, ale również wydajnością chloru i wodoru otrzymywanych w procesie elektrolizy, stosunek chloru do wodorotlenku sodu na wyjściu wynosi 100/110, reakcja przebiega w następujące proporcje:
1,8 NaCl + 0,5 H 2 O + 2,8 MJ = 1,00 Cl 2 + 1,10 NaOH + 0,03 H 2,Główne wskaźniki różnych metod produkcji podano w tabeli:
| Indeks na 1 tonę NaOH | metoda rtęciowa | metoda membranowa | Metoda membranowa |
|---|---|---|---|
| Wydajność chloru % | 97 | 96 | 98,5 |
| Elektryczność (kWh) | 3 150 | 3 260 | 2 520 |
| Stężenie NaOH | 50 | 12 | 35 |
| Czystość chloru | 99,2 | 98 | 99,3 |
| Czystość wodoru | 99,9 | 99,9 | 99,9 |
| Udział masowy O 2 w chlorze,% | 0,1 | 1-2 | 0,3 |
| Udział masowy Cl - w NaOH, % | 0,003 | 1-1,2 | 0,005 |
Schemat technologiczny elektrolizy z katodą stałą
metoda membranowa - Wnęka ogniwa ze stałą katodą jest podzielona porowatą przegrodą - przesłoną - na przestrzeń katodową i anodową, gdzie znajdują się odpowiednio katoda i anoda ogniwa. Dlatego taki elektrolizer jest często nazywany elektrolizerem przeponowym, a metodą produkcji jest elektroliza przeponowa. Strumień nasyconego anolitu w sposób ciągły wpływa do przestrzeni anodowej celi przeponowej. W wyniku procesu elektrochemicznego na anodzie uwalniany jest chlor w wyniku rozkładu halitu, a wodór na katodzie w wyniku rozkładu wody. Chlor i wodór są usuwane z elektrolizera oddzielnie, bez mieszania:
2Cl - - 2 mi\u003d Cl 2 0, H 2 O - 2 mi− 1/2 O 2 \u003d H 2.
W tym przypadku strefa przykatodowa jest wzbogacana wodorotlenkiem sodu. Roztwór ze strefy katodowej, zwany ługiem elektrolitycznym, zawierający nierozłożony anolit i wodorotlenek sodu, jest w sposób ciągły usuwany z elektrolizera. W kolejnym etapie ług elektrolityczny jest odparowywany, a zawartość NaOH w nim dostosowana do 42-50% zgodnie z normą. Halit i siarczan sodu ze wzrastającym stężeniem osadu wodorotlenku sodu. Roztwór kaustyczny jest dekantowany z osadu i jako gotowy produkt przenoszony do magazynu lub do etapu odparowywania w celu uzyskania produktu stałego, po czym następuje topienie, płatkowanie lub granulacja. Halit krystaliczny (sól odwrócona) jest zawracany do elektrolizy, przygotowując z niego tak zwaną solankę odwróconą. Z niego, aby uniknąć gromadzenia się siarczanu w roztworach, siarczan jest ekstrahowany przed przygotowaniem solanki powrotnej. Ubytek anolitu jest kompensowany przez dodanie świeżej solanki uzyskanej w wyniku podziemnego ługowania warstw soli lub przez rozpuszczenie stałego halitu. Świeża solanka przed zmieszaniem z solanką zwrotną jest oczyszczana z zawiesin mechanicznych oraz znacznej części jonów wapnia i magnezu. Powstały chlor jest oddzielany od pary wodnej, sprężany i podawany albo do produkcji produktów zawierających chlor, albo do skraplania.
Metoda membranowa - podobny do diafragmy, ale przestrzenie anodowe i katodowe są oddzielone membraną kationowymienną. Elektroliza membranowa zapewnia najczystszą substancję żrącą.
System technologii elektroliza.Głównym etapem technologicznym jest elektroliza, głównym aparatem jest kąpiel elektrolityczna, która składa się z elektrolizera, rozkładarki i pompy rtęciowej, połączonych ze sobą komunikacją. W kąpieli elektrolitycznej pod działaniem pompy rtęciowej rtęć krąży, przechodząc przez elektrolizer i rozkładnik. Katodą elektrolizera jest strumień rtęci. Anody - grafitowe lub o niskim zużyciu. Wraz z rtęcią przez elektrolizer przepływa w sposób ciągły strumień anolitu - roztwór halitu. W wyniku elektrochemicznego rozkładu halitu na anodzie powstają jony Cl i uwalniany jest chlor:
2 Cl - - 2 mi\u003d Cl 2 0,
który jest usuwany z elektrolizera, a na katodzie rtęciowej powstaje słaby roztwór sodu w rtęci, tzw. amalgamat:
Na + + e \u003d Na 0 nNa + + nHg - = Na + HgAmalgamat w sposób ciągły przepływa z elektrolizera do rozkładnika. Rozkładnik jest również stale zasilany dobrze oczyszczoną wodą. W nim amalgamat sodu, w wyniku spontanicznego procesu elektrochemicznego, jest prawie całkowicie rozkładany przez wodę z utworzeniem rtęci, roztworu kaustycznego i wodoru:
Na + Hg + H 2 0 = NaOH + 1/2H 2 + HgOtrzymany w ten sposób roztwór kaustyczny, będący produktem handlowym, nie zawiera zanieczyszczeń halitowych, które są szkodliwe przy produkcji wiskozy. Rtęć jest prawie całkowicie uwolniona z amalgamatu sodu i zawracana do ogniwa elektrolitycznego. Wodór jest usuwany w celu oczyszczenia. Anolit opuszczający elektrolizer nasyca się świeżym halitem, wprowadzane nim zanieczyszczenia oraz wypłukiwane z anod i materiałów konstrukcyjnych są z niego usuwane i zawracane do elektrolizy. Przed ponownym nasyceniem rozpuszczony w nim chlor jest ekstrahowany z anolitu w dwu- lub trzystopniowym procesie.
Laboratoryjne metody otrzymywania
W laboratorium wodorotlenek sodu jest wytwarzany metodami chemicznymi o znaczeniu historycznym niż praktycznym.
metoda wapna Produkcja wodorotlenku sodu polega na oddziaływaniu roztworu sody z mlekiem wapiennym o temperaturze około 80 ° C. Ten proces nazywa się kaustyzacją; opisuje to reakcja:
Na 2 C0 3 + Ca (OH) 2 \u003d 2NaOH + CaC0 3W wyniku reakcji powstaje roztwór wodorotlenku sodu i osad węglanu wapnia. Węglan wapnia oddziela się od roztworu, który odparowuje się, otrzymując stopiony produkt zawierający około 92% NaOH. Stopiony NaOH wlewa się do żelaznych beczek, gdzie krzepnie.
ferrytyczny sposób opisane przez dwie reakcje:
Na 2 C0 3 + Fe 2 0 3 = Na 2 0 Fe 2 0 3 + C0 2 (1) Na 2 0 Fe 2 0 3 -f H 2 0 \u003d 2 NaOH + Fe 2 O 3 (2)(1) - proces spiekania sody kalcynowanej tlenkiem żelaza w temperaturze 1100-1200°C. W tym przypadku powstaje ferryt drobin sodowych i uwalniany jest dwutlenek węgla. Następnie placek traktuje się (ługuje) wodą zgodnie z reakcją (2); otrzymuje się roztwór wodorotlenku sodu i osad Fe 2 O 3, który po oddzieleniu z roztworu zawraca się do procesu. Roztwór zawiera około 400 g/l NaOH. Odparowuje się otrzymując produkt zawierający około 92% NaOH.
Chemiczne metody wytwarzania wodorotlenku sodu mają znaczące niedociągnięcia: skonsumowany duża liczba paliwo, powstająca soda kaustyczna jest zanieczyszczona zanieczyszczeniami, konserwacja aparatu jest pracochłonna. Obecnie metody te zostały prawie całkowicie wyparte przez elektrochemiczną metodę produkcji.
Rynek sody kaustycznej
Produkcja światowa soda kaustyczna, 2005| Producent | Wielkość produkcji, miliony ton | Udział w światowej produkcji |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Zachodnia firma chemiczna | 2.552 | 4.4 |
| Tworzywa sztuczne Formosa | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Akzo Nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Olin | 0.970 | 1.7 |
| Rosja | 1.290 | 2.24 |
| Chiny | 9.138 | 15.88 |
| Inny | 27.559 | 47,87 |
| Całkowity: | 57,541 | 100 |
TR - rtęć stała (płatkowana);
TD - membrana pełna (stopiona);
RR - roztwór rtęci;
РХ - roztwór chemiczny;
RD - rozwiązanie membranowe.
| Nazwa wskaźnika | TR OKP 21 3211 0400 | TD OKP 21 3212 0200 | RR OKP 21 3211 0100 | Х 1 klasa OKP 21 3221 0530 | Х 2 klasa OKP 21 3221 0540 | RD Najwyższa klasa OKP 21 3212 0320 | RD Pierwsza klasa OKP 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| Wygląd zewnętrzny | Skalowana masa biały kolor. Dozwolone słabe zabarwienie | Stopiona biała masa. Dozwolone słabe zabarwienie | Bezbarwna przezroczysta ciecz | Bezbarwna lub barwna ciecz. Dozwolony skrystalizowany osad | Bezbarwna lub barwna ciecz. Dozwolony skrystalizowany osad | Bezbarwna lub barwna ciecz. Dozwolony skrystalizowany osad | |
| Udział masowy wodorotlenku sodu, %, nie mniej niż | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
| Nazwa firmy | 2005 tys. ton | 2006 tys. ton | udział w 2005% | udział w 2006% |
|---|---|---|---|---|
| OJSC "Kaustik" , Sterlitamak | 239 | 249 | 20 | 20 |
| UAB „Kaustik”, Wołgograd | 210 | 216 | 18 | 18 |
| UAB „Sayanskkhimplast” | 129 | 111 | 11 | 9 |
| Usoliekhimprom LLC | 84 | 99 | 7 | 8 |
| OAO Sibur-Neftekhim | 87 | 92 | 7 | 8 |
| OAO "Khimprom", Czeboksary | 82 | 92 | 7 | 8 |
| VOAO „Khimprom”, Wołgograd | 87 | 90 | 7 | 7 |
| ZAO Ilimchimprom | 70 | 84 | 6 | 7 |
| JSC "KChKhK" | 81 | 79 | 7 | 6 |
| NAK "AZOT" | 73 | 61 | 6 | 5 |
| OAO Chimprom, Kemerowo | 42 | 44 | 4 | 4 |
| Całkowity: | 1184 | 1217 | 100 | 100 |
| Nazwa firmy | 2005 ton | 2006 ton | udział w 2005% | udział w 2006% |
|---|---|---|---|---|
| UAB „Kaustik”, Wołgograd | 67504 | 63510 | 62 | 60 |
| OJSC "Kaustik" , Sterlitamak | 34105 | 34761 | 31 | 33 |
| OAO Sibur-Neftekhim | 1279 | 833 | 1 | 1 |
| VOAO „Khimprom”, Wołgograd | 5768 | 7115 | 5 | 7 |
| Całkowity: | 108565 | 106219 | 100 | 100 |
Aplikacja
Biodiesel

Dorsz Lutefisk podczas obchodów Dnia Konstytucji Norwegii

niemiecki bajgiel
Wodorotlenek sodu stosowane w wielu różnych branżach i na potrzeby domowe:
- Kaustyka jest używana w przemysł celulozowo-papierniczy do delignifikacji (reakcja Krafta) celulozy, w produkcji papieru, tektury, włókien sztucznych, płyt pilśniowych.,
- Do zmydlania tłuszczów produkcja mydła, szamponu i innych detergentów. W czasach starożytnych popiół dodawano do wody podczas mycia i najwyraźniej gospodynie domowe zauważyły, że jeśli popiół zawiera tłuszcz, który dostał się do paleniska podczas gotowania, naczynia były dobrze umyte. Pierwsza wzmianka o zawodzie mydlarza (saponariusa) nastąpiła około 385 r. n.e. mi. Teodor Priscianus. Arabowie wytwarzają mydło z olejów i sody od VII wieku, dziś mydła są robione w taki sam sposób jak 10 wieków temu.
- W przemysł chemiczny- do neutralizacji kwasów i tlenków kwasowych, jako odczynnik lub ze skafandrami winylowymi lub gumowanymi.
MAC wodorotlenku sodu w powietrzu wynosi 0,5 mg/m³.
Literatura
- Ogólna technologia chemiczna. Wyd. I.P. Mukhlenova. Podręcznik do specjalności chemiczno-technologicznych uczelni wyższych. - M.: Szkoła podyplomowa.
- Podstawy chemia ogólna, t. 3, B. W. Niekrasow. - M.: Chemia, 1970.
- Ogólna technologia chemiczna. Furmer I. E., Zaitsev V. N. - M .: Szkoła Wyższa, 1978.
- Rozporządzenie Ministerstwa Zdrowia Federacji Rosyjskiej z dnia 28 marca 2003 r. N 126 „O zatwierdzeniu Listy szkodliwych czynników produkcji, pod wpływem których w celach profilaktycznych zaleca się stosowanie mleka lub innych równoważnych produktów spożywczych. "
- Dekret Głównego Państwowego Lekarza Sanitarnego Federacji Rosyjskiej z dnia 4 kwietnia 2003 r. N 32 „W sprawie uchwalenia przepisów sanitarnych dla organizacji ruch towarowy w transporcie kolejowym. SP 2.5.1250-03".
- Ustawa federalna nr 116-FZ z dnia 21 lipca 1997 r. „O bezpieczeństwie przemysłowym niebezpiecznych zakładów produkcyjnych” (zmieniona 18 grudnia 2006 r.).
- Rozporządzenie Ministerstwa Zasobów Naturalnych Federacji Rosyjskiej z 2 grudnia 2002 r. N 786 „W sprawie zatwierdzenia federalnego katalogu klasyfikacyjnego odpadów” (zmienione i uzupełnione 30 lipca 2003 r.).
- Dekret Państwowego Komitetu Pracy ZSRR z dnia 25 października 1974 r. N 298 / P-22 „O zatwierdzeniu wykazu branż, warsztatów, zawodów i stanowisk o szkodliwych warunkach pracy, w których praca daje prawo do dodatkowego urlopu i krótszej pracy dzień” (zmieniony 29 maja 1991 r.).
- Dekret Ministerstwa Pracy Rosji z dnia 22 lipca 1999 r. N 26 „O zatwierdzeniu standardowych norm branżowych dotyczących bezpłatnego wydawania odzieży specjalnej, obuwia specjalnego i innego sprzętu ochrony osobistej dla pracowników w przemyśle chemicznym”.
- Dekret Głównego Państwowego Lekarza Sanitarnego Federacji Rosyjskiej z dnia 30 maja 2003 r. N 116 W sprawie wejścia w życie GN 2.1.6. powietrze atmosferyczne obszary zaludnione” (zmienione 3 listopada 2005 r.). Ilustrowany słownik encyklopedyczny
WODOROTLENEK SODU- (soda kaustyczna, soda kaustyczna, kaustyczna) NaOH bezbarwna stała substancja krystaliczna, gęstość 2130 kg m. t = 320 ° C; kiedy rozpuszcza się w wodzie, uwalniana jest duża ilość ciepła; destrukcyjny wpływ na skórę, tkaniny, papier, niebezpieczny ... ... Wielka Encyklopedia Politechniczna
- (soda kaustyczna, soda kaustyczna), NaOH, mocna zasada (zasady). Bezbarwne kryształy (produkt techniczny biała nieprzezroczysta masa). Higroskopijny, rozpuszczalny w wodzie, wydzielający dużą ilość ciepła. Otrzymywany przez elektrolizę roztworu ... słownik encyklopedyczny
wodorotlenek sodu- natrio hidroksidas statusas T sritis chemija formulė NaOH atitikmenys: engl. soda kaustyczna; wodorotlenek sodu. żrący; soda kaustyczna; ług sodowy; wodorotlenek sodu ryšiai: sinonimas – natrio šarmas sinonimas – kaustinė soda … Chemijos terminų aiskinamasis žodynas
- (soda kaustyczna, soda kaustyczna), NaOH, mocna zasada (zasady). Najlepsze. kryształy (produkt techniczny biała nieprzezroczysta masa). Higroskopijny, rozpuszczalny w wodzie, wydzielający dużą ilość ciepła. Otrzymywany przez elektrolizę roztworu chlorku sodu ... Naturalna nauka. słownik encyklopedyczny
- (soda kaustyczna) NaOH, bezbarwny kryształy; romb odporny do 299 ° C. modyfikacja (a = 0,33994 nm, c = 1,1377 nm), powyżej 299 o z jednoskośnym; DH0 przemiany polimorficznej 5,85 kJ/mol; poseł. 323 °С, t.w. 1403°С; obcisły 2,02 g/cm3; … Encyklopedia chemiczna
Soda kaustyczna, kaustyczna, bezbarwna krystaliczna NaOH. masa, gęstość 2130 kg/m3, t Pl 320 °C, rozpuszczalność w wodzie 52,2% (przy 20 °C). Silna baza, destrukcyjny wpływ na tkankę zwierzęcą; szczególnie niebezpieczne jest dostanie się kropli N. g. do oczu ... ... Duży encyklopedyczny słownik politechniczny
Silne zasady, szeroko stosowane jako środek czyszczący. Kontakt wodorotlenku sodu z powierzchnią skóry powoduje poważne oparzenia chemiczne; w takim przypadku konieczne jest natychmiastowe umycie dotkniętego obszaru skóry dużą ilością ... ... terminy medyczne
WODOROTLENEK SODU, SODA KAUSTYCZNA- (soda kaustyczna) silna zasada, szeroko stosowana jako środek myjący. Kontakt wodorotlenku sodu z powierzchnią skóry powoduje poważne oparzenia chemiczne; w takim przypadku konieczne jest natychmiastowe umycie dotkniętego obszaru skóry ... ... Słownik w medycynie
Zarówno wodorotlenek sodu, jak i inne zasady, nazwa „zasada żrąca” wynika z właściwości korodowania skóry, papieru, szkła i powodowania poważnych oparzeń. Do XVII wieku alkalicznymi (fr. alkalia) były również nazywane węglanami sodu i potasu. U francuskiego naukowca A. L. Duhamela du Monceau najpierw wyróżniono te substancje: wodorotlenek sodu nazwano sodą kaustyczną, węglan sodu nazwano sodą kalcynowaną (według zakładu Salsola Soda, z którego popiół został wyekstrahowany), a węglan potasu nazwano potasem . Obecnie soda jest powszechnie nazywana sole sodowe kwas węglowy. w języku angielskim i Francuski słowo sód oznacza sód, potas - potas.
Właściwości fizyczne
Wodorotlenek sodu
Termodynamika roztworów
Δ H0 rozpuszczanie dla nieskończenie rozcieńczonego roztworu wodnego -44,45 kJ / mol.
Z roztworów wodnych w temperaturze 12,3 - 61,8 ° C krystalizuje monohydrat (syngonia rombowa), temperatura topnienia 65,1 ° C; gęstość 1,829 g/cm3; ΔH 0 przył-734,96 kJ / mol), w zakresie od -28 do -24 ° С - heptahydrat, od -24 do -17,7 ° С - pentahydrat, od -17,7 do -5,4 ° С - tetrahydrat ( modyfikacja α), od -5,4 do 12,3 °C. Rozpuszczalność w metanolu 23,6 g/l (t=28°C), w etanolu 14,7 g/l (t=28°C). NaOH 3,5H2O (temperatura topnienia 15,5°C);
Właściwości chemiczne
(ogólnie taką reakcję można przedstawić za pomocą prostego równania jonowego, reakcja przebiega z uwolnieniem ciepła (reakcja egzotermiczna): OH - + H3O + → 2H2O.)
- z tlenkami amfoterycznymi, które mają zarówno właściwości zasadowe, jak i kwasowe, oraz zdolność do reagowania z alkaliami, podobnie jak w przypadku ciał stałych po stopieniu:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O
oraz rozwiązaniami:
ZnO + 2NaOH (roztwór) + H 2 O → Na 2 (roztwór)+H2
(Otrzymany anion nazywa się jonem tetrahydroksozykanu, a sól, którą można wyizolować z roztworu, to tetrahydroksocynkian sodu. Wodorotlenek sodu wchodzi również w podobne reakcje z innymi tlenkami amfoterycznymi.)
- z tlenkami kwasowymi - z tworzeniem soli; ta właściwość jest wykorzystywana do oczyszczania emisji przemysłowych z kwaśnych gazów (na przykład: CO 2 , SO 2 i H 2 S):
2Na + + 2OH - + Cu 2+ + SO 4 2- → Cu(OH) 2 ↓+ Na 2 SO 4
Wodorotlenek sodu służy do wytrącania wodorotlenków metali. Na przykład, żelopodobny wodorotlenek glinu otrzymuje się w ten sposób działając z wodorotlenkiem sodu na siarczan glinu w roztworze wodnym. Służy w szczególności do oczyszczania wody z drobnych zawiesin.

Hydroliza estrów
- w przypadku tłuszczów (zmydlanie) reakcja ta jest nieodwracalna, ponieważ powstały kwas z zasadą tworzy mydło i glicerynę. Gliceryna jest następnie ekstrahowana z ługów mydlanych przez odparowanie próżniowe i dodatkowe oczyszczanie destylacji otrzymanych produktów. Ta metoda wytwarzania mydła znana jest na Bliskim Wschodzie od VII wieku:

Proces zmydlania tłuszczów
W wyniku oddziaływania tłuszczów z wodorotlenkiem sodu otrzymuje się mydła stałe (są wykorzystywane do produkcji mydła w kostce), a z wodorotlenkiem potasu mydła stałe lub płynne, w zależności od składu tłuszczu.
HO-CH2-CH2OH + 2NaOH → NaO-CH2-CH2-ONa + 2H2O
2NaCl + 2H2O \u003d H2 + Cl2 + 2NaOH,Obecnie alkaliczną zasadę i chlor wytwarza się trzema metodami elektrochemicznymi. Dwie z nich to elektroliza z katodą stałą azbestową lub polimerową (metoda produkcji membran i membran), trzecia to elektroliza katodą ciekłą (metoda produkcji rtęci). Wśród elektrochemicznych metod produkcji elektroliza katodowa rtęciowa jest najłatwiejszą i najwygodniejszą metodą, ale metoda ta powoduje znaczne szkody środowiskowe w wyniku parowania i wycieku rtęci metalicznej. Metoda produkcji membran jest najbardziej wydajna, najmniej energochłonna i najbardziej przyjazna dla środowiska, ale także najbardziej kapryśna, w szczególności wymaga surowców o wyższej czystości.
Alkalia kaustyczne otrzymywane metodą elektrolizy z katodą ciekłą rtęciową są znacznie czystsze niż te otrzymywane metodą membranową. Dla niektórych branż jest to ważne. Tak więc w produkcji sztucznych włókien można stosować tylko kaustykę otrzymaną przez elektrolizę za pomocą ciekłej katody rtęciowej. W praktyce światowej stosowane są wszystkie trzy metody otrzymywania chloru i ługu, z wyraźną tendencją do wzrostu udziału elektrolizy membranowej. W Rosji około 35% całkowitej produkowanej ługu jest wytwarzane przez elektrolizę z katodą rtęciową i 65% przez elektrolizę z katodą stałą (metody membranowe i membranowe).
Wydajność procesu produkcyjnego oblicza się nie tylko wydajnością sody kaustycznej, ale również wydajnością chloru i wodoru otrzymywanych w procesie elektrolizy, stosunek chloru do wodorotlenku sodu na wyjściu wynosi 100/110, reakcja przebiega w następujące proporcje:
1,8 NaCl + 0,5 H 2 O + 2,8 MJ = 1,00 Cl 2 + 1,10 NaOH + 0,03 H 2,Główne wskaźniki różnych metod produkcji podano w tabeli:
| Indeks na 1 tonę NaOH | metoda rtęciowa | metoda membranowa | Metoda membranowa |
|---|---|---|---|
| Wydajność chloru % | 97 | 96 | 98,5 |
| Elektryczność (kWh) | 3 150 | 3 260 | 2 520 |
| Stężenie NaOH | 50 | 12 | 35 |
| Czystość chloru | 99,2 | 98 | 99,3 |
| Czystość wodoru | 99,9 | 99,9 | 99,9 |
| Udział masowy O 2 w chlorze,% | 0,1 | 1-2 | 0,3 |
| Udział masowy Cl - w NaOH, % | 0,003 | 1-1,2 | 0,005 |
Schemat technologiczny elektrolizy z katodą stałą
metoda membranowa - Wnęka ogniwa ze stałą katodą jest podzielona porowatą przegrodą - przesłoną - na przestrzeń katodową i anodową, gdzie znajdują się odpowiednio katoda i anoda ogniwa. Dlatego taki elektrolizer jest często nazywany elektrolizerem przeponowym, a metodą produkcji jest elektroliza przeponowa. Strumień nasyconego anolitu w sposób ciągły wpływa do przestrzeni anodowej celi przeponowej. W wyniku procesu elektrochemicznego na anodzie uwalniany jest chlor w wyniku rozkładu halitu, a wodór na katodzie w wyniku rozkładu wody. Chlor i wodór są usuwane z elektrolizera oddzielnie, bez mieszania:
2Cl - - 2 mi\u003d Cl 2 0, H 2 O - 2 mi− 1/2 O 2 \u003d H 2.
W tym przypadku strefa przykatodowa jest wzbogacana wodorotlenkiem sodu. Roztwór ze strefy katodowej, zwany ługiem elektrolitycznym, zawierający nierozłożony anolit i wodorotlenek sodu, jest w sposób ciągły usuwany z elektrolizera. W kolejnym etapie ług elektrolityczny jest odparowywany, a zawartość NaOH w nim dostosowana do 42-50% zgodnie z normą. Halit i siarczan sodu ze wzrastającym stężeniem osadu wodorotlenku sodu. Roztwór kaustyczny jest dekantowany z osadu i jako gotowy produkt przenoszony do magazynu lub do etapu odparowywania w celu uzyskania produktu stałego, po czym następuje topienie, płatkowanie lub granulacja. Halit krystaliczny (sól odwrócona) jest zawracany do elektrolizy, przygotowując z niego tak zwaną solankę odwróconą. Z niego, aby uniknąć gromadzenia się siarczanu w roztworach, siarczan jest ekstrahowany przed przygotowaniem solanki powrotnej. Ubytek anolitu jest kompensowany przez dodanie świeżej solanki uzyskanej w wyniku podziemnego ługowania warstw soli lub przez rozpuszczenie stałego halitu. Świeża solanka przed zmieszaniem z solanką zwrotną jest oczyszczana z zawiesin mechanicznych oraz znacznej części jonów wapnia i magnezu. Powstały chlor jest oddzielany od pary wodnej, sprężany i podawany albo do produkcji produktów zawierających chlor, albo do skraplania.
Metoda membranowa - podobny do diafragmy, ale przestrzenie anodowe i katodowe są oddzielone membraną kationowymienną. Elektroliza membranowa zapewnia najczystszą substancję żrącą.
System technologii elektroliza.Głównym etapem technologicznym jest elektroliza, głównym aparatem jest kąpiel elektrolityczna, która składa się z elektrolizera, rozkładarki i pompy rtęciowej, połączonych ze sobą komunikacją. W kąpieli elektrolitycznej pod działaniem pompy rtęciowej rtęć krąży, przechodząc przez elektrolizer i rozkładnik. Katodą elektrolizera jest strumień rtęci. Anody - grafitowe lub o niskim zużyciu. Wraz z rtęcią przez elektrolizer przepływa w sposób ciągły strumień anolitu - roztwór halitu. W wyniku elektrochemicznego rozkładu halitu na anodzie powstają jony Cl i uwalniany jest chlor:
2 Cl - - 2 mi\u003d Cl 2 0,
który jest usuwany z elektrolizera, a na katodzie rtęciowej powstaje słaby roztwór sodu w rtęci, tzw. amalgamat:
Na + + e \u003d Na 0 nNa + + nHg - = Na + HgAmalgamat w sposób ciągły przepływa z elektrolizera do rozkładnika. Rozkładnik jest również stale zasilany dobrze oczyszczoną wodą. W nim amalgamat sodu, w wyniku spontanicznego procesu elektrochemicznego, jest prawie całkowicie rozkładany przez wodę z utworzeniem rtęci, roztworu kaustycznego i wodoru:
Na + Hg + H 2 0 = NaOH + 1/2H 2 + HgOtrzymany w ten sposób roztwór kaustyczny, będący produktem handlowym, nie zawiera zanieczyszczeń halitowych, które są szkodliwe przy produkcji wiskozy. Rtęć jest prawie całkowicie uwolniona z amalgamatu sodu i zawracana do ogniwa elektrolitycznego. Wodór jest usuwany w celu oczyszczenia. Anolit opuszczający elektrolizer nasyca się świeżym halitem, wprowadzane nim zanieczyszczenia oraz wypłukiwane z anod i materiałów konstrukcyjnych są z niego usuwane i zawracane do elektrolizy. Przed ponownym nasyceniem rozpuszczony w nim chlor jest ekstrahowany z anolitu w dwu- lub trzystopniowym procesie.
Laboratoryjne metody otrzymywania
W laboratorium wodorotlenek sodu jest wytwarzany metodami chemicznymi o znaczeniu historycznym niż praktycznym.
metoda wapna Produkcja wodorotlenku sodu polega na oddziaływaniu roztworu sody z mlekiem wapiennym o temperaturze około 80 ° C. Ten proces nazywa się kaustyzacją; opisuje to reakcja:
Na 2 C0 3 + Ca (OH) 2 \u003d 2NaOH + CaC0 3W wyniku reakcji powstaje roztwór wodorotlenku sodu i osad węglanu wapnia. Węglan wapnia oddziela się od roztworu, który odparowuje się, otrzymując stopiony produkt zawierający około 92% NaOH. Stopiony NaOH wlewa się do żelaznych beczek, gdzie krzepnie.
ferrytyczny sposób opisane przez dwie reakcje:
Na 2 C0 3 + Fe 2 0 3 = Na 2 0 Fe 2 0 3 + C0 2 (1) Na 2 0 Fe 2 0 3 -f H 2 0 \u003d 2 NaOH + Fe 2 O 3 (2)(1) - proces spiekania sody kalcynowanej tlenkiem żelaza w temperaturze 1100-1200°C. W tym przypadku powstaje ferryt drobin sodowych i uwalniany jest dwutlenek węgla. Następnie placek traktuje się (ługuje) wodą zgodnie z reakcją (2); otrzymuje się roztwór wodorotlenku sodu i osad Fe 2 O 3, który po oddzieleniu z roztworu zawraca się do procesu. Roztwór zawiera około 400 g/l NaOH. Odparowuje się otrzymując produkt zawierający około 92% NaOH.
Chemiczne metody wytwarzania wodorotlenku sodu mają znaczne wady: zużywa się dużą ilość paliwa, powstająca soda kaustyczna jest zanieczyszczona zanieczyszczeniami, a konserwacja aparatu jest pracochłonna. Obecnie metody te zostały prawie całkowicie wyparte przez elektrochemiczną metodę produkcji.
Rynek sody kaustycznej
Światowa produkcja sody kaustycznej, 2005| Producent | Wielkość produkcji, miliony ton | Udział w światowej produkcji |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Zachodnia firma chemiczna | 2.552 | 4.4 |
| Tworzywa sztuczne Formosa | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Akzo Nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Olin | 0.970 | 1.7 |
| Rosja | 1.290 | 2.24 |
| Chiny | 9.138 | 15.88 |
| Inny | 27.559 | 47,87 |
| Całkowity: | 57,541 | 100 |
TR - rtęć stała (płatkowana);
TD - membrana pełna (stopiona);
RR - roztwór rtęci;
РХ - roztwór chemiczny;
RD - rozwiązanie membranowe.
| Nazwa wskaźnika | TR OKP 21 3211 0400 | TD OKP 21 3212 0200 | RR OKP 21 3211 0100 | Х 1 klasa OKP 21 3221 0530 | Х 2 klasa OKP 21 3221 0540 | RD Najwyższa klasa OKP 21 3212 0320 | RD Pierwsza klasa OKP 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| Wygląd zewnętrzny | Skalowana masa koloru białego. Dozwolone słabe zabarwienie | Stopiona biała masa. Dozwolone słabe zabarwienie | Bezbarwna przezroczysta ciecz | Bezbarwna lub barwna ciecz. Dozwolony skrystalizowany osad | Bezbarwna lub barwna ciecz. Dozwolony skrystalizowany osad | Bezbarwna lub barwna ciecz. Dozwolony skrystalizowany osad | |
| Udział masowy wodorotlenku sodu, %, nie mniej niż | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
| Nazwa firmy | 2005 tys. ton | 2006 tys. ton | udział w 2005% | udział w 2006% |
|---|---|---|---|---|
| OJSC "Kaustik" , Sterlitamak | 239 | 249 | 20 | 20 |
| UAB „Kaustik”, Wołgograd | 210 | 216 | 18 | 18 |
| UAB „Sayanskkhimplast” | 129 | 111 | 11 | 9 |
| Usoliekhimprom LLC | 84 | 99 | 7 | 8 |
| OAO Sibur-Neftekhim | 87 | 92 | 7 | 8 |
| OAO "Khimprom", Czeboksary | 82 | 92 | 7 | 8 |
| VOAO „Khimprom”, Wołgograd | 87 | 90 | 7 | 7 |
| ZAO Ilimchimprom | 70 | 84 | 6 | 7 |
| JSC "KChKhK" | 81 | 79 | 7 | 6 |
| NAK "AZOT" | 73 | 61 | 6 | 5 |
| OAO Chimprom, Kemerowo | 42 | 44 | 4 | 4 |
| Całkowity: | 1184 | 1217 | 100 | 100 |
| Nazwa firmy | 2005 ton | 2006 ton | udział w 2005% | udział w 2006% |
|---|---|---|---|---|
| UAB „Kaustik”, Wołgograd | 67504 | 63510 | 62 | 60 |
| OJSC "Kaustik" , Sterlitamak | 34105 | 34761 | 31 | 33 |
| OAO Sibur-Neftekhim | 1279 | 833 | 1 | 1 |
| VOAO „Khimprom”, Wołgograd | 5768 | 7115 | 5 | 7 |
| Całkowity: | 108565 | 106219 | 100 | 100 |
Aplikacja
Biodiesel

Dorsz Lutefisk podczas obchodów Dnia Konstytucji Norwegii
Sód należy do metali alkalicznych i znajduje się w głównej podgrupie pierwszej grupy PSE im. DI. Mendelejew. Na zewnętrznym poziomie energetycznym jego atomu, w stosunkowo dużej odległości od jądra, znajduje się jeden elektron, z którego atomy metali alkalicznych dość łatwo oddają, zamieniając się w pojedynczo naładowane kationy; wyjaśnia to bardzo wysoką aktywność chemiczną metali alkalicznych.
Powszechną metodą otrzymywania zasad jest elektroliza stopów ich soli (zwykle chlorków).
Sód jako metal alkaliczny charakteryzuje się niską twardością, niską gęstością i niską temperaturą topnienia.
Sód, wchodząc w interakcje z tlenem, tworzy głównie nadtlenek sodu
2 Na + O2 (Na2O2)
Redukując nadtlenki i ponadtlenki nadmiarem metalu alkalicznego można otrzymać tlenek:
Na2O2 + 2 Na 2 Na2O
Tlenek sodu reaguje z wodą tworząc wodorotlenek: Na2O + H2O → 2 NaOH.
Nadtlenki są całkowicie hydrolizowane przez wodę z wytworzeniem alkaliów: Na2O2 + 2 HOH → 2 NaOH + H2O2
Jak wszystkie metale alkaliczne, sód jest silnym środkiem redukującym i oddziałuje silnie z wieloma niemetalami (z wyjątkiem azotu, jodu, węgla, gazów szlachetnych):
Wyjątkowo słabo reaguje z azotem w wyładowaniu jarzeniowym, tworząc bardzo nietrwałą substancję - azotek sodu.
Reaguje z rozcieńczonymi kwasami jak normalny metal:
Dzięki stężonym kwasom utleniającym uwalniane są produkty redukcji:
Wodorotlenek sodu NaOH (zasada kaustyczna) jest silną zasadą chemiczną. W przemyśle wodorotlenek sodu wytwarzany jest metodami chemicznymi i elektrochemicznymi.
Chemiczne metody otrzymywania:
Wapno, które polega na oddziaływaniu roztworu sody z mlekiem wapiennym w temperaturze około 80 ° C. Ten proces nazywa się kaustacją; przechodzi przez reakcję:
Na 2 CO 3 + Ca (OH) 2 → 2NaOH + CaCO 3
Ferrytyczny, który obejmuje dwa etapy:
Na 2 CO 3 + Fe 2 O 3 → 2NaFeO 2 + CO 2
2NaFeO2 + xH2O \u003d 2NaOH + Fe2O3 * xH2O
Elektrochemicznie wodorotlenek sodu otrzymuje się przez elektrolizę roztworów halitu (minerału składającego się głównie z soli kuchennej NaCl) z jednoczesną produkcją wodoru i chloru. Proces ten można przedstawić w postaci sumarycznej formuły:
2NaCl + 2H 2 O ± 2e- → H 2 + Cl 2 + 2NaOH
Wodorotlenek sodu reaguje:
1) neutralizacja:
NaOH + HCl → NaCl + H2O
2) wymiana z solami w roztworze:
2NaOH + CuSO 4 → Cu (OH) 2 ↓ + Na 2 SO 4
3) reaguje z niemetalami
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O
4) reaguje z metalami
2Al + 2NaOH + 6H2O → 3H2 + 2Na
Wodorotlenek sodu jest szeroko stosowany w różnych gałęziach przemysłu, na przykład w roztwarzaniu, do zmydlania tłuszczów w produkcji mydła; jako katalizator reakcji chemicznych, przy produkcji oleju napędowego itp.
Węglan sodu wytwarzany jest albo w postaci Na 2 CO 3 (soda kalcynowana), albo w postaci krystalicznego Na 2 CO 3 * 10H 2 O (soda krystaliczna) lub w postaci wodorowęglanu NaHCO 3 (soda pitna).
Soda jest najczęściej wytwarzana metodą chlorku amoniaku, w oparciu o reakcję:
NaCl + NH4HCO3 (NaHCO3 + NH4Cl)
Wiele gałęzi przemysłu zużywa węglany sodu: chemiczny, mydlany, celulozowo-papierniczy, tekstylny, spożywczy itp.


