2.1.1 Положение алюминия в периодической системе и строение его атома
Алюминий находится в главной подгруппе III группы. Схема расположения по энергетическим уровням следующая:
3 Al 2e - , 8e - ,3e -
Так как у атомов алюминия на внешнем уровне 3 электрона, то алюминий в соединениях проявляет степень окисления 4-3.
К такому же выводу приходим, руководствуясь представлениями о характере движения электронов в атомах и расположении их не только по энергетическим уровням, но и по подуровням. В атоме алюминия легко происходит распаривание 3s 2 -электронов и один электрон переходит 3p-орбиталь:
Электронное строение атома алюминия
Чистый алюминий - серебристо-белый металл со многими желательными характеристиками. Он легкий, нетоксичный, немагнитный и непаркирующий. Он легко формируется, обрабатывается и отливается. Чистый алюминий является мягким и не имеет прочности, но сплавы с небольшим количеством меди, магния, кремния, марганца и других элементов обладают очень полезными свойствами. Алюминий является обильным элементом земной коры, но он не обнаружен в природе. Процесс Байера используется для очистки алюминия от бокситов, алюминиевой руды.
В результате получаются три неспаренных электрона. Ответьте на вопрос 1 (с. 138 ).
2.1.2 Нахождение алюминия в природе, его получение и свойства
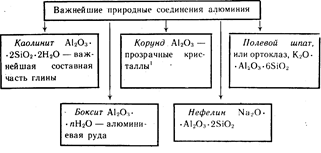
Алюминий - третий по распространенности элемент в земной коре. Он встречается только в соединениях. Важнейшие из них указаны на схеме 19.
Алюминий: историческая информация
Древние греки и римляне использовали квасцы в медицине в качестве вяжущего и в процессах крашения. Нагрев полученной алюминиевой амальгамы при пониженном давлении заставил ртуть отвариться, оставив нечистый образец алюминиевого металла.
Алюминий вокруг нас Подробнее
Алюминиевые соединения токсичны для большинства растений и несколько токсичны для млекопитающих. Алюминий связан с болезнью Альцгеймера.Физические свойства Подробнее
Алюминиевый металл не является свободным элементом, однако алюминий является обильным элементом в земной коре. Наиболее важной рудой является боксит.
Алюминий: свойства орбиты Читать дальше
Алюминиевые атомы имеют 13 электронов и структура оболочки. Алюминий не может быть изготовлен в лаборатории, поскольку он так легко доступен в коммерческих целях.Окрашенные кристаллы Al 2 O 3 красного цвета - рубины, синего цвета – сапфиры.
Получение
Немецкий химик Ф. Вёлер в 1827 г. получил алюминий при нагревании хлорида-алюминия со щелочными металлами калием или натрием без доступа воздуха.
AlCl 3 +3K 3KCl + Al
Для промышленного получения алюминия эти методы экономически невыгодны, поэтому был разработан электрохимический метод получения алюминия из бокситов.
Алюминий добывается в огромных масштабах в виде бокситов. Чтобы изолировать чистый алюминий, эти примеси должны быть удалены из боксита. Это включает обработку раствором гидроксида натрия, что приводит к раствору алюмината натрия и силиката натрия. Железо остается твердым. Следующим этапом является образование чистого алюминия. Электролиз необходим, так как алюминий является электроположительным.
Изотопы алюминия Читать дальше
Кажется, что в наши дни наиболее распространен электролиз горячего оксида в углеродистой футерованной стальной ячейке, действующей как катод с углеродными анодами. Древние греки и римляне использовали квасцы в качестве вяжущего и как протрава в крашении. Криолит, природная руда, найденная в Гренландии, больше не используется в промышленном производстве, а заменена искусственной смесью фторида натрия, алюминия и кальция. Теперь алюминий можно получать из глины, но в настоящее время этот процесс экономически невозможен.
Алюминий - серебристо-белый металл, легкий (r = 2,7 г/cм 3), плавится при 660 °С. Он очень пластичен, легко вытягивается в проволоку и прокаливается в листы и фольгу. По электрической проводимости алюминий уступает лишь серебру и меди (она составляет 2/3 от электрической проводимости меди).
Лабораторная работа: «Химические свойства алюминия»
Алюминий - самый распространенный металл, который можно найти в земной коре, но он никогда не встречается в природе. Помимо минералов, упомянутых выше, он также встречается в гранитах и во многих других распространенных минералах. Чистый алюминий, серебристо-белый металл, обладает многими желательными характеристиками. Он легкий, он немагнитный и непаркирующий, занимает второе место среди металлов в масштабе ковкости, а шестой по пластичности.
Физические свойства алюминия. Лабораторная работа
Он широко используется для кухонной утвари, наружной отделки здания и в тысячах промышленных применений, где необходим сильный, легкий, легко строительный материал. Хотя его удельная электропроводность составляет всего около 60% от удельной электропроводности меди, она используется в линиях электропередачи из-за ее небольшого веса. Чистый алюминий является мягким и не имеет прочности, но легированный небольшими количествами меди, магния, кремния, марганца или других элементов придает множество полезных свойств.
В электрохимическом ряду напряжения алюминий помещается за самыми активными металлами. Однако из повседневного опыта известно, что на алюминиевые изделия (посуду и т. д.) не действует ни кислород, ни вода даже при температуре ее кипения. На алюминий не действует также концентрированная холодная азотная кислота. Это объясняется наличием на поверхности алюминия тонкой оксидной пленки, которая предохраняет его от дальнейшего окисления. Если поверхность алюминия потереть солью ртути, то происходит реакция:
Г) электролизом раствора солей алюминия
Эти сплавы имеют жизненно важное значение для строительства современных самолетов и ракет. Алюминий, испарившийся в вакууме, образует высокоотражающее покрытие как для видимого, так и для лучистого тепла. Эти покрытия вскоре образуют тонкий слой защитного оксида и не ухудшаются, как и серебряные покрытия. Они используются для покрытия зеркал телескопа и изготовления декоративной бумаги, упаковок и игрушек.
Соединениями, имеющими наибольшее значение, являются оксид алюминия, сульфат и растворимый сульфат с калием. Оксид, оксид алюминия, встречается естественным образом как рубин, сапфир, корунд и наждак, и используется в производстве стекла и огнеупоров. Синтетический рубин и сапфир используются в лазерах для получения когерентного света.
2А1 + 3HgCl 2 ® 2А1С1 3 + 3Hg
Выделившаяся ртуть растворяет алюминий, и образуется его сплав с ртутью - амальгама алюминия. На амальгамированной поверхности пленка не удерживается, поэтому алюминий реагирует с водой при обычных условиях (рис. 46):
2А1 + 6НОН ® 2А1(ОН) 3 ¯ + 3Н 2
При повышенной температуре алюминий реагирует со многими неметаллами и сложными веществами без амальгамирования:
Необходима система, которая позволила бы ее классифицировать и классифицировать. Однако он не может распространять эту функцию на все известные элементы. Когда атомные массы известных элементов были представлены в кремнеземе, когда «шаг нити» составлял шестнадцать единиц, он заметил, что элементы со схожими свойствами падают на одну и ту же вертикаль. К сожалению, он ввел в свою классификацию ионы и другие неэлементарные вещества.
Сортируя элементы в порядке возрастания атомной массы, восьмой элемент имел свойства, подобные первому, девятый - второй и т.д. однако его закон не был полностью строгим, и совпадение предсказанных свойств не всегда происходило. Однако рецензент занял два года, чтобы завершить свою работу, и таблица Мейера не была опубликована до сегодняшнего дня, они оба разделяют честь открыть периодический закон.

Применение
Алюминий применяют для производства различных сплавов. Наибольшее распространение имеют дюралюмины, содержащие медь и магний, и силумины - сплавы алюминия с кремнием. Основные преимущества этих сплавов-легкость и высокая прочность. Упомянутые сплавы широко используют в авиа-, авто-, судо- и приборостроении, в ракетной технике и в строительстве. В виде чистого металла алюминий идет на изготовление электрических проводов и различной химической аппаратуры.
В таблице Менделеева представлены три аспекта, которые отличают его от таковых у его предшественников, таких как Ньюлендс или Де Чанкуруа: периоды не всегда имеют одинаковую длину, но они уходят; в некоторых местах он меняет порядок атомных масс, так что элементы со схожими свойствами совпадают в одной и той же вертикали; и оставляет зазоры в таблице, отверстия, соответствующие атомным элементам, не обнаруженным в свое время.
Публикуя свою таблицу, Менделеев сделал предсказания о свойствах элементов, которые будут занимать дыры, оставшиеся под алюминием, элемент, который он называет эка-алюминием, под бором, который он назвал эка-боро и под кремнием, который он назвал экой кремний.
Алюминий используют также для алитирования, т. е. насыщения поверхностей стальных и чугунных изделий алюминием с целью защиты их от коррозии.
На практике часто используют термит (смесь оксида Fе 3 O 4 с порошком алюминия). Если эту смесь поджечь (с помощью магниевой ленты), то происходит бурная реакция с выделением большого количества теплоты:
Были обнаружены благородные газы, элементы, свойства которых не совпадали ни с одной из групп в периодической таблице. Добавление новой колонки, в которой подходят благородные газы, было последним подтверждением гения предложения Менделеева. Текущая периодическая таблица мало отличается от предложенной Менделеевым, хотя были предложены другие формы распределения элементов с трехмерными, треугольными или спиральными формами.
Современное представление периодической таблицы содержит элементы в семи строках, каждый из которых называется периодами. Не все периоды одинаковы, но количество элементов увеличивается при движении вниз в таблице. Первый период состоит только из двух элементов: водорода и гелия. Второй и третий периоды состоят из восьми элементов. Четвертый и пятый период имеют восемнадцать элементов. Шестой и седьмой периоды состоят из тридцати двух элементов, но некоторые из их элементов представлены в нижней части периодической таблицы, чтобы избежать чрезмерной длины этого.
8Al + 3Fe 3 O 4 ® 4Al 2 O 3 + 9Fe
Этот процесс используют при так называемой термитной сварке, а также для получения некоторых металлов в свободном виде.
Ответьте на вопросы 2-6 (с. 138). Решите задачи 1 – 2 (с. 138).
2.1.3 Важнейшие соединения алюминия
Оксид алюминия
Аl 2 О 3 можно получить следующими способами:
1. Непосредственным сжиганием порошка металлического алюминия (вдуванием порошка алюминия в пламя горелки):
Хотя в седьмом периоде в таблице тридцать два места, элементы, соответствующие всем из них, не были обнаружены, оставив некоторые пробелы. Столбцы периодической таблицы называются группами. Есть восемнадцать групп, которые, подобно периодам, имеют различное количество элементов. Элементы той же группы имеют сходные химические свойства.
Эти десять групп называются основными группами. Они имеют четыре группы элементов от 3 до 12, десять групп, образованных так называемыми элементами перехода. Элементы, написанные отдельно, иногда считаются включенными в группу 3 и составляют элементы внутреннего перехода.
4Al + 3O 2 ® 2А1 2 O 3
2. Путем превращения по приведенной ниже схеме:
Оксид алюминия - твердое, тугоплавкое (темп. пл. 2050 °С) вещество белого цвета.
По химическим свойствам это амфотерный оксид (I, § 37). Реагирует с кислотами, проявляет свойства основных оксидов:
А1 2 O 3 + 6НС1 2А1С1 3 + 3Н 2 O
Al 2 O 3 + 6H + +6С1 - 2Al 3+ + 6С1 - + 3Н 2 O
А1 2 O 3 + 6Н + 2A1 3+ + 3Н 2 O
Классификация и электронная конфигурация
Порядок элементов в периодической таблице определяется атомным номером, числом протонов ядра или электронов нейтрального атома. Форма и распределение элементов в таблице фиксируются электронной конфигурацией элементов. Чтобы узнать положение элемента в периодической таблице, необходимо определить его электронную конфигурацию: количество электронных энергетических уровней элемента совпадает с периодом, в котором оно расположено. Орбитала с наибольшей энергией, занятой, т.е. последней, в которой электроны были размещены при выполнении электронной конфигурации, укажет группу, к которой принадлежит элемент.
Оксид алюминия реагирует со щелочами и проявляет свойства кислотных оксидов. Причем при сплавлении образуются соли метаалюминиевой кислоты НА1O 2 , т. е. мета-алюминаты:
Al 2 O 3 + 2NaOH 2NaA10 2 + H 2 0
В присутствии воды реакция протекает иначе:
А1 2 О 3 + 2NаОН + Н 2 O ® 2
Это объясняется тем, что в водном растворе алюминат натрия NaA1O 2 присоединяет одну или две молекулы воды, что можно изобразить так:
Это связано с тем, что элементы той же группы имеют схожие химические свойства, а химические свойства определяются электронами, которые образуют валентный слой электрона: последний слой электронов в электронной конфигурации. Химические свойства элементов зависят от их электронной конфигурации, на том, как их электроны расположены в их последних слоях, так как это с ними электроны, с которыми они взаимодействуют с другими атомами или молекулами. А так как порядок в периодической таблице также связан с электронной конфигурацией, то, как правило, элементы групп имеют сходные химические свойства.
а) NaA1O 2 -Н 2 О, или NaH 2 A1O 3 ; б) NaA1O 2 -2H 2 O, или NaAl(OH) 4 .
Гидроксид алюминия
Гидроксид алюминия А1(ОН) 3 получают при взаимодействии раствора щелочи с растворами солей алюминия (раствор щелочи нельзя брать в избытке):
АlCl 3 + NaOН ® Al(OH) 3 ¯ + 3NaCl
A1 3+ + 3Cl - + 3Na + + 3OH - ® Al(OH) 3 ¯ + 3Na + + 3С1 -
Аl 3+ + 3ОН - ® А1(ОН) 3 ¯
Если белую желеобразную массу гидроксида алюминия выделить из раствора и высушить, то получается белое кристаллическое вещество, практически не растворяющееся в воде.
Это так называемые периодические свойства. Наиболее важными периодическими свойствами являются. Рекомендуемое использование Рабочий урок. Задача с комментариями исходит из публикации. Издание является детищем исследовательского проекта, финансируемого Центральной экзаменационной комиссией и Европейским социальным фондом.
Получение алюминия в промышленности
Положение семи элементов указано на диаграмме периодической таблицы. Какие из следующих атрибутов демонстрируют каждый из этих элементов? Этот элемент хорошо проводит тепло и электроэнергию.
- Этот элемент лежит во втором периоде периодической таблицы.
- Атом этого элемента имеет 6 валентных электронов.
- Этот элемент не металлический.
- Атомное ядро этого элемента имеет 10 протонов.
- Этот элемент всегда моновалентный.
Гидроксид алюминия (как и его оксид) обладает амфотерными свойствами. Подобно всем основаниям гидроксид алюминия реагирует с кислотами. При сплавлении гидроксида алюминия со щелочами образуются метаалюминаты, а в водных растворах - гидраты метаалюминатов:
А1(OH) 3 + NaOH NaА1O 2 + 2Н 2 O
А1(OH) 3 + NaOH ® NaH 2 А1O 3 + Н 2 O
Соли алюминия получают в основном при взаимодействии металлического алюминия с кислотами. По физическим свойствам это твердые кристаллические вещества, хорошо растворимые в воде. Химические свойства солей алюминия аналогичны свойствам других солей (, с. 98-99). Так как соли алюминия образованы слабым основанием и сильной кислотой, то они в водных растворах подвергаются гидролизу (с. 18).
Студент приобретает и обрабатывает информацию из различных источников, используя информационные и коммуникационные технологии. Студент читает из периодической таблицы основную информацию об элементах. 2 Внутреннее построение материи. Студент определяет количество протонов, электронов и нейтронов в атоме данного элемента при атомарном и массовом числах. Внутренняя структура вещества.
Студент объясняет сходство свойств элементов, хранящихся в той же группе периодической таблицы, и структуры атомов и числа валентных электронов. 10 Внутренняя структура материи. Открытие атомной структуры и систематизация знаний о химических элементах являются одними из важнейших достижений науки. Периодическая таблица для химика является отправной точкой для обсуждения вопроса. Он организует эту область знаний и вносит ее в строгие рамки. Вы можете рисковать тем, что информация о чтении из периодической таблицы, их анализ и интерпретация являются одними из самых важных навыков, которые студент должен брать с курса химии.
Ответьте на вопросы 7-10 (с. 138). Решите задачу 3 (с. 138 ).
Генетическая связь между алюминием и его важнейшими соединениями (схема 20).
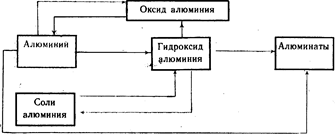
Таким образом, из вышеизложенного материала можно сделать вывод, что в школьной программе на изучение данной темы отводится очень мало часов, и, кроме этого, практически нет сведений об экологических аспектах этой темы.
Азот образует ряд оксидов, формально отвечающих всем возможным степеням окисления от +1 до +5: N 2 O, NО, N 2 O 3 , NO 2 , N 2 O 5 , однако всего два из них – оксид азота(II) и оксид азота(IV) – не только устойчивы при обычных условиях, но и активно задействованы в природном и промышленном круговоротах азота.
2.2.1 Некоторые соединения азота и их свойства 1.2.1.1. Оксиды азота
N 2 +1 O – оксид азота(I), закись азота, «веселящий» газ, несолеобразующий оксид. Получают N 2 O разложением аммиачной селитры:
N 2 O имеет слабый приятный запах и сладковатый вкус. С кислородом, водой, растворами кислот и щелочей не реагирует. Разлагается на элементы при температуре выше 500 °С, иными словами, достаточно устойчив.
Строение: у кислорода 2 неспаренных электрона, у азота 3 – образуется двойная связь и один неспаренный электрон в остатке. Можно предположить, что молекулы NO будут спариваться и образовывать димерную молекулу ONNO. Строение молекулы: линейная молекула О=N=N, в которой центральный атом N четырехвалентен. Он образует две двойные связи: одну – с кислородом по типичной схеме создания ковалентной связи (два электрона азота, два электрона кислорода), другую – с атомом азота (который два из своих трех неспаренных электронов спаривает и образует за счет этого пустую орбиталь), одна из связей ковалентная, вторая донорно-акцепторная (рис. 1).
Установка для получения оксида азота(I) состоит из штативов, пробирки, пробки с газоотводной трубкой, кристаллизатора, цилиндра и спиртовки (рис. 2). В пробирку помещают NH 4 NO 3 , закрывают пробкой с газоотводной трубкой и нагревают. Газ собирают в цилиндр, наполненный водой.

Рис. 1. Молекула оксида азота(I) – N 2 O
Оксид N 2 O разлагается при нагревании:
Оксид N 2 O реагирует с водородом:
N +2 O – оксид азота(II), несолеобразующий оксид. Получают NO реакцией меди с кислотой HNO 3 (разб.) (рис. 3).
Кристаллическая решетка молекулярная; молекула легкая, слабополярная (электроотрицательность кислорода немного выше, чем у азота). Можно предположить, что температуры плавления и кипения будут низкими, но выше, чем у азота, т. к. полярность молекулы дает возможность подключать электростатические силы притяжения к просто межмолекулярным силам. Образование димера тоже способствует повышению температуры кипения. Строение молекулы позволяет предположить и невысокую растворимость в воде. Оксид азота(II) не имеет ни цвета, ни запаха.
Для получения оксида азота(II) в пробирку помещают немного медных стружек и заливают разбавленную азотную кислоту. Пробирку закрывают пробкой с газоотводной трубкой и укрепляют в штативе. Конец газоотводной трубки опускают в кристаллизатор с водой и далее в цилиндр (рис. 3). При нагревании выделяется NO. NO легко окисляется кислородом воздуха, т. е. действует как восстановитель:
![]()
В реакции с сернистым газом оксид NO – окислитель:
![]()
N +2 2 O 3 – оксид азота(III), азотистый ангидрид (ему соответствуют азотистая кислота HNО 2 и соли нитриты); это кислотный оксид, для него характерны все свойства кислотных оксидов. Получают оксид N 2 O 3 по реакции:
NO 2 + NO N 2 O 3 .
N +4 O 2 – оксид азота(IV), диоксид азота, бурый газ (токсичен).
Рассмотрим электроны азота в молекуле NО. Это неспаренный электрон, свободная пара электронов и еще два электрона на связи с кислородом – всего пять. А у атома кислорода, «выходящего на связь», шесть электронов на четырех орбиталях. Если расположить их по два, то одна орбиталь останется свободной. Именно ее и занимает пара электронов атома азота (рис. 4, 5).
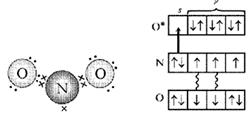
Рис. 4. Схема электронного строения молекулы NO 2 (первый вариант). (Точками обозначены электроны атомов О, крестиками – электроны атома N)
Рис. 5. Схема электронного строения молекулы NO 2 (второй вариант). (Звездочкой обозначен возбужденный атом O, стрелкой – донорно-акцепторная связь.
Раз пара электронов, находящаяся на s-орбитали, «пошла на связь», она просто обязана подвергнуться гибридизации. Возникает вопрос: какой тип гибридизации использует атом? Ответ: три электронные орбитали азота находятся в состоянии sp 2 -гибридизации. Молекула NO 2 угловая, угол 134° (угол больше 120° потому, что 1 электрон отталкивает от себя электроны связи слабее, чем пара электронов) (рис. 6, 7).
Кристаллическая решетка молекулярная, однако, поскольку сама молекула тяжелее NO и склонность к димеризации у нее заметно выше, то плавиться и кипеть это вещество должно при заметно более высоких температурах. Температура кипения составляет 21 °С, поэтому при обычных условиях – 20 °С и 760 мм рт. ст. – оксид азота(IV) жидкий.
Оксид азота (IV) в воде растворяется, одновременно с ней реагируя, и получается при этом сразу две кислоты.


Рис. 6. Молекула NO 2 - вид «сверху»
Рис. 7. Молекула NO 2 – вид «сбоку», со стороны донорно-акцепторной связи. (Второй атом кислорода не виден за орбиталями атома азота. Заштрихованные кружки – это гибридизованные орбитали атомов, направленные к читателю.)
Оксид азота(IV) имеет и характерный резкий запах, и рыжевато-бурый цвет, оттенки которого отличаются друг от друга в зависимости от концентрации. Именно за этот цвет выбросы оксидов азота в атмосферу называют «лисьими хвостами» .
Реакции оксида NO 2
1) С водой:
2NO 2 + Н 2 O = НNO 3 + НNO 2 .
2) С щелочами:
2NO 2 + 2NaOH = NаNО 3 + NаNО 2 + Н 2 O.
3) Димеризация при охлаждении:
![]()
При температуре –11 °С равновесие полностью смещено вправо, а при +140 °С – целиком влево.
N +5 2 O 5 – оксид азота(V), азотный ангидрид, кислотный оксид, сильный окислитель. Оксид N 2 O 5 легко разлагается:
2N 2 O 5 = 4NO 2 + O 2 .
2.2.1.2 Азотная кислота
Из гидроксидов азота мы рассмотрим наиболее многотоннажный – азотную кислоту.
Молекула азотной кислоты полярна (из-за разной электроотрицательности кислорода и водорода, потому что азот как бы скрыт внутри молекулы) и асимметрична. Все три имеющихся в ней угла между связями азота с кислородом разные. Формальная степень окисления азота высшая (+5). Но при этом только 4 связи у атома азота с другими атомами – валентность азота равна 4.
Строение молекулы легче понять, если рассмотреть процесс ее получения. Азотная кислота получается при реакции оксида азота(IV) с водой (в присутствии кислорода): две молекулы NO 2 одновременно «атакуют» молекулу воды своими неспаренными электронами, в результате связь водорода с кислородом разрывается не как обычно (пара электронов у кислорода и «голый протон»), а одной молекуле NO 2 достается водород со своим электроном, другой – радикал ОН (рис. 8). Образуются две кислоты: обе кислоты сильные, обе быстро отдают свой протон ближайшим молекулам воды и остаются в итоге в виде ионов NO 2 - и NO 3 - . Ион NO 2 - нестоек, две молекулы НNО 2 разлагаются на воду, NО 2 и NО. Оксид NO реагирует с кислородом, превращаясь в NО 2 , и так до тех пор, пока не получится одна только азотная кислота.
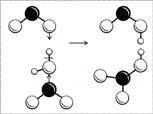
Рис. 8. Схема образования молекул азотной и азотистой кислот. (Черный шар – атом N, большие белые шары – атомы O, маленькие белые шарики – атомы H.)
Формально выходит, что с одним атомом кислорода атом азота связан двойной связью, а с другим – обычной одинарной связью (этот атом кислорода связан еще и с атомом водорода). С третьим атомом кислорода азот в HNO 3 связан донорно-акцепторной связью, причем в качестве донора выступает атом азота. Гибридизация атома азота при этом должна быть sр 2 из-за наличия двойной связи, что определяет структуру – плоский треугольник. Реально получается, что действительно фрагмент из атома азота и трех атомов кислорода – плоский треугольник, только в молекуле азотной кислоты этот треугольник неправильный – все три угла ОNО разные, следовательно, и разные стороны треугольника. Когда же молекула диссоциирует, треугольник становится правильным, равносторонним. Значит, и атомы кислорода в нем становятся равноценными. Одинаковыми становятся и все связи.
Физические свойства азотной кислоты
Соединение ионизированное, пусть даже и частично, сложно перевести в газ. Таким образом, температура кипения должна бы быть достаточно высокой, однако при такой небольшой молекулярной массе температура плавления высокой быть не должна. Следовательно, агрегатное состояние при 20°С жидкое. Что касается растворимости, то, как и многие другие полярные жидкости, азотная кислота легко смешивается с водой в любых соотношениях. Чистая азотная кислота бесцветна и не имеет запаха. Однако из-за разложения на кислород и оксид азота(IV), который в ней же и растворяется, можно сказать, что обычная концентрированная азотная кислота имеет желто-бурый цвет и характерный для NO 2 резкий запах. Посмотрим, как влияет строение молекулы азотной кислоты на ее химические свойства.
НNО 3 – cильный окислитель
При взаимодействии НNО 3 с металлами (М) водород не выделяется:
М + НNО 3 ® соль + вода + газ.
Смесь HNO 3 (конц.) с HCl (конц.) в объемном соотношении 1:3 (1V HNO 3 + 3V HCl) называют «царской водкой».
Au + HNO 3 + 3HCl = AuCl 3 + NO + 2H 2 O.
Азотная кислота не реагирует с другими кислотами по типу реакций обмена или соединения. Однако вполне способна реагировать как сильный окислитель. В смеси концентрированных азотной и соляной кислот протекают обратимые реакции, суть которых можно обобщить уравнением:
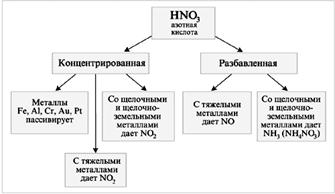
Образующийся атомарный хлор очень активен и легко отбирает электроны у атомов металлов, а хлорид-ион образует устойчивые комплексные ионы с получающимися ионами металлов. Все это позволяет перевести в раствор даже золото. Концентрированная H 2 SO 4 как сильное водоотнимающее средство способствует реакции разложения азотной кислоты на оксид азота(IV) и кислород. Азотная кислота – одна из сильных неорганических кислот и, естественно, со щелочами реагирует. Реагирует она также и с нерастворимыми гидроксидами, и с основными оксидами .
При изучении темы «Азот. Соединения азота» пользуются учебником химии под редакцией Г.Е. Рудзитис, Ф.Г. Фельдман, также учебником за 9 класс под редакцией Н.С. Ахметова. Дидактическим материалом служит книга по химии для 8-9 классов под редакцией А. М. Радецкого, В. П. Горшкова; используются задания для самостоятельной роботы по химии за 9 класс под редакцией Р.П. Суровцева, С.В. Софронова; используется сборник задач по химии для средней школы и для поступающих в вузы под редакцией Г.П. Хомченко, И.Г. Хомченко. На изучение этой темы отводится 7 ч .
ГЛАВА 3. МЕЖПРЕДМЕТНЫЕ СВЯЗИ ПРИ ИЗУЧЕНИИ III И V ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д.И.МЕНДЕЛЕЕВА 3.1 III-А группа 3.1.1 Бор 3.1.1.1 Распространение в природе
Бор никогда не встречается в природе в свободном состоянии, он всегда оказывается связанным с кислородом. В этой форме он присутствует в борной кислоте Н 3 BO 3 , которая содержится в воде горячих источников вулканических местностей. Кроме того, в природе распространены многочисленные соли борной кислоты. Из этих солей наиболее известна бура или тинкал Na 2 B 4 О 7 . 10Н 2 О. Техническое значение имеют борацит 2Mg 3 B 8 O 15 . MgCl 2 , пандермит Са 2 B 6 О 11 . 3Н 2 О, колеманит Са 2 B 6 О 11 . 5Н 2 О, кернит Na 2 B 4 О 7 . 4Н 2 О.
Необходимо указать и следующие минералы, которые являются производными борной кислоты: борокальцит СаB 4 О 7 . 4Н 2 О, борнонатрокальцит NaСаB 5 О 9 . 6Н 2 О, гидроборацит MgCaB 6 О 11 . 6Н 2 О, боромагнезит 2Mg 5 B 4 О 11 . 5Н 2 О, сингалит MgAlBО 4 и др. .
3.1.1.2 Биохимическая роль
Бор и его соединения имеют большое значение в народном хозяйстве. Изотоп 5 10 B, поглощающий нейтроны, применяют в ядерной технике для замедления ядерных цепных реакций. Бура и борная кислота издавна применяется в медицине как антисептики.
Физиологическая и биологическая активность бора очень высока. Бор способен влиять на важнейшие процессы биохимии животных и растений. Вместе с Mn, Cu, Zn и Мо бор входит в число пяти жизненно важных микроэлементов. Бор концентрируется в костях и зубах, в мышцах, в костном мозгу, печени и щитовидной железе. Вероятно, что он ускоряет рост и развитие организмов. Это видно из влияния бора на растения. При борном голодании значительно уменьшается урожай и особенно количество семян. Для жизнедеятельности животных важно его нахождение в молоке (коровьем) и в желтке куриных яиц. Некоторые растения (кормовые травы и сахарная свекла) собирают по несколько граммов бора с гектара угодий. Бор содержится в значительных количествах в жировых тканях некоторых животных, пасущихся на пастбищах, обогащенных бором. Состав соединений бора в организме неизвестен. Установлено, что бор тормозит кишечную амилазу и кишечные протеиназы, усиливает действие инсулина и тормозит окисление адреналина, ослабляет витамины В 2 и В 12 . При избытке бора появляются борные энтериты. Избыточное содержание бора ведет к заболеванию растений. Пшеница и овес страдают при наличии 0,7 - 0,8 мгВ/кг почвы. Борьба с засолением почв бором ведется с помощью промывки борных почв .
И дидактические основы организации обучения позволяют более доступно объяснять изучаемый материал на уроках физики при изучении темы «Основы электродинамики». Анализ различных технологий позволил составить авторскую технологию развития у учащихся направленности на диалогическое общение при групповой форме обучения. От того, на сколько правильно будет построен процесс обучения при использовании...
С этим возникает необходимость рассмотрения вопроса взаимосвязи молекулярной физики и химии в курсе средней школы. При изучении молекулярной физики взаимосвязь ее с химией проявляется в двух главных направлениях. Первое из них заключаются в использовании знаний учащихся, полученных ими в процессе изучения химии в качестве материала для доказательства основных положений молекулярной физики. Второе...
Цели урока:
Обучающая – изучить физические и химические свойства алюминия и области его применения. Рассмотреть характеристику химического элемента алюминия и изучить строение атома.
Развивающая – развивать умения в проведении эксперимента, перенесении содержания научно-познавательного текста в форму схем; развитие коммуникативных способностей, умения слушать, умение правильно высказывать свои мысли.
Воспитательная – воспитывать культуру работы с химическими веществами, соблюдение правил техники безопасности, воспитывать сознательную дисциплинированность, четкость и организованность в работе.
Учащиеся должны знать:
строение атома алюминия, физические и химические свойства алюминия как простого вещества, области применения.
Учащиеся должны уметь:
давать характеристику алюминия, как химического элемента, так и простого вещества. Записывать уравнения реакций, доказывающие химические свойства алюминия в молекулярном и окислительно-восстановительном виде.
Тип урока:
изучение нового материала.
Форма организации учебной деятельности учащихся:
групповая работа, индивидуальная, химический эксперимент.
Методы и приемы обучения:
поисковый, частично-исследовательский, демонстрационный химический эксперимент, работа в группах, устные ответы у доски, самостоятельная работа с текстами, взаимоконтроль.
Оборудование урока:
научно-познавательные тексты по теме урока, карточки-задания по отдельному вопросы плана изучения материала для каждой группы, ПСХЭ,
Коллекция «Алюминий и его соединения», алюминиевая фольга, соляная кислота и гидроксид натрия, алюминий, лабораторное оборудование.
1. Организационный момент.
Учитель приветствует учащихся.
2. Актуализация опорных знаний, сообщение темы, задач и структуры проведения урока:
Вступительное слово учителя
Сами, трудясь, вы сделаете все
и для близких людей и для себя,
а если при труде успеха не будет,
неудача – не беда, попробуйте ещё.
Д. И. Менделеев.
Мы продолжаем изучение большой и важной темы «Металлы». Сегодня на уроке нам предстоит познакомиться с металлом хорошо известным вами с детства. Данный урок я хочу начать с легенды.
«Однажды к римскому императору Тиберию пришел незнакомец. В дар императору он принес изготовленную им чашу из блестящего, как серебро, но чрезвычайно легкого металла. Мастер поведал, что получил этот металл из «Глинистой земли». Но император, боясь, что обесценятся его золото и серебро, велел отрубить мастеру голову, а его мастерскую разрушить». О каком металле идет речь?
(Об алюминии)
Учитель:
Таким образом, тема нашего урока: «Алюминий – химический элемент и простое вещество».
Формулируются задачи урока.
План изучения темы в группах:
- Физические свойства алюминия.
- Химические свойства алюминия.
- Применение алюминия и нахождение его в природе.
План работы в группе:
Изучите текст и выделите сведения, относящиеся к своему вопросу;
- выполните предложенные задания;
- подготовьте выступление по своему вопросу, основываясь на краткости, ясности и четкости изложения
Групповая работа по изучению материала.
Подготовка выступления по своему вопросу.
Группа 1.
Характеристика химического элемента алюминия по положению его в ПСХЭ.
Задание:
- Ознакомьтесь с текстом.
- Дайте характеристику алюминию по положению в ПСХЭ по плану:
А) порядковый номер.
Б) атомная масса.
В) период (малый, большой).
Г) группа (подгруппа: главная или побочная).
Д) химический знак.
Е) Строение атома (заряд ядра, число протонов, электронов, нейтронов, электронная формула).
И) оксиды.
К) летучие водородные соединения.
2. Обсудите в группе полученные результаты и ответьте на вопросы:
- Сколько электронов находится на внешнем уровне атома алюминия?
- Алюминий будет отдавать или принимать данные электроны?
- Какую степень окисления будет приобретать при этом ион алюминия?
- Сделайте вывод: К какому классу соединений относится алюминий (металл или неметалл)
- Сравните активность химического элемента алюминия с элементами 1 и 2 групп этого же периода.
- Подготовьте выступление по данному вопросу, основываясь на краткости, ясности и четкости изложении.
Группа 2.
Физические свойства алюминия.
Задание:
- Ознакомьтесь с текстом.
- Выделите материал, относящийся к вашему вопросу.
- Рассмотрите коллекцию «Алюминий и его сплавы».
- Обсудите в группе вопросы:
- а) Агрегатное состояние, цвет, блеск, плотность (легкий или тяжелый), плавкость (легко –или тугоплавкий), электро- и теплопроводность, пластичный.
- б) Полученные данные изобразите в виде схемы.
5. Подготовьте выступление поданному вопросу, основываясь на краткости четкости изложении.
Группа 3.
Химические свойства алюминия.
Задание:
- Ознакомьтесь с текстом.
- Выделите материал, относящийся к вашему вопросу.
- Изучите, как ведет себя алюминий по отношению к сложным веществам?
- Выполните лабораторную работу, используя инструкцию
Задание:
А) Выполните опыты.
Б) Обговорите в группе наблюдаемые явления.
В) Запишите уравнение реакций.
Г) Сделайте выводы.
5. Подготовьте выступление по данному вопросу, основываясь на краткости, ясности и четкости изложении.
Группа 4.
Применение алюминия.
Задание:
- Ознакомьтесь с текстом.
- Выделите материал, относящийся к вашему вопросу.
- Обсудите в группе следующие вопросы:
а) Какова роль алюминия в жизни человека?
б) Применение алюминия, как простого вещества.
- Составьте схему, характеризующую области применения алюминия.
- Подготовьте выступление по данному вопросу, основываясь на краткости, ясности и четкости изложении
- Отчет групп по изученным вопросам.
Каждая группа, выполнив все задания, представляет схематизированное изложение своего вопроса с обсуждением и комментариями, учащиеся делают записи, переносят предложенные схемы в тетради, в результате всех групп поэтапно составляется опорный конспект по теме урока.
Выводы по теме урока:
Какое количество электронов находится на внешнем энергетическом уровне атома алюминия.
- Какую степень окисления имеет атом алюминия? Почему? А ион?
- При помощи каких опытов мы доказали, что алюминий – это активный металл?
- Какие вещества называются амфотерными?
- На каких свойствах основаны следующие области применения?
- Где в организме больше всего содержится алюминия?
- Можно ли длительное время хранить продукты питания в алюминиевой посуде?
- Домашнее задание: § 13 до стр. 60, ? 1, 4. Подготовить презентацию по применению алюминия.
- Заключительное слово учителя.
Учитель благодарит учащихся за сотрудничество, выставляет оценки выступающим у доски.
Справка.
Алюминий.
В главную подгруппу III группы входят элементы: бор, алюминий, галлий, индий, таллий. На внешнем электронном слое атомы этих элементов содержат три электрона (…ns2np1). Они являются р-элементами. В реакциях атомы этих элементов являются восстановителями, за исключением неметалла бора, он может быть окислителем. Все элементы этой подгруппы проявляют высшую степень окисления +3. Они образуют высшие оксиды Э2О3 и гидроксиды Э(ОН)3, которые проявляют амфотерные свойства. Наибольший интерес в этой подгруппе представляют алюминий.
Алюминий в свободном виде – серебристо-белый металл, обладает блеском, высокой тепло-электропроводностью (уступает в этом отношении меди), легкий (плотность 2,7 г/см3) и одновременно – это прочный металл. Является мягким, пластичным металлом, его можно прокатывать в фольгу, вытягивается в проволоку. Плавится при температуре 6600С. При 6000С алюминий становится хрупким и его можно истолочь в зерна или в порошок.
Алюминий – металл, поверхность которого обычно покрыта тонкой, прочной оксидной пленкой. Виде стружек и порошка он ярко горит на воздухе, выделяя большое количество теплоты.
При комнатной температуре активно реагирует с галогенами, при нагревании взаимодействует с серой (2000С), азотом (8000 С) и другими неметаллами.
Отношение алюминия к сложным веществам:
Алюминий растворяется в соляной кислоте любой концентрации:
Алюминий растворяется в растворах щелочей:
Алюминий играет важную биологическую роль в жизни человека. Он принимает участие в построении эпителиальной и соединительной тканях. Содержание алюминия в организме человека (на 70 кг массы тела) составляет 61 мг. Находится во всех органах и тканях: больше всего в печени, легких, костях головном мозге. Основным поступлением алюминия в организм является пища – это хлебопродукты, чай (от 20 – 200мг на 100г. продукта), картофель – 4 мг на 100г. продукта, желтая репа – 46 мг на 100 г. продукта.
При приготовлении и хранении пищи в алюминиевой посуде содержание алюминия в продуктах увеличивается вдвое. Повышение содержания алюминия в крови вызывает возбуждение центральной нервной системы. При избытке алюминия в организме нарушается двигательная активность, судороги, ослабление памяти, заболевание печени и почек. При понижении содержания алюминия происходит торможение центральной нервной системы.
Области применения алюминия весьма многочисленны. Благодаря легкости и прочности алюминий и его сплавы применяют в самолето- и ракетостроении (алюминий называют крылатым металлом), строительстве судов и автомобилей; в строительстве- для изготовления оконных рам и дверей, легкость и хорошая электрическая проводимость алюминия используется при изготовлении электрических проводов для линии электропередач. Теплопроводность и неядовитость важны при изготовлении алюминиевой посуды и фольги для хранения пищевых продуктов. Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии. Способность алюминия гореть в воздухе ярким пламенем, используется при приготовлении красочных фейерверков и изготовление бенгальских огней.


