За да се приготви 0,01 нормален разтвор на сярна киселина, е необходимо да има данни за нейната концентрация.
Концентрацията на сярна киселина може да се определи от нейното специфично тегло, което от своя страна се определя от показанията на хидрометър, спуснат в цилиндър, напълнен с тази киселина.
Познавайки специфичното тегло на сярната киселина, нейната концентрация може да се определи с помощта на спомагателна таблица (вижте приложенията). С други думи, възможно е да се определи какво количество химически чиста киселина се съдържа в определен обем от сместа, както и на какъв процент съответства това количество (промишлеността произвежда сярна киселина, смесена с малко количество вода и някои други вещества ).
Молекулното тегло на сярната киселина е 98,06, а еквивалентът е 49,03 g. Следователно 1 литър 0,01 нормален разтвор на сярна киселина трябва да съдържа 0,4903 g чиста киселина.
След като определите необходимото количество чиста сярна киселина за приготвяне на сантинормален разтвор, можете също така да определите количеството силна сярна киселина (с предварително определена концентрация), което трябва да се вземе за приготвяне на определения разтвор. Така например търговската силна (концентрирана) сярна киселина, която обикновено има специфично тегло 1,84 и съдържа 96% чиста сярна киселина, трябва да вземе 0,5107 g (100 x 0,4902: 96) или 0,28 ml (0,5107: 1,84).
Количеството концентрирана сярна киселина (в този случай 0,28 ml), определено чрез такова изчисление, което ще се използва за приготвяне на даден разтвор, се филтрира от микробюрета с шлифован спирателен кран в мерителна колба, в която след това се налива дестилирана вода до нивото на литровия знак.
След това сантинормален разтвор на сярна киселина се излива от колбата в бутилка, затворена с гумена запушалка, през която в разтвора преминава стъклена изпускателна тръба, свързана с микробюрета, и се определя корекцията за точността на приготвения разтвор , тъй като рядко е възможно да се подготви точно решение с дадена нормалност. В повечето случаи тези разтвори с този метод на приготвяне са малко по-силни или по-слаби от сантинормалните.
Корекцията за точността на сантинормален разтвор на сярна киселина често се определя с помощта на боракс (Na2 B4 O7 10 H2 O).
Процедурата за това определяне е следната:
1. Претеглете 953 mg химически чист боракс на аналитична везна (Еквивалентното тегло на боракс е 190,6 g. Следователно, за да приготвите литър 0,01-нормален разтвор, трябва да вземете 1,906 g химически чист боракс (190,6: 100) , а за да приготвите 500 ml разтвор с посочената нормалност, трябва да вземете 953 mg боракс).
2. Внимателно, опитвайки се да не се разлее, прехвърлете получената проба, предназначена за приготвяне на 0,01 нормален разтвор на боракс, през фуния в мерителна колба от 500 ml.
3. Използвайки дестилирана вода, изсипете зърната боракс, останали върху фунията, в колбата.
4. Разтворете съдържанието на колбата чрез разклащане и след това използвайте дестилирана вода, за да доведете нивото на разтвора до марката 500 ml.
5. Затворете колбата с чиста запушалка и разбъркайте добре приготвения разтвор на боракс.
6. Изсипете 20 ml 0,01 нормален разтвор на боракс в малка конична колба от микробюрета или пипета, добавете 2...3 капки двуцветен индикатор и титруйте с 0,01 нормален разтвор на сярна киселина.
7. Изчислете корекцията на точността за 0,01 нормален разтвор на сярна киселина, която се изразява като частно, получено чрез разделяне на милилитри от 0,01 нормален разтвор на боракс, взет за титруване, на броя милилитри от 0,01 нормален разтвор на сярна киселина киселина, използвана за неутрализация. Нека обясним това с конкретен пример.
Да приемем, че 22 ml разтвор на сярна киселина са използвани за неутрализиране на 20 ml разтвор на боракс. Това означава, че приготвеният киселинен разтвор е по-слаб от 0,01 нормално. Ако този разтвор съответства на 0,01-нормален, тогава равно количество киселинен разтвор ще бъде изразходвано за неутрализиране на всеки милилитър разтвор на боракс.
В нашия пример, както вече беше посочено, 22 ml киселинен разтвор са изразходвани за неутрализиране на 20 ml разтвор на боракс и следователно изменението на приготвения киселинен разтвор:
Операцията за установяване на корекцията се повтаря 2-3 пъти. Резултатите от паралелните определяния трябва задължително да се сближават с точност до 0,001. Крайната стойност на корекционния фактор се приема като средноаритметична стойност, получена от две или три определяния.
За да се преобразува приготвеният разтвор на сярна киселина в точен 0,01 нормален разтвор, едно или друго количество, взето за анализ, трябва да се умножи по корекционния коефициент. Обикновено корекционният коефициент е написан върху бутилката с киселинен разтвор и периодично се актуализира, тъй като при продължителна работа с този разтвор или продължително съхранение може да промени силата си.
Приготвяне на разтвор на сярна киселина с масова част от 5%. 28,3 cm 3 концентрирана сярна киселина се смесват с 948 cm 3 дестилирана вода.
Приготвяне на разтвор с масова концентрация на манган 0,1 mg/cm3.Калиевият перманганат с тегло 0,288 g се разтваря в малко количество разтвор на сярна киселина с масова част от 5% в мерителна колба с капацитет 1000 cm 3. Обемът на разтвора в колбата се регулира до марката със същия разтвор на сярна киселина. Полученият разтвор се обезцветява чрез добавяне на няколко капки водороден прекис или оксалова киселина и се разбърква. Разтворът се съхранява не повече от 3 месеца при стайна температура.
Приготвяне на референтен разтвор. Разтвор с масова концентрация на манган 0,1 mg/cm3 се поставя в мерителни колби с вместимост 50 cm3 в обемите, посочени в таблицата за сравнение на разтвора.
маса 1
Сравнителна таблица за манганови разтвори
Добавете 20 cm 3 дестилирана вода към всяка колба. Разтворите се приготвят в деня на тестването.
Приготвяне на разтвор на сребърен нитрат с масова част от 1%.Сребърен нитрат с тегло 1,0 g се разтваря в 99 cm 3 дестилирана вода.
Тестване:Въз основа на рецептата за премикс, вземете обем от тестовия разтвор, съдържащ от 50 до 700 μg манган, поставете го в стъклени чаши с вместимост 100 cm 3 и изпарете до сухо на пясъчна баня или електрическа печка с азбестова мрежа. Сухият остатък се навлажнява с капки концентрирана азотна и след това сярна киселина, чийто излишък се изпарява. Лечението се повтаря два пъти. След това остатъкът се разтваря в 20 cm 3 гореща дестилирана вода и се прехвърля в мерителна колба с вместимост 50 cm 3. Стъклото се измива няколко пъти с малки порции гореща дестилирана вода, които също се наливат в мерителна колба. В колбите с еталонните разтвори и тестовия разтвор се добавят 1 cm 3 ортофосфорна киселина, 2 cm 3 разтвор на сребърен нитрат с масова част от 1% и 2,0 g амониев персулфат. Съдържанието на колбите се нагрява до кипене и когато се появи първото мехурче, се добавя още амониев персулфат на върха на скалпела. След кипене разтворите се охлаждат до стайна температура, довеждат се до марката с разтвор на сярна киселина с масова част от 5% и се преместват. Оптичната плътност на разтворите се измерва на фотоелектроколориметър спрямо първия референтен разтвор, който не съдържа манган, в кювети с дебелина на полупрозрачния слой 10 mm при дължина на вълната (540 ± 25) nm, като се използва подходящ светлинен филтър, или на спектрофотометър при дължина на вълната 535 nm. В същото време се провежда контролен експеримент, като се изключва вземането на проба от премикса.
GAPOU LO "Политехнически колеж в Кириши"
Методическо ръководство за изучаване
MDK.02.01 Основи на приготвяне на проби и разтвори с различни концентрации
240700.01 за специалността лаборант химичен анализ.
Разработено
Учител: Рассказова В.В.
2016 г
Съдържание
Съдържаниестраници
Решения
3-15
Изчисления за приготвяне на разтвори на соли и киселини
Преизчисляване на концентрацията от един вид в друг.
Разтвори за смесване и разреждане.Закон за смесване на разтвори
Техника за приготвяне на разтвори.
15-20
Приготвяне на солеви разтвори
Приготвяне на киселинни разтвори
Приготвяне на базови разтвори
Техника за определяне концентрацията на разтвори.
21-26
Определяне на концентрация чрез денсиметрия
Определяне на концентрацията титриметрично.
Шест правила за титруване.
Условия за титриметрично определяне на концентрацията на веществото
Приготвяне на титруван
Задаване на титъра на разтвора
Изчисления при обемен анализ.
26-28
РЕШЕНИЯ
Концепцията за разтвори и разтворимост
Както при качествения, така и при количествения анализ основната работа се извършва с решения. Обикновено, когато използваме името „решение“, имаме предвид истински решения. В истинските разтвори разтвореното вещество под формата на отделни молекули или йони се разпределя между молекулите на разтворителя.Решение- хомогенна (хомогенна) смес, състояща се от частици от разтворено вещество, разтворител и продуктите на тяхното взаимодействие.Когато твърдо вещество се разтвори във вода или друг разтворител, молекулите на повърхностния слой преминават в разтворителя и в резултат на дифузия се разпределят в целия обем на разтворителя, след което нов слой от молекули преминава в разтворителя , и т.н. Едновременно с разтворителя протича и обратният процес - отделяне на молекули от разтвора. Колкото по-висока е концентрацията на разтвора, толкова повече ще се случи този процес. Чрез увеличаване на концентрацията на разтвора, без да променяме други условия, достигаме състояние, при което за единица време същият брой молекули от разтвореното вещество ще бъдат освободени от разтвора, тъй като те се разтварят. Това решение се наричанаситен. Ако добавите дори малко количество разтворено вещество към него, то ще остане неразтворено.
Разтворимост- способността на веществото да образува хомогенни системи с други вещества - разтвори, в които веществото е под формата на отделни атоми, йони, молекули или частици.Количеството вещество в наситен разтвор определяразтворимост вещества при определени условия. Разтворимостта на различните вещества в определени разтворители е различна. В определено количество от всеки разтворител може да се разтвори не повече от определено количество от дадено вещество.Разтворимост изразено чрез броя на грамовете на дадено вещество в 100 g разтворител в наситен разтвор, при дадена температура. Въз основа на способността им да се разтварят във вода веществата се делят на: 1) силно разтворими (сода каустик, захар); 2) слабо разтворими (гипс, бертолетова сол); 3) практически неразтворим (меден сулфит). Практически неразтворимите вещества често се наричат неразтворими, въпреки че няма абсолютно неразтворими вещества. „Неразтворимите вещества обикновено се наричат онези вещества, чиято разтворимост е изключително ниска (1 тегловна част от веществото се разтваря в 10 000 части разтворител).
Обикновено разтворимостта на твърдите вещества се увеличава с повишаване на температурата. Ако приготвите разтвор, който е близък до наситен чрез нагряване, и след това бързо, но внимателно го охладете, т.нарсвръхнаситен разтвор. Ако пуснете кристал от разтворено вещество в такъв разтвор или го смесите, тогава кристалите ще започнат да падат от разтвора. Следователно, охладеният разтвор съдържа повече вещество, отколкото е възможно за наситен разтвор при дадена температура. Следователно, когато се добави кристал от разтворено вещество, цялото излишно вещество кристализира.
Свойствата на разтворите винаги се различават от свойствата на разтворителя. Разтворът кипи при по-висока температура от чистия разтворител. Напротив, точката на замръзване на разтвора е по-ниска от тази на разтворителя.
Според естеството на разтворителя разтворите се делят наводни и неводни. Последните включват разтвори на вещества в органични разтворители като алкохол, ацетон, бензен, хлороформ и др.
Разтворите на повечето соли, киселини и основи се приготвят във водни разтвори.
Методи за изразяване на концентрацията на разтворите. Понятието грам еквивалент.
Всеки разтвор се характеризира с концентрация на разтворено вещество: количеството вещество, съдържащо се в определено количество разтвор. Концентрацията на разтворите може да бъде изразена като процент, в молове на 1 литър разтвор, в еквиваленти на 1 литър разтвор и чрез титър.
Концентрацията на веществата в разтворите може да се изрази по различни начини:
Масовата част на разтвореното вещество w(B) е безразмерна величина, равна на отношението на масата на разтвореното вещество към общата маса на разтвора m
w(B)= m(B) / m
или наречено по друг начин:процентна концентрация разтвор - определя се от броя на грамовете вещество в 100 g разтвор. Например 5% разтвор съдържа 5 g вещество в 100 g разтвор, т.е. 5 g вещество и 100-5 = 95 g разтворител.
Моларната концентрация C(B) показва колко мола разтворено вещество се съдържат в 1 литър разтвор.
C(B) = n(B) / V = m(B) / (M(B) V),
където M(B) е моларната маса на разтвореното вещество g/mol.
Моларната концентрация се измерва в mol/L и се обозначава с "M". Например, 2 М NaOH е двумоларен разтвор на натриев хидроксид;мономоларните (1 М) разтвори съдържат 1 мол вещество на 1 литър разтвор, бимоларните (2 М) разтвори съдържат 2 мола на 1 литър и т.н.
За да установите колко грама от дадено вещество има в 1 литър разтвор с дадена моларна концентрация, трябва да го знаетемоларна маса, т.е. масата на 1 мол. Моларната маса на веществото, изразена в грамове, е числено равна на молекулната маса на веществото. Например, молекулното тегло на NaCl е 58,45, следователно моларната маса също е 58,45 g. По този начин 1 М разтвор на NaCl съдържа 58,45 g натриев хлорид в 1 литър разтвор.
Нормалността на разтвор показва броя на грам еквиваленти от дадено вещество в един литър разтвор или броя на милиграм еквиваленти в един милилитър разтвор.
Грамов еквивалент
от вещество е броят грамове от вещество, което е числено равно на неговия еквивалент.
Съставен еквивалент - наричат количеството му, което отговаря (еквивалентно) на 1 мол водород в дадена реакция.
Коефициентът на еквивалентност се определя от:
1) естеството на веществото,
2) специфична химическа реакция.
а) при метаболитни реакции;
КИСЕЛИНИ
Еквивалентната стойност на киселините се определя от броя на водородните атоми, които могат да бъдат заменени с метални атоми в киселинната молекула.
Пример 1. Определете еквивалента на киселини: а) HCl, б) Н 2 ТАКА 4 , в) Н 3 RO 4 ; г) Н 4 .
Решение.
а) E= M.M/1
б) E= M.M/2
в) E= M.M/3
г) E= M.M/4
В случай на многоосновни киселини, еквивалентът зависи от специфичната реакция:
А) З 2 ТАКА 4 +2KOH→ К 2 ТАКА 4 + 2H 2 О.
в тази реакция два водородни атома се заместват в молекулата на сярната киселина, следователно E = M.M/2
b) З 2 ТАКА 4 + КОН→ KHSO 4 +З 2 О.
В този случай един водороден атом е заменен в молекулата на сярната киселина E = M.M/1
За фосфорната киселина, в зависимост от реакцията, стойностите са а) E = M.M/1
b) E= M.M/2 c) E= M.M/3
БАЗИ
Основният еквивалент се определя от броя на хидроксилните групи, които могат да бъдат заменени от киселинния остатък.
Пример 2. Определете еквивалента на основите: а) КОН; б)Cu( ОХ) 2 ;
V)Ла( ОХ) 3 .
Решение.
а) E= M.M/1
б) E= M.M/2
в) E= M.M/3
СОЛ
Стойностите на солния еквивалент се определят от катион.
Стойността, на която трябва да се раздели M.M при солите е равноq·n , Къдетор – заряд на металния катион,н – броят на катионите във формулата на солта.
Пример 3. Определете еквивалента на солите: а) KNO 3 ; б)Na 3 П.О. 4 ; V)Кр 2 ( ТАКА 4 ) 3;
G)Ал( НЕ 3 ) 3.
Решение.
а)q·n = 1 б)1 3 = 3 V)z = 3 2 = 6, G)z = 3 1 = 3
Стойността на коефициентите на еквивалентност за солите също зависи от
реакция, подобна на нейната зависимост за киселини и основи.
б) при окислително-възстановителни реакции за определяне
еквивалентно използване на схема за електронен баланс.
Стойността, на която трябва да се раздели M.M за вещество в този случай, е равна на броя на електроните, приети или отдадени от молекула на веществото.
ДА СЕ 2 Кр 2 О 7 + HCl → CrCl 3 + Кл 2 + KCl + Н 2 О
за прав 2Сr +6 +2·3д →2Кр 3+
2Cl реакции - - 2 1д →Кл 2
за обратен 2Cr+3-2 3д →Кр +6
Cl2-2 реакциид →2Cl
(К 2 Кр 2 О 7 )=1/6
(Cr)=1/3 (HCl)=1 (Cl)=1) (Cl2)=1/2 (Cl)=1
Нормалната концентрация е обозначена с букватан (във формулите за изчисление) или буквата „n“ - при посочване на концентрацията на даден разтвор. Ако 1 литър разтвор съдържа 0,1 еквивалент от вещество, той се нарича децинормален и се обозначава като 0,1 N. Разтвор, съдържащ 0,01 еквивалента вещество в 1 литър разтвор, се нарича сантинормален и се обозначава като 0,01 N. Тъй като еквивалентът е количеството на всяко вещество, което е в дадена реакция. съответства на 1 мол водород, очевидно еквивалентът на всяко вещество в тази реакция трябва да съответства на еквивалента на всяко друго вещество. И това означава, чеПри всяка реакция веществата реагират в еквивалентни количества.
Титриран се наричат разтвори, чиято концентрация се изразяванадпис, т.е. броят на грамовете вещество, разтворено в 1 ml разтвор. Много често в аналитичните лаборатории титрите на разтвора се преизчисляват директно спрямо определяното вещество. Togда Титърът на разтвора показва колко грама от определяното вещество съответства на 1 ml от този разтвор.
За да се приготвят разтвори с моларни и нормални концентрации, проба от веществото се претегля на аналитична везна и разтворите се приготвят в мерителна колба. При приготвяне на киселинни разтвори необходимият обем концентриран киселинен разтвор се измерва с бюрета със стъклен спирателен кран.
Теглото на разтвореното вещество се изчислява до четвъртия знак след десетичната запетая, а молекулните тегла се вземат с точността, с която са дадени в референтните таблици. Обемът на концентрираната киселина се изчислява до втория знак след десетичната запетая.
При приготвяне на разтвори с процентна концентрация веществото се претегля на технико-химичен баланс, а течностите се измерват с мерителен цилиндър. Следователно теглото на веществото се изчислява с точност до 0,1 g, а обемът на 1 течност с точност до 1 ml.
Преди да започнете да приготвяте разтвора, е необходимо да направите изчисление, т.е. да изчислите количеството разтворено вещество и разтворител, за да приготвите определено количество разтвор с дадена концентрация.
Изчисления за приготвяне на солеви разтвори
Пример 1. Необходимо е да се приготвят 500 g 5% разтвор на калиев нитрат. 100 g от такъв разтвор съдържа 5 g KN0 3 ; Да направим пропорция:
100 g разтвор - 5 g KN0 3
500" -х » KN0 3
5*500/100 = 25гр.
Трябва да вземете 500-25 = 475 ml вода.
Пример 2. Необходимо е да се приготвят 500 g 5% разтвор на CaCазот сол CaCl 2 .6N 2 0. Първо, извършваме изчислението за безводна сол.
100 g разтвор - 5 g CaCl 2
500 "" -x g CaC1 2
5*500/100 = 25гр
Моларна маса на CaCl 2 = 111, моларна маса на CaCl 2 6H 2 0 = 219. Следователно,
219 g CaCl 2 *6Н 2 0 съдържат 111 g CaCl 2 . Да направим пропорция:
219 g CaCl 2 *6Н 2 0 -- 111 g CaCl 2
х » CaС1 2 -6H 2 0- 25 "CaCI 2 ,
219*25/ 111= 49,3гр.
Количеството вода е 500-49,3=450,7 гр., или 450,7 мл. Тъй като водата се измерва с помощта на мерителен цилиндър, десети от милилитър не се вземат предвид. Следователно трябва да измерите 451 ml вода.
4. Изчисления за приготвяне на киселинни разтвори
При приготвянето на киселинни разтвори е необходимо да се има предвид, че концентрираните киселинни разтвори не са 100% и съдържат вода. Освен това необходимото количество киселина не се претегля, а се измерва с помощта на мерителен цилиндър.
Пример 1. Необходимо е да се приготвят 500 g 10% разтвор на солна киселина от наличната 58% киселина, чиято плътност е d = l.19.
1. Намерете количеството чист хлороводород, което трябва да бъде в приготвения киселинен разтвор:
100 g разтвор -10 g НС1
500 "" -х » NS1
500*10/100= 50гр
За да се изчислят разтвори с процентна концентрация, моларната маса се закръгля до цели числа.
2. Намерете броя на грамовете концентрирана киселина, които ще съдържат 50 g НС1:
100 g киселина - 38 g НС1
х » » - 50 » NS1
100 50/38 = 131,6 g.
3. Намерете обема, зает от това количество киселина:
V= 131,6 / 1,19= 110, 6 мл. (закръглено до 111)
4. Количеството разтворител (вода) е 500-131,6 = 368,4 g, или 368,4 ml. Тъй като необходимото количество вода и киселина се измерва с мерителен цилиндър, десети от милилитъра не се вземат предвид. Следователно, за да приготвите 500 g 10% разтвор на солна киселина, трябва да вземете 111 ml солна киселина и 368 ml вода.
Пример 2. Обикновено, когато се правят изчисления за приготвяне на киселини, се използват стандартни таблици, които показват процента на киселинния разтвор, плътността на този разтвор при определена температура и броя на грамовете на тази киселина, съдържащи се в 1 литър разтвор с тази концентрация. В този случай изчислението е опростено. Количеството приготвен киселинен разтвор може да се изчисли за определен обем.
Например, трябва да приготвите 500 ml 10% разтвор на солна киселина на базата на концентриран 38% разтвор. Според таблиците установяваме, че 10% разтвор на солна киселина съдържа 104,7 g НС1 в 1 литър разтвор. Трябва да подготвим 500 ml, следователно разтворът трябва да съдържа 104,7:2 = 52,35 g HCl.
Нека изчислим колко концентрирана киселина трябва да вземете. Според таблицата 1 литър концентрирана НС1 съдържа 451,6 g НС1. Да направим пропорция:
1000 ml - 451,6 g НС1
X мл - 52.35 "NS1
1000*52,35/ 451,6 =115,9 мл.
Количеството вода е 500-116 = 384 мл.
Следователно, за да приготвите 500 ml 10% разтвор на солна киселина, трябва да вземете 116 ml концентриран разтвор на НС1 и 384 ml вода.
Пример 1. Колко грама бариев хлорид са необходими за приготвяне на 2 литра 0,2 М разтвор?
Решение. Молекулното тегло на бариевия хлорид е 208,27. Следователно. 1 литър 0,2 М разтвор трябва да съдържа 208,27 * 0,2 = = 41,654 g BaCаз 2 . За да приготвите 2 литра ще ви трябват 41,654*2 = 83,308 g VaCаз 2 .
Пример 2. Колко грама безводна сода Na 2 C0 3 ще трябва да приготвите 500 ml 0,1 N. решение?
Решение. Молекулното тегло на содата е 106.004; еквивалентна маса на Na 2 C0 3 =М: 2 = 53.002; 0,1 екв. = 5,3002 g
1000 ml 0,1 н. разтвор съдържа 5,3002 g Na 2
C0 3
500 »» » »х
» На 2
C0 3
х= 2,6501 g Na 2 C0 3 .
Пример 3. Колко концентрирана сярна киселина (96%: d=l,84) е необходима за приготвяне на 2 литра 0,05 N. разтвор на сярна киселина?
Решение. Молекулното тегло на сярната киселина е 98,08. Еквивалентна маса на сярна киселина Н 2 така 4 =M: 2 = 98,08: 2 = 49,04 g Маса 0,05 екв. = 49,04*0,05 = 2,452 g.
Нека намерим колко H 2 S0 4 трябва да съдържа 0,05 N в 2 литра. решение:
1 l-2,452 g H 2 S0 4
2"-х » Х 2 S0 4
х = 2,452*2 = 4,904 g H 2 S0 4 .
За да определите колко 96,% разтвор на Н трябва да се вземе за това 2 S0 4 , нека направим пропорция:
в 100 гр. конц. з 2 S0 4 -96 g H 2 S0 4
U » » Х 2 S0 4 -4,904 g H 2 S0 4
Y = 5,11 g H 2 S0 4 .
Ние преизчисляваме това количество в обем: 5,11:1.84=2.77
Така се приготвят 2 литра 0,05 н. разтвор трябва да вземете 2,77 ml концентрирана сярна киселина.
Пример 4. Изчислете титъра на разтвор на NaOH, ако е известно, че точната му концентрация е 0,0520 N.
Решение. Нека припомним, че титърът е съдържанието в 1 ml разтвор на вещество в грамове. Еквивалентна маса на NaOH=40. 01 g Нека намерим колко грама NaOH се съдържат в 1 литър от този разтвор:
40,01*0,0520 = 2,0805 g.
1 литър разтвор съдържа 1000 мл.
Т=0,00208 g/ml. Можете също да използвате формулата:
T=E N/1000 g/l
КъдетоT - титър, g/ml;д - еквивалентна маса;Н- нормалност на решението.
Тогава титърът на този разтвор е: 40.01 0.0520/1000=0.00208 g/ml.
Пример 5. Изчислете нормалната концентрация на разтвор HN0 3 , ако е известно, че титърът на този разтвор е 0,0065 За изчисляване използваме формулата:
T=E N/1000 g/l, от тук:
N=T1000/E 0,0065.1000/ 63,05= 0,1030 n.
Пример 6. Каква е нормалната концентрация на разтвор, ако е известно, че 200 ml от този разтвор съдържа 2,6501 g Na 2 C0 3
Решение.
Както е изчислено в пример 2: EнА 2
с 3
=53,002.
Нека намерим колко еквивалента са 2,6501 g Na 2
C0 3
:
2,6501: 53,002 = 0,05 екв.
За да изчислим нормалната концентрация на разтвор, създаваме пропорция:
200 мл съдържат 0,05 екв.
1000 ""Х "
X=0,25 екв.
1 литър от този разтвор ще съдържа 0,25 еквивалента, т.е. разтворът ще бъде 0,25 N.
За това изчисление можете да използвате формулата:
н =P 1000/Е V
КъдетоР - количество вещество в грамове;д - еквивалентна маса на веществото;V - обем на разтвора в милилитри.
днА 2 с 3 =53,002, тогава нормалната концентрация на този разтвор е
2,6501* 1000 / 53,002*200=0,25
5. Преизчисляване на концентрацията от един вид в друг .
В лабораторната практика често е необходимо да се преизчисли концентрацията на наличните разтвори от една единица в друга. Когато преобразувате процентната концентрация в моларна концентрация и обратно, е необходимо да запомните, че процентната концентрация се изчислява за определена маса на разтвора, а моларната и нормалната концентрация се изчисляват за обема, следователно за преобразуване трябва да познайте плътността на разтвора.
Плътността на разтвора се дава в справочниците в съответните таблици или се измерва с хидрометър. Ако обозначим:СЪС - процентна концентрация;М - моларна концентрация;н- нормална концентрация;д - плътност на разтвора;д - еквивалентна маса;м - моларна маса, тогава формулите за преобразуване от процентна концентрация в моларна и нормална концентрация ще бъдат както следва:
Пример 1. Каква е моларната и нормалната концентрация на 12% разтвор на сяракиселина, чиято плътностd=l.08g/cm??
Решение. Моларната маса на сярната киселина е98. СледователНо,
E n 2 така 4 =98:2=49.
Заместване на необходимите стойностиVформули, получаваме:
1) моларна концентрация12% разтвор на сярна киселина е равен на
M=12*1.08 *10/98=1.32 M;
2) нормална концентрация12% разтвор на сярна киселинаравна на
N= 12*1.08*10/49= 2.64 n.
Пример 2. Каква е процентната концентрация на 1 N. разтвор на солна киселина, чиято плътност е1,013?
Решение. МолнаятеглоНСазравно на 36,5,следователно Ens1=36,5. От горната формула(2) получаваме:
° С= н*E/10d
следователно процентната концентрация1 н. разтвор на солна киселина е равен на
36,5*1/ 1,013*10 =3,6%
Понякога в лабораторната практика е необходимо моларната концентрация да се преизчисли до нормална и обратно. Ако еквивалентната маса на дадено вещество е равна на моларната маса (например KOH), тогава нормалната концентрация е равна на моларната концентрация. И така, 1 n. разтвор на солна киселина ще бъде едновременно 1 М разтвор. За повечето съединения обаче еквивалентната маса не е равна на моларната маса и следователно нормалната концентрация на разтвори на тези вещества не е равна на моларната концентрация. За преобразуване от една концентрация в друга можем да използваме формулите:
M = (NE)/m; N=M(m/E)
Пример 3. Нормална концентрация на 1М разтвор на сярна киселина Отговор-2М
Пример 4, Моларна концентрация 0,5 N. Na разтвор 2 CO 3 Отговорът е 0,25N
Когато преобразувате процентната концентрация в моларна концентрация и обратно, е необходимо да запомните, че процентната концентрация се изчислява за определена маса разтвор, а моларната и нормална концентрация се изчисляват за обем, следователно за преобразуване трябва да знаете плътността на решение. Ако обозначим: c - процентна концентрация; M - моларна концентрация; N - нормална концентрация; e - еквивалентна маса, r - плътност на разтвора; m е моларна маса, тогава формулите за преобразуване от процентна концентрация ще бъдат както следва:
M = (s p 10)/m
N = (c p 10)/e
Същите формули могат да се използват, ако трябва да преобразувате нормална или моларна концентрация в проценти.
Понякога в лабораторната практика е необходимо моларната концентрация да се преизчисли до нормална и обратно. Ако еквивалентната маса на дадено вещество е равна на моларната маса (например за HCl, KCl, KOH), тогава нормалната концентрация е равна на моларната концентрация. И така, 1 n. разтвор на солна киселина ще бъде едновременно 1 М разтвор. За повечето съединения обаче еквивалентната маса не е равна на моларната маса и следователно нормалната концентрация на разтвори на тези вещества не е равна на моларната концентрация.
За да преобразувате от една концентрация в друга, можете да използвате следните формули:
M = (N E)/m
N = (M m)/E
6. Разтвори за смесване и разреждане.
Ако разтворът се разреди с вода, неговата концентрация ще се промени обратно пропорционално на промяната в обема. Ако обемът на разтвора се удвои поради разреждане, тогава неговата концентрация също ще намалее наполовина. При смесване на няколко разтвора, концентрациите на всички смесени разтвори намаляват.
Когато се смесят два разтвора на едно и също вещество, но с различни концентрации, се получава разтвор с нова концентрация.
Ако смесите a% и b% разтвори, ще получите разтвор с % концентрация, а ако a>b, то a>c>b. Новата концентрация е по-близка до концентрацията на разтвора, от който е взето по-голямо количество при смесването.
7. Закон за смесване на разтворите
Количествата на смесените разтвори са обратно пропорционални на абсолютните разлики между техните концентрации и концентрацията на получения разтвор.
Законът за смесване може да се изрази с математическа формула:
mA/ mB=S-b/като,
КъдетоmA, mB– количества разтвори А и Б, взети за смесване;
а, b, ° С-съответно концентрациите на разтворите А и Б и на получения в резултат на смесването разтвор. Ако концентрацията е изразена в %, тогава количествата смесени разтвори трябва да се вземат в тегловни единици; ако концентрациите са взети в молове или нормали, тогава количествата на смесените разтвори трябва да бъдат изразени само в литри.
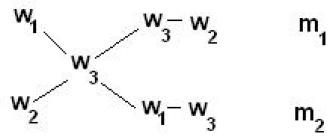
За по-лесно използванеправила за смесване Приложиправило на кръста:

m1 / m2 = (w3 – w2) / (w1 – w3)
За да направите това, извадете по-малката диагонално от по-голямата стойност на концентрация, получавайки (w 1 –w 3 ), w 1 >w 3 и (w 3 –w 2 ), w 3 >w 2 . След това се изчислява отношението на масите на изходните разтвори m 1 /м 2 и изчислете.
Пример
Определете масите на първоначалните разтвори с масови части на натриев хидроксид от 5% и 40%, ако смесването им доведе до разтвор с тегло 210 g с масова част от натриев хидроксид 10%.

5/30 = m 1
/ (210 - м 1
)
1/6 = m 1
/ (210 – м 1
)
210 – м 1
= 6м 1
7м 1
= 210
м 1
=30 g; м 2
= 210 – m 1
= 210 – 30 = 180 g
ТЕХНИКИ ЗА ПРИГОТВЯНЕ НА РАЗТВОРИ.
Ако разтворителят е вода, тогава трябва да се използва само дестилирана или деминерализирана вода.
Подгответе предварително подходящия съд, в който ще се приготвя и съхранява полученият разтвор. Съдовете трябва да са чисти. Ако има опасения, че водният разтвор може да взаимодейства с материала на съдовете, тогава вътрешността на съдовете трябва да бъде покрита с парафин или други химически устойчиви вещества.
Преди да приготвите разтвори, трябва да подготвите, ако е възможно, 2 еднакви съда: един за разтваряне, а другият за съхранение на разтвора. Предварително калибрирайте измития съд.
За разтваряне трябва да се използват чисти вещества. Приготвените разтвори трябва да бъдат проверени за съдържанието на необходимото вещество и, ако е необходимо, разтворът се коригира. Необходимо е да се вземат мерки за защита на приготвените разтвори от прах или газове, с които някои разтвори могат да реагират.
По време на приготвянето и съхранението на разтворите, бутилките или други контейнери трябва да бъдат запушени.
За особено прецизни анализи трябва да се вземе предвид възможността за излугване на стъкло и, ако е възможно, да се използва кварцова стъклария.
В този случай е по-добре да оставите разтворите в порцеланови съдове, а не в стъклени.
1. Техника за приготвяне на солни разтвори.
Приблизителни решения.
Готовият разтвор се филтрира или се оставя да се утаи от неразтворими във вода примеси, след което се отделя бистър разтвор с помощта на сифон. Полезно е да се проверява концентрацията на всеки приготвен разтвор. Най-лесният начин да направите това е да измерите плътността с хидрометър и да сравните получената стойност с табличните данни. Ако концентрацията на разтвора е по-малка от дадена, към него се добавя необходимото количество разтворено твърдо вещество. Ако концентрацията на разтвора е по-голяма от посочената, добавете го към вода и коригирайте концентрацията до необходимата.
Прецизни решения.
Най-често се приготвят точни разтвори на соли за аналитични цели и обикновено с нормална концентрация. Някои от прецизните разтвори не са достатъчно стабилни при съхранение и могат да се променят под въздействието на светлина или кислород, или други органични примеси, съдържащи се във въздуха. Такива точни решения се проверяват периодично. В точен разтвор на натриев сулфат, когато стои, често се появяват серни люспи. Това е резултат от жизнената дейност на определен вид бактерии. Разтворите на калиев перманганат се променят при излагане на светлина, прах и примеси от органичен произход. Разтворите на сребърен нитрат се разрушават при излагане на светлина. Следователно не трябва да имате големи запаси от прецизни солни разтвори, които са нестабилни за съхранение. Разтворите на такива соли се съхраняват в съответствие с известни предпазни мерки. Разтворите се променят под въздействието на светлината:AgNO 3, KSCN, Н.Х. 4 SCN, KI, аз 2, К 2 Кр 2 О 7.
2. Техника за приготвяне на киселинни разтвори.
В повечето случаи в лабораторията се използват разтвори на солна, сярна и азотна киселина. Концентрираните киселини се доставят в лабораториите; Процентното съдържание на киселини се определя от плътността.
За да приготвите разтвор, напълнете 1-литрова колба с дестилирана вода (наполовина), добавете необходимото количество вещество с определена плътност, разбъркайте и след това добавете до един литър обем. По време на разреждането колбите стават много горещи.
Точните разтвори се приготвят по същия начин, като се използват химически чисти препарати. Приготвят се разтвори с по-висока концентрация, които допълнително се разреждат с вода. Разтворите с точна концентрация се проверяват чрез титруване с натриев карбонат (Na 2 CO 3 ) или кисел калиев карбонат (KHCO 3 ) и „правилно“.
3. Техника за приготвяне на алкални разтвори.
Най-често използваният разтвор е сода каустик (NaOHПървоначално се приготвя концентриран разтвор (приблизително 30-40%) от твърдото вещество. По време на разтварянето разтворът се нагрява силно. По правило лугата се разтваря в порцеланови съдове. Следващата стъпка е утаяването на разтвора.
След това прозрачната част се изсипва в друг съд. Такъв контейнер е оборудван с тръба от калциев хлорид за абсорбиране на въглероден диоксид. За да се приготви разтвор с приблизителна концентрация, плътността се определя с помощта на хидрометър. Съхраняването на концентрирани разтвори в стъклени съдове е разрешено, ако повърхността на стъклото е покрита с парафин, тъй като в противен случай стъклото ще се излужи.
За приготвяне на точни разтвори се използва химически чиста основа. Приготвеният разтвор се проверява чрез титруване с оксалова киселина и се коригира.
4. Приготвяне на работен разтвор от фиксанал.
Fixanaly- това са точно претеглени количества твърди химически чисти вещества или точно измерени обеми от техните разтвори, поставени в запечатани стъклени ампули.
Фиксаналите се приготвят в химически заводи или в специални лаборатории. Най-често ампулата съдържа 0,1 или 0,01g-екв вещества. Повечето фиксанали са добре запазени, но някои от тях се променят с времето. По този начин разтворите на каустични алкали стават мътни след 2-3 месеца поради взаимодействието на алкалите със стъклото на ампулата.
За да се приготви разтвор от фиксанал, съдържанието на ампулата се прехвърля количествено в мерителна колба, разтворът се разрежда с дестилирана вода, като обемът му се довежда до марката.
Това става по следния начин: ударниците в кутията с фиксанала се измиват първо с чешмяна вода, а след това с дестилирана вода. Един ударник се вкарва в чиста химическа фуния 3, така че дългият край на ударника да влезе в тръбата на фунията, а късият (остър) край е насочен нагоре; кръстообразното удебеление на ударника опира в долната част на тялото на фунията. Фунията заедно с ударника се поставя в чиста мерителна колба.
Ампулата се измива първо с топла, а след това със студена дестилирана вода за отмиване на етикета и замърсяванията. Дъното на добре измита ампула се удря (там, където има вдлъбнатина) срещу нападателя във фунията и дъното на ампулата се счупва. Без да променяте позицията на ампулата над фунията, втория нападател пробийте горната вдлъбнатина върху него.
Съдържанието на ампулата се излива (или се излива) в мерителна колба. Без да променяте позицията на ампулата, вкарайте края на промивната тръба, изтеглен в капиляра, в образувания горен отвор и измийте ампулата отвътре със силна струя. След това със струя вода от шайбата измийте добре външната повърхност на ампулата и фунията с ударника. След като извадите ампулата от фунията, доведете нивото на течността в колбата до маркировката. Колбата се затваря плътно и разтворът се смесва старателно.
ТЕХНИКА ЗА ОПРЕДЕЛЯНЕ НА КОНЦЕНТРАЦИЯТА НА РАЗТВОРИ.
Концентрацията на вещество в разтвор се определя чрез денсиметрични и титриметрични методи.
1. Денсиметрията измерва плътността на разтвора, като знае, че тегловният % концентрация се определя от таблиците.
2. Титриметричният анализ е метод за количествен анализ, при който се измерва количеството реагент, изразходван по време на химическа реакция.
1. Определяне на концентрация чрез денсиметрия. Концепция за плътност
Плътността е физична величина, определена за хомогенно вещество от масата на неговата единица обем. За нехомогенно вещество плътността в определена точка се изчислява като границата на съотношението на масата на тялото (m) към неговия обем (V), когато обемът се свие до тази точка. Средната плътност на хетерогенно вещество е отношението m/V.
Плътността на веществото зависи от неговата маса , от които се състои, и върху плътността на опаковкатаатомии молекули в материята. Колкото по-голяма е масатаатоми, толкова по-голяма е плътността.
Видове плътност и мерни единици
Плътността се измерва в kg/m³ в системата SI и в g/cm³ в системата GHS, останалата част (g/ml, kg/l, 1 t/ ) – производни.
За гранулирани и порести тела има:
- истинска плътност, определена без отчитане на празнините
-видима плътност, изчислена като съотношение на масата на веществото към целия обем, който то заема.
Зависимост на плътността от температурата
Като правило, когато температурата намалява, плътността се увеличава, въпреки че има вещества, чиято плътност се държи по различен начин, например вода, бронз иизлято желязо.
По този начин плътността на водата има максимална стойност при 4 °C и намалява както с повишаване, така и с понижаване на температурата.
2. Определяне на концентрацията титриметричен анализ
При титриметричния анализ два разтвора се принуждават да реагират и краят на реакцията се определя възможно най-точно. Познавайки концентрацията на един разтвор, можете да определите точната концентрация на друг.
Всеки метод използва свои собствени работни решения и индикатори и решава съответните типични проблеми.
В зависимост от вида на реакцията, протичаща по време на титруване, се разграничават няколко метода за обемен анализ.
От тях най-често използваните са:
1. Метод на неутрализация.
Основната реакция е реакцията на неутрализация: взаимодействието на киселина с основа.
2. Метод на оксидиметрия, включително методи на перманганатометрия и йодометрия. Основава се на окислително-редукционни реакции.
3. Метод на отлагане.
Основава се на образуването на слабо разтворими съединения.
4. Комплексометричен метод – за образуване на нискодисоцииращи комплексни йони и молекули.
Основни понятия и термини на титриметричния анализ.
Титрант - разтвор на реагент с известна концентрация (стандартен разтвор).
Стандартно решение – Първичните вторични стандартни разтвори се разграничават според метода на приготвяне. Първичният се приготвя чрез разтваряне на точно определено количество чист химикал в определено количество разтворител. Вторичният се приготвя с приблизителна концентрация и концентрацията му се определя с помощта на първичния стандарт.
Точка на еквивалентност – моментът, в който добавеният обем на работния разтвор съдържа количество вещество, еквивалентно на количеството на определяното вещество.
Цел на титруването - точно измерване на обемите на два разтвора, съдържащи еквивалентно количество вещество
Директно титруване – това е титруване на определено вещество „А” директно с титрант „В”. Използва се, ако реакцията между „А” и „Б” протича бързо.
Схема на титриметрично определяне.
За извършване на титриметрично определяне са необходими стандартни (работни) разтвори, т.е. разтвори с точна нормалност или титър.
Такива разтвори се приготвят чрез точно или приблизително претегляне, но след това точната концентрация се определя чрез титруване с разтвори на втвърдяващи вещества.
За киселините инсталационните разтвори са: натриев тетраборат (боракс), натриев оксалат, амониев оксалат.
За алкали: оксалова киселина, янтарна киселина
Приготвянето на разтвора включва три етапа:
Изчисляване на теглото
Поемане на засечка
Разтваряне на пробата
Ако концентрацията се определя с помощта на точна проба, тя се претегля на аналитична везна.
Ако концентрацията не може да се определи от точна проба, тогава тя се взема на технохимичен баланс, а при течните вещества се измерва изчисленият обем.
За да се определи точната концентрация, се извършва титруване, което се състои в това, че два разтвора реагират един с друг и точката на еквивалентност се фиксира с помощта на индикатор.
Концентрацията на един от разтворите (работен) е точно известна. Обикновено се поставя в бюрета. Вторият разтвор с неизвестна концентрация се пипетира в конични колби в строго определени обеми (метод на пипетиране) или точна проба се разтваря в произволно количество разтворител (метод на отделна проба). Към всяка колба се добавя индикатор. Титруването се извършва най-малко 3 пъти, докато резултатите се сближат; разликата между резултатите не трябва да надвишава 0,1 ml. Дефиницията завършва с изчисляването на резултатите от анализа. Най-важният момент е да се фиксира точката на еквивалентност.
Шест правила за титруване .
1. Титруването се извършва в конични стъклени колби;
2. Съдържанието на колбата се смесва с въртеливи движения, без да се изважда колбата изпод бюретата.
3. Удълженият край на бюретата трябва да е на 1 cm под горния ръб на колбата. Нивото на течността в бюретата се настройва на нула преди всяко титруване.
4. Титрува се на малки порции - капка по капка.
5. Титруването се повтаря най-малко 3 пъти, докато се получат постоянни резултати с разлика не повече от 0,1 ml.
6. След края на титруването деленията се преброяват след 20-30 секунди, за да се отцеди течността, останала по стените на бюретата.
Условия за титриметрично определяне на концентрацията на вещество.
При обемния анализ основната операция е да се измери обемът на два взаимодействащи разтвора, единият от които съдържа аналита, а концентрацията на втория е предварително известна. Неизвестната концентрация на анализирания разтвор се определя, като се знае съотношението на обемите на реагиращите разтвори и концентрацията на един от тях.
За успешно извършване на обемен анализ трябва да бъдат изпълнени следните условия:
Реакцията между реагиращите вещества трябва да бъде завършена и да протече бързо и количествено.
Тъй като по време на титруването е необходимо точно да се установи моментът на еквивалентност или да се фиксира точката на еквивалентност, краят на реакцията между разтворите трябва да бъде ясно видим чрез промяна в цвета на разтвора или чрез появата на цветна утайка.
Индикаторите често се използват за установяване на точката на еквивалентност в обемния анализ
Концентрацията на разтвора на един от разтворите (работен разтвор) трябва да бъде точно известна. Други вещества в разтвора не трябва да пречат на основната реакция.
Приготвяне на стандартни разтвори.
1. Приготвяне на титруван разтвор според точното претегляне на изходното вещество
Основният разтвор в обемния анализ е титруван илистандартен- разтвор на изходния реагент, по време на титруването на който се определя съдържанието на веществото в анализирания разтвор.
Най-простият начин за приготвяне на разтвор с точно известна концентрация, т.е. характеризиращ се с определен титър, е да се разтвори точна претеглена част от първоначалното химически чисто вещество във вода или друг разтворител и да се разреди полученият разтвор до необходимия обем. Познавайки масата (А ) на химически чисто съединение, разтворено във вода и обема (V) на получения разтвор, лесно е да се изчисли титърът (T) на приготвения реагент:
T = a/V (g/ml)
При този метод се приготвят титрувани разтвори на вещества, които лесно се получават в чист вид и чийто състав отговаря на точно определена формула и не се променя по време на съхранение. Директният метод за приготвяне на титрувани разтвори се използва само в определени случаи. По този начин е невъзможно да се приготвят титрувани разтвори на вещества, които са силно хигроскопични, лесно губят вода от кристализация, изложени са на атмосферен въглероден диоксид и др.
2. Задаване на титъра на разтвора с помощта на агент за настройка
Този метод за определяне на титри се основава на приготвяне на разтвор на реагент с приблизително необходимата нормалност и след това точно определяне на концентрацията на получения разтвор.Титърилинормалностприготвения разтвор се определя чрез титруване на разтвори на т.наринсталационни вещества.
Втвърдяващото вещество е химически чисто съединение с точно известен състав, използвано за определяне на титъра на разтвор на друго вещество.
Въз основа на данните от титруването на веществото за настройка се изчислява точният титър или нормалност на приготвения разтвор.
Разтворът на химически чисто втвърдяващо се вещество се приготвя чрез разтваряне на изчисленото му количество (претеглено на аналитична везна) във вода и след това обемът на разтвора се довежда до определена стойност в мерителна колба. Отделни (аликвотни) части от така приготвения разтвор се пипетират от мерителна колба в конични колби и се титруват с разтвор, чийто титър се установява. Титруването се извършва няколко пъти и се взема средният резултат.
ИЗЧИСЛЕНИЯ В ОБЕМНИЯ АНАЛИЗ.
1. Изчисляване на нормалността на анализирания разтвор въз основа на нормалността на работния разтвор
Когато две вещества взаимодействат, грам еквивалент на едното реагира с грам еквивалент на другото. Разтвори на различни вещества с еднаква нормалност съдържат в равни обеми еднакъв брой грам еквиваленти от разтвореното вещество. Следователно равни обеми от такива разтвори съдържат еквивалентни количества от веществото. Следователно, например, за неутрализиране на 10 ml 1N. HCI изисква точно 10 ml 1N. разтвор на NaOH.Разтвори с еднаква нормалност реагират в равни обеми.
Познавайки нормалността на един от двата реагиращи разтвора и техните обеми, изразходвани за взаимно титруване, е лесно да се определи неизвестната нормалност на втория разтвор. Нека означим нормалността на първото решение с N 2 и обемът му през V 2 . Тогава, въз основа на казаното, можем да създадем равенството
V 1 н 1 =V 2 н 2
2. Изчисляване титър за работното вещество.
Това е масата на разтвореното вещество, изразено в грамове, съдържащо се в един милилитър разтвор. Титърът се изчислява като съотношение на масата на разтвореното вещество към обема на разтвора (g/ml).
T= m/ V
където: m - масата на разтвореното вещество, g; V - общ обем на разтвора, ml;
T=E*н/1000.(g/ml)
Понякога, за да се посочи точната концентрация на титруваните разтвори, се използва т.наркорекционен факторилиизменение К.
K = взето действително тегло/изчислено тегло.
Корекцията показва с какво число трябва да се умножи обемът на даден разтвор, за да се доведе до обема на разтвор с определена нормалност.
Очевидно, ако корекцията за дадено решение е по-голяма от единица, тогава неговата действителна нормалност е по-голяма от нормалността, взета за стандарт; ако корекцията е по-малка от единица, тогава действителната нормалност на решението е по-малка от референтната нормалност.
Пример: От 1.3400Ж Х. ч.NaClварени 200мл решение. Изчислете корекцията, за да доведете концентрацията на приготвения разтвор до точно 0,1 N.
Решение. На 200мл O,1n. решениеNaClтрябва да съдържа
58.44*0.1*200/1000 =1.1688g
Следователно: K=1,3400/1,1688=1,146
Корекцията може да се изчисли като съотношението на титъра на приготвения разтвор към титъра на разтвор с определена нормалност:
K = Титър на приготвения разтвор/ титър на разтвора с определена нормалност
В нашия пример титърът на приготвения разтвор е 1,340/200= 0,00670g/ml
Tetr 0,1 N разтворNaClравно на 0,005844g/ml
Следователно K= 0,00670/0,005844=1,146
Заключение: Ако корекцията за дадено решение е по-голяма от единица, тогава неговата действителна нормалност е по-голяма от нормалността, приета за стандарт; Ако корекцията е по-малка от единица, тогава действителната й нормалност е по-малка от референтната.
3. Изчисляване на количеството на аналита от титъра на работния разтвор, изразен в грамове от аналита.
Титърът на работния разтвор в грамове от аналита е равен на броя грамове от аналита, което е еквивалентно на количеството вещество, съдържащо се в 1 ml от работния разтвор. Познавайки титъра на работния разтвор за аналита Т и обема на работния разтвор, използван за титруване, можете да изчислите броя на грамовете (масата) на аналита.
Пример. Изчислете процента на Na 2 CO 3 в пробата, ако за титруване пробата е 0,100 g. Консумирани са 15,00 ml 0,1 N.HCI.
Решение .
М(На 2 CO 3 ) =106,00 гр. д(На 2 CO 3 ) =53,00 гр.
T(HCI/Na 2 CO 3 )= д(На 2 CO 3 )* Н HCI./1000 Ж/ мл
m(Na 2 CO 3 ) = T(HCI/Na 2 CO 3 ) В HCI=0,0053*15,00=0,0795 Ж.
Na процент 2 CO 3 се равнява на 79,5%
4. Изчисляване на броя милиграм еквиваленти на изпитваното вещество.
Чрез умножаване на нормалността на работния разтвор по неговия обем, изразходван за титруване на тестваното вещество, получаваме броя милиграм еквиваленти на разтвореното вещество в титруваната част от тестваното вещество.
Списък на използваната литература
Алексеев В. Н. “Количествен анализ”
Золотов Ю. “Основи на аналитичната химия”
Крешков А.П., Ярославцев А.А. „Курс по аналитична химия. Количествен анализ"
Пискарева С.К., Барашков К.М. “Аналитична химия”
Шапиро С.А., Гурвич Я.А. "Аналитична химия"
Решения
Приготвяне на солеви разтвори
Техника за определяне концентрацията на разтвори.
Определяне на концентрация чрез денсиметрия
Определяне на концентрацията титриметрично.
Основни понятия и термини на титриметричния анализ.
Схема на титриметрично определяне.
Шест правила за титруване.
Условия за титриметрично определяне на концентрацията на веществото
Приготвяне на титруван разтвор чрез точно претегляне на изходното вещество
Настройване на титъра на разтвора с помощта на коригиращ агент
Изчисления при обемен анализ.
Списък на използваната литература
РЕШЕНИЯ
1. Концепцията за разтвори и разтворимост
Както при качествения, така и при количествения анализ основната работа се извършва с решения. Обикновено, когато използваме името „решение“, имаме предвид истински решения. В истинските разтвори разтвореното вещество под формата на отделни молекули или йони се разпределя между молекулите на разтворителя.
Решение- хомогенна (хомогенна) смес, състояща се от частици от разтворено вещество, разтворител и продуктите на тяхното взаимодействие. Когато твърдо вещество се разтвори във вода или друг разтворител, молекулите на повърхностния слой преминават в разтворителя и в резултат на дифузия се разпределят в целия обем на разтворителя, след което нов слой от молекули преминава в разтворителя , и т.н. Едновременно с разтворителя протича и обратният процес - отделяне на молекули от разтвора. Колкото по-висока е концентрацията на разтвора, толкова повече ще се случи този процес. Чрез увеличаване на концентрацията на разтвора, без да променяме други условия, достигаме състояние, при което за единица време същият брой молекули от разтвореното вещество ще бъдат освободени от разтвора, тъй като те се разтварят. Това решение се нарича наситен.Ако добавите дори малко количество разтворено вещество към него, то ще остане неразтворено.
Разтворимост- способността на веществото да образува хомогенни системи с други вещества - разтвори, в които веществото е под формата на отделни атоми, йони, молекули или частици. Количеството вещество в наситен разтвор определя разтворимоствещества при определени условия. Разтворимостта на различните вещества в определени разтворители е различна. В определено количество от всеки разтворител може да се разтвори не повече от определено количество от дадено вещество. Разтворимостизразено чрез броя грамове вещество на 100 g разтворител в наситен разтвор при дадена температура . Въз основа на способността им да се разтварят във вода веществата се делят на: 1) силно разтворими (сода каустик, захар); 2) слабо разтворими (гипс, бертолетова сол); 3) практически неразтворим (меден сулфит). Практически неразтворимите вещества често се наричат неразтворими, въпреки че няма абсолютно неразтворими вещества. „Неразтворимите вещества обикновено се наричат онези вещества, чиято разтворимост е изключително ниска (1 тегловна част от веществото се разтваря в 10 000 части разтворител).
Обикновено разтворимостта на твърдите вещества се увеличава с повишаване на температурата. Ако приготвите разтвор, който е близък до наситен чрез нагряване, и след това бързо, но внимателно го охладете, т.нар свръхнаситен разтвор.Ако пуснете кристал от разтворено вещество в такъв разтвор или го смесите, тогава кристалите ще започнат да падат от разтвора. Следователно, охладеният разтвор съдържа повече вещество, отколкото е възможно за наситен разтвор при дадена температура. Следователно, когато се добави кристал от разтворено вещество, цялото излишно вещество кристализира.
Свойствата на разтворите винаги се различават от свойствата на разтворителя. Разтворът кипи при по-висока температура от чистия разтворител. Напротив, точката на замръзване на разтвора е по-ниска от тази на разтворителя.
Според естеството на разтворителя разтворите се делят на водни и неводни.Последните включват разтвори на вещества в органични разтворители като алкохол, ацетон, бензен, хлороформ и др.
Разтворите на повечето соли, киселини и основи се приготвят във водни разтвори.
2. Методи за изразяване на концентрацията на разтворите. Понятието грам еквивалент.
Всеки разтвор се характеризира с концентрация на разтворено вещество: количеството вещество, съдържащо се в определено количество разтвор. Концентрацията на разтворите може да бъде изразена като процент, в молове на 1 литър разтвор, в еквиваленти на 1 литър разтвор и чрез титър.
Концентрацията на веществата в разтворите може да се изрази по различни начини:
Масовата част на разтвореното вещество w(B) е безразмерна величина, равна на отношението на масата на разтвореното вещество към общата маса на разтвора m
или наречено по друг начин: процентна концентрацияразтвор - определя се от броя на грамовете вещество в 100 g разтвор. Например 5% разтвор съдържа 5 g вещество в 100 g разтвор, т.е. 5 g вещество и 100-5 = 95 g разтворител.
Моларната концентрация C(B) показва колко мола разтворено вещество се съдържат в 1 литър разтвор.
C(B) = n(B) / V = m(B) / (M(B) V),
където M(B) е моларната маса на разтвореното вещество g/mol.
Моларната концентрация се измерва в mol/L и се обозначава с "M". Например, 2 М NaOH е двумоларен разтвор на натриев хидроксид; мономоларните (1 М) разтвори съдържат 1 мол вещество на 1 литър разтвор, бимоларните (2 М) разтвори съдържат 2 мола на 1 литър и т.н.
За да установите колко грама от дадено вещество има в 1 литър разтвор с дадена моларна концентрация, трябва да го знаете моларна маса,т.е. масата на 1 мол. Моларната маса на веществото, изразена в грамове, е числено равна на молекулната маса на веществото. Например, молекулното тегло на NaCl е 58,45, следователно моларната маса също е 58,45 g. По този начин 1 М разтвор на NaCl съдържа 58,45 g натриев хлорид в 1 литър разтвор.
Нормалността на разтвор показва броя на грам еквиваленти от дадено вещество в един литър разтвор или броя на милиграм еквиваленти в един милилитър разтвор.
Грамов еквивалентот вещество е броят грамове от вещество, което е числено равно на неговия еквивалент.
Съставен еквивалент- наричат количеството му, което отговаря (еквивалентно) на 1 мол водород в дадена реакция.
Коефициентът на еквивалентност се определя от:
1) естеството на веществото,
2) специфична химическа реакция.
а) при метаболитни реакции;
Еквивалентната стойност на киселините се определя от броя на водородните атоми, които могат да бъдат заменени с метални атоми в киселинната молекула.
Пример 1.Определете еквивалента на киселини: а) HCl, б) H 2 SO 4, в) H 3 PO 4; г) З 4.
Решение.
В случай на многоосновни киселини, еквивалентът зависи от специфичната реакция:
а) H 2 SO 4 + 2KOH → K 2 SO 4 + 2H 2 O.
в тази реакция два водородни атома се заместват в молекулата на сярната киселина, следователно E = M.M/2
б) H 2 SO 4 + KOH → KHSO 4 + H 2 O.
В този случай един водороден атом е заменен в молекулата на сярната киселина E = M.M/1
За фосфорната киселина, в зависимост от реакцията, стойностите са а) E = M.M/1
b) E= M.M/2 c) E= M.M/3
БАЗИ
Основният еквивалент се определя от броя на хидроксилните групи, които могат да бъдат заменени от киселинния остатък.
Пример 2.Определете еквивалента на основите: а) КОН; b) Cu(OH)2;
Решение.
Стойностите на солния еквивалент се определят от катион.
Стойността, на която трябва да се раздели М в случая на соли, е равна на q·n, Където р– заряд на металния катион, н– броят на катионите във формулата на солта.
Пример 3.Определете еквивалента на солите: а) KNO 3 ; b) Na3PO4; c) Cr2(SO4)3;
Решение.
а) q·n = 1б) 1 3 = 3 V) z = 3 2 = 6, G) z = 3 1 = 3
Стойността на коефициентите на еквивалентност за солите също зависи от
реакция, подобна на нейната зависимост за киселини и основи.
б) при окислително-възстановителни реакцииза определяне
еквивалентно използване на схема за електронен баланс.
Стойността, на която трябва да се раздели M.M за вещество в този случай, е равна на броя на електроните, приети или отдадени от молекула на веществото.
K 2 Cr 2 O 7 + HCl → CrCl 3 + Cl 2 + KCl + H 2 O
за права линия 2Сr +6 +2 3 д→2Cr 3+
реакции 2Cl - - 2 1 д→Cl 2
за обратен 2Cr+3-2 3 д→Cr +6
Cl2-2 реакции д→2Cl
(K 2 Cr 2 O 7) = 1/6
(Cr)=1/3 (HCl)=1 (Cl)=1) (Cl2)=1/2 (Cl)=1
Нормалната концентрация е обозначена с буквата н (във формулите за изчисление) или буквата „n“ - при посочване на концентрацията на даден разтвор. Ако 1 литър разтвор съдържа 0,1 еквивалент от вещество, той се нарича децинормален и се обозначава като 0,1 N. Разтвор, съдържащ 0,01 еквивалента вещество в 1 литър разтвор, се нарича сантинормален и се обозначава като 0,01 N. Тъй като еквивалентът е количеството на всяко вещество, което е в дадена реакция. съответства на 1 мол водород, очевидно еквивалентът на всяко вещество в тази реакция трябва да съответства на еквивалента на всяко друго вещество. Това означава, че при всяка реакция веществата реагират в еквивалентни количества.
Титрирансе наричат разтвори, чиято концентрация се изразява надпис,т.е. броят на грамовете вещество, разтворено в 1 ml разтвор. Много често в аналитичните лаборатории титрите на разтвора се преизчисляват директно спрямо определяното вещество. Tog даТитърът на разтвора показва колко грама от определяното вещество съответства на 1 ml от този разтвор.
За да се приготвят разтвори с моларни и нормални концентрации, проба от веществото се претегля на аналитична везна и разтворите се приготвят в мерителна колба. При приготвяне на киселинни разтвори необходимият обем концентриран киселинен разтвор се измерва с бюрета със стъклен спирателен кран.
Теглото на разтвореното вещество се изчислява до четвъртия знак след десетичната запетая, а молекулните тегла се вземат с точността, с която са дадени в референтните таблици. Обемът на концентрираната киселина се изчислява до втория знак след десетичната запетая.
При приготвяне на разтвори с процентна концентрация веществото се претегля на технико-химичен баланс, а течностите се измерват с мерителен цилиндър. Следователно теглото на веществото се изчислява с точност до 0,1 g, а обемът на 1 течност с точност до 1 ml.
Преди да започнете да приготвяте разтвора, е необходимо да направите изчисление, т.е. да изчислите количеството разтворено вещество и разтворител, за да приготвите определено количество разтвор с дадена концентрация.
3. Изчисления при приготвяне на солни разтвори
Пример 1. Необходимо е да се приготвят 500 g 5% разтвор на калиев нитрат. 100 g от такъв разтвор съдържа 5 g KN0 3; Да направим пропорция:
100 g разтвор - 5 g KN0 3
500" - х» KN0 3
5*500/100 = 25гр.
Трябва да вземете 500-25 = 475 ml вода.
Пример 2. Необходимо е да се приготвят 500 g 5% разтвор на CaCI от солта CaCl 2 .6H 2 0. Първо извършваме изчислението за безводната сол.
100 g разтвор - 5 g CaCl 2
500 "" - x g CaC1 2
5*500/100 = 25гр
Моларна маса на CaCl 2 = 111, моларна маса на CaCl 2 6H 2 0 = 219. Следователно,
219 g CaC1 2 *6H 2 0 съдържат 111 g CaC1 2. Да направим пропорция:
219 g CaC1 2 *6H 2 0 -- 111 g CaC1 2
х"СаС1 2 -6Н 2 0-25" CaCI 2,
219*25/ 111= 49,3гр.
Количеството вода е 500-49,3=450,7 гр., или 450,7 мл. Тъй като водата се измерва с помощта на мерителен цилиндър, десети от милилитър не се вземат предвид. Следователно трябва да измерите 451 ml вода.
4. Изчисления за приготвяне на киселинни разтвори
При приготвянето на киселинни разтвори е необходимо да се има предвид, че концентрираните киселинни разтвори не са 100% и съдържат вода. Освен това необходимото количество киселина не се претегля, а се измерва с помощта на мерителен цилиндър.
Пример 1. Необходимо е да се приготвят 500 g 10% разтвор на солна киселина от наличната 58% киселина, чиято плътност е d = l.19.
1. Намерете количеството чист хлороводород, което трябва да бъде в приготвения киселинен разтвор:
100 g разтвор -10 g НС1
500 "" - х» NS1
500*10/100= 50гр
За да се изчислят разтвори с процентна концентрация, моларната маса се закръгля до цели числа.
2. Намерете броя на грамовете концентрирана киселина, които ще съдържат 50 g НС1:
100 g киселина - 38 g НС1
х» » - 50 » NS1
100 50/38 = 131,6 g.
3. Намерете обема, зает от това количество киселина:
V= 131,6/ 1,19= 110,6 мл. (закръглено до 111)
4. Количеството разтворител (вода) е 500-131,6 = 368,4 g, или 368,4 ml. Тъй като необходимото количество вода и киселина се измерва с мерителен цилиндър, десети от милилитъра не се вземат предвид. Следователно, за да приготвите 500 g 10% разтвор на солна киселина, трябва да вземете 111 ml солна киселина и 368 ml вода.
Пример 2. Обикновено, когато се правят изчисления за приготвяне на киселини, се използват стандартни таблици, които показват процента на киселинния разтвор, плътността на този разтвор при определена температура и броя на грамовете на тази киселина, съдържащи се в 1 литър разтвор с тази концентрация. В този случай изчислението е опростено. Количеството приготвен киселинен разтвор може да се изчисли за определен обем.
Например, трябва да приготвите 500 ml 10% разтвор на солна киселина на базата на концентриран 38% разтвор. Според таблиците установяваме, че 10% разтвор на солна киселина съдържа 104,7 g НС1 в 1 литър разтвор. Трябва да подготвим 500 ml, следователно разтворът трябва да съдържа 104,7:2 = 52,35 g HCl.
Нека изчислим колко концентрирана киселина трябва да вземете. Според таблицата 1 литър концентрирана НС1 съдържа 451,6 g НС1. Да направим пропорция:
1000 ml - 451,6 g НС1
X мл- 52.35 "NS1
1000*52,35/ 451,6 =115,9 мл.
Количеството вода е 500-116 = 384 мл.
Следователно, за да приготвите 500 ml 10% разтвор на солна киселина, трябва да вземете 116 ml концентриран разтвор на НС1 и 384 ml вода.
Пример 1. Колко грама бариев хлорид са необходими за приготвяне на 2 литра 0,2 М разтвор?
Решение.Молекулното тегло на бариевия хлорид е 208,27. Следователно. 1 литър от 0,2 М разтвор трябва да съдържа 208,27 * 0,2 = 41,654 g BaCI 2 . За да приготвите 2 литра, ще ви трябват 41,654 * 2 = 83,308 g BaCI 2.
Пример 2. Колко грама безводна сода Na 2 C0 3 са необходими за приготвяне на 500 ml 0,1 N. решение?
Решение.Молекулното тегло на содата е 106.004; еквивалентна маса на Na 2 C0 3 =M: 2 = 53,002; 0,1 екв. = 5,3002 g
1000 ml 0,1 н. разтворът съдържа 5,3002 g Na 2 C0 3
500 »» » » х
» Na 2 C0 3
x = 2,6501 g Na 2 C0 3.
Пример 3. Колко концентрирана сярна киселина (96%: d=l,84) е необходима за приготвяне на 2 литра 0,05 N. разтвор на сярна киселина?
Решение.Молекулното тегло на сярната киселина е 98,08. Еквивалентна маса на сярна киселина H 2 so 4 = M: 2 = 98,08: 2 = 49,04 g Маса 0,05 екв. = 49,04*0,05 = 2,452 g.
Нека намерим колко H 2 S0 4 трябва да се съдържа в 2 литра от 0,05 n. решение:
1 l-2,452 g H2S04
2"- х » H 2 S0 4
х= 2,452*2 = 4,904 g H2S04.
За да определим колко 96,% разтвор на H 2 S0 4 трябва да се вземе за това, нека направим пропорция:
в 100 гр. конц. H2S04 -96 g H2S04
U» » H 2 S0 4 -4,904 g H 2 S0 4
Y = 5,11 g H2S04.
Преизчисляваме тази сума в обем: 5,11: 1,84 = 2,77
Така се приготвят 2 литра 0,05 н. разтвор трябва да вземете 2,77 ml концентрирана сярна киселина.
Пример 4. Изчислете титъра на разтвор на NaOH, ако е известно, че точната му концентрация е 0,0520 N.
Решение.Нека припомним, че титърът е съдържанието в 1 ml разтвор на вещество в грамове. Еквивалентна маса на NaOH=40. 01 g Нека намерим колко грама NaOH се съдържат в 1 литър от този разтвор:
40,01*0,0520 = 2,0805 g.
1 литър разтвор съдържа 1000 мл.
Т=0,00208 g/ml. Можете също да използвате формулата:
T=E N/1000 g/l
Където T- титър, g/ml; д- еквивалентна маса; Н-нормалност на решението.
Тогава титърът на този разтвор е: 40,01 0,0520/1000 = 0,00208 g/ml.
Пример 5 Изчислете нормалната концентрация на разтвор HN0 3, ако е известно, че титърът на този разтвор е 0,0065 За изчисляване използваме формулата:
T=E N/1000 g/l, от тук:
N=T1000/E0,0065.1000/ 63,05= 0,1030 n.
Пример 6. Каква е нормалната концентрация на разтвор, ако е известно, че 200 ml от този разтвор съдържа 2,6501 g Na 2 C0 3
Решение.Както е изчислено в пример 2: ENа 2 с 3 =53.002.
Нека намерим колко еквивалента са 2,6501 g Na 2 C0 3:
2,6501: 53,002 = 0,05 екв.
За да изчислим нормалната концентрация на разтвор, създаваме пропорция:
1000 "" Х "
1 литър от този разтвор ще съдържа 0,25 еквивалента, т.е. разтворът ще бъде 0,25 N.
За това изчисление можете да използвате формулата:
N = P 1000/E V
Където Р - количество вещество в грамове; д - еквивалентна маса на веществото; V - обем на разтвора в милилитри.
ENа 2 с 3 =53.002, то нормалната концентрация на този разтвор е
2,6501* 1000 / 53,002*200=0,25
5.Преизчисляване на концентрацията от един вид в друг.
В лабораторната практика често е необходимо да се преизчисли концентрацията на наличните разтвори от една единица в друга. Когато преобразувате процентната концентрация в моларна концентрация и обратно, е необходимо да запомните, че процентната концентрация се изчислява за определена маса на разтвора, а моларната и нормалната концентрация се изчисляват за обема, следователно за преобразуване трябва да познайте плътността на разтвора.
Плътността на разтвора се дава в справочниците в съответните таблици или се измерва с хидрометър. Ако обозначим: СЪС- процентна концентрация; М- моларна концентрация; N - нормална концентрация; д- плътност на разтвора; д- еквивалентна маса; м- моларна маса, тогава формулите за преобразуване от процентна концентрация в моларна и нормална концентрация ще бъдат както следва:
Пример 1. Каква е моларната и нормалната концентрация на 12% разтвор на сярна киселина, чиято плътност е d = l,08 g/cm??
Решение.Моларната маса на сярната киселина е 98. Следователно,
E n 2, така че 4 =98:2=49.
Замествайки необходимите стойности във формулите, получаваме:
1) моларната концентрация на 12% разтвор на сярна киселина е
M=12*1.08 *10/98=1.32 M;
2) нормалната концентрация на 12% разтвор на сярна киселина е
N= 12*1.08*10/49= 2.64 n.
Пример 2. Каква е процентната концентрация на 1 N. разтвор на солна киселина, чиято плътност е 1,013?
Решение.Моларната маса на HCI е 36,5, следователно Ens1 = 36,5. От горната формула (2) получаваме:
следователно процентната концентрация е 1 N. разтвор на солна киселина е равен на
36,5*1/ 1,013*10 =3,6%
Понякога в лабораторната практика е необходимо моларната концентрация да се преизчисли до нормална и обратно. Ако еквивалентната маса на дадено вещество е равна на моларната маса (например KOH), тогава нормалната концентрация е равна на моларната концентрация. И така, 1 n. разтвор на солна киселина ще бъде едновременно 1 М разтвор. За повечето съединения обаче еквивалентната маса не е равна на моларната маса и следователно нормалната концентрация на разтвори на тези вещества не е равна на моларната концентрация. За преобразуване от една концентрация в друга можем да използваме формулите:
M = (NE)/m; N=M(m/E)
Пример 3. Нормална концентрация на 1М разтвор на сярна киселина Отговор-2М
Пример 4, Моларна концентрация 0,5 N. Разтвор на Na 2 CO 3 Отговор - 0.25H
Когато преобразувате процентната концентрация в моларна концентрация и обратно, е необходимо да запомните, че процентната концентрация се изчислява за определена маса разтвор, а моларната и нормална концентрация се изчисляват за обем, следователно за преобразуване трябва да знаете плътността на решение. Ако обозначим: c - процентна концентрация; M - моларна концентрация; N - нормална концентрация; e - еквивалентна маса, r - плътност на разтвора; m е моларна маса, тогава формулите за преобразуване от процентна концентрация ще бъдат както следва:
M = (s p 10)/m
N = (c p 10)/e
Същите формули могат да се използват, ако трябва да преобразувате нормална или моларна концентрация в проценти.
Понякога в лабораторната практика е необходимо моларната концентрация да се преизчисли до нормална и обратно. Ако еквивалентната маса на дадено вещество е равна на моларната маса (например за HCl, KCl, KOH), тогава нормалната концентрация е равна на моларната концентрация. И така, 1 n. разтвор на солна киселина ще бъде едновременно 1 М разтвор. За повечето съединения обаче еквивалентната маса не е равна на моларната маса и следователно нормалната концентрация на разтвори на тези вещества не е равна на моларната концентрация.
За да преобразувате от една концентрация в друга, можете да използвате следните формули:
M = (N E)/m
N = (M m)/E
Закон за смесване на разтвори
Количествата на смесените разтвори са обратно пропорционални на абсолютните разлики между техните концентрации и концентрацията на получения разтвор.
Законът за смесване може да се изрази с математическа формула:
mA/mB =С-b/а-с,
където mA,mB са количествата разтвори А и Б, взети за смесване;
a, b, c - съответно концентрациите на разтвори А и В и разтвора, получен в резултат на смесване. Ако концентрацията е изразена в %, тогава количествата смесени разтвори трябва да се вземат в тегловни единици; ако концентрациите са взети в молове или нормали, тогава количествата на смесените разтвори трябва да бъдат изразени само в литри.
За по-лесно използване правила за смесванеПриложи правило на кръста:

m1 / m2 = (w3 – w2) / (w1 – w3)
За да направите това, извадете по-малката диагонално от по-голямата стойност на концентрация, получавайки (w 1 – w 3), w 1 > w 3 и (w 3 – w 2), w 3 > w 2. След това се съставя и изчислява съотношението на масата на първоначалните разтвори m 1 / m 2.
Пример
Определете масите на първоначалните разтвори с масови части на натриев хидроксид от 5% и 40%, ако смесването им доведе до разтвор с тегло 210 g с масова част от натриев хидроксид 10%.

5 / 30 = m 1 / (210 - m 1)
1/6 = m 1 / (210 – m 1)
210 – m 1 = 6m 1
7m 1 = 210
m1 =30 g; m 2 = 210 – m 1 = 210 – 30 = 180 g
Основни понятия и термини на титриметричния анализ.
Титрант -разтвор на реагент с известна концентрация (стандартен разтвор).
Стандартно решение– Първичните вторични стандартни разтвори се разграничават според метода на приготвяне. Първичният се приготвя чрез разтваряне на точно определено количество чист химикал в определено количество разтворител. Вторичният се приготвя с приблизителна концентрация и концентрацията му се определя с помощта на първичния стандарт.
Точка на еквивалентност– моментът, в който добавеният обем на работния разтвор съдържа количество вещество, еквивалентно на количеството на определяното вещество.
Цел на титруването- точно измерване на обемите на два разтвора, съдържащи еквивалентно количество вещество
Директно титруване– това е титруване на определено вещество „А” директно с титрант „В”. Използва се, ако реакцията между „А” и „Б” протича бързо.
Решения
Концепцията за разтвори и разтворимост
Методи за изразяване на концентрацията на разтворите. Понятието грам еквивалент.
Изчисления за приготвяне на разтвори на соли и киселини
Преизчисляване на концентрацията от един вид в друг.
Разтвори за смесване и разреждане
Техника за приготвяне на разтвори.
Приготвяне на солеви разтвори
Приготвяне на киселинни разтвори
Приготвяне на базови разтвори
Приготвяне на работен разтвор от фиксанал.
Изпратете добрата си работа в базата знания е лесно. Използвайте формата по-долу
Студенти, докторанти, млади учени, които използват базата от знания в обучението и работата си, ще ви бъдат много благодарни.
Публикувано на http://www.allbest.ru/
Министерство на образованието и науката на Руската федерация
Федерална държавна бюджетна образователна институция за висше професионално образование
"Южен Уралски държавен университет"
(национален изследователски университет)
Катедра Технологии и обществено хранене
Приготвяне на киселинни разтвори
Изпълнено от: Шарапова V.N.
Проверен от: Сидоренкова Л.А.
Челябинск 2014 г
- 1. Приготвяне на киселинни разтвори
- 2. Изчисления при приготвяне на разтвори и характеристики на приготвяне на разтвори с различни концентрации
- 2.1 Изчисления за приготвяне на разтвори с нормална концентрация
- 2.2 Изчисления при приготвяне на разтвори, чиято концентрация се изразява в грамове на 1 l
- 2.3 Изчисления при приготвяне на разтвори с определена процентна концентрация
1. Приготвяне на киселинни разтвори
При неутрализационните анализи се използва 0,1 N. и 0,5 n. точни разтвори на сярна и солна киселина, а в други методи за анализ, например редокс, често се използва 2 N. приблизителни разтвори на тези киселини.
За бързо приготвяне на точни разтвори е удобно да се използват фиксали, които са претеглени порции (0,1 g-equiv или 0,01 g-equiv) от химически чисти вещества, претеглени с точност от четири до пет значими цифри, разположени в запечатани стъклени ампули. При приготвяне на 1л. разтвор от фиксанал се получава 0,1 N. или 0,01 n. решения. Малки количества разтвори на солна и сярна киселина 0,1 N. концентрации могат да се приготвят от фиксанали. Стандартни разтвори, приготвени от фиксанали, обикновено се използват за установяване или проверка на концентрацията на други разтвори. Киселините Fixanal могат да се съхраняват дълго време.
За да приготвите точен разтвор от фиксанал, измийте ампулата с топла вода, измийте надписа или етикета от нея и я избършете добре. Ако надписът е направен с боя, тогава той се отстранява с кърпа, навлажнена с алкохол. В мерителна колба от 1 литър. поставете стъклена фуния и в нея стъклен ударник, чийто остър край трябва да е насочен нагоре. След това ампулата с фиксанал се удря леко с тънкото си дъно по върха на ударника или се оставя да падне свободно, така че дъното да се счупи при удар с върха. След това с помощта на стъклена игла със заострен край разбиват тънката стена на вдлъбнатината в горната част на ампулата и позволяват на съдържащата се в ампулата течност да изтече. След това ампулата, разположена във фунията, се измива обилно с дестилирана вода от промивката, след което се изважда от фунията, фунията се измива и изважда от колбата и разтворът в колбата се добавя до марката с дестилирана вода , затваря се и се разбърква.
Когато приготвяте разтвори от сухи фиксали (например от фиксанал на оксалова киселина), вземете суха фуния, така че съдържанието на ампулата да може да се излее в колбата с леко разклащане. След като веществото се прехвърли в колбата, измийте ампулата и фунията, разтворете веществото във водата в колбата и доведете обема на разтвора до марката с дестилирана вода.
Големи количества 0,1 н. и 0,5 n. разтвори на солна и сярна киселина, както и приблизителни разтвори на тези киселини (2 N и др.) се приготвят от концентрирани химически чисти киселини. Първо, плътността на концентрираната киселина се определя с помощта на хидрометър или денсиметър.
Въз основа на плътността в референтните таблици се намира концентрацията на киселината (съдържанието на хлороводород в солна киселина или монохидрат в сярна киселина), изразена в грамове на 1 литър. Формулите се използват за изчисляване на обема концентрирана киселина, необходим за приготвяне на даден обем киселина с подходяща концентрация. Изчислението се извършва с точност до две или три значещи цифри. Количеството вода за приготвяне на разтвора се определя от разликата в обемите на разтвора и концентрираната киселина.
Таблица 1. Плътност и концентрация на разтвори на солна киселина (15°C)
|
Плътност g/cm3 |
Плътност g/cm3 |
|||||
Таблица.2 Плътност и концентрация на разтвори на сярна киселина (15°C)
|
Плътност g/cm3 |
|||
Разтвор на солна киселина се приготвя, като в съд за приготвяне на разтвора се налива половината от необходимото количество дестилирана вода и след това концентрирана киселина; След смесване разтворът се долива до пълния обем с останалото количество вода. Използвайте част от втората порция вода, за да изплакнете чашата, използвана за измерване на киселината.
Разтвор на сярна киселина се приготвя чрез бавно изливане на концентрирана киселина при непрекъснато разбъркване (за да се предотврати нагряване) към вода, излята в топлоустойчив стъклен съд. В този случай се оставя малко количество вода за изплакване на чашата, с която е измерена киселината, като този остатък се излива в разтвора, след като се охлади.
Понякога за химически анализ се използват разтвори на твърди киселини (оксалова, винена и др.). Тези разтвори се приготвят чрез разтваряне на проба от химически чиста киселина в дестилирана вода.
Масата на проба киселина се изчислява по формулата. Обемът вода за разтваряне се взема приблизително равен на обема на разтвора (ако разтварянето не се извършва в мерителна колба). За разтваряне на тези киселини се използва вода, която не съдържа въглероден диоксид.
В таблицата по плътност намираме съдържанието на хлороводород HCl в концентрирана киселина: Гк = 315 g/l.
Изчисляваме обема на концентриран разтвор на солна киселина:
V c = 36,5N*V / T c = 36,5*0,1*10000 / 315 = 315 ml.
Количество вода, необходимо за приготвяне на разтвора:
V H2O = 10000 - 115 = 9885 ml.
Тегло на проба от оксалова киселина H2C2O4*2H2O:
63.03N*V / 1000 = 63.03*0.1*3000 / 1000 = 12.6 g.
Установяване на концентрацията на работни киселинни разтвориможе да се извърши с натриев карбонат, боракс, прецизен алкален разтвор (титруван или приготвен от фиксанал). При установяване на концентрацията на разтвори на солна или сярна киселина с помощта на натриев карбонат или боракс, те използват метода на титруване на претеглени порции или (по-рядко) метода на пипетиране. При използване на метода на титруване се използват бюрети с вместимост 50 или 25 ml.
При определяне на концентрацията на киселини изборът на индикатор е от голямо значение. Титруването се извършва в присъствието на индикатор, в който преходът на цвета се извършва в диапазона на рН, съответстващ на точката на еквивалентност за химическата реакция, протичаща по време на титруване. Когато силна киселина взаимодейства със силна основа, като индикатори могат да се използват метилово оранжево, метилово червено, фенолфталеин и други, при които цветният преход става при рН = 4:10.
Когато силна киселина взаимодейства със слаба основа или със соли на слаби киселини и силни основи, тези, при които цветният преход се извършва в кисела среда, например метилоранж, се използват като индикатори. Когато слабите киселини взаимодействат със силни алкали, се използват индикатори, при които цветният преход се извършва в алкална среда, например фенолфталеин. Концентрацията на разтвор не може да се определи чрез титруване, ако слаба киселина реагира със слаба основа по време на титруване.
При установяване на концентрацията на солна или сярна киселина на базата на натриев карбонатНа аналитични везни в отделни бутилки се вземат три или четири претеглени порции безводен химически чист натриев карбонат с точност до 0,0002 g, за да се установи концентрация от 0,1 N. разтвор чрез титруване от бюрета с вместимост 50 ml, масата на пробата трябва да бъде около 0,15 g. Чрез сушене в пещ при 150 ° C пробите се довеждат до постоянно тегло и след това се прехвърлят в конични колби с вместимост 200-250 мл и се разтваря в 25 мл дестилирана вода. Бутилките с карбонатни остатъци се претеглят и от разликата в масата се определя точната маса на всяка проба.
Титруването на разтвор на натриев карбонат с киселина се извършва в присъствието на 1-2 капки от 0,1% разтвор на метилоранж (титруването завършва в кисела среда), докато жълтият цвят на разтвора се промени в оранжево-жълт. При титруване е полезно да се използва "свидетел" разтвор, за приготвянето на който една капка киселина от бюрета и толкова капки индикатор, колкото се добавя към титрувания разтвор, се добавят към дестилирана вода, налята в същата колба. като колбата, в която се извършва титруването.
Обемът на дестилирана вода за приготвяне на "свидетелския" разтвор трябва да бъде приблизително равен на обема на разтвора в колбата в края на титруването.
Нормалната концентрация на киселина се изчислява от резултатите от титруването:
N = 1000m N/E Na2CO3 V = 1000m N/52.99V
където m n е масата на проба от сода, g;
V е обемът на киселинния разтвор (ml), изразходван за титруване.
Средната конвергентна стойност на концентрацията е взета от няколко експеримента.
Очакваме да използваме около 20 ml киселина за титруване.
Тегло на пробата сода:
52,99 * 0,1 * 20 / 1000 = 0,1 g.
Пример 4. Проба от 0,1482 g натриев карбонат се титрува с 28,20 ml разтвор на солна киселина. Определете концентрацията на киселината.
Нормална концентрация на солна киселина:
1000 * 0,1482 / 52,99 * 28,2 = 0,1012 n.
При определяне на концентрацията на киселинен разтвор по отношение на натриев карбонат чрез пипетиране, проба от химически чист натриев карбонат, предварително доведена до постоянна маса чрез изсушаване в пещ и претеглена с точност до 0,0002 g, се разтваря в дестилирана вода в калибрирана мерителна колба с вместимост 100 ml.
Размерът на пробата при настройка на концентрацията на 0,1 N. киселинният разтвор трябва да бъде около 0,5 g (за да се получи приблизително 0,1 N разтвор при разтваряне). За титруване се пипетират 10-25 ml разтвор на натриев карбонат (в зависимост от капацитета на бюретата) и 1-2 капки 0,1% разтвор на метилоранж.
Методът на пипетиране често се използва за определяне на концентрацията на разтвори, като се използват полумикробюрети от 10 ml с деления от 0,02 ml.
Нормалната концентрация на киселинен разтвор, установена чрез пипетиране с натриев карбонат, се изчислява по формулата:
N = 1000m n V 1 / 52,99 V до V 2,
където m n е масата на проба от натриев карбонат, g;
V 1 - обемът на карбонатния разтвор, взет за титруване, ml;
V k е обемът на мерителната колба, в която е разтворена карбонатната проба;
V 2 е обемът на киселинния разтвор, изразходван за титруване.
Пример 5. Определете концентрацията на разтвор на сярна киселина, ако за нейното установяване 0,5122 g натриев карбонат са разтворени в мерителна колба от 100,00 ml и са използвани 14,70 ml разтвор на киселина за титруване на 15,00 ml разтвор на карбонат (като се използва бюрета с вместимост 25 ml).
Нормална концентрация на разтвор на сярна киселина:
1000 * 0,5122 * 15 / 52,99 * 100 * 14,7 = 0,09860 n.
При установяване на концентрацията на сярна или солна киселина с помощта на натриев тетраборат (боракс)Обикновено се използва методът на титруване. Кристалният хидрат на боракс Na 2 B 4 O 7 * 10H 2 O трябва да бъде химически чист и преди определяне на концентрацията на киселина се подлага на прекристализация. За прекристализация 50 g боракс се разтварят в 275 ml вода при 50-60°C; разтворът се филтрира и охлажда до 25-30°С. Енергичното разбъркване на разтвора предизвиква кристализация. Кристалите се филтрират върху фуния на Бюхнер, разтварят се отново и прекристализират. След филтриране, кристалите се сушат между листове филтърна хартия при температура на въздуха 20°С и относителна влажност 70%; сушенето се извършва на въздух или в ексикатор над наситен разтвор на натриев хлорид. Изсъхналите кристали не трябва да залепват по стъклената пръчка.
За титруване 3-4 проби от боракс се вземат последователно в чаша с точност до 0,0002 g и се прехвърлят в конични титруващи колби, като всяка проба се разтваря в 40-50 ml топла вода при енергично разклащане. След прехвърляне на всяка проба от бутилката в колбата, бутилката се претегля. Въз основа на разликата в масата по време на претеглянето се определя размерът на всяка проба. Размерът на отделна проба от боракс за установяване на концентрация от 0,1 N. киселинният разтвор при използване на бюрета с вместимост 50 ml трябва да бъде около 0,5 g.
Титруването на разтвори на боракс с киселина се извършва в присъствието на 1-2 капки от 0,1% разтвор на метилово червено, докато жълтият цвят на разтвора се промени в оранжево-червен или в присъствието на разтвор на смесен индикатор, състоящ се от метилово червено и метиленово синьо.
Нормалната концентрация на киселинен разтвор се изчислява по формулата:
N = 1000m n / 190.69V,
където m n е масата на пробата боракс, g;
V е обемът на киселинния разтвор, изразходван за титруване, ml.
Предполага се, че 15 ml киселинен разтвор ще бъдат използвани за титруване.
Тегло на пробата боракс:
190,69 * 0,1 * 15 / 1000 = 0,3 g.
Пример 7. Намерете концентрацията на разтвора на солна киселина, ако 24,38 ml солна киселина са използвани за титруване на 0,4952 g проба от боракс.
1000 * 0,4952 / 190,624,38 = 0,1068
Определяне на концентрацията на киселина с помощта на разтвор на натриев хидроксидили каустичен калий се извършва чрез титруване на алкален разтвор с киселинен разтвор в присъствието на 1-2 капки 0,1% разтвор на метилоранж. Въпреки това, този метод за определяне на концентрацията на киселина е по-малко точен от горния. Обикновено се използва при контролни тестове на киселинни концентрации. Като изходен разтвор често се използва алкален разтвор, приготвен от фиксанал.
Нормалната концентрация на киселинен разтвор N2 се изчислява по формулата:
N 2 = N 1 V 1 / V 2,
където N 1 е нормалната концентрация на алкалния разтвор;
V 1 - обемът на алкален разтвор, взет за титруване;
V 2 е обемът на киселинния разтвор, изразходван за титруване (средна стойност на резултатите от конвергентното титруване).
Пример 8. Определете концентрацията на разтвор на сярна киселина, ако се титруват 25,00 ml от 0,1000 N. разтвор на натриев хидроксид са изразходвани 25,43 ml разтвор на сярна киселина.
Концентрация на киселинен разтвор:
0,1 * 25 / 25,43 = 0,09828 n.
2. Изчисления при приготвяне на разтвори и характеристики на приготвяне на разтвори с различни концентрации
чаша за концентрация на разтвор на киселина
Точността на изчисленията при приготвяне на разтвори зависи от вида на приготвения разтвор: приблизителен или точен. При изчисляване на приблизителните разтвори атомните и молекулните маси се закръглят до три значещи цифри. Така, например, атомната маса на хлора се приема за 35,5 вместо 35,453, атомната маса на водорода е 1,0 вместо 1,00797 и т.н. Закръгляването обикновено се прави нагоре.
При изготвянето на стандартни разтвори изчисленията се извършват с точност до пет значими цифри. Атомните маси на елементите се вземат със същата точност. При извършване на изчисления се използват петцифрени или четирицифрени логаритми. Разтворите, чиято концентрация след това ще се определи чрез титруване, се приготвят по същия начин като приблизителните.
Разтворите могат да се приготвят чрез разтваряне на твърди вещества, течности или разреждане на по-концентрирани разтвори.
2.1 Изчисления за приготвяне на разтвори с нормална концентрация
Претегленото количество вещество (g) за приготвяне на разтвор с определена нормалност се изчислява по формулата:
m n =ENV/1000,
където Е е химическият еквивалент на разтворимото вещество;
N е необходимата нормалност на разтвора, g-eq/l;
V е обемът на разтвора, ml.
Претеглена част от веществото обикновено се разтваря в мерителна колба. Разредени приблизителни разтвори могат да се приготвят чрез разтваряне на проба от веществото в обем разтворител, равен на обема на разтвора. Този обем може да се измери с градуиран цилиндър или чаша.
Ако се приготвя разтвор от проба от кристален хидрат на вещество, тогава стойността на химичния еквивалент на кристалния хидрат се замества в изчислителното уравнение, за да се определи пробата.
Когато се приготвя разтвор с определена нормална концентрация чрез разреждане на по-концентриран разтвор, обемът на концентрирания разтвор (ml) се изчислява по формулата:
V k = ENV/T k,
където Tk е концентрацията на концентрирания разтвор, g/l, или:
където Nk е нормалността на концентрирания разтвор, или:
V до =ENV/10 p до d до,
където p k е процентната концентрация на концентрирания разтвор;
dk е плътността на концентрирания разтвор, g/cm3.
Концентрираните разтвори се разреждат в мерителни колби. При приготвяне на точни разтвори (например стандартни разтвори от по-концентриран стандартен разтвор), концентрираните разтвори се измерват с пипети или се изливат от бюрети. Когато се приготвят приблизителни разтвори, разреждането може да се извърши чрез смесване на концентрирания разтвор с обем вода, равен на разликата между обемите на разредения и концентрирания разтвор:
2.2 Изчисления при приготвяне на разтвори, чиято концентрация се изразява в грамове на 1 l
Теглото на веществото (g) за такива разтвори се изчислява по формулата:
където Т е концентрацията на разтвора, g/l;
V е обемът на разтвора, ml.
Разтварянето на веществото обикновено се извършва в мерителна колба, като обемът на разтвора след разтваряне се довежда до марката. Приблизителни разтвори могат да се приготвят чрез разтваряне на проба в обем вода, равен на обема на разтвора.
Ако разтвор се приготвя от проба от кристален хидрат и концентрацията на разтвора се изразява на базата на безводно вещество, размерът на пробата от кристален хидрат се изчислява по формулата:
m n =TVM k /1000M,
където Mk е молекулното тегло на кристалния хидрат;
При приготвяне на разтвори чрез разреждане на по-концентрирани, обемът на концентрирания разтвор се определя по формулата:
където T k е концентрацията на концентрирания разтвор, g/l, или:
V k =100VT/1000p k d k,
където p k е процентната концентрация на концентрирания разтвор;
d k - плътност на концентрирания разтвор, g/cm 3 ;
V k =VT/EN k,
където N k е нормалната концентрация на концентрирания разтвор; Е е химическият еквивалент на веществото.
Разтворите се приготвят по същия начин, както при приготвянето на разтвори с определена нормална концентрация чрез разреждане на по-концентрирани разтвори.
За приблизителни изчисления, свързани с приготвянето на разтвори чрез разреждане на по-концентрирани, можете да използвате правилото за разреждане („правило на кръста“), което гласи, че обемите на смесените разтвори са обратно пропорционални на разликите в концентрациите на смесените и разтворите, получени чрез смесване. Това се изразява с диаграми:
където N 1, T 1, N 3, T 3 са концентрациите на смесените разтвори;
N 2, T 2 - концентрация на разтвора, получен чрез смесване;
V 1, V 3 - обеми на смесените разтвори.
Ако разтворът се приготвя чрез разреждане на концентриран разтвор с вода, тогава N 3 = 0 или T 3 = 0. Например, за да се приготви разтвор с концентрация T 2 = 50 g/l от разтвори с концентрация T 1 = 100 g/ l и T 3 = 20 g/l е необходимо да се смеси обем от V 1 = 50 - 20 = 30 ml разтвор с концентрация 100 g/l и V 3 = 100 - 50 = 50 ml разтвор с концентрация 20 g/l:
2.3 Изчисления при приготвяне на разтвори с определена процентна концентрация
Масата на пробата (g) се изчислява по формулата:
където p е процентната концентрация на разтвора;
Q е масата на разтвора, g.
Ако е даден обемът на разтвора V, масата на разтвора се определя:
където d е плътността на разтвора, g / cm 3 (може да се намери в справочните таблици).
Масата на пробата при даден обем разтвор се изчислява:
Масата на водата за разтваряне на пробата се определя:
Тъй като масата на водата е приблизително числено равна на нейния обем, водата обикновено се измерва с помощта на измервателен цилиндър.
Ако разтворът се приготвя чрез разтваряне на кристалния хидрат на дадено вещество и концентрацията на разтвора се изразява като процент от безводното вещество, тогава масата на кристалния хидрат се изчислява по формулата:
m n =pQM k /100M,
където Mk е молекулното тегло на кристалния хидрат;
M е молекулното тегло на безводното вещество.
Удобно е да се приготвят разтвори чрез разреждане на по-концентрирани чрез измерване на определени обеми разтвори и вода, докато обемът на концентрирания разтвор се изчислява по формулата:
V k = pdV/p k d k,
където d k е плътността на концентрирания разтвор.
Разтвори с определена процентна концентрация се приготвят като приблизителни и затова проби от вещества с точност до две или три значими цифри се претеглят на технически везни, а за измерване на обеми се използват чаши или градуирани цилиндри.
Ако разтвор се получи чрез смесване на два други разтвора, единият от които има по-висока концентрация, а другият по-ниска, тогава масата на първоначалните разтвори може да се определи с помощта на правилото за разреждане ("правилото на кръста"), което за разтвори с определена процентна концентрация гласи: масите на смесените разтвори са обратно пропорционални на разликите в процентните концентрации на смесените и получените разтвори. Това правило е изразено чрез диаграмата:
Например, за да получите разтвор с концентрация p 2 = 10% от разтвори с концентрация p 1 = 20% и p 3 = 5%, трябва да смесите количеството на първоначалните разтвори: m 1 = 10-5 = 5 g от 20% разтвор и m 3 = 20 -10=10g от 5% разтвор. Познавайки плътността на разтворите, можете лесно да определите обемите, необходими за смесване.
Публикувано на Allbest.ru
Подобни документи
Характеристики на разтвори, съдържащи буферни системи и имащи способността да поддържат pH на постоянно ниво. Приложение на буферни разтвори и тяхната класификация. Същността на буферното действие. Буферни свойства на разтвори на силни киселини и основи.
тест, добавен на 28.10.2015 г
Класификация и особености на разтвори и разтворители. Участие на разтворителите в киселинно-алкални взаимодействия и техните резултати. Протеолитична теория на киселините и основите. Методи за изразяване на концентрацията на разтворите. Буферни разтвори и изчисляване на тяхното pH.
резюме, добавено на 23.01.2009 г
Константи и параметри, които определят качественото (фазовото) състояние и количествените характеристики на разтворите. Видове разтвори и техните специфични свойства. Методи за получаване на твърди разтвори. Характеристики на разтвори с евтектика. Разтвори на газове в течности.
резюме, добавено на 09/06/2013
Ролята на осмозата в биологичните процеси. Процес на дифузия за два разтвора. Формулиране на закона на Раул и последствията от него. Приложение на методите криоскопия и ебулиоскопия. Изотоничен коефициент на Вант Хоф. Колигативни свойства на електролитни разтвори.
резюме, добавено на 23.03.2013 г
Метод на киселинно-алкално титруване: понятие и съдържание, основни етапи и принципи на изпълнение, изисквания, основни условия и възможности за приложение. Изчисляване на pH на разтвори. Построяване на титруващи криви. Избор на индикатор и неговата обосновка.
презентация, добавена на 16.05.2014 г
Характеристики на методите на редокс титруване. Основни изисквания към реакциите, константа на равновесие. Характеристики на видовете редокс титруване, неговите показатели и криви. Приготвяне и стандартизиране на разтвори.
курсова работа, добавена на 25.12.2014 г
Класификация на методите за титриметричен анализ. Стъклария в титриметричния анализ и техники за работа с нея. Методи за изразяване на концентрацията на разтворите. Връзката между различните начини за изразяване на концентрацията на разтворите. Еквивалент на моларна концентрация.
резюме, добавено на 23.02.2011 г
Приготвяне на полимерни разтвори: процес на разтваряне на полимери; разтвори за филтриране и обезвъздушаване. Етапи на производство на филми от полимерен разтвор. Общи изисквания към пластификаторите. Подготовка на разтвора за формоване. Образуване на течен филм.
курсова работа, добавена на 01/04/2010
Класификация на методите за титраметричен анализ. Същността на метода "неутрализиране". Приготвяне на работни разтвори. Изчисляване на точки и построяване на киселинно-базови и редокс титруващи криви. Предимства и недостатъци на йодометрията.
курсова работа, добавена на 17.11.2013 г
Естество на разтвореното вещество и разтворителя. Методи за изразяване на концентрацията на разтворите. Влиянието на температурата върху разтворимостта на газове, течности и твърди вещества. Фактори, влияещи върху разтварянето. Връзка между нормалност и моларност. Закони за решения.