Алюминий - элемент 13-й (III)группы периодической таблицы химических элементов с атомным номером 13. Обозначается символом Al. Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Оксид алюминия Al2O3 - в природе распространён как глинозём, белый тугоплавкий порошок, по твердости близок к алмазу.
Оксид алюминия – природное соединение, может быть получен из бокситов или при термическом разложении гидроксидов алюминия:
2Al(OH)3 = Al2O3 + 3H2O;
Al2O3 - амфотерный оксид, химически инертен, благодаря своей прочной кристаллической решетке. Он не растворяется в воде, не взаимодействует с растворами кислот и щелочей и может реагировать лишь с расплавленной щелочью.
Около 1000°С интенсивно взаимодействует со щелочами и карбонатами щелочных металлов с образованием алюминатов:
Al2O3 + 2KOH = 2KAlO2 + H2O; Al2O3 + Na2CO3 = 2NaAlO2 + CO2.
Другие формы Al2O3 более активны, могут реагировать с растворами кислот и щелочей, α-Al2O3 взаимодействует лишь с горячими концентрированными растворами:Al2O3 + 6HCl = 2AlCl3 + 3H2O;
Амфотерные свойства оксида алюминия проявляются при взаимодействии с кислотными и основными оксидами с образованием солей:
Al2O3 + 3SO3 = Al2(SO4)3 (основные свойства),Al2O3 + Na2O = 2NaAlO2 (кислотные свойства).
Гидрокси́д алюми́ния, Al(OH)3 - соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами. Получают при взаимодействии солей алюминия с водными растворами щёлочи: AlCl3+3NaOH=Al(OH)3+3NaCl
Гидроксид алюминия – типичное амфотерное соединение, свежеполученный гидроксид растворяется в кислотах и щелочах:
2Al(OH)3 + 6HCl = 2AlCl3 + 6H2O. Al(OH)3 + NaOH + 2H2O = Na.
При нагревании разлагается, процесс дегидратации довольно сложен и схематично может быть представлен следующим образом:
Al(OH)3 = AlOOH + H2O. 2AlOOH = Al2O3 + H2O.
Алюминаты - соли, образующиеся при действии щёлочи на свежеосаждённый гидроксид алюминия:Al(ОН)3 + NaOH = Na (тетрагидроксоалюминат натрия)
Алюминаты получают также при растворении металлического алюминия (или Al2O3) в щелочах:2Al + 2NaOH + 6Н2О = 2Na + ЗН2
Гидроксоалюминаты образуются при взаимодействии Al(OH)3 с избытком щелочи: Al(OH)3 + NaOH (изб) = Na
Соли алюминия.
Из гидроксида алюминия можно получить практически все соли алюминия. Почти все соли алюминия хорошо растворимы в воде; плохо растворяется в воде фосфат алюминия.
В растворе соли алюминия показывают кислую реакцию. Примером может служить обратимое воздействие с водой хлорида алюминия:
AlCl3+3Н2O«Аl(ОН)3+3НСl
Практическое значение имеют многие соли алюминия. Так, например, безводный хлорид алюминия АlСl3 используется в химической практике в качестве катализатора при переработке нефти
Сульфат алюминия Al2(SO4)3 18Н2O применяется как коагулянт при очистке водопроводной воды, а также в производстве бумаги.
Широко используются двойные соли алюминия - квасцы KAl(SO4)2 12H2O, NaAl(SO4)2 12H2O, NH4Al(SO4)2 12H2O и др. - обладают сильными вяжущими свойствами и применяются при дублении кожи, а также в медицинской практике как кровоостанавливающее средство.
Применение - Благодаря комплексу свойств широко распространён в тепловом оборудовании.- Алюминий и его сплавы сохраняют прочность при сверхнизких температурах. Благодаря этому он широко используется в криогенной технике.- алюминий - идеальный материал для изготовления зеркал.- В производстве строительных материалов как газообразующий агент.- Алитированием придают коррозионную и окалиностойкость стальным и другим сплавам, - Сульфид алюминия используется для производства сероводорода.- Идут исследования по разработке пенистого алюминия как особо прочного и лёгкого материала.
В качестве восстановителя - Как компонент термита, смесей для алюмотермии- В пиротехнике.- Алюминий применяют для восстановления редких металлов из их оксидов или галогенидов. (Алюминотермия)
Алюминотермия. - способ получения металлов, неметаллов (а также сплавов) восстановлением их оксидов металлическим алюминием.
Строение и свойства атомов. Алюминий Аl - элемент главной подгруппы III группы (IIIA группы) 3-го периода Периодической системы Д. И. Менделеева.
Атом алюминия содержит на внешнем энергетическом уровне три электрона, которые он легко отдаёт при химических взаимодействиях. У родоначальника подгруппы и верхнего соседа алюминия - бора радиус атома меньше (у бора он равен 0,080 нм, у алюминия - 0,143 нм). Кроме того, у атома алюминия появляется один промежуточный восьмиэлектронный слой (2ё; 8ё; Зё), который препятствует притяжению внешних электронов к ядру. Поэтому у атомов алюминия восстановительные свойства выражены гораздо сильнее, чем у атомов бора, который проявляет неметаллические свойства.
Почти во всех своих соединениях алюминий имеет степень окисления +3.
Алюминий - простое вещество. Серебристо-белый лёгкий металл. Плавится при 660 °С. Очень пластичен, легко вытягивается в проволоку и прокатывается в фольгу толщиной до 0,01 мм. Обладает очень большой электрической проводимостью и теплопроводностью. Образует с другими металлами лёгкие и прочные сплавы.
Алюминий - очень активный металл. В ряду напряжений он находится сразу же после щелочных и щёлочноземельных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, поскольку его поверхность покрыта очень прочной тонкой плёнкой оксида, которая защищает металл от воздействия с компонентами воздуха и воды.
Если порошок алюминия или тонкую алюминиевую фольгу сильно нагреть, то они воспламеняются и сгорают ослепительным пламенем:
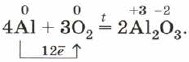
Эту реакцию вы наблюдаете при горении бенгальских огней и фейерверков.
Алюминий, как и все металлы, легко реагирует с неметаллами, особенно в порошкообразном состоянии. Для того чтобы началась реакция, необходимо первоначальное нагревание (за исключением реакций с галогенами - хлором и бромом), зато потом все реакции алюминия с неметаллами идут очень бурно и сопровождаются выделением большого количества теплоты:

Алюминий хорошо растворяется в разбавленных серной и соляной кислотах:

А вот концентрированные серная и азотная кислоты пассивируют алюминий, образуя на поверхности металла плотную, прочную оксидную плёнку, которая препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах.
Как вы уже знаете, оксид и гидроксид алюминия обладают амфотерными свойствами. Алюминий растворяется в водных растворах щелочей, образуя соли - алюминаты, которые называют комплексными 1:
-
1 При взаимодействии гидроксида и оксида алюминия с растворами щелочей также образуются комплексные соли, например Na.
Алюминий широко используют в металлургии для получения металлов - хрома, марганца, ванадия, титана, циркония из их оксидов. Как вы помните, этот способ носит название алюминотермии. На практике часто применяют термит - смесь Fe3O 4 с порошком алюминия. Если эту смесь поджечь, например, с помощью магниевой ленты, то происходит энергичная реакция с выделением большого количества теплоты:
Выделяющейся теплоты вполне достаточно для полного расплавления образующегося железа, поэтому этот процесс используют для сварки стальных изделий.
Алюминий очень прочно связан в природных соединениях с кислородом и другими элементами, и выделить его из этих соединений химическими методами очень трудно. Алюминий можно получить электролизом - разложением расплава его оксида Аl 2 O 3 на составные части с помощью электрического тока. Но температура плавления оксида алюминия около 2050 °С, поэтому для проведения электролиза необходимы большие затраты энергии.
Технически доступным металлом алюминий стал после того, как в 1886 г. американский и французский учёные Ч. Холл и П. Эру установили, что оксид алюминия хорошо растворяется в расплавленном при 1000 °С криолите, формула которого Na 3 AlF 6 , с образованием электропроводного расплава. Расплав оксида алюминия в криолите подвергают электролизу в специальных установках (рис. 63) на алюминиевых заводах.

Рис. 63.
Схема электролизной установки для получения алюминия:
1 - электролит - расплавленный криолит с добавками фторидов кальция и алюминия (для снижения температуры плавления) и оксид алюминия (добавляют периодически); 2 - угольный катод; 3 - угольный анод; 4 - корка из застывшего оксида алюминия, защищающая расплавленный алюминий от окисления; 5 - стальная ванна; 6 - патрубок для отбора расплавленного алюминия
Мировое производство алюминия постоянно увеличивается. В настоящее время он оттеснил на третье и последующие места медь и другие цветные металлы и стал вторым по значению металлом продолжающегося железного века.
Алюминий почти втрое легче стали и устойчив к коррозии, поэтому выгоднее стали в тех областях применения, где требуются эти свойства (рис. 64).

Рис. 64.
Основные области применения алюминия и его сплавов
Соединения алюминия . В природе алюминий встречается только в виде соединений и по распространённости в земной коре занимает первое место среди металлов и третье - среди всех элементов (после кислорода и кремния). Общее содержание алюминия в земной коре составляет около 9% (по массе).
Укажем важнейшие природные соединения алюминия.
Алюмосиликаты. Эти соединения можно рассматривать как соли, образованные оксидами алюминия, кремния, щелочных и щёлочноземельных металлов. Они и составляют основную массу земной коры. В частности, алюмосиликаты входят в состав полевых шпатов - наиболее распространённых минералов и глин.
Боксит (рис. 65, а) - горная порода, из которой получают алюминий, содержит оксид алюминия Аl 2 O 3 .

Рис. 65.
Природные соединения алюминия:
а - боксит; б - корунд; в - рубин; г - сапфир
Корунд (рис. 65, б) - минерал состава Аl 2 O 3 , обладает очень высокой твёрдостью, его мелкозернистая разновидность, содержащая примеси, - наждак - применяется как абразивный (шлифовочный) материал.
Эту же формулу имеет и другое природное соединение - глинозём.
Хорошо известны прозрачные, окрашенные примесями кристаллы корунда: красные - рубины (рис. 65, в) и синие - сапфиры (рис. 65, г), которые используют как драгоценные камни. В настоящее время их получают искусственно и используют не только в ювелирном деле, но и для технических целей, например для изготовления деталей часов и других точных приборов. Кристаллы рубинов применяют в лазерах.
Оксид алюминия Аl 2 O 3 - белое вещество с очень высокой температурой плавления. Может быть получен разложением при нагревании соответствующего ему гидроксида алюминия:
Гидроксид алюминия Аl(OН) 3 выпадает в виде белого студенистого осадка при действии щелочей на растворы солей алюминия (рис. 66), например:
АlСl 3(изб) + 3NaOH = Аl(ОН) 3 ↓ + 3NaCl.
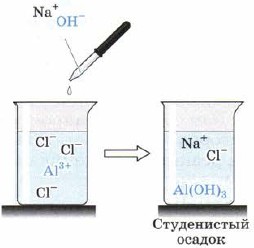
Рис. 66.
Получение гидроксида алюминия реакцией обмена из растворимой соли алюминия
Как амфотерный гидроксид, он легко растворяется в щелочах и кислотах (рис. 67):
Аl(ОН) 3 + NаОН (изб) = Na,
Аl(ОН)3 + 3HN03 = Al(NO 3) 3 + 3H 2 O.

Рис. 67.
Химические свойства гидроксида алюминия:
а - взаимодействие с щёлочью; б - взаимодействие с кислотой
Лабораторный опыт № 16
Получение гидроксида алюминия и исследование его свойств
Соли неустойчивых алюминиевых кислот - орто-алюминиевой Н 3 АlO 3 и метаалюминиевой НАlO 2 (её можно рассматривать как ортоалюминиевую кислоту, от молекулы которой отняли молекулу воды) - называют алюминатами. К природным алюминатам относится благородная шпинель (она украшает историческую реликвию - корону российских императоров) и драгоценный хризоберилл.
Соли алюминия, кроме фосфатов, хорошо растворимы в воде. Некоторые соли (сульфиды, сульфиты) разлагаются водой.
Хлорид алюминия АlСl 3 применяют в качестве катализатора в производстве очень многих органических веществ.
Открытие алюминия . Алюминий был впервые получен датским физиком X. Эрстедом в 1825 г. Название этого элемента происходит от латинского алюмен, так в древности назывались квасцы, которые использовали для крашения тканей.
Новые слова и понятия
- Строение атома алюминия.
- Физические и химические свойства алюминия: образование бромида, сульфида, карбида, оксида и алюминатов.
- Алюминотермия.
- Получение алюминия электролизом.
- Области применения алюминия.
- Природные соединения алюминия: алюмосиликаты (глина и полевые шпаты), корунд (рубин, сапфир, наждак).
- Амфотерность оксида и гидроксида алюминия.
Мы отправляем его в воздух и запускаем в космос, ставим на плиту, строим из него здания, изготавливаем шины, мажем на кожу и лечим им язву... Вы еще не поняли? Речь идет об алюминии.
Попробуйте перечислить все области применения алюминия и обязательно ошибетесь. Скорее всего о существовании многих из них вы даже не подозреваете. Все знают, что алюминий - материал авиастроителей. Но как насчет автомобилестроения или, скажем. медицины? Знаете ли вы, что алюминий является пищевой добавкой Е-137, которая обычно используется как краситель, придающий продуктам серебристый оттенок?
Алюминий - элемент, который с легкостью образует устойчивые соединения с любыми металлами, кислородом, водородом, хлором и многими другими веществами. В результате подобных химических и физических воздействий получаются диаметрально разные по своим свойствам сплавы и соединения.
Использование оксидов и гидроксидов алюминия
Сферы применения алюминия настолько обширны, что для ограждения товаропроизводителей, конструкторов и инженеров от непреднамеренных ошибок, в нашей стране применение маркировки сплавов алюминия - стало обязательным. Каждому сплаву или соединению присваивается свое буквенно-цифровое обозначение, которое в дальнейшем позволяет быстро отсортировать их и направить для дальнейшей обработки.
Наиболее распространенные природные соединения алюминия - его оксид и гидроксид. в природе они существуют исключительно в виде минералов - корундов, бокситов, нефелинов, пр. - и в качестве глинозема. Применение алюминия и его соединений связано с ювелирной, косметологической, медицинской сферами, химической промышленностью и строительством.
Цветные, "чистые" (не мутные) корунды - это известные всем нам драгоценности - рубины и сапфиры. Однако по своей сути они - не что иное, как самый обычный оксид алюминия. Помимо ювелирной сферы, применение оксида алюминия распространяется на хим.промышленность, где он обычно выступает адсорбентом, а также на производство керамической посуды. Керамические котелки, горшочки, чашки обладают замечательными жаропрочными свойствами именно благодаря содержащемуся в них алюминию. Свое применение окись алюминия нашла и как материал для изготовления катализаторов. Нередко оксиды алюминия добавляют в бетон для его лучшего затвердевания, а стекло, в которое добавили алюминий, становится жаропрочным.
Перечень областей применения гидроксида алюминия выглядит еще более внушительно. Благодаря способности поглощать кислоту и оказывать каталитическое действие на иммунитет человека, гидроксид алюминия используется при изготовлении лекарств и вакцин от гепатитов типа "А" и "В" и столбнячной инфекции. Им также лечат почечную недостаточность, обусловленную наличием большого числа фосфатов в организме. Попадая в организм, гидроксид алюминия вступает в реакцию с фосфатами и образует неразрывные с ними связи, а затем естественным путем выводится из организма.
Гидроксид, в виду его отличной растворимости и не токсичности, нередко добавляют в пасту для чистки зубов, шампунь, мыло, примешивают к солнцезащитным средствам, питательным и увлажняющим кремам для лица и тела, антиперсперантам, тоникам, очищающим лосьонам, пенкам и пр. Если необходимо равномерно и стойко окрасить ткань, то в краситель добавляют немного гидроксида алюминия и цвет буквально "втравляется" в поверхность материи.
Применение хлоридов и судьфатов алюминия
Крайне важными соединениями алюминия являются также хлориды и сульфаты. Хлорид алюминия в естественном состоянии не встречается, однако его довольно просто получить промышленным путем из бокситов и каолинов. Применение хлорида алюминия ввиде катализатора довольно однобоко, но практически бесценно для нефтеперерабатывающей отрасли.

Алюминиевые сульфаты существуют в естественном состоянии в качестве минералов вулканических пород и известны своей способностью к абсорбации воды из воздуха. Применение сернокислого алюминия распространяется на косметическую и текстильную промышленность. В первой, он выступает в качестве добавки в антиперсперанды, во второй - в виде красителя. Интересно применение сульфата алюминия в составе реппелентов от насекомых. Сульфаты не только отпугивают комаров, мух и мошек, но и обезболивают место укуса. Однако несмотря на ощутимую пользу, сульфаты алюминия неоднозначно действуют на здоровье людей. Если вдохнуть или проглотить сульфат алюминия, можно получить серьезное отравление.

Алюминиевые сплавы - основные области применения
Искусственно полученные соединения алюминия с металлами (сплавы), в отличие от естественных образований, могут иметь такие свойства, какие пожелает сам производитель - достаточно изменить состав и количество легирующих элементов. На сегодняшний день существуют практически безграничные возможности для получения сплавов алюминия и их применения.
Самая известная отрасль использования алюминиевых сплавов - авиастроение. Самолеты практически полностью изготовлены из алюминиевых сплавов. Сплавы цинка, магния и алюминия дают небывалую прочность, используемую в обшивке самолетов и изготовлении деталей конструкции.
Аналогично используются алюминиевые сплавы и в строении кораблей, подводных лодок и мелкого речного транспорта. Здесь из алюминия наиболее выгодно делать надстроечные конструкции, они более чем в половину снижают вес судна, при этом не ухудшая их надежности.
Подобно самолетам и кораблям, автомобили с каждым годом все больше и больше становятся "алюминиевыми". Алюминий применяется не только в деталях кузова, теперь это еще и рамы, балки, стойки и панели кабины. Благодаря химической инертности алюминиевых сплавов, низкой подверженности коррозии и теплоизоляционным свойствам из сплавов алюминия изготавливают цистерны для перевозок жидких продуктов.

Широко известно применение алюминия в промышленности. Нефте- и газодобыча не были бы такими как сейчас, если бы не чрезвычайно коррозионстойкие, химически инертные трубопроводы из алюминиевых сплавов. Буры, сделанные из алюминия, весят в несколько раз меньше, а значит легко перевозятся и монтируются. И это не говря уже о разного рода, резервуарах, котлах и прочих емкостях...
Из алюминия и его сплавов производят кастрюли, сковороды, противни, половники и прочую домашнюю утварь. Алюминиевая посуда отлично проводит тепло, очень быстро нагревается, при этом легко чистится, не вредит здоровью и продуктам. На алюминиевой фольге мы запекаем мясо в духовке и выпекаем пироги, в алюминий упакованы масла и маргарины, сыры, шоколад и конфеты.

Крайне важная и перспективная область - применение алюминия в медицине. Помимо тех областей использования (вакцины, почечные лекарства, адсорбенты), о которых говорилось ранее, следует также упомянуть использование алюминия в лекарствах от язвы и изжоги.
Из всего вышесказанного можно сделать один вывод - марки алюминия и их применение слишком многообразны, чтобы посвящать им одну небольшую статью. Об алюминии лучше писать книги, ведь не зря же его называют "металлом будущего".
25.11.14 21:22
Химические реагенты являются неотъемлемой составляющей многих технологических процессов. Сегодня невозможно себе представить работу текстильных, фармакологических, нефтеперерабатывающих производств без активного применения химических веществ. Оксид алюминия – важный участник многих процессов, благодаря своим свойствам он может выступать катализатором, осушителем, составляющей полимерного соединения.
Способы получения оксида алюминия
Природным материалом для получения оксида алюминия являются каолины, нефелины, бокситы, алуниты. Достаточно широкая распространенность в естественной среде позволяет добывать необходимый материал в достаточном количестве. Обработка сырья проводится алюминатным или хлоридным методом.
Химические свойства
Является атмосферным оксидом, устойчив к действию большинства кислот. Различают несколько модификаций оксида алюминия, природная альфа модификация называется корунд. Остальные получают путем термической обработки алюминийсодержащих веществ.
Характеристики оксида алюминия активного
Выпускается промышленностью в виде гранул, шариков, обладает хорошей устойчивостью к внешним воздействиям. Поверхность отдельных элементов гладкая, микропористая, вещество без запаха. Имеет высокие адсорбционные свойства, при этом при комнатной температуре характеризуется высокой химической стабильностью. Оксид алюминия, один из немногих оксидов металлов, сочетает в себе необходимые химические свойства и обладает устойчивой химической формой, удобной для транспортировки и хранения. Механическая прочность, устойчивость к воздействию капельной влаги, минимальная токсичность делают оксид алюминия востребованным сырьем для химической промышленности.
Сфера применения
Наиболее широко оксид алюминия применяет в нефте- и газоперерабатывающей промышленности. В качестве катализатора он участвует в таких процессах как гидрокрекинг, гидроочистка, риформинг.
Высокая адсорбционная активность материала позволяет его эффективно применять для осушки газов. Эта способность максимально эффективна на этапе крекинга, когда необходимо интенсифицировать процесс. Также адсорбционные свойства оксида используются для осушки природного газа, технологического оборудования, при консервации приборов и техники. Как адсорбент улавливает углеводородные газовые примеси из атмосферы, извлекает фторсодержащие соединения из различных сред. Благодаря своим химическим свойствам обеспечивает очистку масел от продуктов окисления. Оксид алюминия является мощным абсорбентом, как для газовых, так и для жидкостных сред.
Применяется как структурный материал в составе металлических композиций. Авиа и автомобилестроение, электроника, производство керамических изделий в своем цикле используют оксид алюминия. В стоматологии материал применяют для создания пломбировочного материала.
Оксид является прекрасным консервантом, который генерирует защитную атмосферу при длительном хранении пищевой и фармакологической продукции, защищая ее от воздействия капельной влаги. В пищевой промышленности участвует в процессе осветления растворов.
Химический реагент активно применяется в хроматографии как адсорбент, осадитель и инертный носитель.
На сегодняшний день оксид алюминия востребован в самых различных производственных отраслях: химическая, нефтедобывающая, фармакологическая, пищевая промышленности активно использует его в качестве катализатора, адсорбента, структурной единицы, химического реагента.
Государственное общеобразовательное учреждение средняя общеобразовательная школа № 325
Фрунзенского района Санкт-Петербурга
РЕФЕРАТ ПО ХИМИИ
«ОКСИД АЛЮМИНИЯ»
Работу выполнила ученица 9 «А»
Ершова Мария
Научный руководитель:
Рогова Е. В.
Научный консультант:
Головко Н. В.
Санкт-Петербург
Содержание
Введение……………………………………………………….3
Содержание в природе………………………………………..4
Драгоценные камни и их образование……………………….6
Корунд..………………………………………………….……..6
Сапфиры………………………………………………………..7
Рубины…………………………………………………….……8
Физические свойства……………………………………....…..9
Химические свойства ……………………..............................10
Применение…………………….. ………………………..…..12
Получение алюминия……………………………… …….…..12
Использование физических свойств Al 2 O 3 ………………......15
Заключение……………………………………………….…....17
Информационные источники…………………………..……..18
Введение
Драгоценности – это символ особого статуса, они украшают короны королей, как наглядное напоминание богатства и процветания того, кто их носит, а также и тех, кто это видит.
Знахари и целители приписывают некоторым драгоценным камням магическую силу. Легенды о знаменитых камнях, о счастье и бедах, которые они принесли своим владельцам, завораживают наше воображение.
Драгоценные камни – это именно сокровища. Их уникальные свойства ценились во все времена и по всему миру. Ценятся они, и по сей день. Возможно, внимание того, кто впервые поднял драгоценный камень, привлекла его яркая окраска или кристаллическая форма, а может быть, и цвет породы, в которую он был заключен.
Разнообразие цветов корунда зачаровывает и привлекает большинство людей, в особенности дам.
Чистый корунд бесцветен. Однако корунды используют не только, как драгоценность, есть еще множество применений этого минерала. А точнее то, из чего он состоит.
Цель работы: проанализировать свойства оксида алюминия и его применение в промышленности и в быту.
Задачи
:
Проанализировать литературу по теме «Оксид алюминия»
Изучить исторический аспект явления вещества.
Изучить применение оксида алюминия.
Сделать выводы данной теме.
По распространенности в земной коре алюминий занимает первое место среди металлов и третье место среди всех элементов (после кислорода и кремния), на его долю приходится около 8,8% массы земной коры. Алюминия вдвое больше, чем железа, и в 350 раз больше, чем меди, цинка, хрома, олова и свинца вместе взятых! Алюминий входит в огромное число минералов, главным образом, алюмосиликатов, и горных пород. Соединения алюминия содержат граниты, базальты, глины, полевые шпаты и др. Всего же известно более 250 минералов, в состав которых входит алюминий; большинство из них – алюмосиликаты, из которых и образована в основном земная кора.
С оединения алюминия были известны человеку с древних времён. Одними из них являлись вяжущие вещества, к которым относятся алюмо-калиевые квасцы КAl(SO 4) 2 . Они находили широкое применение. Использовались в качестве протравы и как средство, останавливающее кровь. Пропитка древесины раствором алюмокалиевых квасцов делало её негорючей. Известен интересный исторический факт. Архелай, полководец из Рима, во время войны с персами приказал намазать башни, которые служили в качестве оборонительных сооружений, квасцами. Персам так и не удалось сжечь их.
оединения алюминия были известны человеку с древних времён. Одними из них являлись вяжущие вещества, к которым относятся алюмо-калиевые квасцы КAl(SO 4) 2 . Они находили широкое применение. Использовались в качестве протравы и как средство, останавливающее кровь. Пропитка древесины раствором алюмокалиевых квасцов делало её негорючей. Известен интересный исторический факт. Архелай, полководец из Рима, во время войны с персами приказал намазать башни, которые служили в качестве оборонительных сооружений, квасцами. Персам так и не удалось сжечь их.
При выветривании алюмосиликатов образуется глина , основу которой составляет минерал каолинит Al 2 O 3 ·2SiO 2 ·2H 2 O. Химический состав глин колеблется в широких пределах, и входящие в состав глин оксиды по разному влияют на процесс получения конечные свойства керамики. Оксид алюминия (глинозем – А1 2 0 3) при повышенном его количестве в глине приводит к увеличению температуры обжига и интервала спекания. А изделия с низким содержанием глинозема обладают невысокой прочностью. Примеси железа обычно окрашивают глину в бурый цвет, но встречаются и белая глина – каолин, которую применяют для изготовления фарфоровых и фаянсовых изделий.
Глинозём , Аl 2 О з - белое кристаллическое веществово, нерастворимое в воде, t пл =2050 о С. Встречается в природе в виде минералов - корунда (бесцветный), рубина (красный), сапфира (синий). О корунде мы будем говорить в следующей главе.
Важнейший минерал алюминия – боксит , Al 2 O 3 ·xH 2 O. Крупнейшие месторождения боксита находятся в Австралии, Бразилии, Гвинее и на Ямайке; промышленная добыча ведется и в других странах. Боксит (фр. bauxite) (по названию местности Baux на юге Франции) - алюминиевая руда, сырьё для получения глинозёма и глинозёмосодержащих огнеупоров. Содержание глинозёма в промышленных бокситах колеблется от 40 % до 60 % и выше. Используется также в качестве флюса в чёрной металлургии.
Но вот парадокс: при огромном числе минералов и пород, содержащих алюминий, месторождения бокситов - главного сырья при промышленном получении алюминия, довольно редки. В России месторождения бокситов имеются в Сибири и на Урале. Промышленное значение имеют также алуниты и нефелины .
(Алунит, квасцовый камень (фр. alunite - квасцы) - минерал состава K 2 SO 4 *Al 2 (SO 4) 3 *4Al(OH) 3 или KAl 3 (SO 4) 2 (OH) 6 . Цвет белый, серый.
Нефелин (элеолит) - породообразующий минерал, алюмосиликат калия и натрия ортокремниевой кислоты (Na,K)AlSiO 4 .)
Образование драгоценных камней
Сем ейство корундов, к которому принадлежит рубин и сапфир, имеет очень простую химическую формулу - Al 2 O 3 : в молекуле корунда содержится два атома алюминия и три атома кислорода.
Чистый корунд - бесцветное вещество, но в природе редко образуются идеальные драгоценные камни, и обычно корунд бывает окрашен. Хром и ванадий – это те самые акцессорные элементы, которые придают рубину характерный для него красный цвет; синий сапфир обязан своим цветом железу и титану, а зеленый, желтый и розовый сапфиры – другим сочетаниям элементов-спутников.
Корунд
Н азвание «корунд»
происходит от древних названий этого минерала: от тамильского
kurundam
и
kurund
на хинди.
азвание «корунд»
происходит от древних названий этого минерала: от тамильского
kurundam
и
kurund
на хинди.
Древние греки добывали корунд на острове Наксос в Эгейском море, и в наше время Наксос остается основным поставщиком абразивного наждака, используемого в промышленности в виде порошка , в быту мы встречаемся с ним в виде пилок для ногтей.
Чистый корунд бесцветен, сегодня он используется, как декоративный камень, в производстве часов, и как абразивный материал.
Месторождение корунда есть во многих странах мира.
Сапфиры
В быту слово
«сапфир»
ассоциируется исключительно с синими камнями. Традиционные цвета сапфиров – от бледно-голубого до глубокого синего (индиго). Сапфиры
других цветов обычно называют «фантазийными апфирами»,
и среди них
встречаются черные, фиолетовые, зеленые, темно-серые, желтые, оранжевые и белые. Сапфиры, как драгоценные камни получили признание еще в
VIII
веке до н.э. Правители древней Персии полагали, что небо голубое потому, что в нем отражаются сапфиры. Разными оттенками сапфиры обязаны примесям железа и титана, причем встречаются полосатые и пятнистые камни. Включения, присутствующие в сапфирах отражают свет, в результате чего возникает эффект, получивший название «шелк»
. Самая прозрачная и
бесцветная разновидность сапфира называется лейкосапфир
.
быту слово
«сапфир»
ассоциируется исключительно с синими камнями. Традиционные цвета сапфиров – от бледно-голубого до глубокого синего (индиго). Сапфиры
других цветов обычно называют «фантазийными апфирами»,
и среди них
встречаются черные, фиолетовые, зеленые, темно-серые, желтые, оранжевые и белые. Сапфиры, как драгоценные камни получили признание еще в
VIII
веке до н.э. Правители древней Персии полагали, что небо голубое потому, что в нем отражаются сапфиры. Разными оттенками сапфиры обязаны примесям железа и титана, причем встречаются полосатые и пятнистые камни. Включения, присутствующие в сапфирах отражают свет, в результате чего возникает эффект, получивший название «шелк»
. Самая прозрачная и
бесцветная разновидность сапфира называется лейкосапфир
.
 Обычно сапфиры находят в виде кристаллов, имеющих таблитчатую пирамидальную или ромбоэдрическую форму, а также форму бочонка. Для сапфиров характерно повторяющееся двойникование. Всем сапфирам присущ плеохроизм
: стоит камень повернуть, как его цвет меняется.
Обычно сапфиры находят в виде кристаллов, имеющих таблитчатую пирамидальную или ромбоэдрическую форму, а также форму бочонка. Для сапфиров характерно повторяющееся двойникование. Всем сапфирам присущ плеохроизм
: стоит камень повернуть, как его цвет меняется.
Звездчатыми называют такие камни, в которых несколько включений рутила, похожих на тонкие иглы, так отражают свет, что возникает мерцающая шестиконечная звезда. Этот эффект называется астеризмом .
Самые ценные сапфиры добываются в Кашмире. Эти сапфиры обладают богатым бархатным блеском.
С 1902 года стали выпускать синтетические сапфиры, полученные из расплава оксида алюминия с добавлением титана.
Сапфир-падпарадша
Падпарадша – чрезвычайно редкая разновидность сапфира нежного розовато-оранжевого цвета, что объясняется нал ичием небольших количеств хрома, железа и ванадия. Название происходит от сингальского padmaragaya , что значит «цвет лотоса».
Самый дорогой камень из всех сапфиров. Добывают его в Шри-Ланка.
Рубин ы
Р убин
ы – чрезвычайно редкие драгоценные камни. Известны рубины разных оттенков красного цвета – от розоватого до коричневато-красного. Интенсивность красного цвета зависит от количества хрома, усиливающего цвет. Коричневатый оттенок рубина свидетельствует о присутствии в них железа. Название происходит от латинского слова
ruber
, что значит «красный».
убин
ы – чрезвычайно редкие драгоценные камни. Известны рубины разных оттенков красного цвета – от розоватого до коричневато-красного. Интенсивность красного цвета зависит от количества хрома, усиливающего цвет. Коричневатый оттенок рубина свидетельствует о присутствии в них железа. Название происходит от латинского слова
ruber
, что значит «красный».
Рубины упоминаются еще в Библии. В Шри-Ланке их добычей занимаются более двух с половиной тысяч лет, а в Бирме с VI века.
Рубины встречаются в кристаллической известняке вместе со слюдой графитом, пирротитом и т. д.
Рубин- твердый камень, но двойниковые кристаллы ломаются довольно легко.
В 1902 году французский химик Огюст Вернейль разработал способ получения синтетических рубинов из оксида алюминия и красящего вещества.
Физические свойства
O=Al-O-Al=O
Оксид алюминия Al 2 O 3 – белый тугоплавкий порошок, температура плавления 2044°С, температура кипения 3530°С, плотность 4 г/см3, по твердости близок к алмазу. Известно несколько кристаллических форм оксида алюминия, до 2044°С стабильна кристаллическая модификация α-Al 2 O 3 – корунд.
Его кристаллическая структура представляет собой двухслойную плотнейшую шаровую упаковку из ионов кислорода, в октаэдрических пустотах которой размещены ионы алюминия, решетка ромбоэдрическая.
Химические свойства Al 2 O 3
На воздухе алюминий покрывается тончайшей, но очень плотной плёнкой оксида, предохраняющей металл от дальнейшего окисления. В связи с этим поверхность его обычно имеет не блестящий, а матовый вид.
Образующаяся на поверхности алюминия в атмосферных условиях плёнка оксида имеет обычно толщину менее 1 нм, но очень прочно связана с металлом. Искусственно получаемые действием окислителей плёнки значительно толще. Хорошая защитная плёнка может быть получена, например, погружением алюминия в раствор, содержащий 20 % Na 2 SO 4 и 10 % HNO 3 . С помощью подобранных наполнителей таким плёнкам можно придавать различную окраску.
Напротив, после контакта алюминия с раствором HgCl 2 плёнка эта становится столь рыхлой, что уже не защищает металл от дальнейшего окисления. В результате он быстро обрастает “бородой” из водного оксида (Al 2 O 3 ·xH 2 O) и постепенно окисляется нацело. Получившийся водный оксид, и сам по себе и после обезвоживания нагреванием, обладает высокой сорбционной активностью.
При нагревании стойкость оксидной плёнки значительно снижается. Особо следует отметить возможность заметной растворимости алюминия при кипячении его с разбавленными растворами некоторых органических кислот.
Лёгкость растворения алюминия в сильных щелочах обусловлена снятием с него защитной оксидной плёнки по схеме:
Al 2 O 3 + 2КOH - + 3 H 2 O = 2К.
Al 2 O 3 + 2 OH - + 3 H 2 O = 2 Al(OH) 4 -
Так как в ряду напряжений Al стоит значительнее левее водорода, обнажение чистой поверхности металла тотчас сопровождается реакциями по схемам:
2Al + 6H + ·(из воды) = 2Al +3 + 3H 2 и 2Al +3 + 8 OH - = 2Al(OH) 4 - .
Равновесие первой из них всё время смещается вправо за счёт второй. Аналогично протекает растворение в щелочах и других активных металлов, гидроксиды которых амфотерны (Sn, Zn и т. п.).
Оксид алюминия представляет собой белую очень тугоплавкую и нерастворимую в воде массу. Природный Al 2 O 3 (минерал корунд ), а также получаемый искусственно и затем сильно прокаленный, отличается большой твёрдостью и нерастворимостью в кислотах.
Оксид алюминия - а мфотерный оксид с преобладанием основных свойств; с водой не реагирует.
1. Реагирует с кислотами и растворами щелочей:
а. Как основной оксид:
Al 2 O 3 + 6 HCl = 2 AlCl 3 + 3 H 2 O
б. Как кислотный оксид:
Al 2 O 3 + 2 NaOH + 3 H 2 O = 2 Na [ Al ( OH ) 4 ]
2) Сплавляется со щелочами или карбонатами щелочных металлов:
Al 2 O 3 + Na 2 CO 3 = 2NaAlO 2 (алюминат натрия) + CO 2
Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O
Al 2 O 3 +2KOH = 2KAlO 2 ( метаалюминат K) + H 2 O
Сплавляя Al 2 O 3 со щелочами, получают высокомолекулярные метааоксоалюминаты.
В алюмосиликатах алюминий играет такую же роль, как кремний: оба эти элемента образуют смешанное соединение – алюминат-силикат.
Кристаллические модификации Al 2 O 3 химически очень стойки, не взаимодействуют с водой и кислотами. В растворимое состояние оксид (сесквиоксид) алюминия можно перевести сплавлением со щелочами или K 2 S 2 O 7 по реакциям:
Al 2 O 3 + 2 NaOH = H 2 O + 2 NaAlO 2
Al 2 O 3 + 3 K 2 S 2 O 7 = Al 2 (SO 4) 3 + 3 K 2 SO 4 .
П рименение Al 2 O 3
1. Оксид алюминия - сырьё для получения алюминия ; производится из алюминийсодержащих руд, преим. бокситов. Также алюминий получают из нефелинов, каолина, алунитов алюминатным или хлоридным методом. Сырьё в производстве алюминия, катализатор, адсорбент, огнеупорный и абразивный материал.
Первые попытки получить алюминий были сделаны только в середине XIX века. Попытка, предпринятая, датским учёным Х.К.Эрстедом увенчалась успехом. Для получения он использовал амальгированный калий в качестве восстановителя алюминия из оксида. Но что за металл был получен тогда выяснить так и не удалось. Через некоторое время, алюминий был получен немецким ученым-химиком Велером, который получил алюминий, используя нагревание безводного хлорида алюминия с металлическим калием.
Многие годы труда немецкого ученого не прошли даром. За 20 лет он сумел приготовить гранулированный металл. Он оказался похожим на серебро, но был значительно легче его. Алюминий был очень дорогим металлом, и вплоть до начала XX века, его стоимость была выше стоимости золота. Поэтому многие-многие годы алюминий использовался как музейный экспонат.
Около 1807 г. Дэви попытался провести электролиз глинозема, получил металл, который был назван алюмиумом (Alumium) или алюминумом (Aluminum), что в переводе с латинского - квасцы.
Получение алюминия из глин интересовало не только ученых-химиков, но и промышленников. Алюминий очень тяжело было отделить от других веществ, это способствовало тому, что он был дороже золота. В 1886 году химиком Ч.М. Холлом был предложен способ, который позволил получать металл в больших количествах. Проводя исследования, он в расплаве криолита AlF 3 nNaF растворил оксид алюминия. Полученную смесь поместил в гранитный сосуд и пропустил через расплав постоянный электрический ток. Он был очень удивлен, когда через некоторое время на дне сосуда он обнаружил бляшки чистого алюминия. Этот способ и в настоящее время является основным для производства алюминия в промышленных масштабах. Полученный металл всем был хорош, кроме прочности, которая была необходима для промышленности. И эта проблема была решена. Немецкий химик Альфред Вильм сплавил алюминий с другими металлами: медью, марганцем и магнием. Получился сплав, который был значительно прочнее алюминия. В промышленных масштабах такой сплав был получен в немецком местечке Дюрене. Это произошло в 1911 году. Этот сплав был назван дюралюминием, в честь городка.
В промышленности алюминий получают электролизом раствора глинозема Al 2 O 3 в расплавленном криолите Na 3 AlF 6 . Процесс ведут при температурах около 1000 °С в специальных электрических печах. Электролиз Al 2 O 3 можно представить следующей условной схемой. В растворе оксид диссоциирует на ионы
Al 2 O 3 ↔ Al 3+ + AlO 3- 3
На катоде разряжаются ионы Al 3+ : Al 3+ +3 e - = Al 0
На аноде происходит процесс: 4 AlO 3- 3 – 12 e - =2 Al 2 O 3 +3 O 2
На аноде выделяется кислород, а на катоде - жидкий алюминий. Последний собирается на дне печи, откуда его периодически и выпускают. Катодом служит корпус элекролизера, на котором выделяется жидкий алюминий. На графитовом аноде выделяется кислород, который окисляет графит до оксидов углерода. По мере сгорания анода его наращивают. Поскольку жидкий алюминий имеет более высокую плотность, чем расплав, он собирается на дне элекролизера.
Очистка алюминия от примесей трудна, поэтому необходимо, чтобы чисты были сами исходные материалы для его получения. Криолит обычно готовят искусственно путём совместного растворения Al(OН) 3 и соды в плавиковой кислоте по реакции:
3 Na 2 CO 3 + 2 Al(OH) 3 + 12 HF = 2 Na 3 AlF 6 + 3 CO 2 + 9 H 2 O.
Природные бокситы, в состав которых входит 50-60 % Al 2 O 3 и ряд примесей (SiO 2 , Fe 2 O 3 и др), подвергаются предварительной химической переработке с целью выделения из них достаточно чистого сесквиоксида алюминия (содержащей не более 0,2 % SiO 2 и 0,04 % Fe 2 O 3). Методы такой переработки сильно зависит от состава исходного боксита и довольно сложны.
Печь для выплавки алюминия состоит из железного ящика, внутренние стенки и дно которого выложены теплоизолирующим слоем из огнеупорных материалов и поверх него - толстой угольной обкладкой, служащей при электролизе катодом. В качестве анода применяется массивный угольный электрод. Процесс ведут при температуре около 960 °С, напряжении около 5 В и силе тока около 140 тыс. А. Выделяющийся кислород образует с углём анода CO и CO 2 . Параллельно за счёт незначительного выделения фтора получаются небольшие количества CF 4 . Вследствие сгорания анода его приходится постепенно опускать вниз. Боковые стенки печи (и большая часть поверхности жидкости) покрыты твёрдой коркой электролита, препятствующий их разъединению выделяющимися у анода газами и предохраняющий расплав от охлаждения. Во время работы печи в неё периодически добавляется Al 2 O 3 (и немного криолита), а расплавленный металл удаляется.
Выплавка алюминия весьма энергоемка: тонна металла требует затраты около 10 тыс. кВт·ч электроэнергии. Первичная его очистка осуществляется продувкой хлора. Продажный металл содержит обычно 99,7 % алюминия. Наряду с другими примесями (главным образом Si и Fe) в нём имеются и следы галия.
Постоянный и все возрастающий спрос на алюминий в 1980-е годы уже не мог удовлетворить запасы бокситов. По прогнозам ученых, к середине XXI столетия бокситовый источник начнет иссякать. Необходимо срочно найти другие виды сырья. Впервые в мировой практике, столкнувшийся с этой же проблемой, именно в СССР стали получать глинозем (окись алюминия- Al 2 O 3) из алунита – белых или серовато-желтых квасцов (гидросульфатов калия и алюминия, содержащих до 37 % Al 2 O 3).
2. Высокая прочность связи Al - O - Al и плотная кристаллическая структура предопределяют высокую температуру плавления (порядка 2050°С), твердость и огнеупорность оксида алюминия. Так, корунд по твердости уступает лишь алмазу и применяется в качестве абразивного материала в виде корундовых кругов и наждака. В качестве огнеупорного материала широко используется также искусственно, получаемый, из бокситов сильно прокаленный Al 2 O 3 , называемый алундом. Благодаря высокой твердости, искусственно получаемые монокристаллы корунда (в частности рубины) используют как опорные камни в точных механизмах. Искусственные рубины используют в качестве квантовых генераторов (лазеры).
Обычно загрязнённый оксидом железа природный корунд вследствие своей чрезвычайной твёрдости применяется для изготовления шлифовальных кругов, брусков и т. п. В мелко раздробленном виде он под названием наждака служит для очистки металлических поверхностей и изготовления наждачной бумаги. Для тех же целей часто пользуются оксидом алюминия, получаемым сплавлением боксита (техническое название - алунд).
Чистый оксид алюминия (т. пл. 2050, т. кип. 3500 °С) непосредственно используется в производстве зубных цементов. Так, порошок одного из видов высококачественного зубного цемента получается сплавлением при 700-800 °С и последующим измельчением тщательно приготовленной смеси следующего состава: 28,4 % Al 2 O 3 , 20,9-SiO 2 , 19,7-Na 2 SiF 6 , 19,0-CaSiF 6 , 3,9-CaCO 3 , 4,1-H 3 PO 4 , 4,0-H 3 AsO 4 . Жидкость для замешивания такого цемента представляет собой крепкий раствор Al(H 2 PO 4) 3 .
Изделия из оксида алюминия обладают очень высокой механической прочностью и сохраняют её до 1800 °С. Исключительно велика и их химическая стойкость. Вместе с тем они хорошо проводят тепло и переносят температурные колебания. Напылением расплавленного оксида алюминия может быть создано эффективное защитное покрытие на металлах.
Сплавление равных по массе количеств Al 2 O 3 и SiO 2 с последующим выдуванием их расплава было получено стекловолокно (“файберфракс ”), характеризующееся высокой термической устойчивостью и большой устойчивостью к химическим воздействиям. Оно не изменяет свои свойства до 1250°С, плавится лишь выше 1600°С и особенно пригодно для изготовления теплоизоляционных материалов.
На основе корунда был сконструирован сверхпрочный искусственный камень - “микролит ”. Он состоит из очень мелких (порядка микронов) зёрен корунда с небольшой добавкой связывающего стеклообразного материала. Микролитовые резцы сохраняют свою чрезвычайную твёрдость до 1200 °С и допускают поэтому очень большую скорость металлообработки.
На кристалле рубина была впервые (1960 г.) реализована идея оптического квантового генератора (“лазера ”) - устройства, создающего направленный пучок монохроматического (т. е. имеющего одну определенную длину волны) излучения в видимой области спектра или вблизи неё. Действие лазера (как и родственного ему “мазера”, генерирующего аналогичный пучок коротких радиоволн) основано на выделение энергии за счёт одновременно происходящего определённого снижения энергетического уровня множества одинаковых частиц.
Заключение
Область применения оксида алюминия очень широка, увлекательная история его откр ытия начинается еще с древних времен. Еще в древнем Риме люди стремились узнать об этом веществе, узнавая все больше и больше о его свойствах. И уже сейчас существуют новые нано-технологии, в которых оксид алюминия играет главную роль. Возможно, в будущем с помощью этого вещества, будет разработана новая техника, появится еще один, а может и несколько видов драгоценных камней, полученных так же, как и ныне существующие, искусственным путем.
Информационные источники
1. Энциклопедия. Геология.М., «Аванта+»1995,с.304,306,357.
2. Ахметов Н.С. Общая и неорганическая химия.М., «Высшая школа»1998.с.430-432.
3. Олдершоу.К. Атлас драгоценных камней.
4. Комкова Е.Г. Группа химических астероидов.М., «Просвещение» 1984.с.404,405
5.Сайт: http://schoolchemistry. by . ru Оксид Алюминия.
6. Сайт: http://www.alhimikov.net Алюминий.


